呼吸道病毒的免疫测定方法和检测试剂盒与流程
1.本发明涉及一种检测呼吸道病毒例如流感病毒的免疫测定方法和检测试剂盒。本发明还涉及一种用于检测呼吸道病毒例如流感病毒的免疫测定方法中的样品稀释剂。
背景技术:
2.感染哺乳动物(例如人类)的呼吸器官的病毒的例子包括rs病毒、冠状病毒、流感病毒、巨细胞病毒和腺病毒。其中,流感是一种流行性呼吸道病毒感染,并且影响人群广泛。流感病毒是一种单链rna病毒,属于正粘病毒科。根据m1蛋白和np蛋白的抗原性,流感病毒分为a、b和c三种类型。a型和b型表示流行性盛行(epidemic prevalence)。流感会引起全身症状,例如发烧(通常发烧38℃或更高)、头痛、全身不适、肌肉疼痛和关节疼痛。另外,流感常常并发老年人的肺炎或者婴幼儿的脑病等,有些情况下导致死亡。此外,流感可能会成为大流行病。
3.对于呼吸道感染,早期诊断很重要,以便在感染变得严重之前在感染的早期阶段开始治疗。早期诊断对于防止传染给家庭成员和朋友也很重要。有鉴于此,在患者所在地实时进行poct(即时检测,point
‑
of
‑
care testing),以快速获取对诊断和治疗有用的信息。为了检测poct中呼吸道感染的致病病毒,广泛开展了使用与呼吸道病毒特异性反应的抗体的免疫测定。然而,在样本中含有诸如细菌、病毒和具有交叉抗原性的蛋白质的污染物的情况下,这种免疫测定法往往伴随着非特异性反应。这是有问题的,因为这种假阳性反应可能会妨碍准确诊断。
4.专利文献1公开了,通过使含有流感病毒的样本与特定的非离子表面活性剂接触,可以提高免疫测定中流感m1蛋白的测量灵敏度。然而,当本发明人对专利文献1中使用的几种非离子表面活性剂进行测试时,结果是在流感病毒的检测中发生了非特异性反应。
5.专利文献2公开了一种用于制备待进行免疫测定的样本悬浮液的培养基组合物,其含有离子表面活性剂。然而,该试验仅用阳离子表面活性剂或两性表面活性剂进行。此外,无法明确确定产生这种效果的因素是否是除离子表面活性剂以外的因素,例如添加的精氨酸量的增加,或离子表面活性剂的添加。
6.引用列表
7.专利文献
8.专利文献1:wo 2015/037635
9.专利文献2:jp
‑
a
‑
2005
‑
291783
技术实现要素:
10.技术问题
11.本发明的一个目的是提供一种呼吸道病毒的免疫测定方法,该方法抑制非特异性反应。
12.问题解决方案
13.发明人发现,通过使可能含有呼吸道病毒的生物样品与阴离子表面活性剂接触,然后执行抗原抗体反应,即呼吸道病毒与缀合物反应,可以有效抑制非特异性反应,从而完成本发明。
14.更具体地说,本发明如下。
15.<1>一种呼吸道病毒的免疫测定方法,该方法包括:
16.(a)使可能含有呼吸道病毒的生物样品与阴离子表面活性剂接触;
17.(b)使呼吸道病毒与缀合物接触以形成第一复合物;
18.(c)使第一复合物与对呼吸道病毒具有免疫反应性的抗体接触以形成第二复合物;和
19.(d)测量源自缀合物的信号。
20.<2>根据<1>的免疫测定方法,其中呼吸道病毒是流感病毒。
21.<3>根据<1>或<2>的免疫测定方法,其使用免疫层析法。
22.<4>根据<3>的免疫测定方法,其特征在于,该方法使用具有以下配置的免疫层析测试条:
23.一种测试条,包括以下(1)和(2):
24.(1)样品垫,含有样品施加区,用于施加可能含有呼吸道病毒的生物样品;和
25.(2)不溶性膜,含有至少一个检测区,对呼吸道病毒具有免疫反应性的抗体固定在检测区上;
26.其中(1)或(2)包括含有缀合物的缀合物区,并且其中缀合物区设在样品施加区和检测区之间。
27.<5>根据<1>至<4>中任一项的免疫测定方法,其中步骤(a)是将生物样品与含有阴离子表面活性剂的样品稀释剂混合的步骤。
28.<6>根据<5>的免疫测定方法,其中在含有阴离子表面活性剂的样品稀释剂中的阴离子表面活性剂的浓度为0.1至10质量%。
29.<7>根据<1>至<6>中任一项的免疫测定方法,其中生物样品是呼吸道分泌物。
30.<8>根据<1>至<7>中任一项的免疫测定方法,其中呼吸道病毒是乙型流感病毒。
31.<9>根据<1>至<8>中任一项的免疫测定方法,其中阴离子表面活性剂选自基于磺酸盐的阴离子表面活性剂、基于羧酸盐的阴离子表面活性剂、基于聚氧乙烯烷基醚硫酸钠的阴离子表面活性剂及其组合。
32.<10>一种呼吸道病毒检测试剂盒,包括以下(1)和(2):
33.(1)使用呼吸道病毒抗体的检测试剂;和
34.(2)包含阴离子表面活性剂的生物样品稀释剂。
35.<11>根据<10>的呼吸道病毒检测试剂盒,其中呼吸道病毒是流感病毒。
36.<12>根据<10>或<11>的呼吸道病毒检测试剂盒,包括具有以下配置的免疫层析测试条:
37.一种测试条,包括以下(3)和(4):
38.(3)样品垫,含有样品施加区,用于施加可能含有呼吸道病毒的生物样品;和
39.(4)不溶性膜,含有至少一个检测区,对呼吸道病毒具有免疫反应性的抗体固定在检测区上;
40.(3)或(4)包括含有缀合物的缀合物区,并且其中缀合物区设在样品施加区和检测区之间。
41.<13>根据<10>至<12>中任一项的呼吸道病毒检测试剂盒,其中包含阴离子表面活性剂的样品稀释剂中的阴离子表面活性剂的浓度为0.1~10质量%。
42.<14>根据<10>至<13>中任一项的呼吸道病毒检测试剂盒,其中生物样品是呼吸道分泌物。
43.<15>根据<10>至<14>中任一项的呼吸道病毒检测试剂盒,其中呼吸道病毒是乙型流感病毒。
44.<16>根据<10>至<15>中任一项的呼吸道病毒检测试剂盒,其中阴离子表面活性剂选自基于磺酸盐的阴离子表面活性剂、基于羧酸盐的阴离子表面活性剂、基于聚氧乙烯烷基醚硫酸钠的阴离子表面活性剂及其组合。
45.<17>一种用于使用呼吸道病毒抗体的免疫测定方法中的生物样品稀释剂,其中生物样品稀释剂包含阴离子表面活性剂。
46.<18>根据<17>的生物样品稀释剂,其中呼吸道病毒是流感病毒。
47.<19>根据<17>或<18>的生物样品稀释剂,其中阴离子表面活性剂的浓度为0.1~10质量%。
48.<20>根据<17>至<19>中任一项的生物样品稀释剂,其中生物样品是呼吸道分泌物。
49.<21>根据<17>至<20>中任一项的生物样品稀释剂,其中呼吸道病毒是乙型流感病毒。
50.<22>根据<17>至<21>中任一项的生物样品稀释剂,其中阴离子表面活性剂选自基于磺酸盐的阴离子表面活性剂、基于羧酸盐的阴离子表面活性剂、基于聚氧乙烯烷基醚硫酸钠的阴离子表面活性剂及其组合。
51.发明的有益效果
52.在本发明中,使可能含有呼吸道病毒的生物样品与阴离子表面活性剂接触,然后进行抗原抗体反应。由此,可以有效抑制由具有交叉抗原性的物质引起的非特异性反应。
53.附图简要说明
54.[图1]图1是本发明的一个实施方案中使用的测试条的示意图。
[0055]
[图2]图2是本发明的一个实施方案中使用的测试条的示意图。
[0056]
实施方案描述
[0057]
(呼吸道病毒)
[0058]
本发明中作为分析物的呼吸道病毒是引起呼吸道疾病的病毒。本发明的呼吸道病毒优选是可以使用抗原抗体反应检测的病毒。
[0059]
呼吸道病毒的例子包括但不限于冠状病毒,例如冠状病毒229e、冠状病毒oc43和冠状病毒nl63;流感病毒,例如甲型流感病毒、乙型流感病毒、丙型流感病毒、副流感病毒1、副流感病毒2和副流感病毒3;rs病毒,例如rs病毒a和rs病毒b;腺病毒;鼻病毒;偏肺病毒;巨细胞病毒;和博卡病毒。特别地,分析物优选是流感病毒,更优选乙型流感病毒。最优选地,在多个位置(例如,两个位置)形成稍后描述的检测区以检测甲型流感病毒和乙型流感病毒。
[0060]
在本说明书中,“呼吸道”是参与呼吸的器官的总称,是指从鼻前庭到肺泡(肺)的器官,包括鼻腔、咽、喉、气管、支气管和细支气管。
[0061]
(生物样品)
[0062]
本发明中使用的可能含有呼吸道病毒的生物样品的例子包括主要源自生物体的物质,例如体液;以及通过从这些物质中提取呼吸道病毒而制备的提取物。源自生物体的物质的具体例子包括血液、尿液、粪便和呼吸道分泌物。生物样品尤其优选为呼吸道分泌物,例如源自鼻孔、鼻腔、咽部、鼻咽部等的鼻涕;痰;或唾液。源自生物体的物质及其提取物可以直接作为样品使用,或者可以用样品稀释剂适当稀释以提供样品。它们也可以被适当地过滤以提供样品。样品稀释剂也可称为样本稀释剂、样品提取液、样品展开液、样品悬浮液等。所有这些都具有相同的含义。
[0063]
(阴离子表面活性剂)
[0064]
在本说明书中,阴离子表面活性剂是指一种表面活性剂,其含有当该表面活性剂溶解在水中时被负离子化的疏水基团。在本说明书中,当表面活性剂溶解在水中时不会离子化的表面活性剂称为非离子表面活性剂;含有当表面活性剂溶解在水中时被正离子化的疏水基团的表面活性剂,称为阳离子表面活性剂;在碱性范围内表现出阴离子表面活性剂性质而在酸性范围内表现出阳离子表面活性剂性质的表面活性剂称为两性表面活性剂。
[0065]
阴离子表面活性剂优选为基于磺酸盐的阴离子表面活性剂、基于羧酸盐的阴离子表面活性剂、基于聚氧乙烯烷基醚硫酸钠的阴离子表面活性剂等。阴离子表面活性剂更优选是选自β
‑
萘磺酸钠
‑
甲醛缩合物、特殊聚羧酸盐型聚合物表面活性剂、聚氧乙烯十二烷基醚硫酸钠、聚氧乙烯烷基醚硫酸钠及其组合的阴离子表面活性剂。更具体地,基于磺酸盐的阴离子表面活性剂的例子包括β
‑
萘磺酸钠
‑
甲醛缩合物(商品名:demol nl);基于羧酸盐的阴离子表面活性剂的例子包括特殊的聚羧酸盐类聚合物表面活性剂(商品名:demol ep);以及基于聚氧乙烯烷基醚硫酸钠的阴离子表面活性剂的例子包括聚氧乙烯十二烷基醚硫酸钠(商品名:emal 20c)和聚氧乙烯烷基醚硫酸钠(商品名:emal 20cm)。这些阴离子表面活性剂可以单独使用,也可以组合使用两种或更多种。
[0066]
在本说明书中,“基于磺酸盐的阴离子表面活性剂”是指作为含有磺酸盐基团(
‑
so3h)的物质的盐的表面活性剂;“基于羧酸盐的阴离子表面活性剂”是指作为含有羧酸盐基团(
‑
cooh)的物质的盐的阴离子表面活性剂;“基于聚氧乙烯烷基醚硫酸钠的阴离子表面活性剂”是指具有聚氧乙烯烷基醚硫酸钠化学结构的阴离子表面活性剂。
[0067]
只要不损害本发明的效果,除阴离子表面活性剂外,还可以使用其他种类的表面活性剂。优选不使用其他种类的表面活性剂。
[0068]
阴离子表面活性剂的浓度可以根据阴离子表面活性剂和免疫测定方法的类型适当调整。例如,从抑制非特异性反应的角度来看,关于含有阴离子表面活性剂且将与生物样品混合的样品稀释剂中的浓度,或关于含有阴离子表面活性剂且将用其浸渍不溶性膜的浸渍液中的浓度,阴离子表面活性剂的浓度为0.01至10质量%,优选0.1至10质量%,更优选0.2至10质量%,还更优选0.25至10质量%,最优选0.3至10质量%。浓度的上限可以是8质量%、5质量%、3质量%或2质量%。
[0069]
只要能够获得本发明的效果,使生物样品与阴离子表面活性剂接触的方式不受限制。阴离子表面活性剂可以包含在样品稀释剂中,或者可以预先存在于测量系统中。优选
地,阴离子表面活性剂包含在样品稀释剂中,并且生物样品与所得样品稀释剂混合。
[0070]
(缀合物)
[0071]
缀合物含有对呼吸道病毒具有免疫反应性的抗体,并且抗体被固定在标记物上。关于缀合物的存在方式,缀合物可以以浸渍在垫中的状态作为缀合物垫存在,与样品垫、第三垫和不溶性膜分开提供(a型),可以作为样品垫的一部分或不溶性膜的一部分中的缀合物区存在(b型),或者可以作为与样本混合的缀合物试剂单独存在(c型)。
[0072]
作为本发明中使用的标记物,可以使用通常用于检测呼吸道病毒的已知标记物。例如,标记物优选胶体金属颗粒,例如胶体金颗粒或胶体铂颗粒;有色乳胶颗粒;磁性粒子等。标记物特别优选胶体金颗粒。
[0073]
在检测流感病毒的情况下,缀合物优选是其中抗流感病毒单克隆抗体固定在胶体金颗粒上的缀合物。
[0074]
下面描述一测试条,其中缀合物的存在方式为a型。
[0075]
从样品流动方向的上游到下游,依次放置样品垫、缀合物垫、第三垫和不溶性膜。每一层被放置成使得该层的至少一部分与上游/下游层重叠。图1图示了具有这种配置的测试条的例子。
[0076]
当含有呼吸道病毒的样品被施加到测试条的样品垫上时,呼吸道病毒经过样品垫流向位于下游的缀合物垫。在缀合物垫中,呼吸道病毒接触缀合物,并在形成第一复合物(聚集体)的同时穿过该垫。此后,第一复合物穿过放置成与缀合物垫下侧接触的多孔第三垫,随后展开(develop)到不溶性膜中。
[0077]
在不溶性膜部分,固定了对呼吸道病毒具有免疫反应性的抗体。在此,发生免疫反应使第一复合物结合到对呼吸道病毒具有免疫反应性的抗体,导致形成固定的第二复合物。然后通过检测源自缀合物的信号例如吸光度、反射光、荧光或磁性的装置来检测固定的第二复合物。
[0078]
阴离子表面活性剂可以包含在样品稀释剂中,或者可以预先存在于测量系统中。例如,阴离子表面活性剂可以预先包含在样品垫中。
[0079]
下面描述一测试条,其中缀合物的存在方式为b型。
[0080]
与a型测试条的区别在于样品垫或不溶性膜与缀合物垫一体化。图2图示了测试条的例子,其具有其中样品垫的一部分由样品施加区和缀合物区构成的配置。
[0081]
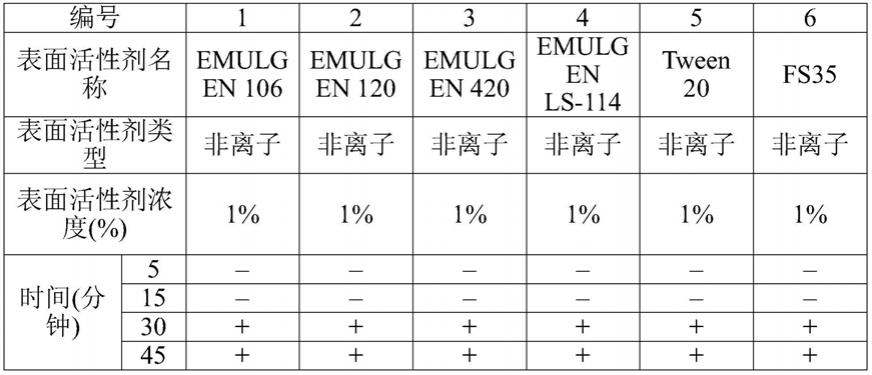
样品施加区是施加含有呼吸道病毒的样品的区域,并且缀合物区是含有缀合物的区域。样品施加区位于缀合物区的上游。
[0082]
缀合物区形成在样品垫或不溶性膜中,使得缀合物区位于样品施加区的下游。缀合物区优选放置成在垂直于样品展开方向的方向上形成线形,即垂直于连接样品垫中的样品施加区的中心和后文提到的不溶性膜的下游端的中心的线。换言之,线形缀合物区优选放置成在垂直于样品垫和不溶性膜的纵向方向的方向上形成线形。尽管缀合物区可以存在于不溶性膜中,使得缀合物区位于检测区的上游,但优选在样品垫中形成。在这种情况下,样品垫中缀合物区的下游侧不必完全被缀合物区占据,并且进一步地,缀合物区的下游侧可以具有不含缀合物的多孔材料部分。
[0083]
本领域技术人员可以适当调整缀合物区的位置。线形缀合物区的线的中心线优选位于样品垫下游端上游至少3mm处。在本说明书中,缀合物区或检测区的“中心线”是指在垂
直于样品垫纵向方向绘制的中心线,而不是在平行于样品垫纵向方向绘制的中心线。
[0084]
施加到样品施加区的含有呼吸道病毒的样品从上游迁移到下游。在缀合物区,呼吸道病毒和缀合物形成第一复合物。第一复合物进一步向下游迁移。然后第一复合物与固定在检测区的抗体形成第二复合物。在检测区,抗体对呼吸道病毒具有免疫反应性。然后通过检测源自缀合物的信号例如吸光度、反射光、荧光或磁性的装置来检测固定到检测区的第二复合物。
[0085]
阴离子表面活性剂可以包含在样品稀释剂中,或者可以预先存在于测量系统中。例如,阴离子表面活性剂可以预先包含在样品垫中。
[0086]
下面描述一测试条,其中缀合物的存在方式为c型。
[0087]
与a型测试条的不同之处在于没有缀合物垫,缀合物作为缀合物试剂单独存在。例如,使用具有其中含有缀合物的过滤器的过滤嘴。样品稀释剂和呼吸道病毒穿过过滤嘴,使缀合物与呼吸道病毒结合,从而形成第一复合物(聚集体)。将含有第一复合物的过滤物施加到与a型相同的测试条(除了此测试条不含缀合物垫)上。借此,在检测区中形成第二复合物,对呼吸道病毒具有免疫反应性的抗体固定在该检测区上。然后通过检测源自缀合物的信号例如吸光度、反射光、荧光或磁性的装置来检测固定的第二复合物。
[0088]
(与呼吸道病毒具有免疫反应性的抗体)
[0089]
本发明中使用的与呼吸道病毒具有免疫反应性的抗体是能够与呼吸道病毒结合的抗体。与呼吸道病毒具有免疫反应性的抗体被固定到标记物和检测区。尽管固定到标记物和检测区的抗体可以是相同的,但是对于标记物和检测区优选使用不同的抗体。通过使用固定到标记物的抗体和固定到检测区的抗体不同的抗体,可以抑制在免疫层析测试条中,在与缀合物结合的呼吸道病毒和检测区内的抗体之间的反应同与缀合物结合的呼吸道病毒和未反应的缀合物之间的反应之间的竞争。此外,可以增加与缀合物结合的呼吸道病毒和检测区中的抗体之间的反应性。因此,免疫层析测试条可以具有良好的灵敏度。不同的抗体是指抗体的类型不同,即抗体识别的表位不同。
[0090]
固定到标记物和检测区的抗体优选是单克隆抗体。通过使用单克隆抗体,可以提高反应的特异性。
[0091]
除了这些抗体的整个分子之外,具有抗原
‑
抗体反应活性的抗体的功能片段同样被视为本发明中的抗体。抗体的功能片段的例子包括通过动物免疫过程获得的那些、使用基因重组技术获得的那些和嵌合抗体。抗体的功能片段的例子包括f(ab’)2和fab’。这些功能片段可以通过用蛋白酶(例如胃蛋白酶或木瓜蛋白酶)处理抗体来产生。
[0092]
(样品垫)
[0093]
样品垫层铺在缀合物垫或后述的不溶性膜上,使得样品垫下游端的下侧与缀合物垫或不溶性膜的上侧接触。构成样品垫的多孔材料的例子包括由无纺纤维制成的垫,例如纸、纤维素混合物、硝基纤维素、聚酯、丙烯腈共聚物、玻璃和人造丝。垫特别优选由玻璃纤维制成(玻璃纤维垫)。
[0094]
(第三垫)
[0095]
在a型测试条中,为了去除生物样品中的非特异性反应物质,将第三垫置于缀合物垫和不溶性膜之间。根据样品等的特性,在必要时优选放置第三垫。第三垫不受限制,只要样品中呼吸道病毒与缀合物的复合物能够穿过第三垫即可。
[0096]
(不溶性膜)
[0097]
可用于本发明的不溶性膜含有至少一个检测区,与呼吸道病毒具有免疫反应性的抗体固定在该检测区上。可通过已知方法将与呼吸道病毒具有免疫反应性的抗体固定在不溶性膜上。在用于横向流动免疫层析的试剂的情况下,制备含有预定浓度的抗体的溶液。此后,使用例如具有能够在水平方向移动同时以恒定速率从喷嘴排出溶液的机构的设备,将溶液施加到不溶性膜以形成线形。通过干燥所施加的溶液,可以将抗体固定到不溶性膜。
[0098]
可以通过向缓冲液中加入抗体来制备含有预定浓度抗体的溶液。缓冲液的种类的例子包括常规使用的缓冲液,例如磷酸盐缓冲液、tris缓冲液和good’s缓冲液。缓冲液具有优选为6.0至9.5的ph范围,更优选为6.5至8.5,又更优选为7.0至8.0。缓冲液还可含有:盐,如氯化钠;稳定剂,如糖;防腐剂;和消毒剂(antiseptics),如proclin。盐的例子不仅包括为了调节离子强度而添加的那些,例如氯化钠,而且包括为了调节缓冲剂的ph而添加的那些,例如氢氧化钠。
[0099]
在将抗体固定到不溶性膜上之后,可以通过用常规使用的封闭剂的溶液或蒸气包被而将除抗体固定部位以外的部分封闭。
[0100]
构成可用于本发明的不溶性膜的膜的例子包括已知的膜,所述膜已常规用作免疫层析测试条的不溶性膜。膜的例子包括由纤维所构成的膜,该纤维由聚乙烯;聚对苯二甲酸乙二酯;尼龙;玻璃;多糖如纤维素或纤维素衍生物;或陶瓷制成。膜的具体例子包括可从sartorius、millipore、toyo roshi kaisha,ltd.、whatman等商购获得的玻璃纤维滤纸和硝化纤维素膜。
[0101]
可用于本发明的免疫层析测试条优选在不溶性膜的下游端设有吸收垫。吸收垫是具有液体吸收能力的部分。吸收垫通过吸收已经迁移/穿过不溶性膜的样品来控制样品的展开。作为吸收垫,可以使用常规用于免疫层析测试条的公知的吸收垫。例如,可以使用滤纸。
[0102]
说明书中的非特异性反应是指检测到源自缀合物的信号,因此判断生物样品为阳性,尽管事实上在生物样品中不存在呼吸道病毒作为分析物,或者尽管事实上基本上不存在病毒,因为例如,病毒的丰度低于检测极限。本发明的包括步骤(a)至(d)的呼吸道病毒免疫测定方法可以是包括步骤(a)至(d)的、抑制呼吸道病毒免疫测定方法中的非特异性反应的方法,或者可以优选地是包括步骤(a)至(d)的抑制流感病毒免疫测定方法中的非特异性反应的方法,或者可以更优选地是包括步骤(a)至(d)的抑制乙型流感病毒免疫测定方法中的非特异性反应的方法。
[0103]
(免疫层析测试条)
[0104]
在本说明书中,“免疫层析”是指利用诸如纤维素膜的多孔质材料的性质的免疫测定法,该性质使测试样本在溶解试剂的同时缓慢地流过(毛细管现象)。免疫层析测试条优选放置在固体支持物例如塑料粘合片上。固体支持物由不阻碍样品和缀合物的毛细流动的物质构成。可以使用粘合剂等将免疫层析测试条固定在固体支持物上。在这种情况下,粘合剂等的组分也由不阻碍样品和缀合物的毛细管流动的物质构成。为增加不溶性膜的机械强度,并防止测定过程中水分蒸发(干燥),测试条可与聚酯膜等层压。考虑到免疫层析测试条的尺寸、添加样品的方法、添加样品的位置、每个检测区在不溶性膜中形成的位置、信号的检测方法等,免疫层析测试条可以在将测试条储存或安装在适当的容器(外壳)中的状态下
使用。在这种状态下储存或安装的测试条被称为“装置”。
[0105]
(其他)
[0106]
适当时,可以通过修改或改变实施例中描述的方法来制备免疫层析测试条。
实施例
[0107]
下面通过实施例具体描述本发明。然而,这些并不限制本发明的范围。在说明中,除非另有说明,“%”表示“质量%”。
[0108]
[抗流感病毒单克隆抗体的制备]
[0109]
以下试验中所用的抗甲型流感病毒单克隆抗体和抗乙型流感病毒单克隆抗体是通过使用重组流感核蛋白作为抗原,通过本领域技术人员生产单克隆抗体所常规使用的方法对小鼠进行免疫获得的。
[0110]
[测试条制备实施例1]免疫层析测试条的制备
[0111]
1)胶体金颗粒标记的抗流感病毒单克隆抗体(缀合物)的制备
[0112]
制备含有浓度为100μg/ml的抗甲型流感病毒单克隆抗体的pbs和含有浓度为100μg/ml的抗乙型流感病毒单克隆抗体的pbs。向20ml 1od/ml胶体金颗粒溶液中加入1ml各抗体溶液,并将每种所得混合物在室温下搅拌10分钟。向胶体金颗粒/抗甲型流感病毒单克隆抗体混合物和金胶体颗粒/抗乙型流感病毒单克隆抗体混合物每种中加入2ml 10%牛血清白蛋白(bsa)水溶液,将每种得到的混合物搅拌5分钟,然后在10℃以10,000rpm离心45分钟以获得沉淀物(缀合物)。向获得的每种缀合物中加入缀合物稀释缓冲液(由scripps制造),并将缀合物悬浮在其中。
[0113]
2)样品垫的制备
[0114]
将上述1)中制备的各缀合物与含有1.33%酪蛋白和4%蔗糖(ph 7.5)的溶液混合到8至20od/ml的浓度,以制备缀合物溶液。用缀合物溶液浸泡具有28mm总长度的玻璃纤维垫,从而形成具有4mm线宽的线。通过在70℃加热30分钟来干燥垫,以提供含有缀合物区的样品垫。
[0115]
3)固定抗流感病毒单克隆抗体的不溶性膜(抗体固定化膜)的制备
[0116]
将浓度分别调整为0.75mg/ml、1.0mg/ml和0.75mg/ml的抗甲型流感病毒单克隆抗体、抗乙型流感病毒单克隆抗体和抗小鼠igg抗体,与磷酸盐缓冲液一起施加到硝酸纤维素膜(孔径,8μm)的短侧端,以在垂直于不溶性膜的纵向方向的方向上形成线。此后,将膜在70℃干燥45分钟以提供抗体固定膜。施加这些线,使得在组装测试条时,抗甲型流感病毒单克隆抗体(c1)、抗乙型流感病毒单克隆抗体(c2)和对照抗体(c3)从上游侧以此顺序排列。
[0117]
4)免疫层析测试条的制备
[0118]
将2)中制备的样品垫层铺在3)中得到的不溶性膜上,制备免疫层析测试条。
[0119]
[实施例1]
[0120]
使用在测试条制备实施例1中制备的免疫层析测试条进行甲型流感病毒和乙型流感病毒的检测试验。
[0121]
1.测试方法
[0122]
(1)样品
[0123]
来自未感染流感的健康受试者的鼻粘液与含有1%浓度的各种表面活性剂的样品
稀释剂混合,以提供每种样品。
[0124]
(2)程序
[0125]
将135μl在(1)中制备的各样品分装到试管中,将免疫层析测试条插入试管中,5、15、30和45分钟后目视判断检测区中抗体固定膜上测试线a和b是否存在显色。
[0126]
2.测试结果
[0127]
测试线b是否存在显色的判断结果如表1和2所示。测试线b指示检测到乙型流感病毒。
[0128]
[表1]
[0129][0130]
[表2]
[0131][0132]
demol、emal、amphitol、emulgen和tween是注册商标。
[0133]
在表中,
“‑”
表示测试线b没有显色。测试线b指示检测到乙型流感病毒。因此,
“‑”
指示不存在假阳性结果。“+”表示线显色,指示假阳性结果的出现。所有加入非离子表面活性剂的样品在插入免疫层析条30分钟后均显示出非特异性反应,而加入阴离子表面活性剂或两性表面活性剂的样品均未显示出非特异性反应。被测样品均未在检测线a中显示出非特异性反应。检测线a指示检测到甲型流感病毒。因此表明,向样品稀释剂中加入阴离子表面活性剂或两性表面活性剂能够防止乙型流感病毒检测中的非特异性反应。
[0134]
[实施例2]
[0135]
1.测试方法
[0136]
除了使用不同类型和浓度的表面活性剂外,以与实施例1相同的方式进行甲型流感病毒和乙型流感病毒的检测试验。
[0137]
2.测试结果
[0138]
测定测试线b是否存在显色的结果如表3、4和5所示。测试线b指示检测到乙型流感病毒。
[0139]
[表3]
[0140][0141]
[表4]
[0142][0143]
[表5]
[0144][0145]
在表3
‑
5中,
“‑”
表示测试线b没有显色。测试线b指示检测到乙型流感病毒。因此,
“‑”
指示不存在假阳性结果。“+”表示线的检测和显色,指示假阳性结果的出现。加入0.5%emal 20cm的样品没有显示出非特异性反应,但加入0.25%emal 20cm的样品在反应45分钟后轻微显示出非特异性反应。加入0.5%amphitol 20n的样品在反应30分钟后显示出非特
异性反应。
[0146]
加入0.5%至2.00%emal 20c的样品未显示出非特异性反应,但加入0.25%emal 20c的样品在反应45分钟后轻微显示出非特异性反应。
[0147]
因此发现,即使在表面活性剂的浓度低的情况下,阴离子表面活性剂对于抑制在乙型流感病毒检测中发生的非特异性反应也是有效的。所测样品均未在甲型流感病毒检测中显示出非特异性反应。
[0148]
[实施例3]
[0149]
1.测试方法
[0150]
为了验证再现性,使用来自未感染流感的另一健康受试者的鼻粘液以与实施例2相同的方式进行甲型和乙型流感病毒的检测试验。
[0151]
2.测试结果
[0152]
检测线b是否存在显色的判断结果如表6和表7所示。检测线b指示检测到乙型流感病毒。
[0153]
[表6]
[0154][0155]
[表7]
[0156][0157]
在表6和表7中,
“‑”
表示检测线b不显色。检测线b指示检测到乙型流感病毒。因此,
“‑”
指示不存在假阳性结果。“+”表示线的检测和显色,指示假阳性结果的出现。与实施例2类似,加入0.5%至2.00%emal 20c的样品未显示出非特异性反应,但加入0.25%emal 20c的样品在反应45分钟后轻微显示出非特异性反应。因此可以确认实施例2的再现性。所有测
试样品均未显示出对甲型流感病毒的非特异性反应。
[0158]
工业适用性
[0159]
通过本发明,可以在抑制非特异性反应的同时进行呼吸道病毒的免疫测定。
[0160]
附图标记列表
[0161]
(a)塑料粘合片
[0162]
(b)不溶性膜
[0163]
(c1)测试线a
[0164]
(c2)测试线b
[0165]
(c3)对照线
[0166]
(d)缀合物垫
[0167]
(e)样品垫
[0168]
(f)吸收垫
[0169]
(g)第三垫
[0170]
(h)缀合物区
[0171]
(i)膜
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1