可用于离子交换色谱和质谱分析的方法、组合物和试剂盒与流程
可用于离子交换色谱和质谱分析的方法、组合物和试剂盒
1.相关申请的交叉引用
2.本技术要求于2019年3月8日提交的美国临时专利申请号62/815,514的权益和优先权,其全部内容以引用方式并入。
技术领域
3.本公开涉及可用于多种分析物的增强梯度离子交换色谱的方法、组合物和试剂盒。
背景技术:
4.离子交换色谱(iex)已广泛应用于蛋白质的分离和分析。在iex中,基于蛋白质与固定相上存在的带相反电荷的部分的离子相互作用来分离蛋白质。在其中ph低于等电点(pi)的条件下,蛋白质带正电。随着流动相ph增加,蛋白质逐渐失去正电荷并变为中性,然后带负电。在阳离子交换色谱中,带正电的蛋白质吸附到带负电的固定相中。可通过盐或ph梯度机制使这些蛋白质洗脱。在盐梯度分离中,具有更多电荷的蛋白质需要更高浓度的盐,而在ph梯度技术中,具有不同pi的蛋白质可通过流动相ph的变化来分离。
5.在实施过程中,1ex用于分析许多不同类型的生物分子和许多不同类型的蛋白质。可从这些分离中收集大量信息,特别是当将它们应用于蛋白质治疗剂的分析时。作为一种类型的蛋白质治疗剂,单克隆抗体(mab)已用于治疗许多疾病。作为生产的内在结果,需要仔细表征蛋白质治疗剂的翻译后修饰(ptm),因为微小的结构差异可对药物稳定性、效力和功效具有显著影响。一些修饰,诸如脱酰胺化、唾液酸化、c
‑
末端赖氨酸变异等,引起蛋白质净电荷的改变。iex是检测和监测这些独特蛋白质变体的形成的有价值的手段。
6.然而,由于在盐梯度方法和ph梯度方法两者中普遍使用高离子强度的非挥发性缓冲液,详细分析的大多数示例依赖于耗时的离线级分收集或麻烦的多维lc质谱(ms)。更理想的是,期望实现基于有利于与质谱直接耦合的挥发性流动相组合物的优化、稳固的iex分离。迄今为止,已公布了两种示例性iex
‑
ms分析。leblanc和同事开发了一种用于利用中间朝上方法对mab进行电荷变体表征的双盐/ph梯度方法。leblanc,y.;ramon,c.;bihoreau,n.;chevreux,g.,“通过与天然质谱在线联接的离子交换色谱对单克隆抗体的电荷变体进行表征:在+5℃下长期储存后的案例研究(charge variants characterization of a monoclonal antibody by ion exchange chromatography coupled on
‑
line to naive mass spectrometry:case study after a long
‑
term storage at+5degrees c)”,journal of chromatography.b,analytical technologies in the biomedical and life sciences 2017,1048,130
‑
139。在该工作中,使用挥发性盐甲酸铵和乙酸铵在3.9至7.4的ph范围内,在天然条件下用iex
‑
ms直接分析mab的ides消化亚基。在实践中,已经证明用该技术获得的ms的色谱分辨率和质量是不理想的,并且流动相组成由于具有比所需更多的组分而不必要地复杂化,因为其继续甲酸铵和乙酸铵两者。最终,盐加合物的丰度损害了来自该方法的质谱的可判读性,并且其取决于高盐浓度。最近,f
ü
ssl和同事开发了基于碳
酸氢铵、乙酸和氢氧化铵的ph梯度方法。fussl,f.;cook,k.;scheffler,k.;farrell,a.;mittermayr,s.;bones,j.,“使用直接联接ph梯度阳离子交换色谱进行高分辨率天然质谱的单克隆抗体的电荷变体分析(charge variantanalysis of monoclonal amibodies using direct coupled ph gradient cation exchange chromatography to high
‑
resolution native mass spectrometry.)”analytical chemistry 2018,90(7),4669
‑
4676。该流动相体系在5.3至10.18的ph范围内提供相对恒定的电导率,以分析具有不同pi的完整mab。然而,针对每种分析物需要对梯度进行微调,并且由于流动相包含碳酸氢铵,在所得ms谱中容易观察到二氧化碳加合物。
技术实现要素:
7.本公开提供了促进分析物的梯度离子交换色谱的新型方法、流动相组合物和试剂盒。本公开的方法、流动相组合物和试剂盒是有利的,因为它们与分析物的ms检测相容。
8.在各个方面,本公开涉及色谱洗脱试剂盒,该色谱洗脱试剂盒包括(a)具有第一ph并包含第一浓度的第一有机酸盐的第一水性缓冲溶液和(b)具有第二ph并包含第二浓度的第一有机酸盐的第二水性缓冲溶液,其中第一有机酸盐包括第一有机酸铵盐,其中第二ph大于第一ph,并且其中第二浓度大于第一浓度。
9.在可结合上述方面中的任一个使用的一些实施方案中,第一水性缓冲溶液和第二水性缓冲溶液中的每一种包含小于20%、小于10%、小于5%、或小于1%的不同于第一有机酸铵盐的第二有机酸铵盐。
10.在可结合上述方面中的任一方面使用的一些实施方案中,第一有机酸盐基本上由第一有机酸铵盐组成。
11.在可结合上述方面中的任一个使用的一些实施方案中,第一有机酸铵盐是第一水性缓冲溶液和第二水性缓冲溶液中的每一者中的唯一有机酸铵盐。
12.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,第一水性缓冲溶液和第二水性缓冲溶液中的每一者不包含碳酸氢铵。
13.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,第一水性缓冲溶液和第二水性缓冲溶液各自具有小于100ppb、有利地小于20ppb的钠和钾浓度。
14.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,第一水性缓冲溶液具有介于4和6之间,更有利地介于4.5和5.5之间的ph,以及介于20mm和120mm之间,更有利地介于40mm和100mm之间的浓度。
15.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,第二水性缓冲溶液具有介于7.5和9.0之间,更有利地介于8和8.5之间的ph,以及介于100mm和300mm之间,更有利地介于120mm和200mm之间的浓度。
16.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,第一水性缓冲溶液具有0.1毫西门子(ms)至10ms范围内的电导率,并且第二水性缓冲溶液具有3ms至100ms范围内的电导率。
17.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,ph对第一水性缓冲溶液相对于第一水性缓冲溶液和第二水性缓冲溶液的二元混合物的总体积的体积百分比的曲线图是线性的。
18.如本文所用,当线性最小二乘回归分析产生至少0.90、更典型地至少0.95的测定系数(r2)值时,一个变量对另一个变量的曲线图是“线性的”。
19.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,电导率对第一水性缓冲溶液相对于第一水性缓冲溶液和第二水性缓冲溶液的二元混合物的总体积的体积百分比的曲线图是线性的。
20.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,电导率对第一水性缓冲溶液相对于第一水性缓冲溶液和第二水性缓冲溶液的二元混合物的总体积的体积百分比的曲线图不表现出负斜率。
21.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,色谱洗脱试剂盒还包括用于稀释第一水性缓冲溶液和第二水性缓冲溶液中的每一者的说明书,当遵循所述说明书时得到具有介于4和6之间,更有利地介于4.5和5.5之间的ph并且第一有机酸铵盐的浓度介于20mm和120mm之间,更有利地介于40mm和100mm之间的稀释的第一水性缓冲溶液,以及具有介于7.5mm和9.0mm之间,更有利地介于8mm和8.5mm之间的ph,并且第一有机酸铵盐的浓度介于100mm和300mm之间,更有利地介于120mm和200mm之间的稀释的第二水性缓冲溶液。
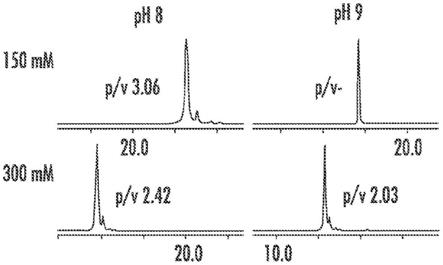
22.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,稀释的第一水性缓冲溶液具有0.1ms至10ms范围内的电导率,并且稀释的第二水性缓冲溶液具有3ms至100ms范围内的电导率。
23.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,ph对稀释的第一水性缓冲溶液相对于稀释的第一水性缓冲溶液和稀释的第二水性缓冲溶液的二元混合物的总体积的体积百分比的曲线图是线性的。
24.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,电导率对稀释的第一水性缓冲溶液相对于稀释的第一水性缓冲溶液和稀释的第二水性缓冲溶液的二元混合物的总体积的体积百分比的曲线图是线性的。
25.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,电导率对稀释的第一水性缓冲溶液相对于稀释的第一水性缓冲溶液和稀释的第二水性缓冲溶液的二元混合物的总体积的体积百分比的曲线图不表现出负斜率。
26.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,第一有机酸铵盐由以下形成:(a)有机酸阴离子,该有机酸阴离子选自甲酸根、乙酸根、二氟乙酸根、三氟乙酸根、丙酸根、丁酸根、碳酸根、碳酸氢根、草酸根、丙二酸根、琥珀酸根、马来酸根、戊二酸根、乙醇酸根、乳酸根、苹果酸根、柠檬酸根或葡糖酸根,和(b)铵阳离子,该铵阳离子选自铵、单烷基铵、二烷基铵、三烷基铵或四烷基铵。
27.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,第一有机酸铵盐选自甲酸铵、乙酸铵、四甲基甲酸铵、四甲基乙酸铵、三乙基乙酸铵或三乙基甲酸铵。
28.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,第一水性缓冲溶液和第二水性缓冲溶液中的每一者容纳在不含玻璃的容器中,例如聚合物容器,诸如由聚烯烃诸如聚乙烯(例如hdpe)或含氟聚合物诸如聚四氟乙烯(ptfe)形成的那些。
29.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,第一水性缓冲溶液和第二水性缓冲溶液中的每一者还包含浓度范围为1%至50%的可混溶有机共溶剂。
例如,除了其他可能性之外,可混溶的有机共溶剂选自乙腈、甲醇、乙醇、正丙醇或异丙醇。
30.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,为了延长货架期,第一水性缓冲溶液和第二水性缓冲溶液可与痕量的杀菌剂(包括但不限于约100ppm至400ppm的氯仿)一起配制。
31.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,为了延长货架期,第一水性缓冲溶液和第二水性缓冲溶液可与吸氧材料一起包装。
32.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,色谱洗脱试剂盒还包括离子交换色谱材料。
33.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,色谱洗脱试剂盒还包括离子交换色谱材料和分离装置(例如,柱、样品制备装置、离心/旋转柱或微洗脱板),该分离装置包括具有入口和出口的壳体,该壳体被构造用于接受和保持离子交换色谱材料。
34.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,色谱洗脱试剂盒还包括阳离子交换色谱材料。阳离子交换色谱材料可以包含(例如)羧酸根基团、磺酸根基团、或这两者。
35.在其他方面,本公开涉及用于分析包含多种分析物的样品的方法,该方法包括:根据上述方面和实施方案中的任一者将样品装载到离子交换色谱材料上,从而使多种分析物结合到离子交换色谱材料;以及用流动相从离子交换色谱材料中洗脱多种分析物,该流动相包含不同量的(a)根据上述方面和实施方案中的任一者的第一水性缓冲溶液和(b)根据上述方面和实施方案中的任一者的第二水性缓冲溶液,从而分离多种分析物中的至少一些。
36.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,第一水性缓冲溶液的体积百分比在洗脱过程中降低并且第二水性缓冲溶液的体积百分比在洗脱过程中增加。
37.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,第一水性缓冲溶液的体积百分比在洗脱期间从100%降低至0%,并且第二水性缓冲溶液的体积百分比在洗脱期间从0%增加至100%。
38.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,在洗脱过程中第二水性缓冲溶液的体积百分比存在线性增加。
39.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,使用自动化系统来混合第一水性缓冲溶液和第二水性缓冲溶液以形成流动相。
40.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,所述方法包括改变第一水性缓冲溶液、第二水性缓冲溶液和水的量。在这些实施方案的一些中,自动化系统可用于混合第一水性缓冲溶液、第二水性缓冲溶液和水。
41.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,方法可还包括检测多种分析物。在这些实施方案的一些中,可使用质谱技术诸如电喷雾电离质谱来检测多种分析物。
42.在可结合上述方面和实施方案中的任一者使用的一些实施方案中,多种分析物包括多种生物分子。
43.在可结合上述方面和实施方案中的任一者使用的各种实施方案中,多种分析物可包括多种肽或多种蛋白质,包括多种mab蛋白、多种非mab蛋白、多种融合蛋白、多种抗体药物缀合物(adc)等。在某些实施方案中,多种分析物可包含pi值在6至10范围内以及其他可能的值的多种蛋白质。
附图说明
44.图1a
‑
1d示出由sec
‑
ms得出的归一化ms响应,观察到其为流动相ph和离子强度的函数。示出来自尺寸排阻色谱(sec)
‑
ms的ides消化的(示于图1a中)和完整的nist mab(示于图1b中)的归一化ms信号响应,其中具有不同ph值的50mm乙酸铵流动相。还示出在sec
‑
ms上,用不同离子强度的ph 5乙酸铵流动相,ides消化的(示于图1c中)和完整的nist mab(示于图1d中)的归一化ms信号响应。对于图1a
‑
1d,ides消化的nist mab的归一化ms信号响应计算为提取的离子色谱图中m/z 4245.8
±
1.5和3376.7
±
1.5的总峰面积与uv色谱图中ides nistmab洗脱窗中的总峰面积的百分比比率。完整nist mab的归一化ms信号响应计算为提取的离子色谱图中m/z 5295.1
±
1.5的峰面积与uv色谱图中完整nist mab洗脱窗中的总峰面积的百分比比率。ms信号响应在4.6mm
×
150mm acquity uplc蛋白beh sec柱(1.7μm)上用与xevo g2
‑
s qtof质谱仪联接的acquityi
‑
class system测量。分离条件可在实施例1中找到。图1a
‑
1d示出相比于离子强度的增加,流动相ph的增加对单克隆抗体(mab)的完整和ides消化的亚基的质谱(ms)信号的影响更大。
45.图2a
‑
2c示出了流动相的ph和离子强度对mab的在线iex
‑
ms分析的效应。示出获得的nist mab(示于图2a中)连同ph(示于图2b中)和电导率迹线(示于图2c中)的uv色谱图,其中流动相由作为缓冲液a的50mm甲酸铵(ph 3.9)和作为缓冲液b的150mm或300mm乙酸铵(ph 8.0或9.0)组成。在图2a
‑
2c中,在具有acquityh
‑
class bio system的2.1
×
50mm bioresolve scx mab柱上获取色谱图,并且用ge医疗监测器ph/c
‑
900获得ph和电导率迹线。分离条件可在实施例2中找到。
46.图3a
‑
3c示出了用于mab的在线iex
‑
ms分析的甲酸铵/乙酸铵对仅乙酸铵的流动相。示出完整nist mab的uv色谱图(示于图3a中)和归一化ms信号响应(示于图3b中),以及ph和电导率迹线(示于图3c中),它们是周由40mm甲酸铵、50mm乙酸铵(ph 5.0)或90mm乙酸铵(ph 5.0)作为缓冲液a、200mm乙酸铵(ph 8.2)作为缓冲液b组成的流动相体系获得的,线性梯度为0%至100%的b,从1.7至20.0分钟。在图3a
‑
3c中,在具有acquityh
‑
class bio system的2.1
×
50mm bioresolve scx mab柱上采集色谱图,并且用ge医疗监测器ph/c
‑
900获得ph和电导率迹线,并且归一化ms信号响应在2.1
×
50mm bioresolve scx mab柱上测量为基峰色谱图和uv色谱图中的总峰面积的千分位数比率,该柱具有与xevo g2
‑
s qtof质谱仪联接的acquityi
‑
class system。分离条件可在实施例2和实施例3中找到。
47.图4a
‑
4c示出了附加的流动相离子强度和梯度优化,以改善用于在线iex
‑
ms分析的完整和ides消化的mab的分辨率。示出了用由以下物质组成的流动相获得的uv色谱图:作为缓冲液a的90mm乙酸铵ph 5.0和作为缓冲液b的200mm乙酸铵ph 8.4(图4a)、作为缓冲液a的45mm乙酸铵ph 5.0和作为缓冲液b的150mm乙酸铵ph 8.4(图4b)、或作为缓冲液a的20mm
乙酸铵ph 5.0和作为缓冲液b的120mm乙酸铵ph 8.4(图4c)。在图4a
‑
4c中,在具有acquityi
‑
class system的2.1
×
50mm bioresolve scx mab柱上获取色谱图。分离条件可在实施例3中找到。
48.图5a
‑
5c示出了用于改善用于在线iex
‑
ms分析的完整和ides消化的mab的分辨率的流动相优化。用流动相获取完整英夫利昔单抗和ides消化的曲妥珠单抗的uv色谱图,流动相由以下物质组成:作为缓冲液a的25mm碳酸氢铵30mm乙酸ph 5.3和作为缓冲液b的2mm乙酸中的10mm氢氧化铵ph 10.18(如图5a所示)、作为缓冲液a的50mm甲酸铵ph 3.9和作为缓冲液b的500mm乙酸铵ph 7.4(示于图5b中)、或作为缓冲液a的45mm乙酸铵ph 5.0和作为缓冲液b的150mm乙酸铵ph 8.4(示于图5c中)。在图5a
‑
5c中,在具有acquityi
‑
class system的2.1
×
50mm bioresolve scx mab柱上获取色谱图。分离条件可在实施例3中找到。
49.图6a
‑
6c示出了用于mab的在线iex
‑
ms分析的流动相制备的最佳实践。用流动相获取ides消化的英夫利昔单抗和完整的nist mab的质谱,该流动相由以下物质组成:作为缓冲液a的90mm乙酸铵ph 5.0和作为缓冲液b的200mm乙酸铵ph 8.4,其用lc/ms级水在玻璃瓶和玻璃实验室器皿中制备(图6a中所示)、或用0.2μm过滤的18.2mω水和塑料实验室器皿制备,其中ph测量使用填充有3m氯化钾的玻璃电极(示于图6b中),并且ph测量不使用填充有3m氯化钾的玻璃电极(示于图6c中)。在图6a
‑
6c中,利用与xevo g2
‑
s qtof质谱仪联接的acquityi
‑
class system在2.1x50mm bioresolve scx mab柱上获取质谱。分离条件可在实施例3中找到。
具体实施方式
50.本文描述了流动相及其使用方法,其提供稳健性和可直接联接到电喷雾电离质谱的蛋白质的高分辨率iex分离。从下面的某些有益实施方案的详细描述中可以看出,已开发出铵盐溶液。
51.具体地讲,下文描述了挥发性流动相体系,其基于具有某些有益ph值、浓度和/或纯度的铵盐溶液,考虑到与离子交换色谱无关的蛋白质电喷雾电离效应。还通过尺寸排阻色谱(sec)
‑
ms研究了流动相ph和离子强度的效应,以获得对蛋白质离子化效率的正交视图和潜在的方法考量。通过将50mm乙酸铵流动相的ph从5增加到7至9来研究流动相ph的效应。研究完整和ides消化的nist mab(参考材料8671)。使用不同ph的缓冲液,未观察到ides消化的或完整的nist mab的电荷态分布的变化。将ides消化的nist mab的ms信号响应归一化为提取的离子色谱图中m/z 4245.8
±
1.5和3376.7
±
1.5的总峰面积(分别对应于f(ab’)2和(fc/2)2亚基的最丰富电荷态)与uv色谱图中ides nist mab洗脱窗中的总峰面积的比率。将完整nist mab的ms信号响应归一化为提取的离子色谱图中m/z 5295.1
±
1.5的峰面积(其对应于完整nist mab的最丰富的电荷态)与uv色谱图中完整nist mab洗脱窗口中的总峰面积的比率。当缓冲液ph从5增加至9时,在ides消化的和完整的nist mab上都观察到ms信号响应的主要下降(图1a和图1b)。同时,通过将乙酸铵流动相的浓度从50mm增加到300mm同时将ph保持在5来研究流动相离子强度的效应。使用不同浓度的缓冲液,在ides消化的或完整的nist mab上未观察到电荷态分布的变化。当乙酸铵浓度从50mm增加到300mm时,仅观察到信号强度的微小降低(图1c和图1d)。这些观察支持使用本公开的双ph/盐梯度
方法,如应用于ides消化的和完整的mab的1ex
‑
ms分析。即,据信仅ph梯度的方法将表现出较低的ms灵敏度,并且仅盐梯度的方法将需要对ph进行调整以使其适用于不同的分析物。
52.为了评估具有离子交换色谱的挥发性流动相体系的分辨能力,再次分析完整和ides消化的nist mab(参考材料8671)、英夫利昔单抗和曲妥珠单抗。nist mab的第一赖氨酸变体的峰
‑
谷比率(p/v)值由uv色谱图计算。执行方法优化以确定流动相体系中洗脱缓冲溶液的ph和离子强度。使用50mm甲酸铵ph 3.9作为初始缓冲溶液(缓冲液a)与150mm或300mm乙酸铵ph 8.0或9.0作为洗脱缓冲溶液(缓冲液b)之间的线性梯度监测高pi mab即nist mab(pi为9.23)的保留和分辨率。如在2.1
×
50mm强阳离子交换固定相上获取的uv色谱图中所证实的,使用包含ph为8的150mm乙酸铵的洗脱液观察到最强的保留和最佳分辨率(图2a)。将150mm乙酸铵的ph从8增加到9导致主峰和第一赖氨酸变体共洗脱。使用150mm乙酸铵ph 8作为洗脱液观察到线性ph迹线,同时在将洗脱液的ph滴定至9之后在nist mab的保留窗口处观察到突然的ph增加(图2b),这被认为是分辨率差的最可能原因。类似地,nist mab的分辨率在将乙酸铵的离子强度从1 50mm增加到300mm之后受到损害。在将300mm乙酸铵缓冲液的ph滴定至9之后,观察到突然的ph增加和缩短的ph线性范围。使用150mm或300mm乙酸铵ph 8溶液作为洗脱液来观察线性电导率迹线(图2c),同时在将洗脱液ph滴定至9之后,在电导率迹线中观察到与线性度的轻微偏差。因此,该流动相体系中洗脱液的有利组成是乙酸铵溶液,其ph介于7.5和9.0之间,更有利地介于8和8.5之间,并且浓度介于100mm和300mm之间,更有利地介于120mm和200mm之间。
53.进行进一步的方法优化以确定应用于该流动相体系中的初始缓冲溶液的最有效ph和离子强度。使用基于40mm甲酸铵50mm乙酸铵ph 5.0(缓冲液a1)或90mm乙酸铵ph 5.0(缓冲液a2)和200mm乙酸铵ph 8.15的初始缓冲溶液作为洗脱缓冲溶液(缓冲液b)的流动相体系监测nist mab的保留和分辨率。在从1.7分钟至20分钟的0%至100%b的相同线性梯度下,观察到类似的分辨率(图3a),而使用缓冲液a2时的保留强于a1。归一化ms信号响应被测量为在qtof质谱仪上获取的基峰色谱图中的总峰面积与在2.1
×
50mm强阳离子交换柱上在280nm下测量的uv色谱图的比率(图3b)。使用缓冲液a2观察到略高的ms信号响应。使用缓冲液a1或a2作为初始缓冲溶液并使用200mm乙酸铵ph 8.2作为洗脱缓冲溶液来观察线性ph迹线(图3c),但用缓冲液a2观察到更宽的线性范围。缓冲液a1示出略高于a2的电导率,如用离线电导率仪测量(对于缓冲液a1,在21.6℃下9.19ms,对于缓冲液a2,在22.9℃下8.58ms),尽管事实上它们示出类似的在线电导率迹线。虽然使用由甲酸铵和乙酸铵的混合物构成的缓冲液和仅由乙酸铵构成的缓冲液观察到相当的lc分辨率和ms灵敏度,但由单一铵盐构成的缓冲体系提供了简单且更严格控制试剂纯度的优点。因此,用于本公开的流动相体系的有利的初始缓冲溶液是ph介于4和6之间,更有利地介于4.5和5.5之间,并且浓度介于20mm和120mm之间,更有利地介于40mm和100mm之间的乙酸铵。
54.获得的流动相离子强度和梯度的附加优化进一步提高了完整和ides消化的mab的分辨率。虽然将初始缓冲溶液的ph保持在5.0并且将洗脱缓冲液盐析的ph保持在8.4,但发现总流动相体系中乙酸铵的离子强度降低可导致改善色谱分离。将初始缓冲溶液和洗脱缓冲溶液的浓度分别从90mm和200mm降低至45mm和150mm被证明是特别有效的。例如,完整nist mab的主峰的酸性变体通过这些变化得到改善(图4a和图4b)。对完整英夫利昔单抗的第一主峰进行类似观察。然而,相对于ides消化的曲妥珠单抗、完整的nist mab或完整的英
夫利昔单抗的分离分辨率,进一步将缓冲液离子强度降低到20mm和120mm(初始溶液与洗脱液相比)没有显示出太多益处(图4c)。概括地说,已建立明确限定的边界以构造用于实现稳健iex
‑
ms方法的流动相体系。最终,该努力导致简单的挥发性缓冲体系,其产生线性ph和电导率迹线并提供具有不同pi值和保留行为的mab和mab亚基的洗脱。
55.本文所述的缓冲体系和方法的色谱能力是示例性的,并且这易于通过与替代方案进行比较来展示。为此,进行研究以将本公开的缓冲体系与由f
ꢀüꢀ
ssi等人(出处同上)制备的基于碳酸氢铵、乙酸和氢氧化铵的ph梯度缓冲液以及leblanc等人(出处同上)的双盐/ph梯度方法进行比较。使用3μm无孔磺化阳离子交换固定相进行使用三种方法的完整和ides消化的mab电荷变体分离的直接比较。由f
ꢀüꢀ
ssl等人描述的缓冲体系的实施未能解析完整的英夫利昔单抗(其三个主峰共洗脱)(图5a)。使用40%至100%洗脱溶液的通用梯度,该方法也不能提供ides消化的曲妥珠单抗的准确分布。在0.8
‑
1.0分钟的未保留保留时间处从峰观察到对应于(fc/2)2的ms信号,并且在大约13分钟的保留时间处仅观察到f(ab’)2亚基的弱信号。该方法的缺点在于它需要对不同分析物进行非常仔细的方法优化,并且它不被设计用于分析mab的ides消化的亚基。相比之下,leblanc方法被设计为用作分析mab的ides消化的亚基的平台方法(图5b)。通过与leblanc方法进行比较,清楚地表明,用本发明的组合物实现了完整英夫利昔单抗和ides消化的曲妥珠单抗的最佳分辨率(图5c)。对于完整英夫利昔单抗以及曲妥珠单抗亚基的分离,观察到分辨率显著增加。
56.最后,优化用于流动相制备的程序以改善质谱质量。在与qtof质谱仪联接的强阳离子交换柱上,使用由90mm乙酸铵(ph 5.0)作为初始缓冲溶液(缓冲液a)和200mm乙酸铵(ph 8.4)作为洗脱缓冲溶液(缓冲液b)组成的流动相监测ides消化的英夫利昔单抗和完整nist mab的质谱中钠和钾加合物的水平。使用在玻璃瓶和玻璃实验室器皿中用lc/ms级水制备的流动相观察到显著量的钠加合物(图6a)。在另一种情况下,在使用由0.2μm过滤的18.2mω水、塑料实验室器皿制备的流动相采集的质谱中观察到高水平的钾加合物,并且使用填充有3m氯化钾的玻璃电极进行ph测量(图6b)。用0.2μm过滤的18.2mω水、塑料实验室器皿和无ph测量值制备的流动相实现最小水平的钠或钾加合物(图6c)。有利的是,将无玻璃工艺应用于流动相浓缩物和/或即用型流动相的制备、储存和应用,使得钠和钾加合物最小化并且使得可获得易于解释的质谱。
57.因此,本文描述了缓冲体系,已发现该缓冲体系提供了对蛋白质(包括完整和ides消化的mab)进行iex
‑
ms分析的有吸引力的手段。该方法的一种流动相溶液可由ph介于4和6之间,更有利地介于4.5和5.5之间,并且浓度介于20mm和120mm之间,更有利地介于40mm和100mm之间的乙酸铵组成。另一流动相溶液可由ph介于7.5和9.0之间,更有利地介于8和8.5之间,并且浓度介于100mm和300mm之间,更有利地介于120mm和200mm之间的乙酸铵组成。在另选的实施方案中,流动相溶液可由甲酸铵、四甲基甲酸铵、四甲基乙酸铵、三乙基乙酸铵或三乙基甲酸铵等形成。为了以最少的盐加合物实现蛋白质的高质量质谱,乙酸铵盐的钠和钾含量小于100ppb,更有利地小于20ppb也是有利的。同样,在一个优选的实施方案中,流动相溶液可以不含玻璃的方法制备,并且以缓冲液浓缩物和/或即用型流动相的形式提供在不含玻璃的容器中。
58.在一些实施方案中,这些流动相溶液可包含有机共溶剂,包括但不限于乙腈、甲醇、乙醇或异丙醇,其浓度范围为1%至50%,更有利地2%至30%w/v,以便减缓细菌生长。
59.在一些实施方案中,流动相溶液可以二元梯度使用,并且在其他实施方案中以具有水的三元梯度的形式使用。具有水的三元梯度可允许针对ph变化对电导率变化进行精细调整分离,这可为用于开发特定蛋白质分析物的分离的有效优化参数。
60.在一个实施方案中,本公开表现为一种方法,该方法需要使用所述ms相容的流动相缓冲体系来进行蛋白质治疗剂(包括但不限于基于mab的治疗剂)的电荷变体分布。
61.此外,已发现,将无玻璃工艺应用于流动相浓缩物和/或即用型流动相的制备是有利的。
62.采用这种具有基于羧化或磺化聚合物树脂的阳离子交换柱的流动相缓冲体系是特别有利的。因此,该流动相缓冲体系在与如名称为“polymer particles with a gradient composition and methods of production thereof”(具有梯度组成的聚合物颗粒及其制备方法)的美国专利申请序列号16/287,364中所述制备的阳离子交换固定相配对方面是有益的,该专利申请以引用方式并入本文。另外,该流动相缓冲体系可有利地与多种可商购获得的阳离子交换柱配对,该阳离子交换柱包括但不限于waters bioresolve
tm scx mab、thermo scientific mab pac scx、thermo scientific pro pac scx、thermo scientific pro pac wcx、thermo scientific pro pac elite wcx、phenomenex biozen wcx、agilent bio scx、agilent bio wcx、sepax proteomix scx、sepax proteomix wcx、sepax antibodix wcx、tosoh tskgel sp
‑
stat、tosoh tskgel sp
‑
npr、和ymc biopro sp
‑
f。
63.在各种实施方案中,本公开提供了上述缓冲流动相的浓缩物,其以2倍至100倍的浓缩体积,更有利地以5倍至20倍的浓缩体积制备。另选地,流动相体系可以即用型形式提供。
64.在其他实施方案中,本公开提供了试剂盒,其中用户遵循提供的说明书以由上述缓冲液浓缩物制备流动相。
65.在另一个实施方案中,可提供试剂盒,该试剂盒包括一套即用型或浓缩型的缓冲液以及阳离子交换柱。在一些实施方案中,上述即用型缓冲液和缓冲液浓缩物可用包含小于100ppb浓度的金属(包括但不限于钠、钾和铁)的缓冲盐制备。
66.此外,为了延长它们的货架期,这些即用型缓冲液和缓冲液浓缩物可与痕量的杀菌剂(包括但不限于200ppm的氯仿)一起配制,并且周吸氧包包装。
67.尽管经过优化以实现mab的高分辨率,但本文所述的方法、组合物和试剂盒可用于分离其它分析物,包括其它类型的生物分子,其具体示例包括肽、其它蛋白质(包括天然存在的非mab蛋白、融合蛋白和抗体药物缀合物(adc))等等。
68.更多细节在下面的实施例中给出。
69.实施例1:sec
‑
uv
‑
ms
70.图1示出了用下列条件获得的柱状图:
71.lc条件:
72.[0073][0074]
ms条件:
[0075][0076]
梯度表:
[0077][0078]
实施例2:iex
‑
uv
[0079]
图2、3a和3c呈现了用下面列出的条件获得的色谱图:
[0080]
lc条件:
[0081]
[0082][0083]
图2的流动相:
[0084]
流动相a
ꢀꢀꢀꢀꢀꢀꢀꢀ
50mm甲酸铵ph 3.9
[0085]
流动相b
ꢀꢀꢀꢀꢀꢀꢀꢀ
150或300mm乙酸铵,滴定至ph 8.0或9.0
[0086]
图3的流动相:
[0087]
流动相a
ꢀꢀꢀꢀꢀꢀꢀꢀ
40mm甲酸铵50mm乙酸铵ph 5.0,或90mm乙酸铵ph 5.0
[0088]
流动相b
ꢀꢀꢀꢀꢀꢀꢀꢀ
200mm乙酸铵ph 8.2
[0089]
图2和图3的梯度表:
[0090][0091]
实施例3:iex
‑
uv
‑
ms
[0092]
图3b、图4、图5和图6呈现了用下列条件获得的色谱图:
[0093]
lc条件:
[0094][0095]
[0096]
ms条件:
[0097][0098]
图3b的流动相:
[0099]
流动相a 40mm甲酸铵50mm乙酸铵ph 5.0,或90mm乙酸铵ph 5.0
[0100]
流动相b 200mm乙酸铵ph 8.2
[0101]
图3b的梯度表:
[0102][0103]
图4a和图6的流动相:
[0104]
流动相a
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
90mm乙酸铵ph 5.0
[0105]
流动相b
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
200mm乙酸铵ph 8.4
[0106]
图4b和图5c的流动相:
[0107]
流动相a
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
45mm乙酸铵ph 5.0
[0108]
流动相b
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
150mm乙酸铵ph 8.4
[0109]
图4c的流动相:
[0110]
流动相a
ꢀꢀꢀꢀꢀꢀꢀ
20mm乙酸铵ph 5.0
[0111]
流动相b
ꢀꢀꢀꢀꢀꢀꢀ
120mm乙酸铵ph 8.4
[0112]
图4、图5c和图6的梯度表:
[0113][0114]
图5a的流动相:
[0115]
流动相a
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
25mm碳酸氢铵和30mm乙酸ph 5.3
[0116]
流动相b
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2mm乙酸中的10mm氢氧化铵ph 10.18
[0117]
图5a完整英夫利昔单抗的梯度表:
[0118][0119][0120]
图5a ides消化的曲妥珠单抗的梯度表:
[0121][0122]
图5b的流动相:
[0123]
流动相a
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
50mm甲酸铵ph 3.9
[0124]
流动相b
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
500mm乙酸铵ph 7.4
[0125]
图5b的梯度表:
[0126]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1