一种基于磁分离同时检测多种目标物的生化分析方法
本发明属于生化分析领域,涉及一种同时检测多种目标物的生化分析方法。
背景技术:
随着国家发展与人民生活水平提高,食品安全、体外诊断和环境监测等领域所面临的挑战与日俱增,高效的检测手段在保障食品安全、生态环境安全,促进人类健康等方面都具有极其重要的影响。传统检测方法大多都依赖于大型精密仪器设备,虽然具有精度高、准确性好等特点,但是大部分仪器造价昂贵且携带不便,使用前需要对检测样品进行复杂的前处理,对使用仪器设备的人员也有较为严格的要求。
基于抗体-抗原识别反应的免疫分析方法在食品安全和体外诊断领域应用广泛。传统的酶联免疫吸附法(elisa)具有灵敏度高、成本低等优点,但整个实验操作繁琐且耗时长,不能实现对同一样品中的多个目标物同时检测;胶体金试纸条法操作简便且检测速度快,但灵敏度比较低,仅适用于定性分析或半定量分析;荧光免疫检测法检测精度高速度快,对多目标物检测具有良好的适应性,但检测所需仪器设备造价昂贵,且荧光试剂需要避光稳定性较差。
采用高分子微球作为信号探针,将颗粒计数和免疫分析相结合,能够实现高灵敏度下的准确检测。目前颗粒计数已有多种实现方式,例如申请人前期研究中报道的库尔特小孔颗粒电阻法和差分阻抗法等,但是小孔颗粒电阻计数器造价昂贵,而且小孔管易发生堵塞,相比之下,光学显微成像法能够直接读取微球数量,因此检测成本更低,操作也更加便捷。例如cn109521202a公开了一种基于数字免疫分析的蛋白质定量方法,该方法将捕获磁珠、目标抗原和检测颗粒进行免疫反应,形成免疫复合物,然后将免疫复合物中的检测颗粒洗脱并转移至微流控颗粒计数芯片,检测颗粒沉积固定在芯片上,对所有固定在芯片上的检测颗粒进行成像记录,统计芯片上检测颗粒的数量,即得到目标蛋白的分子数。该方法实现了疾病相关蛋白质的超灵敏、绝对定量分析,但是无法实现对多种目标物的同时检测,且该方法操作比较复杂,需要通过多步步骤将检测颗粒从免疫复合物上洗脱下来,容易造成累计误差,影响了检测结果的稳定性和准确性。
技术实现要素:
为解决上述问题,本发明提出了一种基于磁分离同时检测多种目标物的生化分析方法,该方法将生化反应与可视化微球计数、机器视觉与深度学习相结合,将与待测目标物对应的生物识别分子分别偶联在纳米磁颗粒和信号探针表面,进行免疫反应或者dna分子杂交反应,磁分离后直接对反应复合物中的信号探针进行光学显微成像计数,本发明通过使用不同粒径或颜色的信号探针用于区分不同的检测对象,最终实现了多种目标物的同时检测。
本发明所使用的技术手段如下:
一种基于磁分离同时检测多种目标物的生化分析方法,包括以下步骤:
1)以不同粒径和/或不同颜色的高分子微球为信号探针,将多种目标物的生物识别分子分别与不同粒径和/或不同颜色的高分子微球偶联,每一种粒径和/或颜色对应一种目标物,同时将多种目标物对应的生物识别分子与纳米磁颗粒偶联,将高分子微球偶联物和纳米磁颗粒偶联物同时加入到待测样品进行生化反应,接着进行磁分离,收集含有反应复合物的分离液备用;
2)将含有反应复合物的分离液滴加到划分网格的载玻片上,涂匀后盖上玻片,光学显微镜对焦后对不同网格的计数区域进行分别拍照,并将高清图像传送至计算机;
3)计算机对高清图像中的微球粒径和/或颜色进行区分,并在python机器视觉识别和深度学习的基础上得出反应复合物中每一种粒径和/或每一种颜色的高分子微球数量,最后根据每一种高分子微球的数量计算待测样品中不同种类目标物的含量,实现多种目标物的定量检测。
优选地,所述高分子微球的粒径为1~50μm,所述纳米磁颗粒的粒径为100~500nm。
优选地,所述不同粒径的高分子微球,它们的粒径倍数应≥2。
优选地,所述不同颜色的高分子微球,它们的颜色分别为紫色、红色、橙色、黑色、蓝色、绿色、黄色或白色中的任一种。
优选地,所述高分子微球为聚苯乙烯微球、二氧化硅微球、聚丁二烯微球、聚异戊二烯微球中的任一种。
优选地,所述光学显微镜的种类为正置光学显微镜、倒置光学显微镜、荧光显微镜或金相显微镜,显微镜放大倍数为50~5000倍。
所述生化反应包括免疫竞争反应、免疫夹心反应或dna分子杂交反应。
所述目标物包括病毒、生物标志物、抗生素分子、农药分子、兽药分子、生物毒素、细菌。
本发明中的生物识别分子及其对应的生物识别分子包括完全抗原/抗体、捕获抗体/检测抗体、dna捕获探针/dna检测探针等,以完全抗原/抗体为例,本发明的检测原理如下:参见图1,将识别不同检测对象的抗体分别偶联在纳米磁颗粒表面,将不同检测对象的完全抗原分别偶联在不同粒径和/或不同颜色的高分子微球(如聚苯乙烯微球)表面,将上述偶联物同时加入到待测样品并进行免疫反应,高分子微球上结合的完全抗原和待测样品中的目标物竞争性地与纳米磁颗粒上的抗体相结合,生成纳米磁颗粒-抗体-待测物-完全抗原-高分子微球复合物,当待测样品中的目标物含量越高则生成的复合物越少,反之,当待测样品中的目标物含量越少则生成的复合物越多,复合物的数量与目标物的含量负相关。
接着将复合物从反应体系中进行磁分离,除去未参与反应的高分子微球和样品基质,然后对含有复合物的分离液进行收集,复合物中的高分子微球数量反映的是待测样品中目标物的含量,二者呈负相关。
由于一种粒径和/或颜色的高分子微球对应的是一种目标物,因此通过检测不同粒径和/或不同颜色的高分子微球数量得到不同目标物的含量。
本发明提出了一种机器视觉可视化的计数方法,该方法通过高倍光学显微镜拍照,并在python机器视觉识别微球的同时进行深度学习提高微球识别准确度。首先,基于光学成像原理对复合物中的高分子微球进行成像,取一定量分离液滴于划分网格的载玻片上涂匀,盖上载玻片后放置于高倍光学显微镜下完成自动对焦,载玻片放置于自动化导轨平台上可对载玻片实现xoy坐标系的定点平移,从而对不同的计数区域分别拍照,复合物中存在不同颜色和/或不同粒径的高分子微球。接着,高倍显微镜将所拍取的微球图像传送至计算机,通过机器视觉微球识别对高分子微球的颜色、粒径进行识别记录并同时结合深度学习,快速高效准确地识别微球数量。同时,由于纳米磁颗粒的粒径远小于高分子微球的粒径且超出光学显微镜的成像极限,因此复合物及分离液中的纳米磁颗粒不会被机器视觉识别。
参见图2所示,为不同粒径的高分子微球信号探针在光学显微镜成像图片。为实现多目标物检测,选用不同粒径的高分子微球信号探针偶联不同种类的生物识别分子,每种粒径的高分子微球信号探针即代表一种待测目标物,每种粒径的高分子微球信号探针的数量与待测目标物含量相关。图中所示为1μm和3μm的高分子微球信号探针在光学显微镜下放大1000倍的成像图片,待计算机机器视觉识别后完成不同粒径高分子微球信号探针识别计数,即可推算不同种类的待测目标物含量,实现多目标物检测。
参见图3所示,为不同颜色的高分子微球信号探针在光学显微镜成像图片,为实现多目标物检测,选用不同颜色的高分子微球信号探针偶联不同种类的生物识别分子,每种颜色的高分子微球信号探针即代表一种待测目标物,每种颜色的高分子微球信号探针的数量与待测目标物含量相关。图中所示为3μm的白色、黄色和蓝色3种颜色的高分子微球信号探针在光学显微镜下放大1000倍的成像图片,待计算机机器视觉识别后完成不同颜色高分子微球信号探针识别计数,即可推算不同种类的待测目标物含量,实现多目标物检测。
参见图4所示,为机器视觉识别不同粒径微球数量对比效果图。当光学显微镜完成微球成像拍照后,将生成的照片直接传送至计算机,由机器视觉对微球的粒径、颜色和数量进行识别,随后函数反馈识别结果。图4a为1μm高分子微球在光学显微镜下放大1000倍拍照成像图,图4b为1μm高分子微球在光学显微镜下拍照成像后机器视觉微球识别结果,图4c为3μm高分子微球在光学显微镜下放大1000倍拍照成像图,图4d为3μm高分子微球在光学显微镜下拍照成像后机器视觉微球识别结果,对比结果表明结合深度学习的机器视觉对不同粒径微球识别率超过99%。
与传统颗粒计数方法相比,本发明计数方法更加快捷直观高效,所用耗材成本更低,可实现一次性使用随用随弃,不同颜色与粒径的高分子微球组合可实现多目标物同时检测,根据实际需求可以应用于多种场景的快速检测,如食品安全快速检测、体外诊断、环境监测等。
所述多目标物检测的具体实现形式为不同粒径的信号探针相互组合、不同颜色的信号探针相互组合和不同颜色与不同粒径的信号探针二维信息的相互组合,但不仅限于此类组合形式。
当生物识别分子为捕获抗体/检测抗体、或dna捕获探针/dna检测探针时,检测原理与上述方法类似,区别在于所发生的反应为免疫夹心反应或dna分子杂交反应,复合物中的高分子微球数量与待测样品中目标物的含量呈正相关。
本发明中的高分子微球包括聚苯乙烯微球、二氧化硅微球、聚丁二烯微球、聚异戊二烯微球等,但不仅限于这些高分子微球。
本发明适合各种目标物的检测,包括病毒、生物标志物、抗生素分子、农药分子、兽药分子、生物毒素、细菌等,但不仅限于这些目标物。
本发明还适合各种基质成分的检测对象,例如全血、血清、牛奶、饮料等,且不仅限于这些检测对象。磁分离免疫分析法可以对复杂基质(例如全血)的目标物进行检测,且无需进行复杂的前处理。
本发明的有益效果是:
(1)基于信号探针粒径和颜色的编码,多目标物同时检测的能力强。传统的检测方法为了实现多个目标物的检测,一般采用荧光微球、量子点、上转换材料或者在不同空间位置上实现多个目标物产生的信号位置不同加以区分。而本发明只需要改变高分子微球的粒径或者颜色,即可通过特异性免疫反应或者dna分子杂交反应和显微镜微球成像计数实现多目标物同时检测。高分子微球的粒径大小可控,悬浮稳定性很好,不同粒径的高分子微球不会发生信号重叠,更为重要的是不同粒径和颜色的微球可以进行组合编码,可供选择的编码组合可以呈指数扩大。例如:3种不同粒径和3种不同颜色的高分子微球进行排列组合编码,种类数可以达到
(2)计数过程可视化,准确性好。本发明通过光学显微镜拍照可精准快速地对高分子微球信号探针进行可视化成像,提高了检测灵敏度和准确性。
(3)操作步骤少,检测速度快。首先,本发明无需对反应产物进行特殊的预处理,而是磁分离后直接进行拍照成像,本发明复合物中的纳米磁颗粒不会对机器视觉识别产生干扰,而现有的方法需要对复合物进行裂解等特殊处理。本发明中信号探针的数量直接与目标物的含量相关,整个信号转换一步完成,不需要多余的信号放大步骤,从而进一步简化了操作步骤并提高了检测效率。
(4)稳定性好,成本低,自动化程度高。相比于其他微球,例如荧光微球等,高分子微球无需避光保存,在室温下可以保存很长时间,稳定性更好。高分子微球价格低廉,实验耗材如离心管、带网格的载玻片、盖玻片等成本价格较低,具有一次性使用免清洗、随用随换、购买便利等优点。基于python的机器视觉微球识别同时结合深度学习与传统颗粒计数器相比,识别速度更快准确度更高,颗粒识别度可达99%。当上一个待测样本完成拍照记录后随即下一个样本在输送装置带动下进入作业区,光学显微镜自动对焦拍照,高程度的自动化作业减少了人力物力,提高了检测效率,可更便捷高效地实现多样本检测。机器视觉识别对图像中微球先进行颜色识别后完成分类,再进行粒径识别,进一步提高了检测的稳定性和准确性,识别单个图像样本时间小于1s。
附图说明
图1为本发明的步骤流程示意图。
图2为光学显微镜对不同粒径的高分子微球成像图。
图3为光学显微镜对不同颜色的高分子微球成像图。
图4为机器视觉识别不同粒径微球的对比效果图。
图5为实施例1检测全血中降钙素原(pct)的标准曲线。
图6为不同粒径大小的纳米磁颗粒下得到的信号探针数量与全血中降钙素原浓度关系变化。
图7为实施例2检测不同抗生素(氯霉素、阿莫西林和新霉素)的标准曲线。
图8为聚苯乙烯微球信号探针粒径为2μm、3μm和4μm条件下检测抗生素(氯霉素、阿莫西林和新霉素)的标准曲线。
图9为实施例3检测不同种类生物标志物(crp、pct和il-6)的标准曲线。
图10为实施例4检测不同种类细菌(沙门氏菌和单增李斯特菌)的标准曲线。
具体实施方式
下面结合具体实施例对本发明进行详细说明。
实施例1定量检测全血中降钙素原(pct)
(1)制备纳米磁颗粒-降钙素原捕获抗体偶联物和聚苯乙烯微球-降钙素原检测抗体偶联物
取2mg羧基修饰的磁性纳米颗粒(200nm,10mg/ml),用mes缓冲液(ph=6.0)洗涤两次,用mes缓冲液重悬后加入50μledc(10mg/ml)和25μlnhs(10mg/ml),混匀后在室温下活化15min。活化完成后用pbs缓冲液洗涤两次,用pbs缓冲液重悬后加入0.2mg降钙素原(pct)捕获抗体,室温下反应2-4h;反应结束后,用1%bsa溶液封闭30min,封闭完成后用pbst缓冲液洗涤2次,纳米磁颗粒-降钙素原捕获抗体偶联物用pbs缓冲液重悬后保存于4℃待用。
取2mg羧基修饰的聚苯乙烯微球(3μm,100mg/ml),用mes缓冲液(ph=6.0)洗涤两次,用mes缓冲液重悬后加入100μledc(10mg/ml)和50μlnhs(10mg/ml),混匀后在室温下活化15min。活化完成后用pbs缓冲液洗涤两次,用pbs缓冲液重悬后加入0.2mg降钙素原检测抗体,室温下反应2-4h;反应结束后,用1%bsa溶液封闭30min,封闭完成后用pbst缓冲液洗涤2次,聚苯乙烯微球-降钙素原检测抗体偶联物用pbs缓冲液重悬后保存于4℃待用。
(2)免疫反应与磁分离
将偶联降钙素原捕获抗体的纳米磁颗粒、偶联降钙素原检测抗体的聚苯乙烯微球和含有降钙素原的全血样本同时加入1.5ml离心管内于37℃免疫反应10-30min,随后将离心管放置于磁分离架中1min完成磁分离,用pbst缓冲液洗涤3次,去掉上清液中未反应的检测抗体-聚苯乙烯微球复合物和样品基质,取含有反应复合物的分离液于4℃保存用于显微镜微球成像计数。
(3)显微镜拍照
显微镜拍照所用主要仪器设备为正置光学显微镜(天津徕科光学仪器有限公司,型号lk50t),取25μl磁分离后的分离液均匀涂于划分网格计数区的载玻片上,将玻片样本放置于自动化导轨平台,通过显微镜控制软件调节显微镜自动对焦,设置显微镜放大倍数为1000倍,自动化导轨平台按设定程序对玻片样本定点平移,随机选取10个计数网格进行拍照,设置计算机对每个计数网格高速拍取10张尺寸为3840*2160高清图像并将传送至计算机保存,每个样本保存图片数量为100张。
(4)图像处理与机器视觉识别
微球识别模型选用windows1064bit操作系统下python环境,处理器选用intercorei910900k,独立显卡选用nvidiageforcertx3080,深度学习框架选用tensorflow。首先对导入计算机待进行微球识别的图片进行自动分割处理,对每一个微球所在区域进行单独的切割划分成尺寸为227*227的图像,设置不同数量的像素点阈值,识别成像微球不同像素点的数量和设置微球阈值即可实现微球的粒径识别和数量统计。
识别并设置单个3μm微球在显微镜下放大1000倍所占用像素点数量为阈值a,当待测微球像素点数量接近设置阈值a范围(a±5%)内时即判定为1个微球并计数1次,当待测微球像素点与设置阈值a偏离过大则单独计数并筛选剔除。采用割补法对图像边缘区域的残缺微球进行像素点数量合并处理并与设置阈值a对比,每当合并像素点总数溢出阈值a时,则计数为1个微球,减少边缘残缺微球造成的计数误差;对于重叠、联结等微球采用重复识别法进行计数,重叠微球区域像素点颜色会更深,对重复区域进行像素点数量识别后与非重复区域进行像素点数量合并再与阈值a进行比对计数,重复过程直至识别所有重复区域微球。依次对每一个切割划分的图像进行识别计数并统计,对计数网格拍照的多张微球图像进行处理识别,同时基于tensorflow训练微球进行深度学习建立微球模型并记忆误差允许范围内的微球形状。最后对所有图像识别数据进行整合对比处理,当图像微球识别误差≤1%时系统判断计数有效,反馈函数值到计算机,计算机输出3μm和其他微球数量。
(5)机器视觉微球识别检测全血中降钙素原
通过双抗夹心法检测全血中降钙素原(pct)检测方法的原理如下:将全血样本、磁微球-降钙素原捕获抗体和聚苯乙烯微球-降钙素原检测抗体分别加入离心管中充分混合反应生成免疫复合物,随后磁分离去除未反应的聚苯乙烯微球和样品基质,对免疫复合物洗脱后进行显微镜微球成像计数,从而直接得出待测目标物降钙素原的含量,免疫反应生成的复合物越多,则待测物中的目标物含量越高。因此,全血样品中降钙素原(pct)的含量浓度与复合物中聚苯乙烯微球数量呈现正相关,从而直接计算得出全血样品中降钙素原(pct)的含量。
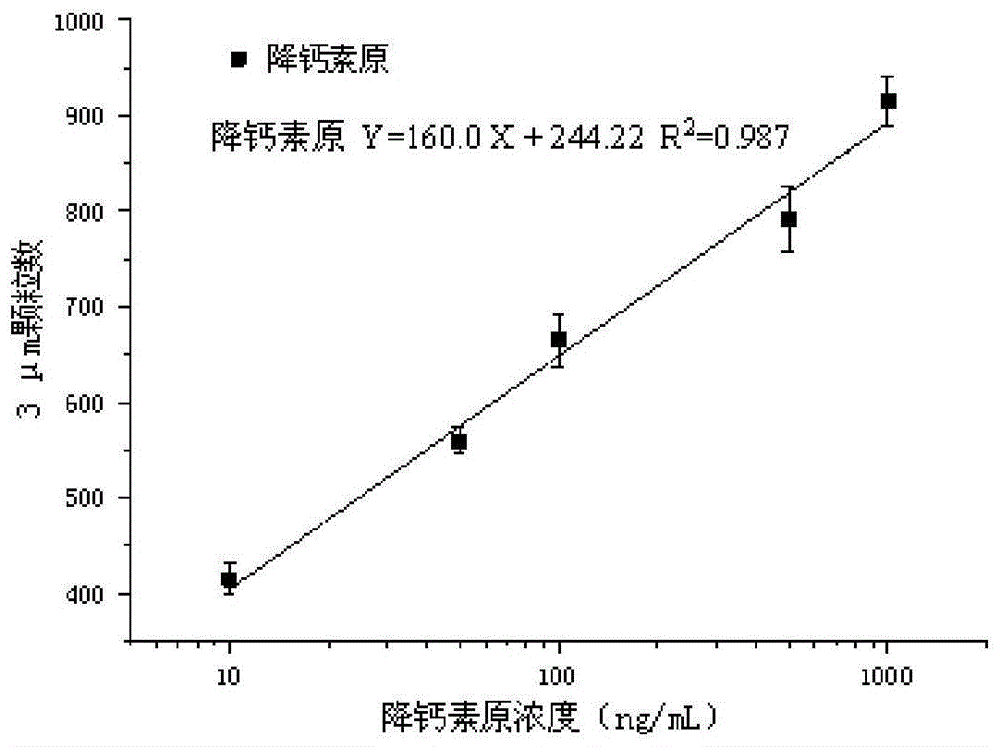
以免疫复合物中的3μm聚苯乙烯微球个数为纵坐标,降钙素原浓度的对数值为横坐标,得到两者之间的相互关系可用于降钙素原的定量检测。如图5所示,在10~1000ng/ml范围内,微球个数与降钙素原浓度之间具有良好的线性关系,线性方程为y=160.0x+244.22(x为降钙素原浓度的对数值),r2=0.987。
本实施例中对纳米磁颗粒的粒径大小进行了优化,选取粒径大小分别为200nm、500nm和1000nm的纳米磁颗粒偶联降钙素原捕获抗体,选取粒径大小为3μm聚苯乙烯微球偶联降钙素原检测抗体,其他条件与上述实验条件相同。如图6所示,实验结果表明不同粒径大小的纳米磁颗粒对机器视觉显微镜微球成像计数有着显著影响,当纳米磁颗粒粒径增加时,机器视觉所识别的微球数目会偏离实际值,识别误差也随之增加。当纳米磁颗粒粒径为200nm时,微球识别结果准确,出现此现象原因为当纳米磁颗粒粒径过大时光学显微镜拍照时会将纳米磁颗粒与聚苯乙烯微球同时成像,导致机器视觉识别出现误差,而粒径大小为200nm磁颗粒超出光学显微镜的成像极限,不会被机器视觉所识别,因此实验结果趋近于真实值,同时200nm磁颗粒的磁饱和强度大,可以实现快速的磁分离。
如表1所示,为采用标准加入法对全血中的降钙素原(pct)进行检测的结果,实验结果表明对全血中不同浓度的降钙素原(pct)检测均具有较好的准确性和回收率。
表1采用标准加入法对全血中的降钙素原(pct)进行检测的结果
将本实验方法与传统的小孔颗粒计数法对比,对比结果如表2所示,结果表明本实验方法与传统的小孔计数法相比灵敏度高且相对标准偏差(rsd)小。传统的小孔颗粒计数法准确度与小孔和待测微球之间宽径比相关,待检测微球的直径与小孔孔径越接近准确度越高。但当高分子微球偶联生物识别分子时会出现聚集现象,导致传统的小孔颗粒计数法所测得的微球数值与实际值偏小。而本方法采用光学显微镜可视化拍照的形式将待测高分子微球探针直接成像,机器视觉微球识别软件对微球数量识别度可达99%,检测结果更加准确可靠。且本方法自动化程度高使检测时间大幅缩短,免清洗的可视化拍照与机器视觉微球识别结合,1s内即可完成一个待测样的检测并估算出总体待测物含量。
表2本方法和小孔颗粒计数法对全血中降钙素原检测分析性能对比
实施例2定量检测抗生素分子氯霉素、阿莫西林和新霉素
(1)制备纳米磁颗粒-不同种类抗生素抗体偶联物和不同粒径聚苯乙烯微球-不同种类抗生素完全抗原偶联物
取3mg羧基修饰的磁性纳米颗粒(200nm,10mg/ml)分为3份,每份1mg,分别用mes缓冲液(ph=6.0)洗涤两次,每份用mes缓冲液重悬后分别加入20μledc(10mg/ml)和10μlnhs(10mg/ml),在室温下活化15min后混匀。活化完成后均分别用pbs缓冲液洗涤两次,用pbs缓冲液重悬后分别加入0.1mg氯霉素抗体、0.1mg阿莫西林抗体和0.1mg新霉素抗体,室温下反应2-4h;反应结束后,用1%bsa溶液封闭30min,封闭完成后用pbst缓冲液洗涤2次,聚苯乙烯微球-氯霉素抗体、聚苯乙烯微球-阿莫西林抗体和聚苯乙烯微球-新霉素抗体用pbs缓冲液重悬后保存于4℃待用。
分别取羧基修饰的不同粒径聚苯乙烯微球3份(1μm、3μm和6μm各1份,100mg/ml),每份1mg,用mes缓冲液(ph=6.0)洗涤两次,用mes缓冲液重悬后加入20μledc(10mg/ml)和10μlnhs(10mg/ml),混匀后在室温下活化15min。活化完成后均分别用pbs缓冲液洗涤两次,用pbs缓冲液重悬后加入0.1mg氯霉素完全抗原与1μm聚苯乙烯微球偶联、0.1mg阿莫西林完全抗原与3μm聚苯乙烯微球偶联、0.1mg新霉素完全抗原与3μm聚苯乙烯微球偶联,室温下反应2-4h;反应结束后,用1%bsa溶液封闭30min,封闭完成后用pbst缓冲液洗涤2次,1μm聚苯乙烯微球-氯霉素完全抗原、3μm聚苯乙烯微球-阿莫西林完全抗原和6μm聚苯乙烯微球-新霉素完全抗原用pbs缓冲液重悬后保存于4℃待用。
(2)免疫反应与磁分离
将偶联氯霉素抗体、阿莫西林抗体和新霉素抗体的纳米磁颗粒;偶联氯霉素完全抗原、阿莫西林完全抗原和新霉素完全抗原的不同粒径的聚苯乙烯微球;含有氯霉素、阿莫西林和新霉素的待测物样本同时加入1.5ml离心管内于37℃免疫反应10-30min,随后将离心管放置于磁分离架中1min完成磁分离,用pbst缓冲液洗涤3次,去掉上清液中未反应的抗体-聚苯乙烯微球复合物和样品基质,取含有免疫复合物的分离液于4℃保存用于显微镜微球成像计数。
(3)显微镜拍照
显微镜拍照所用主要仪器设备为正置光学显微镜(天津徕科光学仪器有限公司,型号lk50t),取25μl磁分离后的分离液均匀涂于划分网格计数区的载玻片上,将玻片样本放置于自动化导轨平台,通过显微镜控制软件调节显微镜自动对焦,设置显微镜放大倍数为1000倍,自动化导轨平台按设定程序对玻片样本定点平移,随机选取10个计数网格进行拍照,设置计算机对每个计数网格高速拍取10张尺寸为3840*2160高清图像并将传送至计算机保存,每个样本保存图片数量为100张。
(4)图像处理与机器视觉深度学习
微球识别模型选用windows1064bit操作系统(版本号1909)下python环境,处理器选用intercorei910900k,独立显卡选用nvidiageforcertx3080,深度学习框架选用tensorflow。首先对导入计算机待进行微球识别的图片进行自动分割处理,对每一个微球所在区域进行单独的切割划分成尺寸为227*227的图像,设置不同数量的像素点阈值,识别成像微球不同像素点的数量和设置微球阈值即可实现微球的粒径识别和数量统计。
对不同粒径同一颜色的高分子微球进行识别时,计算机直接对微球的粒径进行识别分类。识别并分别设置单个1μm、3μm和6μm微球在显微镜下放大1000倍所占用像素点为阈值a、阈值b和阈值c(a<b<c)。以1μm微球识别为例,当待测微球像素点数量接近设置阈值a范围(a±5%)内时即判定为1个1μm微球并计数1次,当待测微球像素点与设置阈值a偏离过大则与阈值b或阈值c对比计数,若与阈值b和阈值c对比均不满足范围条件,则对该微球单独计数。采用割补法对图像边缘区域的残缺微球进行相同粒径像素点数量合并处理,每当合并像素点总数溢出时,则计数为1个微球,减少边缘残缺微球造成的计数误差;对于重叠、联结等微球采用重复识别法进行计数,重叠微球区域像素点颜色会更深,对重复区域进行像素点数量识别后与非重复区域进行像素点数量合并再与阈值a进行比对计数,重复过程直至识别所有重复区域微球。同理,采用同样的方法通过待测微球像素点数量与阈值b或阈值c对比,对3μm和6μm的微球进行计数。依次对每一个切割划分的图像进行识别计数并统计,对计数网格拍照的多张微球图像进行处理识别,同时基于tensorflow训练微球进行深度学习建立微球模型并记忆误差允许范围内的微球形状。最后对所有图像识别数据进行整合对比处理,当图像微球识别误差≤1%时系统判断计数有效,反馈函数值到计算机,计算机输出1μm、3μm、6μm和其他微球数量。
(5)机器视觉微球识别检测氯霉素、阿莫西林和新霉素
机器视觉识别对导入计算机的显微镜拍照图像进行微球识别,记录不同粒径微球数量并通过函数返回给计算机,通过网格计数区微球数量估算整体测量样本的微球数量,从而计算待测目标物含量,1μm、3μm和6μm的微球数量分别代表氯霉素、阿莫西林和新霉素含量。以免疫复合物中的聚苯乙烯微球个数为纵坐标,不同种类抗生素浓度的对数值为横坐标,得到两者之间的线性关系。如图7为不同粒径的聚苯乙烯微球信号探针数量与不同种类抗生素(氯霉素、阿莫西林和新霉素)浓度关系变化图,在0.1~100000ng/ml范围内,不同粒径微球个数与不同种类抗生素浓度之间具有良好的线性关系,氯霉素、阿莫西林和新霉素的线性方程分别为y=-161.5x+514、y=-143x+1195和y=-144.4x+1195(x为不同种类抗生素浓度的对数值),r2分别为0.997、0.980和0.960,能够用于不同种类抗生素的定量检测。
本实施例中对聚苯乙烯微球的粒径组合进行了优化,选取了粒径大小为2μm、3μm和4μm的聚苯乙烯微球分别偶联氯霉素、阿莫西林和新霉素完全抗原,选取粒径大小为200nm纳米磁颗粒偶联不同种类抗生素抗体,其他条件与上述实验条件相同。如图8所示,实验结果表明不同粒径组合的聚苯乙烯微球对机器视觉显微镜微球成像计数有着显著影响,与1μm、3μm和6μm聚苯乙烯微球粒径组合下的实验结果进行对比发现,当不同的聚苯乙烯微球粒径倍数≥2时,实验结果趋近于真实值,显微镜微球成像计数误差小。
实施例3定量检测全血中的c-反应蛋白(crp)、降钙素原(pct)和白细胞介素-6(il-6)
(1)制备纳米磁颗粒-不同种类生标志物捕获抗体偶联物和不同颜色聚苯乙烯微球-不同种类生物标志物检测抗体偶联物
取3mg羧基修饰的磁性纳米颗粒(200nm,10mg/ml)分为3份,每份1mg,分别用mes缓冲液(ph=6.0)洗涤两次,每份用mes缓冲液重悬后分别加入20μledc(10mg/ml)和10μlnhs(10mg/ml),在室温下活化15min后混匀。活化完成后用pbs缓冲液洗涤两次,用pbs缓冲液重悬后分别加入0.1mg的crp捕获抗体、0.1mgpct捕获抗体、0.1mgil-6捕获抗体,室温下反应2-4h;反应结束后,用1%bsa溶液封闭30min,封闭完成后用pbst缓冲液洗涤2次,磁颗粒-捕获抗体偶联物用pbs缓冲液重悬后保存于4℃待用。
分别取羧基修饰的红色、黄色和蓝色聚苯乙烯微球(3μm,100mg/ml,大鹅科技有限公司)各1mg,用mes缓冲液(ph=6.0)洗涤两次,用mes缓冲液重悬后加入20μledc(10mg/ml)和10μlnhs(10mg/ml),混匀后在室温下活化15min。活化完成后均分别用pbs缓冲液洗涤两次,用pbs缓冲液重悬后分别加入0.1mgcrp检测抗体与红色聚苯乙烯微球偶联、0.1mgpct检测抗体与黄色聚苯乙烯微球偶联、0.1mgil-6检测抗体与蓝色聚苯乙烯微球偶联,室温下反应2-4h;反应结束后,用1%bsa溶液封闭30min,封闭完成后用pbst缓冲液洗涤2次,红色聚苯乙烯微球-crp检测抗体、黄色聚苯乙烯微球-pct检测抗体、蓝色聚苯乙烯微球-il-6检测抗体用pbs缓冲液重悬后保存于4℃待用。
(2)免疫反应与磁分离
将偶联crp捕获抗体、pct捕获抗体和il-6捕获抗体的纳米磁颗粒;偶联crp检测抗体、pct检测抗体和il-6检测抗体的不同颜色的聚苯乙烯微球;含有crp、pct和il-6的待测物样本同时加入1.5ml离心管内于37℃免疫反应10-30min,随后将离心管放置于磁分离架中1min完成磁分离,用pbst缓冲液洗涤3次,去掉上清液中未反应的检测抗体-聚苯乙烯微球复合物和样品基质,取含有免疫复合物的分离液于4℃保存用于显微镜微球成像计数。
(3)显微镜拍照
显微镜拍照所用主要仪器设备为正置光学显微镜(天津徕科光学仪器有限公司,型号lk50t),取25μl磁分离后的免疫复合物待测液均匀涂于划分网格计数区的载玻片上,将玻片样本放置于自动化导轨平台,通过显微镜控制软件调节显微镜自动对焦,设置显微镜放大倍数为1000倍,自动化导轨平台按设定程序对玻片样本定点平移,随机选取10个计数网格进行拍照,设置计算机对每个计数网格高速拍取10张尺寸为3840*2160高清图像并将传送至计算机保存,每个样本保存图片数量为100张。
(4)图像处理与机器视觉深度学习
微球识别模型选用windows1064bit操作系统(版本号1909)下python环境,处理器选用intercorei910900k,独立显卡选用nvidiageforcertx3080,深度学习框架选用tensorflow。首先对导入计算机待进行微球识别的图片进行自动分割处理,对每一个微球所在区域进行单独的切割划分成尺寸为227*227的图像,设置不同数量的像素点阈值,识别成像微球不同像素点的数量和设置微球阈值即可实现微球的粒径识别和数量统计;由于不同颜色所对应的rgb值不同,如:红色rgb(255,0,0)、黄色rgb(255,255,0)、蓝色rgb(0,0,255)等,通过计算机识别微球rgb值即可判断微球颜色。
对不同颜色的高分子微球进行识别时,计算机首先对微球的颜色进行识别分类,随后再对不同颜色下的粒径进行识别分类并计数。识别并分别设置单个3μm微球在显微镜下放大1000倍所占用像素点为阈值a,设置红色微球颜色阈值c1、黄色微球颜色阈值c2和蓝色微球颜色阈值c3。以3μm红色微球识别为例,先将待测微球像素点颜色rgb值与红色微球颜色阈值c1进行识别比对,当待测微球像素点颜色接近设置阈值c1范围(c1±20%)内时即判定为1个红色微球并归类,若不满足红色颜色阈值条件则再与颜色阈值c2和颜色阈值c3进行对比,均不满足则单独归类,确定待测微球颜色;随后确定待测微球粒径,当待测微球像素点数量接近设置阈值a范围(a±5%)内时即判定为1个3μm微球,当待测微球像素点与设置阈值a偏离过大则对该微球单独计数。采用割补法对图像边缘区域的残缺微球进行像素点数量合并处理并与设置阈值a对比,先识别残缺微球颜色,对不同颜色的微球进行分类像素点数量合并,每当合并像素点总数溢出阈值a时,则计数为1个微球;对于重叠、联结等微球采用重复识别法进行计数,先对未重合的微球部分识别颜色,随后叠加重叠部分和未重叠部分像素点数量与阈值a对比,满足阈值范围则计数1次,重复过程直至识别所有重复区域微球;依次对每一个切割划分的图像进行识别计数并统计,对计数网格拍照的多张微球图像进行处理识别,同时基于tensorflow训练微球进行深度学习建立微球模型并记忆误差允许范围内的微球形状与颜色。最后对所有图像识别数据进行整合对比处理,当图像微球识别误差≤1%时系统判断计数有效,反馈函数值到计算机,计算机输出3μm粒径下红色微球、黄色微球、蓝色微球和其他微球数量。
(5)机器视觉微球识别检测crp、pct和il-6
机器视觉识别软件对导入计算机的显微镜拍照图像进行微球识别,记录颜色种类和不同颜色的微球数量并通过函数返回给计算机,通过网格计数区微球数量估算整体测量样本的微球数量,从而计算待测目标物含量,红色、黄色和蓝色的微球数量分别代表crp、pct和il-6含量。以免疫复合物中的不同颜色聚苯乙烯微球个数为纵坐标,不同种类的生物标志物浓度的对数值为横坐标,得到两者之间的线性关系。图9为不同颜色的聚苯乙烯微球信号探针数量与不同种类生物标志物(crp、pct和il-6)浓度关系变化图。在0.01~1000ng/ml范围内,不同粒径微球个数与不同种类抗生素浓度之间具有良好的线性关系,crp、pct和il-6的线性方程分别为y=80.8x+718.3、y=145.7x+573.0和y=96.0x+172.2(x为不同种类生物标志物浓度的对数值),r2分别为0.998、0.998和0.999,能够用于不同种类生物标志物的定量检测。
实施例4定量检测沙门氏菌和单增李斯特菌
(1)制备纳米磁颗粒-不同细菌捕获探针偶联物和不同粒径/颜色的聚苯乙烯微球-不同细菌检测探针偶联物
取2mg羧基修饰的磁性纳米颗粒(200nm,10mg/ml)分为2份,每份1mg,分别用mes缓冲液(ph=6.0)洗涤两次,每份用mes缓冲液重悬后分别加入20μledc(10mg/ml)和10μlnhs(10mg/ml),在室温下活化15min后混匀。活化完成后用pbs缓冲液洗涤两次,用pbs缓冲液重悬后分别加入0.1mg沙门氏菌捕获探针和0.1mg单增李斯特菌捕获探针,室温下反应2-4h;反应结束后,用1%bsa溶液封闭30min,封闭完成后用pbst缓冲液洗涤2次,纳米磁颗粒-捕获探针偶联物用pbs缓冲液重悬后保存于4℃待用。
取1mg羧基修饰的红色聚苯乙烯微球(6μm,100mg/ml)和1mg羧基修饰的蓝色聚苯乙烯微球(3μm,100mg/ml),用mes缓冲液(ph=6.0)洗涤两次,分别用mes缓冲液重悬后加入50μledc(10mg/ml)和25μlnhs(10mg/ml),混匀后在室温下活化15min。活化完成后用pbs缓冲液洗涤两次,用pbs缓冲液重悬后分别加入0.1mg沙门氏菌检测探针与6μm红色聚苯乙烯微球偶联、0.1mg单增李斯特菌检测探针与3μm蓝色聚苯乙烯微球偶联,室温下反应2-4h;反应结束后,用1%bsa溶液封闭30min,封闭完成后用pbst缓冲液洗涤2次,不同粒径/颜色的聚苯乙烯微球-不同细菌检测探针偶联物用pbs缓冲液重悬后保存于4℃待用。
(2)dna分子杂交反应与磁分离
将偶联沙门氏菌捕获探针和单增李斯特菌捕获探针的纳米磁颗粒复合物;偶联沙门氏菌检测探针和单增李斯特菌检测探针的不同颜色/粒径的聚苯乙烯微球复合物;含有沙门氏菌和单增李斯特菌的待测物样本同时加入1.5ml离心管内于37℃dna分子杂交反应10-30min,随后将离心管放置于磁分离架中1min完成磁分离,用pbst缓冲液洗涤3次,洗脱上清液中未反应的检测探针-聚苯乙烯微球和样品基质,取含有复合物的分离液于4℃保存用于显微镜微球成像计数。
(3)显微镜拍照
显微镜拍照所用主要仪器设备为正置光学显微镜(天津徕科光学仪器有限公司,型号lk50t),取25μl磁分离后的分离液均匀涂于划分网格计数区的载玻片上,将玻片样本放置于自动化导轨平台,通过显微镜控制软件调节显微镜自动对焦,设置显微镜放大倍数为1000倍,自动化导轨平台按设定程序对玻片样本定点平移,随机选取10个计数网格进行拍照,设置计算机对每个计数网格高速拍取10张尺寸为3840*2160高清图像并将传送至计算机保存,每个样本保存图片数量为100张。
(4)图像处理与机器视觉深度学习
微球识别模型选用windows1064bit操作系统(版本号1909)下python环境,处理器选用intercorei910900k,独立显卡选用nvidiageforcertx3080,深度学习框架选用tensorflow。首先对导入计算机待进行微球识别的图片进行自动分割处理,对每一个微球所在区域进行单独的切割划分成尺寸为227*227的图像,设置不同数量的像素点阈值,识别成像微球不同像素点的数量和设置微球阈值即可实现微球的粒径识别和数量统计;由于不同颜色所对应的rgb值不同,如:红色rgb(255,0,0)、黄色rgb(255,255,0)、蓝色rgb(0,0,255)等,通过计算机识别微球rgb值即可判断微球颜色。
对不同颜色/粒径组合编码的高分子微球进行识别时,计算机首先对微球的颜色进行识别分类,随后再对不同颜色下的粒径进行识别分类并计数。分别识别设置单个3μm和6μm微球在显微镜下放大1000倍所占用像素点为阈值a和阈值b,设置红色微球颜色阈值c1和蓝色微球颜色阈值c2。以3μm红色微球识别为例,首先将待测微球像素点颜色rgb值与红色微球颜色阈值c1进行识别比对,当待测微球像素点颜色接近设置阈值c1范围(c1±20%)内时即判定为1个红色微球并归类,若不满足红色颜色阈值条件则再与颜色阈值c2进行对比,均不满足则单独归类,确定待测微球颜色;随后确定待测微球粒径,当待测微球像素点数量接近设置阈值a范围(a±5%)内时即判定为1个3μm微球,当待测微球像素点与设置阈值a偏离过大则与阈值b比对,均不满足对该微球单独计数。采用割补法对图像边缘区域的残缺微球进行像素点数量合并处理,首先识别残缺微球颜色,对不同颜色的微球进行分类像素点数量合并,每当不同类合并像素点总数溢出阈值a或者阈值b时,则计数为1个微球;对于重叠、联结等微球采用重复识别法进行计数,先对未重合的微球部分识别颜色,随后叠加重叠部分和未重叠部分像素点数量与阈值a或阈值b对比,满足阈值范围则计数1次,重复过程直至识别所有重复区域微球;依次对每一个切割划分的图像进行识别计数并统计,对计数网格拍照的多张微球图像进行处理识别,同时基于tensorflow训练微球进行深度学习建立微球模型并记忆误差允许范围内的微球形状与颜色。最后对所有图像识别数据进行整合对比处理,当图像微球识别误差≤1%时系统判断计数有效,反馈函数值到计算机,计算机输出3μm红色微球、6μm蓝色微球和其他微球数量。
(5)机器视觉微球识别检测沙门氏菌和单增李斯特菌
机器视觉识别软件对导入计算机的显微镜拍照图像进行微球识别,记录识别不同颜色/粒径微球数量并通过函数返回给计算机,通过网格计数区微球数量估算整体测量样本的微球数量,从而计算待测目标物含量,对6μm红色聚苯乙烯微球和3μm蓝色聚苯乙烯微球分别代表沙门氏菌和单增李斯特菌的含量。以dna分子杂交复合物中的不同粒径/颜色聚苯乙烯微球个数为纵坐标,不同种类的细菌浓度的对数值为横坐标,得到两者之间的线性关系。图10为不同粒径/颜色的聚苯乙烯微球信号探针数量与不同种类细菌(沙门氏菌和单增李斯特菌)浓度关系变化图。在0~10000000cfu/ml范围内,不同粒径/颜色微球个数与不同种类细菌浓度之间具有良好的线性关系,沙门氏菌和单增李斯特菌的线性方程分别为y=308.4x+301.1和y=542.1x+199.4(x为不同种类细菌浓度的对数值),r2为0.996和0.997,能够用于不同种类细菌的定量检测。
- 还没有人留言评论。精彩留言会获得点赞!