定量检测血清淀粉样蛋白A的试剂盒及其制备方法与流程
本发明涉及医学检验领域,具体涉及一种定量检测人体血清淀粉样蛋白a的试剂盒及其制备方法。
背景技术:
血清淀粉样蛋白a(serumamyloidaprotein,saa)是一种由肝细胞产生后被分泌到血清中的一种急性时相反应蛋白,属于载脂蛋白家族中的异质类蛋白质,与血浆高密度脂蛋白(hdl)结合。炎症或感染急性期患者体内saa含量在48-72小时内急速升高,并且在疾病的恢复期迅速下降,作为新的炎症或感染急性期检测指标,saa在临床应用中发挥着重要作用。
正常人体中,saa的含量在10mg/l以下,在发生轻微感染时,人体内saa的含量上升并处于10-200mg/l范围内。但是对于部分疾病患者而言,其体内saa含量将显著上升,例如重症的手足口患儿体内saa含量高达600mg/l,患者体内超高的saa含量能够有效的反应疾病的严重性,同时更加有利于医生进行疾病的判别。
目前,saa的检测方法包括酶联免疫法以及胶乳增强免疫比浊法等,酶联免疫由于其过程繁琐,检测耗时长,不利于高通量的检测。胶乳增强免疫比浊法具有检测速度快,准确度高的优点,在做到高通量检测的同时保证了检测的准确性,已逐步发展为重要的临床检测手段,但是目前市面上的saa胶乳增强免疫比浊法检测试剂盒具有检测线性窄(多数试剂线性范围为200mg/l以下)、抗hook能力弱等缺点,不利于疾病的诊断以及不同医学水平的判定。
技术实现要素:
根据上述需求,发明人意外发现,通过在saa检测试剂盒的胶乳微球标记过程中添加苯甲酸以及吗啉组合物,可以显著增加saa抗体与胶乳为求的标记效率,同时通过调整试剂配置,显著提升了试剂的检测线性范围以及抗hook能力。
本发明提供一种定量检测人体血清淀粉样蛋白a(saa)的试剂盒,采用如下技术手段:一种定量检测人体血清淀粉样蛋白a的试剂盒,其特征在于,包括试剂r1以及试剂r2;
所述试剂r1包括的成分及相应的含量为:缓冲液50-200mm,表面活性剂i0.1-0.5%,表面活性剂ii0.1-0.5%,防腐剂0.1-0.5%,无机盐0.1-0.8%以及促凝剂1-2%;
所述试剂r2包括的成分及相应的含量为:缓冲液50-100mm,蛋白保护剂1-5%,防腐剂0.1-0.5%,无机盐0.1-0.8%以及包被有saa单克隆抗体的胶乳颗粒;
所述包被有saa单克隆抗体的胶乳颗粒的制备过程包括:在组分a以及组分b的存在下,saa单克隆抗体与胶乳颗粒偶联,所述组分a选自吗啉或哌啶中的至少一种,优选为吗啉,所述组分b选自苯甲酸或水杨酸中的至少一种,优选为苯甲酸。
优选地,在所述试剂r1中:
所述缓冲液选自tris、mops或磷酸盐缓冲液中的至少一种,优选为mops缓冲液;所述表面活性剂i选自tritonx-100或tween-20中的至少一种,优选为tween-20;所述表面活性剂ii选自brii58、tween-80或a90中的至少一种,优选为a90;所述防腐剂选自proclin-300、叠氮钠或庆大霉素中的至少一种;所述无机盐选自氯化钠或氯化钾中的至少一种;所述促凝剂选自peg6000或peg8000中的至少一种。
优选地,所述试剂r1的ph为6-8,优选为6-6.5。
优选地,在所述试剂r2中:
所述缓冲液选自mops、bicine或磷酸盐缓冲液中的至少一种,优选为bicine缓冲液;所述蛋白保护剂选自bsa、酪蛋白、蔗糖或海藻糖中的至少一种,优选为bsa;所述防腐剂选自proclin-300、叠氮钠或庆大霉素中的至少一种;所述无机盐选自氯化钠或氯化钾中的至少一种。
优选地,所述试剂r2的ph为6-8,优选为6.5-7。
优选地,所述包被有鼠抗人saa抗体的胶乳颗粒的粒径范围为100-200nm。
一种如上述任一项所述的一种定量检测人体血清淀粉样蛋白a的试剂盒的制备方法,其特征在于,包括如下步骤:
(1)试剂r1的制备
试剂r1按照下述配方进行配置:
缓冲液50-200mm,表面活性剂10.1-0.5%,表面活性剂ii0.1-0.5%,防腐剂0.1-0.5%,无机盐0.1-0.8%以及促凝剂1-2%;
所述缓冲液选自tris、mops或磷酸盐缓冲液中的至少一种,优选为mops缓冲液;所述表面活性剂i选自tritonx-100或tween-20中的至少一种,优选为tween-20;所述表面活性剂ii选自brii58、tween-80或a90中的至少一种,优选为a90;所述防腐剂选自proclin-300、叠氮钠或庆大霉素中的至少一种;所述无机盐选自氯化钠或氯化钾中的至少一种;所述促凝剂选自peg6000或peg8000中的至少一种;
(2)试剂r2的制备
①saa胶乳颗粒制备
将胶乳微球加入标记缓冲液中,搅拌均匀;随后向其中加入活化剂活化,搅拌均匀;向活化的胶乳微球溶液中加入saa单克隆抗体,同时向其中加入组分a与组分b的组合物,所述组分a选自吗啉或哌啶中的至少一种,优选为吗啉,所述组分b选自苯甲酸或水杨酸中的至少一种,优选为苯甲酸,搅拌均匀后孵育6-14h;离心,弃上清,即可得包被有saa单克隆抗体的胶乳颗粒;
②r2基础缓冲液制备
r2基础缓冲液按照下述配方进行配置:
缓冲液50-100mm,蛋白保护剂1-5%,防腐剂0.1-0.5%,无机盐0.1-0.8%;
所述缓冲液选自mops、bicine或磷酸盐缓冲液中的至少一种,优选为bicine缓冲液;所述蛋白保护剂选自bsa、酪蛋白、蔗糖或海藻糖中的至少一种,优选为bsa;所述防腐剂选自proclin-300、叠氮钠或庆大霉素中的至少一种;所述无机盐选自氯化钠或氯化钾中的至少一种。
③试剂r2制备
将步骤①制备得到的saa胶乳颗粒加入步骤②制备得到的r2基础缓冲液中,溶解后超声,20-40℃孵育6-14h即可得到试剂r2。
优选地,在所述步骤①中,分别加入0.5-1%吗啉以及0.5-1%苯甲酸的组合物。
优选地,在所述步骤①中,所述标记缓冲液选自磷酸缓冲液或tris缓冲液中的至少一种,优选为磷酸缓冲液,所述活化剂采用edc/nhs,所述nhs与edc以及胶乳微球的质量比为:1∶(0.5-1.5)∶(800-1000),所述saa单克隆抗体与胶乳微球的质量比为1∶(350-400)。
优选地,在所述步骤③中,所述r2试剂中包被有saa单克隆抗体的胶乳颗粒的含量为0.05-0.1%。
本发明的有益效果在于:本发明通过在胶乳微球标记液中添加苯甲酸与吗啉组合物的方式,增加了saa抗体与胶乳微球的标记效率,一方面保证了试剂盒检测的精密度和准确度,同时显著提升了试剂盒在检测高值阳性样本时的抗hook能力(抗hook能力可达1043mg/l),使试剂的线性范围达到2-500mg/l。
附图说明
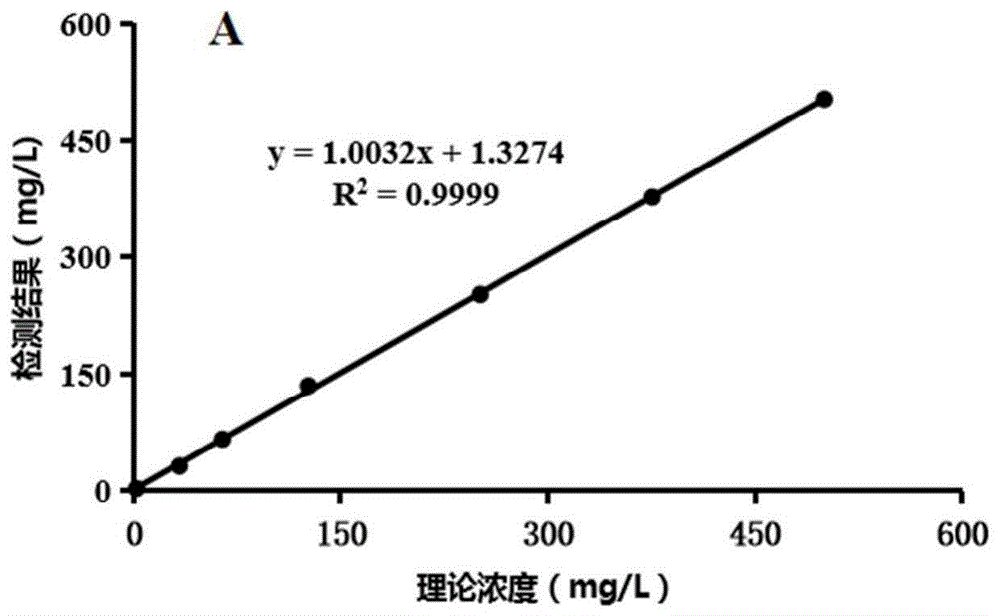
图1为根据本发明实施例3所提供的saa赋值样本理论浓度与a组试剂盒测定值的线性关系图;
图2为根据本发明实施例3所提供的saa赋值样本理论浓度与b组试剂盒测定值的线性关系图;
图3根据本发明实施例3所提供的saa赋值样本理论浓度与c组试剂盒测定值的线性关系图;
图4为根据本发明实施例4所提供的saa超高赋值样本理论浓度与a组试剂盒测定值的线性关系图;
图5为根据本发明实施例4所提供的saa超高赋值样本理论浓度与b组试剂盒测定值的线性关系图;
图6为根据本发明实施例4所提供的saa超高赋值样本理论浓度与c组试剂盒测定值的线性关系图。
图7为根据本发明实施例4所提供的saa超高赋值样本理论浓度与d组试剂盒测定值的线性关系图。
具体实施例
本文包括以下的实施例,用于以例证的方式更清楚、明确地阐述本发明的技术方案。本领域技术人员根据本文的公开应当理解,可以在所公开的特定的实施方式中进行许多改变但是仍然获得相似或类似的结果,而不偏离本发明的思想和范围。本发明的具体实施方式仅用于解释本发明,而非意图通过任何方式限制本发明。
实施例1saa检测试剂盒的制备
本发明的淀粉样蛋白a检测试剂盒包括彼此独立的试剂r1和试剂r2双液体组分。
1.试剂r1的制备
按照下述配方进行配置,充分搅拌混匀后,放于2-8℃保存。
试剂r1:
其余溶剂为纯化水
2.试剂r2的制备
(1)包被鼠抗人saa单克隆抗体的胶乳颗粒的制备
a.将100ug110nm的胶乳微球加入20ml100mm的标记缓冲液中(磷酸缓冲液),搅拌均匀;
b.向上述溶液中加入0.1ugnhs和0.1ugedc活化微球,匀速搅拌1h;
c.向活化的胶乳微球溶液中加入1ml10g/l的鼠抗人saa单克隆抗体,同时向其中加入0.6%的苯甲酸、0.6%的吗啉,搅拌均匀孵育6h;
d.取上述交联后的试剂12500rpm离心25min,弃上清,保留标记好的包被有鼠抗人saa抗体的胶乳颗粒。
(2)r2基础缓冲液的制备
按照下述配方进行配置,充分搅拌混匀后,放于2-8℃保存。
r2基础缓冲液:
其余溶剂为纯化水
(3)试剂r2的制备
将上述制备得到的包被有鼠抗人saa抗体的胶乳颗粒加入r2基础缓冲液中(r2缓冲液中包被有saa单克隆抗体的胶乳颗粒的含量为0.08%),溶解后超声,随后37℃孵育过夜即可得到r2试剂。
实施例2试剂盒的使用方法
本实施例中,使用全自动生化分析仪(日立7180)配合本发明试剂盒进行样本检测。
1.仪器参数设置
2.测定方案
3.计算方式
使用多点非线性/半对数校准模式,以样条函数为计算模式,根据校准品的值与吸光度变化值作计量/响应曲线,样品中saa的含量可根据其吸光度变化值在剂量/响应曲线上计算出。
其中,本发明的检测原理是采用胶乳增强免疫比浊法测定人血清淀粉样蛋白a(saa)的含量,样本中的saa与胶乳微球表面交联的saa抗体结合,使相邻的胶乳微球彼此交联,以致发生凝集反应产生浊度变化,该浊度高低与样本中saa的含量成正比,在一定波长下测定浊度并通过定标曲线可进行saa的定量测定。
实施例3试剂盒性能测试
为了验证本发明试剂盒的各项性能,共设置3组试剂盒进行性能验证:
a组:本发明实施例1制备得到的试剂盒。
b组:按照下述配方进行配制:试剂r1:0.10%的脂肪酸盐、10mmol/l的甘氨酸缓冲液、0.01%的tween20、3.00%的氯化钠、0.01%的叠氮钠、0.01%的聚乙二醇2000、0.20%的牛血清蛋白,溶剂为纯化水;
试剂r2:10mmol/l的甘氨酸缓冲液、0.01%的tween20、3.00%的氯化钠、0.01%的叠氮钠、0.20%的牛血清蛋白、0.10%包被有saa单克隆抗体的胶乳微球;
包被有saa单克隆抗体胶乳微球的制备:.将100ug粒径为50nm的胶乳微球加入100ml10mmol/l的甘氨酸缓冲液,搅拌均匀;向上述溶液中加入0.1ugnhs和0.1ugedc活化微球,匀速搅拌1h;向活化的胶乳微球溶液中加入1ml10g/l的鼠抗人saa单克隆抗体,搅拌均匀孵育6h;加入1%蛋白保护剂bsa以及0.01%的叠氮钠,孵育1h后,放入37℃老化3d,既得包被有saa单克隆抗体的胶乳微球。
c组:按照下述配方进行配制:试剂r1:100mmol/ltris缓冲液、180mmol/l氯化钾、20g/l聚乙二醇-2000、0.7g/l叠氮钠、30g/l牛血清白蛋白,溶剂为纯化水;
试剂r2:125mmol/ltris缓冲液、11g/l牛血清白蛋白、0.7g/l叠氮钠、4g/l胶乳包被抗血清淀粉样蛋白a抗体,溶剂为纯化水;
胶乳包被抗血清淀粉样蛋白a抗体的制备:先用50mmol/l的mes缓冲液将粒径为120nm的聚苯乙烯微球稀释成为所含的聚苯乙烯微球的质量浓度为5%的溶液,然后每毫升溶液中加入0.5mg的1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐,在25℃的条件下反应1小时,使用离心机,在20000rpm/min的转速下离心30分钟,弃上清,用50mmol/l的mes缓冲液对沉淀进行稀释,再使用离心机,在20000rpm/min的转速下离心30分钟,弃上清,用50mmol/l的mes缓冲液继续对沉淀进行稀释,使得聚苯乙烯微球的质量浓度为2.0%,再使用离心机,在20000rpm/min的转速下离心30分钟,弃上清,保留沉淀,再用50mmol/l的mes缓冲液对沉淀进行稀释,并加入等体积的含8mg/ml抗血清淀粉样蛋白a抗体的mes缓冲液,搅拌均匀,使得最终聚苯乙烯微球的质量浓度为1%,在25℃的条件下反应2小时,加入牛血清白蛋白,使得牛血清白蛋白的最终浓度为20g/l,4℃条件下封闭24小时即可制备得到胶乳包被抗血清淀粉样蛋白a抗体。
(1)准确度验证
使用三组试剂盒分别对西门子saa检测试剂盒赋值样本进行测试,设2个重复,通过全自动生化分析仪(日立7180)读取信号,计算测定均值与靶值的相对偏差进行准确度验证。检测结果如下表所示:
表1准确度验证
由上述实验结果可知,三组试剂盒测试值1与靶值1的相对偏差分别为0.11%、-3.82%以及2.88%,测试值2与靶值2的相对偏差分别为1.77%、2.79%以及-1.97%。其中本发明实施例1制备得到的试剂盒(a组)质控准确度优于对比试剂盒-1(b组)以及对比试剂盒-2(c组)。
(2)精密度验证
选取临床saa低值样本、中值样本以及高值样本,使用三组试剂盒分别对样本进行测试,每个样本分别重复测定10次,通过全自动生化分析仪(日立7180)读取信号,分别计算测定均值和标准差,计算变异系数进行精密度考察。检测结果如下表所示:
表2精密度验证
由上述实验结果可知,三组试剂盒在低值样本检测时的变异系数分别为1.86%、6.82%、3.45%,中值样本检测时的变异系数分别为2.12%、3.99%、4.01%,高值样本检测时的变异系数分别为1.34%、9.18%、11.22,实验结果说明,三组试剂盒在低值样本以及中值样本的检测中均具有较好的精密度,而在高值样本的检测中,a组试剂盒的变异系数显著低于b组以及c组,说明本发明实施例1制备得到的试剂盒(a组)在检测高值样本时的精密度显著优于对照试剂盒-1(b组)以及对照试剂盒-2(c组)。
(3)线性范围验证
选择西门子的saa检测试剂盒(散射比浊法)在西门子特种蛋白仪(bniisystem)的赋值样本,其中高值样本的理论浓度值为500.18mg/l,低值样本的理论浓度值为2.01mg/l,随后利用高值样本以及低值样本按比例配置各浓度梯度样本,使用三组试剂盒分别对样本进行测试,每个样本分别重复测定2次,通过全自动生化分析仪(日立7180)读取信号,分别计算测定均值进行线性范围考察。检测结果如下表所示:
表3线性范围验证
由上述实验结果可知,本发明实施例1制备得到的试剂盒(a组)以及对照试剂盒-1(b组)在样本浓度为30-500mg/l范围内,检测值与理论值的相对偏差均较小,特别是在200-500mg/l范围内时,其检测值与理论值的相对偏差均小于5%。而对照试剂盒-2(c组)在样本浓度大于300mg/l时,其检测值与理论值的相对偏差均大于10%。同时,将三组试剂盒的检测结果与样本浓度理论值进行相关性分析(如附图1-3所示),a组以及b组检测值与理论值的相关性显著优于c组,其中a组检测值与理论值的相关性r2为0.9999,b组r2为0.9996,c组r2为0.9704。实验结果说明本发明实施例1制备得到的试剂盒较对照试剂盒-2的线性范围更宽,尤其是针对浓度高于300mg/l的高值样本,对照试剂盒-1不能进行准确检测。根据实验结果,推测本发明实施例制备得到的试剂盒具有较优的抗hook能力。
实施例4抗hook能力验证
为了验证在胶乳微球标记过程中添加苯甲酸以及吗啉的组合物,能够优化试剂的抗hook能力,共设置3组试剂盒进行验证:
a组:本发明实施例1制备得到的试剂盒;
b组:所述试剂盒与实施例1试剂盒的区别仅在于,胶乳微球的标记过程中未加入苯甲酸以及吗啉,其余制备方法均与实施例1相同;
c组:所述试剂盒与实施例1试剂盒的区别仅在于,胶乳微球的标记过程中仅加入吗啉,未加入苯甲酸,其余制备方法均与实施例1相同;
d组:所述试剂盒与实施例1试剂盒的区别仅在于,胶乳微球的标记过程中仅加入苯甲酸,未加入吗啉,其余制备方法均与实施例1相同。
选择西门子的saa检测试剂盒(散射比浊法)在西门子特种蛋白仪(bniisystem)对超高值样本赋值,样本浓度为1192.00mg/l,利用超纯水按比例稀释配置各浓度梯度样本,使用三组试剂盒分别对样本进行测试,每个样本分别重复测定3次,通过全自动生化分析仪(日立7180)读取信号,分别计算测定均值及相对偏差sd进行抗hook能力验证。检测结果如下表所示:
表4a组试剂盒抗hook能力验证
由上述实验结果,将a组试剂盒的检测结果与样本浓度理论值进行比对分析(如附图4所示),结果显示,本发明实施例1制备得到的试剂盒(a组)能够达到的抗hook能力为1043mg/l(测定均值-3sd的值>500时对应的最高浓度,为该试剂的抗hook能力值)。
表5b组试剂盒抗hook能力验证
由上述实验结果,将b组试剂盒的检测结果与样本浓度理论值进行比对分析(如附图5所示),结果显示,b组试剂盒抵抗hook能力较差。
表6c组试剂盒抗hook能力验证
由上述实验结果,将c组试剂盒的检测结果与样本浓度理论值进行比对分析(如附图6所示),结果显示,c组试剂盒抵抗hook能力较差。
表7d组试剂盒抗hook能力验证
由上述实验结果,将d组试剂盒的检测结果与样本浓度理论值进行比对分析(如附图7所示),结果显示,d组试剂盒抵抗hook能力较差。
综上,本发明通过在胶乳微球的标记过程中引入苯甲酸以及吗啉组合物,可以有效提升胶乳微球的标记效率,显著提升了试剂后续的检测性能,包括检测准确度、灵敏度、线性范围以及抗hook能力,推测其原因可能是:只有当抗体上的氨基以正确的方向与微球上的羧基结合时,抗体的标记才是有效的,而苯甲酸是含有羧基的有机物,在标记过程中能够竞争性的与抗体上的氨基反应,而吗啉可以与微球上的羧基反应,在标记过程中加入吗啉可以与抗体竞争交联微球的上的羧基,通过控制体系中苯甲酸以及吗啉的浓度,控制抗体上暴露的氨基以及微球上暴露的羧基数量,有效平衡抗体在胶乳微球上的结合位点,最大程度的保证抗体以正确的方向与微球结合,进而提高抗体在羧基微球上的标记效率,整体上提高试剂的性能。
实施例5
本实施例中共设置4组实验,其中每组实验使用的试剂盒与实施例1的区别仅在于胶乳微球的标记工艺不相同:
a组:所述试剂盒与实施例1试剂盒的区别仅在于,胶乳微球的标记过程中加入0.1%苯甲酸以及0.1%吗啉,其余制备方法均与实施例1相同;
b组:所述试剂盒与实施例1试剂盒的区别仅在于,胶乳微球的标记过程中加入0.5%苯甲酸以及0.5%吗啉,其余制备方法均与实施例1相同。
c组:所述试剂盒与实施例1试剂盒的区别仅在于,胶乳微球的标记过程中,加入1%苯甲酸、1%吗啉,其余制备方法均与实施例1相同。
d组:所述试剂盒与实施例1试剂盒的区别仅在于,胶乳微球的标记过程中,加入2%苯甲酸以及2%吗啉,其余制备方法均与实施例1相同。
(1)精密度验证
选取临床saa中值样本,使用上述五组试剂盒分别对样本进行测试,每个样本分别重复测定10次,通过全自动生化分析仪(日立7180)读取信号,分别计算测定均值和标准差,计算变异系数进行精密度考察。检测结果如下表所示:表8精密度验证
实验结果显示,在胶乳微球的标记过程中,加入0.5-1%的苯甲酸以及0.5-1%的吗啉,有助于提升试剂盒的检测精密度。
(2)线性范围验证
选择西门子的saa检测试剂盒(散射比浊法)在西门子特种蛋白仪(bniisystem)的赋值样本,其中高值样本的理论浓度值为500.18mg/l,低值样本的理论浓度值为2.01mg/l,随后利用高值样本以及低值样本按比例配置各浓度梯度样本,使用四组试剂盒分别对样本进行测试,每个样本分别重复测定2次,通过全自动生化分析仪(日立7180)读取信号,分别计算测定均值进行线性范围考察。检测结果如下表所示:
表9线性范围验证
由上述实验结果可知,由上述实验结果可知,b组试剂盒以及c组试剂盒在样本浓度为30-500mg/l范围内,检测值与理论值的相对偏差均较小,特别是在200-500mg/l范围内时,其检测值与理论值的相对偏差均小于1%。而a组以及d组试剂盒在样本浓度大于300mg/l时,其检测值与理论值的相对偏差均大于b组以及c组试剂盒的相对偏差,实验结果说明,在胶乳微球的标记过程中加入0.5-1%苯甲酸以及0.5-1%吗啉组合物时,更有利于试剂性能的提升。
实施例6
本实施例中共设置5组实验,其中每组实验使用的试剂盒与实施例1的区别仅在于胶乳微球的标记工艺不相同:
a组:所述试剂盒与实施例1试剂盒的区别仅在于,胶乳微球的标记过程中加入0.6%吗啉以及0.6%邻氨基苯甲酸,未加入苯甲酸,其余制备方法均与实施例1相同;
b组:所述试剂盒与实施例1试剂盒的区别仅在于,胶乳微球的标记过程中加入0.6%的吗啉,0.6%水杨酸,未加入苯甲酸,其余制备方法均与实施例1相同;
c组:所述试剂盒与实施例1试剂盒的区别仅在于,胶乳微球的标记过程中加入0.3%哌啶以及0.6%苯甲酸,未加入吗啉,其余制备方法均与实施例1相同;
d组:所述试剂盒与实施例1试剂盒的区别仅在于,胶乳微球的标记过程中加入0.6%哌啶以及0.6%水杨酸,未加入吗啉以及苯甲酸,其余制备方法均与实施例1相同;
e组:所述试剂盒与实施例1试剂盒的区别仅在于,胶乳微球的标记过程中加入0.6%哌啶以及0.6%邻氨基苯甲酸,未加入吗啉以及苯甲酸,其余制备方法均与实施例1相同;
(1)精密度验证
选取临床saa中值样本,使用上述五组试剂盒分别对样本进行测试,每个样本分别重复测定10次,通过全自动生化分析仪(日立7180)读取信号,分别计算测定均值和标准差,计算变异系数进行精密度考察。检测结果如下表所示:表8精密度验证
实验结果显示,在胶乳微球的标记过程中,加入苯甲酸与吗啉、吗啉与水杨酸、哌啶与苯甲酸或哌啶与水杨酸组合物时,有助于提升试剂盒的检测精密度。
(2)线性范围
选择西门子的saa检测试剂盒(散射比浊法)在西门子特种蛋白仪(bniisystem)的赋值样本,其中高值样本的理论浓度值为500.18mg/l,低值样本的理论浓度值为2.01mg/l,随后利用高值样本以及低值样本按比例配置各浓度梯度样本,使用四组试剂盒分别对样本进行测试,每个样本分别重复测定2次,通过全自动生化分析仪(日立7180)读取信号,分别计算测定均值进行线性范围考察。检测结果如下表所示:
表9线性范围验证
由上述实验结果可知,b组、c组以及d组试剂盒在样本浓度为2.01-500.18mg/l范围内,检测值与理论值的相对偏差均小于10%,实验结果说明,在胶乳微球的标记过程中加入苯甲酸与吗啉、吗啉与水杨酸、哌啶与苯甲酸或哌啶与水杨酸组合物时,有利于试剂性能的提升。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变形。
- 还没有人留言评论。精彩留言会获得点赞!