免疫磁珠富集后的细菌待检测样品的磁珠去除方法与流程
技术领域:
本发明属于微生物检测领域,涉及一种细菌检测的前处理方法,具体涉及对经过免疫磁珠捕获的细菌进行纯化去除磁珠的方法。
背景技术:
:
免疫磁珠是对具有超顺磁性的微粒表面进行化学修饰,使之与特异性抗体牢固结合的磁珠。抗体耦连在磁珠上,用于捕获细菌并且磁分离。
很多快速的细菌检测方法,例如流式分析技术检测法、荧光定量pcr检测方法,胶体金免疫层析检测方法等,虽然检测速度快,但是检测的灵敏度不够,还容易受到检测样品中复杂的其它物质的干扰。因此,这些方法往往需要结合免疫磁珠富集技术,即将目标细菌从食品基质中捕获并磁分离,从而得到富集的细菌,便于后续检测。
然而经过磁分离步骤后,免疫磁珠捕获得到的细菌表面往往会连接有大量的磁珠,这些磁珠会对上述快速检测技术产生干扰,影响检测结果的准确性。
比如,流式分析检测方法极易把两个或多个黏连的细菌当做一个细菌去识别,造成检测数据的不准确。
比如,在荧光定量pcr检测方法和胶体金免疫层析检测方法中,磁珠大量包裹细菌,从而降低核酸提取效率,检测数据不准确的同时增加检测时间。
因此,在进行细菌的检测前,将免疫磁珠捕获的细菌去除磁珠,进行纯化很有必要。即,将经过磁分离得到细菌与其表面连接的免疫磁珠有效分开,将大大提高上述快速检测方法的准确性。
开发一种细菌和免疫磁珠分离的技术,是当前免疫磁珠结合快速检测技术检测细菌这类方法的实际需要,也是新思路和技术难点。
技术实现要素:
:
本发明的目的是提供一种对免疫磁珠富集后的细菌待检测样品的磁珠去除方法,尤其是要满足以下要求:
1、能够切断细菌菌体和磁珠之间的连接;
2、不能对细菌产生损伤;
3、纯化得到的细菌菌液中残存的磁珠数量不影响后续细菌检测的准确度;
要达到上述发明目的,具有两个技术关键点:一是找到合适的切割细菌和磁珠连接的位点,二是找到优化的菌体和磁珠的分离条件。
为解决上述关键技术问题,本发明人进行了如下探索,克服了以下技术难点:
1、切割位点的选择,本发明发现已知的两个切割位点都不适于本发明目的。
本发明首次发现,抗体本身的fc端是一个新的有效切割位点,且蛋白酶可以作为切断细菌和磁珠连接的材料。
细菌和磁珠的连接中目前已知存在两个切割位点:抗原抗体之间的连接和磁珠和抗体之间的连接。
(1)细菌和磁珠通过抗原抗体反应进行连接,磁珠表面耦连有大量抗体,可以和细菌特异性结合。抗原抗体之间的亲和力高,亲和力kd通常能达到10-10;特异性好,抗原是o抗原(菌体抗原),抗体是针对整个菌体的单克隆抗体,大量的磁珠通过抗体连接在菌体表面,甚至覆盖住了菌体(见实施例1)。
(2)磁珠和抗体之间通过羧基氨基反应进行连接。磁珠表面的羧基和抗体表面的氨基经过edc/nhs的催化,进行缩合反应,反应进行程度高。
本发明进行实验评估,发现这两个切割位点都不适于达到本发明目的:磁珠和抗体之间的羧基氨基反应难以进行切割,而抗原抗体之间的反应虽然可以通过强酸、强碱、高盐的环境进行逆转,但上述极端环境会严重损伤细菌的活性(见实施例2)。排除了上述两个切割位点后,需要寻找潜在的新的切割位点。
本发明经过大量的研究,发现将抗体本身进行切割是一个可行的思路。
抗体的结构为y形状,分为2个fab端和1个fc端,本发明人发现,使用蛋白酶,可以将抗体的fc端切割分离开。
用蛋白酶进行抗体切割,通常应用于抗体片段化等领域。尚未有任何研究提出将蛋白酶用于抗原和抗体fc端及fc端连接物的分离。
经多种分析技术验证,使用蛋白酶将抗体fc端与抗体切割分离,对于切割细菌磁珠连接是有效的。
2、筛选抗体切割所用的蛋白酶的选择
本发明对多个蛋白酶进行了大量实验验证,发现能用于本发明的蛋白酶应该符合以下技术指标:
a)是能够实现抗体的片段化的内肽酶;
b)不会对细菌产生损伤;
c)使用该蛋白酶对免疫磁珠的细菌进行纯化,纯化效率大于89%;
c)可以在2.5个小时内实现细菌和磁珠的分离。
本发明对多个蛋白酶进行了大量验证筛选,发现达到上述要求的蛋白酶有木瓜蛋白酶、胃蛋白酶、无花果蛋白酶、胰蛋白酶等。其中最优选的蛋白酶是木瓜蛋白酶(见实施例4),该酶切割效率高,速度快,不对细菌产生损伤。
3、建立了一种用于细菌免疫磁珠富集后的纯化方法,其特征是包括如下步骤:
1)在免疫磁珠捕获的细菌样品溶液中加入蛋白酶
蛋白酶可以切断免疫磁珠上细菌抗体的fab端和fc端之间的连接,使得fab端连接的细菌菌体和fc端连接的磁珠分离开来。
2)在上述样品溶液旁放置磁铁
磁铁可以使分离下来的磁珠吸附于靠近磁铁的样品容器壁。可以使用一种能固定磁铁的磁力架进行。
3)将分离出磁珠的样品溶液转移至另外容器,得到纯化的细菌样品。
所述蛋白酶的工作条件是:a)工作浓度在0.01%至0.1%(质量分数)之间;b)最适反应温度是37℃。
经过免疫磁珠捕获的细菌进行纯化(分离免疫磁珠)后的细菌样品,可以用各种细菌快速精确检测方法进行细菌的定量检测。因此,本方法是一种细菌检测的前处理步骤。
所述细菌快速精确检测方法,包括流式分析技术、荧光定量pcr检测方法,胶体金免疫层析技术等。
所述纯化效率,其测定方法为:免疫磁珠对细菌菌液进行捕获,使用流式分析技术测定上清液的细菌浓度;然后使用蛋白酶对磁珠捕获的细菌进行纯化,磁分离后使用流式分析技术检测纯化后的细菌浓度;然后用如下公式计算纯化效率:
式中,α为蛋白酶纯化免疫磁珠捕获的细菌的纯化效率;a为菌液的初始浓度,cfu/ml;b为免疫磁珠捕获后,上清液中的细菌浓度,cfu/ml;c为纯化后的细菌浓度,cfu/ml。
本发明以检测大肠杆菌o157:h7为例,对经过免疫磁珠捕获的大肠杆菌o157:h7进行了纯化实验,证实了本发明的效果。详见实施例。其中:
实施例1是免疫磁珠富集后的大肠杆菌o157:h7菌体,菌体被磁珠包裹。
实施例2证明了其它免疫磁珠捕获的大肠杆菌o157:h7的纯化方法(如强酸、强碱、高盐)会严重损伤细菌的活性。
实施例3是一次使用蛋白酶进行纯化的具体操作。
实施例4使用流式分析技术对多种蛋白酶切割效果进行筛选。
实施例5protease-4蛋白酶对捕获菌体磁珠进行酶切后表征验证。
实施例6纯化方法中,protease-4蛋白酶用量,反应时间,温度的优化。
实施例7-9验证了本专利建立的细菌样品纯化的前处理方法,可以应用于流式分析检测、荧光定量pcr检测、胶体金免疫层析的检测方法。
本发明虽然仅用大肠杆菌o157:h7为例进行验证,但可以推测其它细菌的检测中,也可用本发明方法。因为大量前人的实验表明,所用蛋白酶适用于抗体片段化,可以将任何抗体的fab端与fc端酶解分离。
本发明具有以下创新和优点:
1、本发明首次发现,抗体本身的fc端是一个新的有效切割位点;
2、且首次发现,蛋白酶用于抗原和抗体fc端及fc端连接物的分离,可以作为切断细菌和磁珠连接的材料。
3、不对细菌产生损伤,分离得到的细菌菌液中磁珠的数量不会影响后续的细菌检测。
4、与离心去除磁珠的纯化方法相比,可以从复杂食品基质中纯化细菌。
5、与仅采用磁珠富集后检测的方法相比,减少免疫磁珠发生的黏连现象以及免疫磁珠本身对检测结果的影响,提高结合免疫磁珠的快速检测细菌方法的准确性。
附图说明
图1是实施例1中免疫磁珠捕获大肠杆菌o157:h7的扫描电镜图,其中a为未经免疫磁珠捕获的大肠杆菌o157:h7;b为免疫磁珠捕获的大肠杆菌o157:h7。
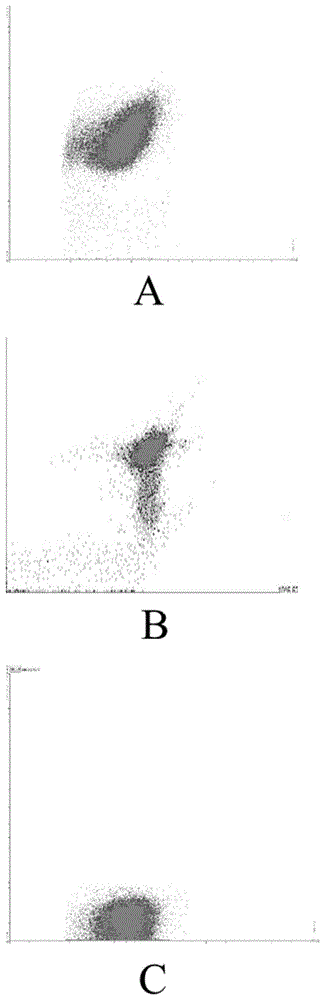
图2是实施例2中强酸强碱方法后使用流式细胞仪检测所得死活比结果图,其中a为盐酸处理;b为氢氧化钠处理;c为对照。
图3是实施例5中酶切后电镜结果和zeta电位对比结果图,其中,a为电镜结果图,b为zeta电位结果图。
具体实施方式
下面以免疫磁珠捕获的大肠杆菌o157:h7的纯化为例,详述本发明的操作过程。应理解为仅用于举例说明本发明,并不能限制本发明所能纯化的细菌的范围。因为与任何细菌连接的磁珠都可以采用抗体的fab端与fc端的酶解分离方式去除磁珠,与菌株本身的性质无关。
以下实施例中所用的实验试剂耗材,如无特殊说明,均为常规试剂或材料。未注明具体条件的实验方法,通常按照本领域技术的常规条件或者试剂或材料产品使用说明中的建议条件进行。
实施例中涉及的大肠杆菌o157:h7菌株和蛋白酶等,很容易从公开商业渠道获得。其中所用的8种不同编号(protease-1—protease-8)蛋白酶,为不同批次来源的木瓜蛋白酶。
实施例1:大肠杆菌o157:h7用免疫磁珠富集后的表征
一、材料与方法
1.制备1份1.0×104cfu/ml的大肠杆菌o157:h7菌液,经处理使用扫描电镜进行观察。
2.制备1份1.0×104cfu/ml的大肠杆菌o157:h7菌液并加入免疫磁珠进行捕获,磁分离后用磷酸缓冲盐溶液(pbs)重悬,经处理使用扫描电镜进行观察。
二、实验结果
电镜结果如图1所示。a为单个大肠杆菌的电镜图,b为大肠杆菌周围连接大量免疫磁珠现象。
实施例2:强酸强碱切割对菌体活性的影响
一、材料与方法
制备3份1.0×106cfu/ml的大肠杆菌o157:h7菌液(a1、a2、a3),a1加入高浓度盐酸溶液,a2加入0.1n氢氧化钠溶液,a3加入等量pbs溶液作为空白对照。分别处理30min,离心后用pbs重悬,之后加入死活菌荧光标记试剂孵育15min,使用流式分析技术分别对3份
菌溶液进行检测。
二、实验结果
电镜结果如图2所示,a1为加入高浓度盐酸溶液的死活菌流式分析图,a2为加入0.1n氢氧化钠溶液的死活菌流式分析图。a3为加入等量pbs溶液空白对照的死活菌流式分析图。
三、结论
经过死活菌荧光标记显示,以a3里活菌为空白对照可见,经过强酸强碱处理后的a1,a2里的菌体几乎全在上方表示全是死菌,所以用强酸强碱溶液作为切割材料对细菌活性会产生较大影响。
实施例3:一次使用protease-4蛋白酶进行纯化的具体操作
1、制备菌液进行免疫磁珠捕获:
挑取大肠杆菌o157:h7单个菌落使用营养肉汤(或者bhi)增菌液进行增菌48小时,使用免疫磁珠捕获大肠杆菌o157:h7,磁分离后用pbs对免疫磁珠进行重悬,获得捕获有大肠杆菌o157:h7的免疫磁珠混合液。
2.加入蛋白酶纯化
对捕获有大肠杆菌o157:h7的免疫磁珠混合液中加入0.04%的蛋白酶,之后放进37℃培养箱中处理2.5h,磁分离,收获上清即为纯化的大肠杆菌o157:h7溶液。
实施例4:多种蛋白酶切割效果的对比与筛选
一、材料与方法
制备1份1.0×107cfu/ml的大肠杆菌o157:h7菌液然后平均分装9支2.0ml离心管中编号(a1—a9),其中(a1—a8)分别加入相同量的免疫磁珠进行捕获后对应加入8种不同蛋白酶编号(protease-1—protease-8)进行纯化后进行流式分析技术检测。a9为空白对照,加入相同量的免疫磁珠捕获后直接进行流式分析技术检测
二、实验结果
蛋白酶protease-1—protease-8的切割效果如表1所示。结果显示与a9空白对照相比,a1—a8均有较好的切割效果,其中a4的效果最好。所以a4中protease-4蛋白酶是满足需求的木瓜蛋白酶。
表1protease-1—protease-8的切割效果
三、结论
使用流式分析技术对多个批次的木瓜蛋白酶切割效果进行筛选,最终筛选得到protease-4木瓜蛋白酶为纯化方法使用蛋白酶。
实施例5:protease-4蛋白酶酶切后菌体的表征
一、材料与方法
1.制备1份1.0×104cfu/ml的大肠杆菌o157:h7菌液并加入免疫磁珠进行捕获,磁分离后用pbs重悬,加入protease-4蛋白酶体系进行切割2.5h后,磁分离取清液,经处理使用扫描电镜进行观察。
2.制备1份1.0×106cfu/ml的大肠杆菌o157:h7菌液,取菌液的三分之一进行zeta电位分析,剩下的溶液加入免疫磁珠进行捕获,磁分离后用pbs重悬,取重悬液的一半进行zeta电位分析,剩下的一半加入并加入protease-4蛋白酶体系进行切割2.5h后,磁分离取清液,进行zeta电位分析。
二、实验结果
结果如图3所示。a为酶切之后大肠杆菌o157的电镜图,周围还有一些残留的磁珠。b为大肠杆菌o157溶液、磁珠捕获大肠杆菌o157溶液和酶切后大肠杆菌o157溶液的zeta电位对比,可见酶切后zeta电位值恢复接近无磁珠的大肠杆菌o157溶液的zeta电位值。
三、结论
根据电镜结果和zeta电位对比结果可见,protease-4蛋白酶可以有效切割磁珠上的抗体起到分离效果。
实施例6:酶切过程中蛋白酶用量,反应时间,温度的优化
一、材料与方法
酶切后影响纯化效率的单因素实验
(1)酶添加量对纯化效率的影响
制备浓度为c1的大肠杆菌o157:h7菌液,使用免疫磁珠后,使用流式分析方法进行检测得到菌液浓度c2,之后,分别加入0.01%、0.02%、0.03%、0.04%、0.05%、0.06%的protease-4蛋白酶,37℃反应2.5h后,使用流式分析方法进行检测得到不同浓度菌液c3,通过公式计算纯化效率。
(2)酶解时间对纯化效率的影响
制备浓度为c1的大肠杆菌o157:h7菌液,使用免疫磁珠后,使用流式分析方法进行检测得到菌液浓度c2,之后,加入protease-4蛋白酶浓度0.04%的条件下,于37℃分别反应1h、2h、2.5h、3h、3.5h、4h后,使用流式分析方法进行检测得到不同菌液浓度c3,通过公式计算纯化效率。
(3)酶解温度对纯化效率的影响
制备浓度为c1的大肠杆菌o157:h7菌液,使用免疫磁珠后,使用流式分析方法进行检测得到菌液浓度c2,之后,加入protease-4蛋白酶浓度0.04%的条件下,分别于35℃、37℃、39℃、41℃、43℃、45℃条件下水解2.5h后,使用流式分析方法进行检测得到不同菌液浓度c3,通过公式计算纯化效率。
纯化效率计算公式:
式中:α为待测蛋白酶的纯化效率a为原始大肠杆菌o157:h7菌液浓度(cfu/ml);b为免疫磁珠捕获后的上清液中大肠杆菌o157:h7浓度(cfu/ml);c3为纯化后大肠杆菌o157:h7菌液浓度(cfu/ml)。
二、实验结果
酶添加量对纯化效率影响的结果如表1所示。
表1酶添加量对纯化效率的影响
酶切时间对纯化效率影响的结果如表2所示。
表2酶切时间对纯化效率的影响
酶切温度对纯化效率影响的结果如表3所示。
表3酶切温度对纯化效率的影响
三、结论
根据上表结果可见,protease-4蛋白酶可以有效切割磁珠上的抗体起到分离效果。酶切过程中蛋白酶用量为0.04%,反应时间为2.5h,温度为37℃。
实施例7:流式分析技术检测验证
一、材料与方法
1.制备6份1.0×107cfu/ml的大肠杆菌o157:h7菌液(编号分别为l1、l2、l3、l4、l5、l6)。
2.使用免疫磁珠分别对6份菌液中的大肠杆菌o157:h7进行捕获。
3.使用protease-4蛋白酶分离菌液l1、l2、l3中的大肠杆菌o157:h7菌体和磁珠;菌液l4、l5、l6不做处理,为对照组。
4.使用fitc标记的大肠杆菌o157抗体对菌液a、b中的大肠杆菌o157:h7进行荧光标记。
5.使用流式分析技术分别对菌液a、b中大肠杆菌o157:h7的数量进行检测。
二、实验结果
流式分析结果如表4所示。l1、l2、l3的平均值0.910×107cells/ml,l4、l5、l6的平均值0.106×107。酶切组大于对照组。
表4用流式分析检测方法验证纯化方法的结果
三、结论
根据上表说明本发明的纯化方法可以有效作为流式分析技术快速定量检测大肠杆菌o157:h7方法的前处理步骤,使得流式检测结果更加准确。
实施例8:荧光定量pcr方法检测验证
一、材料与方法
1.制备6份1.0×107cfu/ml的大肠杆菌o157:h7菌液(编号分别为p1、p2、p3、p4、p5、p6)。
2.使用免疫磁珠分别对6份菌液中的大肠杆菌o157:h7进行捕获。
3.使用protease-4蛋白酶分离菌液p1、p2、p3中的大肠杆菌o157:h7菌体和磁珠;菌液p4、p5、p6不做处理,为对照组。
4.使用荧光定量pcr检测方法分别对菌液中大肠杆菌o157:h7的数量进行检测。
二、实验结果
荧光定量pcr检测结果如表5所示。p1、p2、p3的平均值0.906×107copies/ml,p4、p5、p6的平均值0.011×107copies/ml。酶切组大于对照组。
表5用荧光定量pcr检测方法验证纯化方法的结果
三、结论
根据上表说明本发明的纯化方法可以有效作为pcr方法快速定量检测大肠杆菌o157:h7方法的前处理步骤,使得pcr检测结果更加准确。
实施例9:胶体金免疫层析法检测验证
一、材料与方法
1.制备6份1.0×107cfu/ml的大肠杆菌o157:h7菌液(编号分别为j1、j2、j3、j4、j5、j6)。
2.使用免疫磁珠分别对6份菌液中的大肠杆菌o157:h7进行捕获。
3.使用protease-4蛋白酶分离菌液j1、j2、j3中的大肠杆菌o157:h7菌体和磁珠;菌液j4、j5、j6不做处理,为对照组。
4.使用胶体金免疫层析法检测技术分别对菌液中大肠杆菌o157:h7的数量进行检测。
二、实验结果
胶体金免疫层析法检测结果如表6所示。j1、j2、j3的平均值0.903×107cfu/ml,j4、j5、j6的平均值0.106×107cfu/ml。酶切组大于对照组。
表6用胶体金免疫层析检测方法验证纯化方法的结果
三、结论
根据上表说明本发明的纯化方法可以有效作为免疫层析法快速检测大肠杆菌o157:h7方法的前处理步骤,使得胶体金免疫层析法检测结果更加准确。
- 还没有人留言评论。精彩留言会获得点赞!