一种超灵敏SERS免疫传感器的制备方法及其在宫颈癌血清生物标志物检测的应用
一种超灵敏sers免疫传感器的制备方法及其在宫颈癌血清生物标志物检测的应用
技术领域
1.本发明涉及一种超灵敏sers免疫传感器的制备方法及其在宫颈癌血清生物标志物检测的应用,属于宫颈癌检测技术领域。
背景技术:
2.宫颈癌是最常见的妇科癌症之一,对妇女的健康构成了严重威胁。宫颈癌的早期筛查和准确诊断与有效治疗密切相关,从而提高患者的生存率。但是,在早期阶段,没有典型临床症状的宫颈癌患者很难被诊断。因此,迫切需要具有高灵敏度和特异性的用于早期筛查的新型诊断工具。如今,检测技术已经取得了长足的进步,监测肿瘤标志物的变化可以筛查和诊断癌症。生存素(survivin)是凋亡蛋白家族的成员,它不仅抑制肿瘤细胞凋亡,而且还促进其增殖和侵袭的能力。骨桥蛋白(opn)是一种分泌的糖蛋白,在各种生理和病理过程(包括肿瘤的发生和发展)中起着重要的作用。根据survivin和opn的生物学特性,它们的血清水平在肿瘤发生过程中会发生变化,可以被认为是肿瘤筛查和诊断的生物标志物。
3.目前,已开发出酶联免疫吸附试验(elisa)、比色法、化学发光免疫测定(clia)和局部表面等离振子共振(lspr)来检测肿瘤标志物。尽管这些方法具有一些优势,但高成本,费时和复杂的反应条件限制了它们的临床应用。表面增强拉曼散射(sers)是一种方便,快速且超灵敏的传感技术,由于其独特的光谱指纹图谱,在单分子水平上的高选择性和灵敏性,已被广泛用于生物标志物的定量分析。特别地,窄线宽的sers光谱特征峰有利于同时采集不同被分析物的信号,提高检测效率并节省检测成本。yang的小组报告了基于sers的免疫测定的实际应用,该测定实现了对铁蛋白抗原的定量检测。ma等研究人员开发了由fe3o4@tio2@ag核壳纳米粒子探针和金纳米线底物组成的sers免疫结构,用于检测癌症患者血清样品中的psa和afp,结果精确至pg/ml。这些表明,sers技术在检测生物标志物方面非常有前途。
4.拉曼信号的大幅增强是sers技术实现高灵敏度检测的关键。目前,人们普遍认为sers信号的放大是由于等离子体纳米材料表面等离子体共振(spr)激发的局域电磁场增强。电磁场最强的区域称为“热点”。金属纳米颗粒之间的纳米级间隙形成强的局部电磁场,这对于获得sers“热点”特别有益。为了获得高密度的“热点”,研究人员已经将各种形态的纳米材料组装到基底中。这些sers基底主要分为:无序或高度有序。可重复性是定量检测方法的另一个重要因素。与无序的sers基底相比,高度有序的sers基底由于其出色的信号均匀性和可重复性而保证了数据的可靠性。此外,与无机物质(抗生素,农药等)的检测相比,生物标志物的检测对sers底物的生物传感活性还有其他要求。sio2微球和金纳米颗粒(aunps)具有成本低,制备简单和生物相容性高的优点。通过将它们组装成有序的sers底物,不仅增加了“热点”的密度,而且还促进了免疫活性蛋白的进一步功能化。sers探针的特异性得益于拉曼报告分子的独特指纹图谱,这使sers技术可以实现对不同分析物的同时分析。au
‑
ag纳米壳(au
‑
agnss)是空心无孔球形结构,内表面和外表面均具有spr效应,这有利
于增强表面电磁场并显示出优异的sers性能。此外,au
‑
ag合金结构的化学稳定性可确保其sers活性。au
‑
agnss在sers探针的制备中具有很高的应用前景。
技术实现要素:
5.本发明的目的是针对上述现有技术的不足,提供基于高密度热点au@sio2阵列基底和au
‑
ag纳米壳探针的sers免疫传感器及其在宫颈癌血清生物标志物的超灵敏检测的应用。
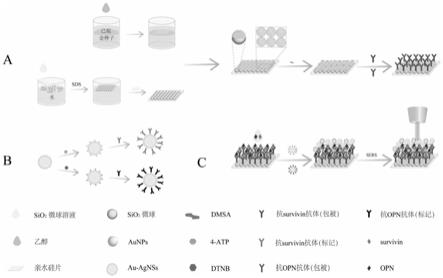
6.本发明通过使用aunps@sio2微球(au@sio2)阵列免疫基底和两种au
‑
agnss免疫探针,开发了一种新型sers免疫传感器,用于临床血清中survivin和opn的超灵敏检测(图1)。在制备au@sio2阵列基底的过程中,使用langmuir
‑
blodgett(lb)方法获得单层sio2微球阵列,然后用油水界面自组装法在sio2微球表面覆盖单层aunps膜。通过有限差分时域(fdtd)模拟了基底的增强电磁场。sio2微球表面上的电磁场以及相邻微球之间的间隙均得到增强,这证明au@sio2阵列基底具有高密度“热点”。4
‑
氨基苯硫酚(4
‑
atp)和5,5'
‑
二硫代双
‑
(2
‑
硝基苯甲酸)(dtnb)的拉曼峰很容易区分,因此选择它们来制备两个探针。它们不仅可以通过
‑
sh键抓住au
‑
agns,而且还可以通过形成酰胺键与抗体结合。将抗survivin抗体和抗opn抗体与au@sio2阵列底物和au
‑
agnss连接后,制成了由免疫探针和免疫底物组成的sers免疫传感器。
7.在survivin和opn被免疫底物捕获后,添加了两个免疫探针,用于形成夹心免疫复合物。接下来,通过监测免疫传感器的sers信号强度对这些生物标志物进行定量分析。它表现出良好的重现性,出色的灵敏度和低检测限。最后,对健康受试者和宫颈上皮内瘤样变1(cin 1),cin 2,cin 3和子宫颈癌患者血清中的survivin和opn进行了检测,取得了与elisa一致的结果。可想而知,这种极具吸引力的sers免疫传感器在宫颈癌早期诊断中具有出色的临床应用。
8.具体的,本发明sers免疫传感器的制备方法如下:
9.步骤1)血液样本的采集和处理:
10.血清样本分为健康人群、cin 1、cin 2、cin 3和宫颈癌患者五组,在早餐前抽取5ml静脉血,在4℃下3000r/min转速离心处理10min之后,将获得的血清样本保存在
‑
80℃下。
11.步骤2)免疫基底的制备:
12.2.1)aunps的合成
13.首先,将25ml 1mm的haucl4溶液加入100ml双口烧瓶中,加热至沸腾;随后逐滴加入4ml 38mm的二水合柠檬酸三钠水溶液,在100℃下700r/min转速剧烈搅拌15min后,溶液的颜色从浅黄色变为酒红色;最后待溶液自然冷却至室温后,aunps溶液制备完成;
14.2.2)sio2微球的合成
15.遵循溶胶
‑
凝胶法合成sio2微球;将10ml氢氧化铵、50ml乙醇与6ml超纯水混合并加热至30℃;然后将10ml原硅酸乙酯滴加到该混合溶液中,溶液的颜色逐渐变成乳白色;反应12h后,制备了sio2微球;最后,通过在4000r/min转速下离心10min除去未反应的原料,并将它们分散在甲醇溶液中以制备浓度为5wt%的sio2微球的悬浮液;
16.2.3)亲水硅片的制备
1mm的dtnb乙醇溶液和5ml au
‑
agnss溶液在室温下反应1h,并通过离心纯化后再分散于5ml pbs中,然后再依次加入于50μl 150mm的edc和50μl30 mm的nhs;接下来,通过振摇1.5h使羧基(
‑
cooh)活化,并向溶液中加入50μl200μg/ml的抗opn抗体(标记);最后,在37℃下孵育2h后,合成了opnau
‑
agnss免疫探针。
32.宫颈癌是全世界女性癌症相关死亡的常见原因,血清肿瘤标志物的定量检测对宫颈癌的早期诊断具有实际意义。本发明提出了一种基于表面增强拉曼散射(sers)的同时检测宫颈癌患者血清中生存素(survivin)和骨桥蛋白(opn)的免疫传感器,该传感器由aunps@sio2微球(au@sio2)阵列免疫基底和au
‑
ag纳米壳(au
‑
agnss)免疫探针组成。单层aunp薄膜和单层sio2微球阵列构成的基底不仅保证了均匀性,而且提高了sers性能。通过时域有限差分模拟证实了基底表面上的高密度“热点”。实验结果表明,构建的sers免疫传感器具有令人满意的选择性和重现性,同时对人血清中survivin和opn的检出限低至0.908pg/ml和0.813pg/ml。最后,验证了其检测真实人血清样品(健康受试者;宫颈上皮内瘤样变1(cin 1)、cin 2、cin 3和宫颈癌患者中)的有效性,检测结果与酶联免疫吸附试验结果吻合较好。该免疫传感器具有出色的性能,有望用于癌症的早期筛查。
33.综上所述,本发明研制了一种由au@sio2阵列免疫底物和两个拉曼信号分子标记的au
‑
agnss免疫探针组成的sers免疫传感器,通过测量免疫探针中4
‑
atp和dtnb的sers信号强度,同时检测人血清中survivin和opn的含量。实验结果表明,金膜与有序sio2微球阵列组装的au@sio2阵列基底具有良好的均匀性和较高的sers活性。该免疫传感器不仅具有良好的特异性识别性能,而且具有低检测极限和良好的重复性。最后,将其成功应用于健康受试者、cin 1、cin 2、cin 3及宫颈癌患者血清中survivin和opn的检测,并通过elisa验证了检测结果的可靠性。总之,这种敏感的sers免疫传感器在宫颈癌早期筛查中具有广阔的应用前景。
附图说明
34.图1是用于同时检测survivin和opn的基于sers的免疫传感器的示意图;制备免疫基底(a);两个免疫探针(b);准备的sers免疫传感器(c)用于定量分析survivin和opn;
35.图2:(a)通过油水界面自组装获得的单层aunps;(b)通过l
‑
b方法制备的单层sio2微球基片;(c)au@sio2阵列基底的sem图,每个图像的右上角是相应的数码照片;(d)吸附在au@sio2阵列基底、4
‑
atp标记的单层aunps和4
‑
atp上的4
‑
atp分子的拉曼光谱;
36.图3:(a)通过在au@sio2阵列基底上40
×
40μm2的面积上测量1083cm
‑1处的4
‑
atp信号强度来获得sers映射;(b)4
‑
atp标记的au@sio2阵列基底存储1天、5天、10天和15天后的平均sers光谱和(c)在1083cm
‑1处的峰强度;
37.图4:(a)fdtd从透视模型模拟了au@sio2阵列基底的电磁场分布;(b)基底的fdtd模拟电场分布的侧视图;基底在(c)z=225nm和(d)z=450nm的fdtd模拟电场分布的顶视图;
38.图5:au
‑
agnss的(a)sem图像;(b)tem图像;(c)hrtem图像和(d)部分放大图;(e)saed图案和(f)stem haadf图像;其中(g)au和(h)ag元素映射;(i)au
‑
agnss的紫外可见吸收光谱和相应的数字照片;
39.图6每个制备步骤中sers免疫传感器的ft
‑
ir光谱:(a)dmsa标记的au@sio2;(b)免
疫底物;(c)4
‑
atp标记的au
‑
agnss;(d)测定survivin的免疫探针;(e)dtnb标记的au
‑
agnss;而(f)则为测定opn的免疫探针;
40.图7不同种类的生物标志物样品和空白样品的sers光谱,说明所制备的sers免疫传感器具有选择性;
41.图8(a)免疫传感器检测不同浓度的survivin和opn分散在pbs中的sers光谱;根据不同浓度的survivin和opn在1083cm
‑1和1329cm
‑1处的sers信号强度,得到pbs中(b)survivin和(c)opn的剂量反应曲线;(d)免疫传感器检测空白人血清中不同浓度的survivin和opn的sers光谱;空白人血清中(e)survivin和(f)opn的剂量反应曲线来源于不同浓度survivin和opn在1083cm
‑1和1329cm
‑1处的sers信号强度;
42.图9用10个不同批次的sers免疫传感器检测同一份含有survivin和opn的人血清样本(100ng/ml)的sers光谱,以及每个光谱中(b)1083cm
‑1和(c)1329cm
‑1处的sers信号强度直方图;
43.图10(a)各组临床样本的平均sers光谱,以及对应的(b)108cm
‑1和(c)1329cm
‑1的sers强度直方图。
具体实施方式
44.一、制备方法
45.1.材料
46.所有材料均直接使用,无需进一步纯化。四水合氯金酸(haucl4)、硝酸银(agno3)、硼氢化钠(nabh4)、氢氧化钠(naoh)、柠檬酸三钠二水合物(c6h5na3o7·
2h2o)、氢氧化铵(nh4oh)、正硅酸乙酯(c8h20o4si)、氯仿(hcl)、过氧化氢(h2o2)、硫酸(h2so4)、己烷(c6h
14
)、碳酸钾(k2co3)、十二烷基硫酸钠(sds)、聚乙烯吡咯烷酮(pvp)、l
‑
抗坏血酸(l
‑
aa)、无水乙醇、甲醇、硅片均购自扬州飞畅化工有限公司(中国)。4
‑
氨基苯硫酚(4
‑
atp)、5,5'
‑
二硫代双
‑
(2
‑
硝基苯甲酸)(dtnb)、二巯基琥珀酸(dmsa)、n
‑
羟基琥珀酰亚胺(nhs)和1
‑
乙基
‑3‑
(3
‑
二甲基氨基丙基)碳二亚胺(edc)购自扬州诺亚化工有限公司(中国)。survivin、opn、抗survivin抗体、抗opn抗体和elisa试剂盒购自上海sangon biotech(中国)。在所有实验中,水都是由milli
‑
q直接供应的(电阻率>18mω.cm,密理博,美国)。
47.2、血液样本的采集和处理
48.血清样本分为健康人群、cin 1、cin 2、cin 3和宫颈癌患者五组,均来自扬州大学临床医学院。在志愿者早餐前抽取5ml静脉血,在4℃下3000r/min转速离心处理10min之后,将获得的血清样本保存在
‑
80℃下。实验得到扬州大学临床医学院伦理委员会的批准,与志愿者签署了知情同意书,并根据《赫尔辛基宣言》遵循了涉及人类受试者的医学研究的道德原则。
49.3、免疫基底的制备
50.3.1、aunps的合成
51.首先,将25ml 1mm的haucl4溶液加入100ml双口烧瓶中,加热至沸腾。随后逐滴加入4ml 38mm的二水合柠檬酸三钠水溶液,在100℃下700r/min转速剧烈搅拌15min后,溶液的颜色从浅黄色变为酒红色。最后待溶液自然冷却至室温后,aunps溶液制备完成。
52.3.2、sio2微球的合成
53.遵循溶胶
‑
凝胶法合成sio2微球。简要地来说,将10ml氢氧化铵、50ml乙醇与6ml超纯水混合并加热至30℃。然后将10ml原硅酸乙酯滴加到该混合溶液中,溶液的颜色逐渐变成乳白色。反应12h后,制备了sio2微球。最后,通过在4000r/min转速下离心10min除去未反应的原料,并将它们分散在甲醇溶液中以制备浓度为5wt%的sio2微球的悬浮液。
54.3.3、亲水硅片的制备
55.用食人鱼溶液处理硅片以获得亲水硅片。简而言之,将过氧化氢(30%)以3:7的体积比加入浓硫酸中以制备食人鱼溶液。然后,将硅片切成10
×
15mm的小片,浸入食人鱼溶液中30min,然后用超纯水和无水乙醇超声清洗3次。
56.3.4、单层sio2微球阵列的制备
57.单层sio2微球阵列是通过langmuir
‑
bloadgate(lb)气液界面组装方法制造的。将氯仿以2:3的体积比添加到微球悬浮液中,然后每次取5μl sio2微球悬浮液滴在水面上。sio2微球自发地在水表面扩散,直至覆盖整个水面。接下来,通过将100μl的2wt%的sds水溶液滴到水面上,形成了紧密排列的sio2微球单层阵列,然后将其转移到干净的亲水硅片上。最后,将单层sio2微球阵列硅片干燥以进一步使用。
58.3.5、au@sio2阵列基底的制备
59.首先,将4ml aunps胶体溶液和2ml己烷依次加入到烧杯中,然后逐滴添加2ml乙醇。加入乙醇后,aunps在油水界面形成金属光泽的薄膜。其次,利用组装好的单层sio2微球阵列硅片拾取au膜,干燥后得到au@sio2阵列基底,其底部具有单层sio2微球阵列结构,顶部具有紧密堆积的单层aunps。
60.3.6、抗survivin抗体和抗opn抗体偶联的au@sio2阵列基底的制备
61.将抗survivin抗体(包被)和抗opn抗体(包被)修饰到au@sio2阵列基底上,以制备免疫基底。首先,将au@sio2阵列基底浸入5ml2 mm的dmsa溶液中2h,然后用水洗涤两次。接下来,用5ml 150mm的edc和30mm的nhs混合溶液活化了修饰在底物上的dmsa的羧基(
‑
cooh),反应0.5h后用pbs清洗底物。接下来,将20μl的200μg/ml抗survivin抗体(包被)和200μg/ml抗opn抗体(包被)混合物添加到dmsa修饰的au@sio2阵列基底的表面。最后,将底物在37℃下孵育4h,然后用pbs洗涤两次,然后自然干燥。
62.4、au
‑
agns的合成
63.au
‑
agnss的合成分为四个步骤。
64.第一步,将1.5ml 0.01m的agno3,0.225ml0.3 m的c6h5na3o7·
2h2o和0.3ml 0.005m的pvp混合在一起,并加水使体积为120ml。
65.第二步,将溶液混合物在室温下磁力搅拌15min后,将0.5ml0.05 m的nabh4逐滴注入反应混合物中,然后将2μl0.3 m的naoh加入溶液中使ph值高于7。反应混合物的颜色从无色变为黄色后,将所得溶液在室温下于黑暗中保存2h。
66.第三步,使用光输出为0.5mw cm
‑2且中心波长为520nm的绿色led(发光二极管)进行照射,每次取20ml所得溶液照射55min。当溶液的颜色变为蓝色时,ag种子制备完成。
67.第四步,在室温下和磁力搅拌下,将150μl 0.3m的naoh和5.5ml 100mm的l
‑
aa依次添加到50ml ag种子溶液中。接下来,将100μl 1mm的haucl4缓慢加入所得溶液中,并剧烈搅拌1h。最后,通过在5000r/min转速下离心15min来收集产物,并分散在水中。
68.5、au
‑
agnss免疫探针的制备
69.首先,将200μl 1mm的4
‑
atp乙醇溶液添加到5ml au
‑
agnss溶液中,在室温下振动1h,4
‑
atp和au
‑
agnss之间形成了共价键。在5000r/min转速下离心5min后,弃去上清液,然后将其重新分散在5ml pbs中。然后,将50μl200μg/ml的抗survivin抗体(标记)添加到溶液中,然后添加50μl 150mm的edc以激活抗survivin抗体的羧基(
‑
cooh)。将获得的溶液在37℃下孵育1h,然后通过在5000r/min转速下离心5min将溶液纯化,将制备的survivinau
‑
agnss免疫探针分散在等体积的pbs溶液中。对于opnau
‑
agnss免疫探针的制备,将200μl 1mm的dtnb乙醇溶液和5ml au
‑
agnss溶液在室温下反应1h,并通过离心纯化后再分散于5ml pbs中,然后再依次加入于50μl 150mm的edc和50μl30 mm的nhs。接下来,通过振摇1.5h使羧基(
‑
cooh)活化,并向溶液中加入50μl200μg/ml的抗opn抗体(标记)。最后,在37℃下孵育2h后,合成了opnau
‑
agnss免疫探针。
70.6、同时检测
71.survivin和opn的检测过程如下:首先,将20μl包含survivin和opn的抗原溶液添加到制备的免疫基底上,并在37℃下孵育1h。接下来,滴加包含10μl survivinau
‑
agnss免疫探针和10μlopnau
‑
agnss免疫探针的混合溶液,并在37℃下继续反应1h。用pbs溶液冲洗掉过量的反应物之后,进行sers测量。
72.7、表征
73.使用紫外
‑
可见分光光度计(cary uv
‑
5000,agilent,美国)监测纳米材料的紫外可见吸收光谱。傅里叶变换红外光谱(ft
‑
ir)分析在显微镜红外光谱仪(cary 610/670,varian,美国)进行。采用透射电镜(tecnai 12,philips,荷兰)和场发射扫描电镜(fesem)(s
‑
4800ⅱ,hitachi,日本)观察纳米材料的形貌和结构。采用s
‑
twin透射电镜(tecnai g2 f30,fei,美国)对纳米材料进行选区电子衍射(saed)图像和高分辨率透射电镜(hrtem)图像测量。雷尼绍拉曼光谱仪在785nm激发波长下,使用50
×
物镜,5mw激光功率,10s采集时间,在室温下测量样品的sers光谱。
74.8、时域有限差分(fdtd)模拟
75.lumerical solutions公司的fdtd模拟软件(8.9版本)用于模拟电磁场分布和增强au@sio2阵列基底(sem图像)。采用波长为785nm的入射光进行激发。采用完美匹配层(pml)在x、y、z轴方向截断模拟域,并设置背景折射率为1。
76.二、本发明优势
77.1、au@sio2阵列基底的表征
78.图1a生动地展示了金阵列基底薄膜的制作过程。当正己烷加入aunps溶液时,由于密度差形成了油水界面,乙醇的加入降低了aunps的表面电荷密度,促使其在油水界面上自组装形成单层aunps膜。图2a为aunps薄膜的数码照片和sem图像。在这张数码照片中,可以清楚地看到位于油水界面上的均匀au薄膜。从sem图像可以看出,au膜由形貌均匀,直径约为20nm的aunps排列,aunps之间的小间隙有利于sers性能的提高。图2b为l
‑
b方法组装的基片的sem图像和光学照片。在亲水硅片上有序排列直径约为450nm的sio2微球。由于只有一层sio2微球,光学照片呈现淡灰色。将这两种有序结构结合在一起会产生一个新的基底,如图2c所示。由于基片上覆盖了一层aunps薄膜,基片的光学颜色(图2c右上角)由浅灰色变为均匀的暗黄色。从sem图像可以看出,大量aunps致密有序地覆盖在sio2微球表面,虽然存在一些轻微的缺陷,这表明au@sio2阵列基底的制备是成功的。以4
‑
atp为拉曼信号分子来评
价不同底物的sers性能,图2d展示了4
‑
atp分子(10
‑6m)吸附在au@sio2阵列基底上;4
‑
atp标记的(10
‑6m)单层aunps和4
‑
atp(10
‑2m)的拉曼光谱。未标记的4
‑
atp的拉曼信号几乎可以忽略,而这两种结构放大了4
‑
atp的拉曼信号。不难发现au@sio2阵列基底的增强效果更显著,说明“热点”更多。为了进一步评价基底的sers活性,我们用ef=(i
sers
/c
sers
)/(i
raman
/c
raman
)计算两种底物的增强因子(ef)。图2d呈现了拉曼光谱中1083cm
‑1处的信号强度,其中c表示4
‑
atp的浓度。au@sio2阵列基底和单层aunps的ef值分别为4.23
×
106和3.65
×
105。计算结果表明,两种有序结构的结合进一步提高了基底sers性能。
79.除了出色的增强性能外,还需要基材的均匀性和稳定性。因此,在40
×
40μm2的随机选择区域上测量了4
‑
atp标记的au@sio2阵列基底的sers强度图。如图3a所示,映射图像中的每个像素代表1083cm
‑1处4
‑
atp的信号强度。尽管图像中有少量的黄色和蓝色区域,但是图像中的大多数区域是相对均匀的绿色,反映了基材的高信号均匀性。图3b是在室温下储存1天,5天,10天和15天时测量的4
‑
atp标记的au@sio2阵列基底的平均sers光谱。除了信号强度减弱外,频谱没有明显变化。为了更直观地了解信号变化,图3c显示了每个周期中在1593cm
‑1处的sers峰值强度。储存15天后,sers强度降低了11.86%,表明底物具有稳定的sers增强作用。
80.2、fdtd模拟
81.为了确认在线性偏振光束的照射下所制备的au@sio2阵列基底的空间电场分布,进行fdtd模拟是有效的方法。模拟的几何参数与sem图像(图2d)中所示样品的平均实际尺寸一致。图4a是透视图的仿真模型,它清楚地展现了仿真光的传播和振动方向。总场散射场(tfsf)线偏振光波沿
‑
z方向注入,x
‑
z平面(侧视图)以及x
‑
y平面(顶视图)中的位于z=225nm和450nm的频域场轮廓监测器分别用于在保持激发波长为785nm的条件下,采集aunps
‑
si表面和内部的电场分布数据。图4b展现出了在x
‑
z平面中基底的局部电磁场的典型分布,发现沿sio2微球表面分布的增强电磁场。此外,相邻的sio2微球之间的间隙比其他区域具有更高的局部电磁场。这种现象是由于sio2微球表面aunps之间的距离逐渐减小引起的,从而使lspr效应逐渐增大。如图4c和图4d所示,当z=225nm和z=450nm时,基底在x
‑
y平面上的电磁场分布。在z=225nm处,x
‑
y平面上相邻的sio2微球之间的间隙中存在一个较强的局部电磁场。当z=450nm时,它位于微球的顶部。尽管aunps之间的距离变大并且lsrp效应减弱,但是电磁场仍显着增强。凭借不同视角的仿真结果,可以预测出基底表面已被强大的局部电磁场覆盖,这对于形成高密度“热点”至关重要。至此,进一步证实了au@sio2阵列基底的优异的sers性能。
82.3、au
‑
agns的表征
83.图5给出了合成的au
‑
agns的组成和结构特征。如sem图像所示(图5a),制备了具有完整结构和相对均匀的形态的au
‑
agns。从tem图像可以更清楚地观察到au
‑
agnss的粒径约为40nm,具有光滑表面和致密壁的中空结构,如图5b所示。图5c中的hrtem图像显示了au
‑
agns的更多细节,进一步证实了中空特征。壳层的厚度约为5nm,这有利于增强spr效果。图5d是hrtem图像的局部放大图,并且清晰可见具有0.232nm节距的晶格结构。如图5e所示,saed图案中的明亮衍射环分别对应于{111},{200},{220}和{311}平面,表明所制备的au
‑
agnss是多晶的。stem
‑
haadf图像从另一个角度证实了au
‑
agnss是一种特殊的中空壳结构,如图5f所示。此外,测量au
‑
agns的元素映射可以更直观地了解au和ag的分布。图5g和5h示
出了au和ag的元素映射。au和ag元素的无规分布形成了结构和化学上稳定的合金结构,进一步证实了au
‑
agns的合成。这种合金结构不仅具有良好的热力学稳定性,而且具有很强的sers活性。如图5i所示,au
‑
agnss溶液在可见光范围内为深蓝色,相应的uv
‑
vis吸收光谱在612nm处具有最强的吸收峰。以上结果表明成功制备了均质的au
‑
agnss。
84.4、sers免疫传感器的ft
‑
ir表征
85.材料表面的化学键和官能团在ft
‑
ir光谱中具有相应的吸收峰,并通过ft
‑
ir对sers免疫传感器的制备过程进行了表征。在免疫传感器的制备过程中,通过洗涤避免了多余试剂(edc,nsh等)的干扰。dmsa具有巯基和羧基,并且不具有拉曼信号,这是制备免疫底物的不错选择。图6a是通过巯基基团偶联到au@sio2阵列基底上的dmsa的ft
‑
ir光谱,1664cm
‑1处的峰归因于羧基中c=o的拉伸,通过使抗体上的氨基与dmsa的羧基反应形成的酰胺键(
‑
conh
‑
)实现了抗survivin抗体和抗opn抗体在底物上的修饰。如图6b所示,在1287cm
‑1、1539cm
‑1和1642cm
‑1的峰分别来自酰胺键(
‑
conh
‑
)中的c
‑
n,n
‑
h和c=o。这些峰的出现证实抗体已成功偶联至au@sio2阵列基底。图6c显示出了与4
‑
atp偶联后的au
‑
agns的ft
‑
ir光谱,并且出现在1286cm
‑1处的峰属于c
‑
n拉伸。图6d是抗survivin抗体与4
‑
atp标记的au
‑
agns偶联的ft
‑
ir光谱,其中1290cm
‑1处的峰与c
‑
n拉伸有关;1562cm
‑1处的峰与n
‑
h酰胺ii拉伸相关;1662cm
‑1处的峰归因于c=o酰胺i拉伸;这些特征峰的出现证实了酰胺键的形成。类似地,在dtnb捕获au
‑
agnss之后,在1660cm
‑1处的峰在羧基中属于c=o(图6e)。此外,当抗opn抗体与dtnb标记的au
‑
agnss偶联时,由于相应的ft
‑
ir光谱(图6f),cn、nh和co的特征峰将出现,形成的酰胺键分别位于1223cm
‑1、1564cm
‑1和1664cm
‑1处。这些峰明确证实了抗体和纳米材料之间存在牢固的化学键,表明sers免疫传感器已成功制备。
86.5、sers免疫传感器的选择性
87.在检测真实样本的过程中,由于存在其他生物标志物,sers免疫传感器对靶标的精确识别就显得尤为重要,其良好的选择性可以避免假阳性的发生。免疫底物捕获抗原后,加入免疫探针形成三明治免疫复合物,通过监测探针中4
‑
atp和dtnb的sers信号来检测抗原的含量。检测相同浓度(1μg/ml)的cea、apf、survivin、opn和survivin/opn样品,空白样品作为对照。对应的光谱如图7所示,可以清楚地看到,只有含有survivin(1083cm
‑1)或opn(1329cm
‑1)的样品中出现了较强的特征峰,而其他样品中没有出现明显的特征峰。survivin/opn样品的光谱中同时出现1083cm
‑1和1329cm
‑1的峰,不仅证实了sers免疫传感器的良好选择性,也证明了其同时检测两个抗原的能力。sers免疫传感器的优异性能为后续实验奠定了基础。
88.6、在pbs和人血清中同时检测survivin和opn
89.将survivin和opn溶解的pbs溶液不断稀释,得到浓度梯度为1pg/ml至1μg/ml的样品。图8a为不同浓度样品经过5次sers免疫传感器检测后的平均sers光谱。结果表明,sers信号随着survivin和opn浓度的降低而降低,空白样本的微弱信号可以忽略。剂量反应曲线更直观地说明sers信号强度与survivin(1083cm
‑1)和opn(1329cm
‑1)的浓度之间的关系,见图8b和图8c。此外,survivin相应的线性方程是y=25928.374+2101.102x,相关系数r2=0.988,和opn相应的线性方程是y=29294.255+2370.933x,r2=0.992。最后参照空白样品计算出survivin和opn的检测限(lod)分别为0.783pg/ml和0.764pg/ml。
90.为了验证其实际应用能力,我们使用sers免疫传感器对含有不同浓度survivin和
opn的人体血清样本进行分析。同样,将survivin和opn溶解于空白人血清中,然后连续稀释,得到浓度梯度为1pg/ml~1μg/ml的样品。图8d所示为每种类型样本进行5次测量的平均光谱,同样,在空白人血清中,随着survivin和opn浓度的降低,所测量的sers信号也随之减弱。图8e和图8f分别为空白人血清中survivin和opn对应的剂量反应曲线,线性回归方程分别为:y=23250.310+1876.532x,y=26556.096+2142.8933x,r2=0.987,r2=0.990。以空白血清样本为参考,根据线性方程计算出人血清中survivin和opn的检测限分别为0.908pg/ml和0.813pg/ml。
91.此外,通过10个不同批次的sers免疫传感器检测同一样品来评估其重复性。图9a显示了survivin和opn浓度为100ng/ml的人血清样本的光谱。不同光谱的峰形没有明显差异,峰强也相似。为了更直观地理解sers信号的波动,图9b和图9c分别给出了各频谱在1083cm
‑1和1329cm
‑1处信号强度的直方图。相对标准偏差(rsd)分别为6.23%(1083cm
‑1)和5.85%(1329cm
‑1),这说明设计sers免疫传感器拥有满意的可重复性。
92.7、临床应用
93.通过对临床血清样本的分析,进一步验证了构建的sers免疫传感器的实际操作性能。图10a显示了40名健康受试者、38名cin 1、35名cin 2、33名cin 3和35名宫颈癌患者的血清样本的平均sers光谱。每个光谱的特征峰分别为1083cm
‑1和1340cm
‑1,表明血清样本中存在survivin和opn。从信号强度相对应的直方图的特征峰可以发现两个抗原与疾病的发生和发展密切相关,如图10b和c所示。将特征峰的信号强度是纳入在人血清中获得的线性回归方程计算出survivin和opn在相应样本的含量。将sers检测结果与elisa结果进行比较,具体数据如表1所示,证实了sers免疫传感器的可靠性。因此,我们提出的sers免疫传感器可以通过监测血清survivin和opn的变化,用于宫颈癌的早期筛查。
94.表1临床样本中survivin和opn的平均血清水平。
[0095][0096]
三、结论
[0097]
综上所述,本发明研制了一种由au@sio2阵列免疫底物和两个拉曼信号分子标记的au
‑
agnss免疫探针组成的sers免疫传感器,通过测量免疫探针中4
‑
atp和dtnb的sers信号强度,同时检测人血清中survivin和opn的含量。实验结果表明,金膜与有序sio2微球阵列组装的au@sio2阵列基底具有良好的均匀性和较高的sers活性。该免疫传感器不仅具有良好的特异性识别性能,而且具有低检测极限和良好的重复性。最后,将其成功应用于健康受试者、cin 1、cin 2、cin 3及宫颈癌患者血清中survivin和opn的检测,并通过elisa验证了检测结果的可靠性。总之,这种敏感的sers免疫传感器在宫颈癌早期筛查中具有广阔的应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1