一种检测非洲猪瘟病毒IgA抗体的ELISA检测方法及检测试剂盒与流程
本发明涉及抗体检测领域,尤其涉及非洲猪瘟病毒抗体的检测试剂及方法。
背景技术:
非洲猪瘟(africanswinefever,asf)是由非洲猪瘟病毒(africanswinefevervirus,asfv)引起的家猪和野猪的烈性传染病,为世界动物卫生组织(oie)规定必须申报的一类动物疫病,给疫区国家造成了巨大的经济损失(costardetal.,2013)。asfv为一大的有囊膜的双链dna病毒,属于非洲猪瘟病毒科(asfarviridae)、非洲猪瘟病毒属(asfivirus)成员(dixonetal.,2013)。
在2018年8月份,非洲猪瘟在我国开始发生后,给我国生猪产业造成了巨大损失,同时给我国的“肉篮子”及食品安全带来巨大威胁。由于该病毒的本身特性,到目前为止,还没有安全有效的疫苗。防控主要是利用检测技术进行生物安全构建和清除感染猪。
目前非洲猪瘟的检测技术主要有两大类。一类是抗原检测,一类是抗体检测。抗原检测主要是采用荧光pcr的方法,对猪的组织(如:血液、唾液、脏器等)和环境样品(饲料、水、猪舍的表面采集样品)进行检测,排查感染猪和检测环境,防止非洲猪瘟病毒感染猪群。抗体检测主要是用elisa方法对血清进行检测,对感染非洲猪瘟病毒的无症状猪或者是耐过猪进行检测,排查到感染猪进行淘汰。抗体检测解决了抗原检测中存在假阴性这一技术漏洞,是抗原检测的必要补充。两种检测方法的联合应用,会大幅提高非洲猪瘟的防控效率和效果。
由此可见,非洲猪瘟抗体检测是防控该病的重要技术手段。目前的抗体检测是通过elisa方法对血清中的igg进行检测,该方法需采集猪的血液后分离血清进行检测。虽然检测血液中的igg是常用的抗体检测方法,但是该检测方法首先需要保定猪、然后采血、分离血清后才能进行检测。方法不但费时费力,主要是需要对体积和重量较大的猪尤其是体重在100kg左右的猪来讲,保定是难度很大的。同时,采血的操作容易造成猪皮肤出现创口,患猪血液中非洲猪瘟病毒含量很高,有造成交叉感染的风险。基于以上原因,针对非洲猪瘟的检测,市场需要采样简单、检验准确并能消除交叉感染风险的检测方法。
技术实现要素:
免疫球蛋白a(简称为iga)分两种类型:即血清型iga和分泌型iga。血清型iga存在于血清中,血清iga具有某些igg和igm的免疫功能,特异性iga能中和血液中的抗原。分泌型iga存在于黏膜的分泌液中,例如:唾液、鼻腔液体、泪液、肛门粘膜处的液体、阴道液体以及乳汁当中,均含有iga抗体。分泌型iga是机体局部黏膜抗感染免疫的主要抗体。故又称黏膜免疫抗体。它能抑制微生物在呼吸道上皮附着,减缓病毒繁殖,有重要的免疫屏障作用,对某些病毒、细菌和—般抗原具有抗体活性,是防止病原体入侵机体的第一道防线。
机体内iga的含量低于igg,因此,针对病毒的抗体检测方法多以血清中的igg为检测对象。我们的研究以iga为检测对象,通过特定的检测手段,建立了非洲猪瘟病毒iga的elisa抗体检测方法,该方法避免了血液采样,通过非洲猪瘟病毒采集猪的口腔拭子、鼻腔拭子、肛门拭子、阴道拭子或乳汁为样品,采用特定的检测试剂及检测方法,高效、灵敏的检测到了非洲猪瘟病毒iga的含量。对非洲猪瘟的抗体检测提供了新的手段。
据此,我们提出本发明。
首先,本发明提供一种针对非洲猪瘟的抗体检测方法,该检测方法以非洲猪瘟病毒采集猪的口腔拭子、鼻腔拭子、肛门拭子、阴道拭子或乳汁为检测样品,通过elisa抗体检测方法获得检测样品中iga的含量,从而对检测猪的感染情况作出判断,或进一步结合检测猪的抗原检测结果对感染情况作出判断。本发明的方法采样简单、敏感性好、特异性强、且能彻底消除由于采血引起交叉感染的风险。
本发明非洲猪瘟病毒iga抗体的elisa检测方法包括如下步骤:
(1)、非洲猪瘟病毒重组蛋白的包被
将纯化后的非洲猪瘟病毒重组蛋白用包被液进行包被;
(2)、洗涤后封闭并进一步洗涤。
(3)、加入待检样品,将稀释后的非洲猪瘟病毒阳性样品和阴性样品加入封闭后的96孔板。
(4)、加入抗猪iga酶标抗体,孵育后进一步洗涤。
(5)、加入底物溶液,孵育结束后加入终止液,在450nm的波长下读数并记录结果。
在本发明的一种具体elisa抗体检测方法中,非洲猪瘟病毒的重组蛋白选择p30、p54、p72、等非洲猪瘟的病毒蛋白及全病毒。
进一步,在本发明的一种具体实施方式中,包被液选择碳酸盐缓冲液、tris-hcl缓冲液或磷酸盐缓冲液;优选碳酸盐缓冲液的ph值9.0-10.0、tris-hcl缓冲液ph值8.2-8.6、磷酸盐缓冲液ph值7.2-7.6。进一步优选包被液的浓度为0.03-0.06mol/l。
进一步,在本发明的一种具体实施方式中,封闭液选择含1-10%脱脂乳的pbst、含0.1-3%%bsa的pbst或含1-5%鱼明胶的pbst。
进一步,在本发明的一种具体实施方式中,用包被液将重组蛋白稀释为0.1-20μg/ml,优选为0.5-15μg/ml,进一步优选为10μg/ml、5μg/ml、2.5μg/ml、1.25μg/ml或0.625μg/ml的包被工作液浓度。
进一步,在本发明的一种具体实施方式中,非洲猪瘟病毒阳性样品及阴性样品均分别进行1:1-1:1000倍的稀释,进一步选择1:10-1:500倍的稀释,更进一步选择1∶100、1∶200、1∶400或1∶500倍的稀释。
其次,本发明提供一种针对非洲猪瘟的iga抗体检测试剂盒,该试剂盒含有非洲猪瘟病毒重组蛋白、包被液、封闭液、抗猪iga酶标抗体、底物溶液、终止液以及洗涤液。进一步,本发明的试剂盒中非洲猪瘟病毒重组蛋白、包被液、封闭液已负载在酶标板上。
进一步,本发明的针对非洲猪瘟的iga抗体检测试剂盒是按照上文所述的非洲猪瘟病毒iga抗体的elisa检测方法完成检测。
再次,本发明提供一种针对非洲猪瘟病毒的联合检测试剂包,该试剂包包括非洲猪瘟病毒抗原检测试剂盒和上文所述的针对非洲猪瘟的iga抗体检测试剂盒。
附图说明
图1:包被液与包被时间确定的检测结果(p/n值)
图2:封闭液与封闭时间确定的试验结果(p/n值)
图3:抗原包被浓度与被检样品稀释度确定的试验结果(p/n值)
图4:待检样品的孵育时间确定的试验结果(p/n值)
图5:山羊抗猪iga酶标抗体孵育时间确定的试验结果(p/n值)
图6:显色时间确定的试验结果(p/n值)
具体实施方式
通过以下实施例对本发明做进一步说明。
实施例1:非洲猪瘟病毒iga的elisa抗体检测方法
试验材料:
蛋白:纯化的重组蛋白p30,由哈尔滨国生生物科技股份有限公司制备、鉴定和保存。
检测样品:阴性样品为采自spf猪口腔拭子样品,由中国农业科学院哈尔滨兽医研究所试验动物中心牧场提供;阳性的猪口腔拭子,由中国农业科学院哈尔滨兽医研究所提供。
主要试剂:
山羊抗猪iga酶标抗体:购自sigema公司。
底物溶液:为可溶型单组分tmb底物溶液,购自abm公司。
终止液:18mol/l浓硫酸。
酶联反应板:购自美国corning公司,货号为42592。
试验方法
(1)、非洲猪瘟病毒重组蛋白的包被
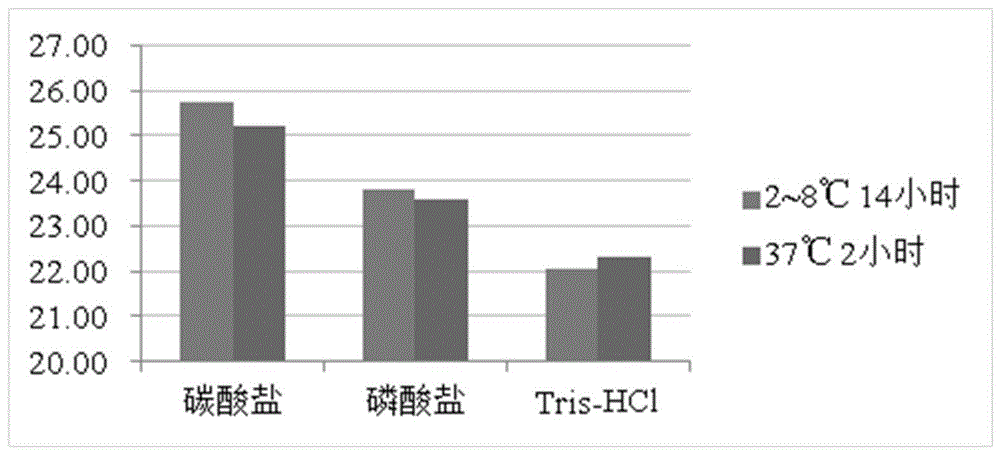
分别用碳酸盐缓冲液(0.05mol/l,ph值9.6)、tris-hcl缓冲液(ph值8.5)和磷酸盐缓冲液(ph值7.4)3种包被液将纯化后的非洲猪瘟病毒重组蛋白p30进行稀释,加入96孔酶联反应板中,100μl/孔,分别置2~8℃作用14小时和37℃作用2小时。
(2)、洗涤后封闭,封闭液为含5%脱脂乳的pbst、1%%bsa的pbst或含3%鱼明胶的pbst150μl/孔,置37℃封闭,进一步洗涤。
(3)、加入待检样品,用pbst(0.01mol/l,ph值7.4)对非洲猪瘟病毒阳性样品和阴性样品进行稀释后,加入96孔板,100μl/孔,置37℃孵育,洗涤。
(4)、加入山羊抗猪iga酶标抗体,孵育后进一步洗涤。
(5)、加入底物溶液孵育结束后加入终止液,在450nm的波长下读数并记录结果。
实施例2:非洲猪瘟病毒iga的elisa抗体检测结果
包被液及包被条件的确定:
分别选用不同的包被液,在不同的条件下包被反应板进行检验。结果表明,用碳酸盐缓冲液作为包被液,2~8℃作用14小时的p/n值最大,详见表1、表2和图1。
表1包被液与包被时间确定的试验结果(od450nm值)
表2包被液与包被时间确定的试验结果(p/n值)
封闭液与封闭时间的确定:
应用不同的封闭液,在不同的孵育条件进行试验。结果表明,用含5%脱脂乳的pbst在37℃孵育2小时的p/n值最大,详见表3、表4和图2。
表3封闭液与封闭时间确定的试验结果(od450nm值)
表4封闭液与封闭时间确定的试验结果(p/n值)
抗原包被浓度与被检样品稀释度的确定:
用不同浓度抗原制备包被板,对不同稀释度的样品进行检测。结果如表5、表6和图3。
表5抗原包被浓度与被检样品稀释度确定的试验结果(od450nm值)
表6抗原包被浓度与被检样品稀释度确定的试验结果(p/n)
待检样品工作时间的确定:
将待检样品37℃孵育不同时间后进行检测,取p/n值相对较大,阳性样品od450nm值较大而阴性样品的od450nm值较小的时间,作为本试剂盒待检样品的工作时间。结果表明,待检样品的最佳工作时间为37℃孵育30分钟,见表7、表8和图4。
表7待检样品工作时间确定的试验结果(od450nm值)
表8待检样品工作时间确定的试验结果(p/n)
山羊抗猪iga酶标抗体孵育条件的确定:
将山羊抗猪iga酶标抗体分别在37℃孵育不同时间后进行检测。结果见表9、表10和图5。
表9山羊抗猪iga酶标抗体孵育时间确定的试验结果(od450nm值)
表10山羊抗猪iga酶标抗体孵育时间确定的试验结果(p/n值)
显色时间的确定:
加入底物溶液后分别显色不同时间,取p/n值相对较大、阳性样品od450nm值较大且阴性样品的od450nm值较小的时间,作为本方法所使用的显色时间。结果详见表11、表12和图6。
表11显色时间确定的试验结果(od450nm值)
表12显色时间确定的试验结果(p/n值)
由上述试验可见:我们成功建立了非洲猪瘟病毒iga的elisa抗体检测方法,并对包被液与包被条件、封闭液与封闭时间、抗原包被浓度、待检样品的稀释倍数、待检样品的孵育时间、山羊抗猪iga酶标抗体反应条件及显色时间做出了特定选择,从而获得了灵敏度高、特异性强的检测结果。
- 还没有人留言评论。精彩留言会获得点赞!