一种纳米花复合膜的纳米酶H2O2传感器的制备方法及其应用与流程
一种纳米花复合膜的纳米酶h2o2传感器的制备方法及其应用
技术领域
1.本发明涉及生物传感器技术领域,尤其涉及一种电化学方法检测h2o2的纳米酶生物传感器、及其构建方法和应用,用于血浆样本中h2o2含量的检测。
背景技术:
2.人体中的活性氧(ros)被认为是生成老化物质,损伤遗传因子,造成衰老的元凶之一,其中过氧化氢(h2o2)是其中重要一员,血浆中的h2o2被认为是疾病诊断和衡量身体状况的指标之一,人们对快速、准确检测h2o2有极大需求,电化学检测技术因为灵敏度高,检测限低,方便快捷等优点被认为是检测h2o2的理想方法。
3.过氧化氢(h2o2)是一种代表性的活性氧簇(ros)物质,在生物体内主要来自于细胞呼吸、蛋白质折叠或是各种新陈代谢的终产物,作为动植物体内一系列生理生化反应的调控物质,尽管它们在各种生物和病理事件中作为介质发挥重要作用,但过量和不受控制h2o2会引起氧化应激反应,导致器官和组织功能衰退,氧化应激反应在癌症和心血管疾病中均扮演着重要的角色,外部环境中过量的的h2o2具有很强的化学活性,因此它同样是氧化应激相关疾病的常见标记物,这是由于活性氧核之外存在不成对的电子,会破坏生物的代谢并导致生物的氧化损伤,同时,h2o2具有强氧化性,常被用作高效的消毒杀菌剂,广泛用于食品卫生,纺织,环保,化工等领域,环境残留中的h2o2与人体的接触将加速细胞衰老危害人体健康,因此准确、快速、灵敏地检测h2o2非常重要,目前,h2o2的检测方法主要包括高效液相色谱法,碘化钾法,比色法等,但是,这些方法具对检测人员技能要求高,仪器分析成本高以及现场检测困难等缺点。因此,开发痕量方法对于人体和环境中h2o2的检测尤为重要,电化学传感器的灵敏,简单和快速的特点已引起研究人员的广泛关注。
4.无机纳米材料作为模拟酶,克服了传统生物酶易失活,环境要求苛刻与成本高等缺点,贵金属纳米材料具有稳定性好,催化性强,可重复使用等独特的电子结构特征和物理化学性能,其表面具有大量的活性位点与生物酶功能类似的性质受到广泛关注,其中贵金属纳米材料(au、pt等),金属卟啉及其衍生物通常被认为类似许多酶的催化活性中心,例如辣根过氧化物酶(hrp)。
技术实现要素:
5.为了克服传统生物酶易失活,环境要求苛刻与成本高等缺点,本发明的首要目的在于提供一种具有重复性好、灵敏度高和稳定性强的h2o2纳米酶生物传感器。
6.本发明的另一目的在于提供上述纳米酶生物传感器的制备方法,利用mof(zif
‑
67)材料的多孔高比表面积与au@pt纳米花的催化活性,组装构建获得性能稳定的用于超灵敏和快速检测h2o2的纳米酶传感器。
7.本发明的再一目的在于提供上述纳米酶传感器在作为人体血浆中的活性氧之一的h2o2定量检测中的应用。
8.本发明的上述目的通过以下技术方法实现:
9.第一方面,本发明的检测血浆中的纳米酶传感器,由参比电极、对电极及修饰电极组成,所述修饰电极通过工作电极表面构建金属有机骨架(mof)
‑
au@pt纳米花复合膜得到;
10.其中:所述金属有机骨架(mof)
‑
au@pt纳米花材料,zif
‑
67
‑
au@pt材料是通过一锅合成超声辅助方法制备的。首先,称量硝酸钴(co(no3)2·
6h2o,2.91克)和2
‑
甲基咪唑(c4h6n2,3.28克),然后将它们溶解在250毫升无水甲醇中。在超声作用下(频率45khz,功率300w)将c4h6n2溶液缓慢倒入co(no3)2·
6h2o溶液中,然后在25℃继续超声反应1h。然后加入2mlh2ptcl6(3mm)和3mlhaucl4(3mm)混合溶液,搅拌并反应3小时。最后,将其用无水甲醇洗涤3次并离心,并将产物在80℃下真空干燥,以获得约0.6g的zif
‑
67
‑
au@pt纳米花复合物。
11.所述金属有机骨架(mof)
‑
au@pt纳米花复合膜传感器的制备主要通过滴涂法构建,传感器构建前,先将gce电极使用氧化铝粉末在抛光布上抛光出镜面,并用超纯水洗涤,最后用氮气吹干,在室温下制备gce/mof
‑
au@pt纳米花复合膜。
12.优选的,将3μl制备的复合膜溶液滴涂在玻碳电极表面,形成均匀平整的膜,然后滴加5μlbsa(1%)溶液封闭并干燥,所得到的传感器在不用时储存在4℃环境下,该传感器将mof
‑
au@pt纳米花复合膜作为模拟酶催化氧化h2o2产生电流变化,达到定性定量检测h2o2的目的。
13.优选的,所述工作电极为铂电极,所述参比电极为ag/agcl电极,所述对电极为铂电极。
14.优选的,应用于检测底液的铁氰化钾溶液为由k3[fe(cn)6]、k4[fe(cn)6]和kcl按摩尔比为1:1:100组成的混合溶液。
[0015]
优选的,所述h2o2纳米酶传感器的线性检测范围为0.8~3mm。
[0016]
优选的,所述h2o2纳米酶传感器的检出限为0.005μm。
[0017]
优选的,活细胞样本制备方法为:向75cm2培养瓶中加入细胞培养基,并均匀分散原始264.7细胞,将上述细胞置于含5%co2的37℃细胞培养箱中,当细胞生长到90%汇合时,离心并用pbs缓冲液洗涤,用血细胞仪计数,将收集的细胞分布在30mln2饱和的pbs溶液(ph=7.4)中以供使用,并用
‑
0.12v电压实时检测细胞中产生的h2o2,刺激剂诱导细胞产生h2o2,将其添加到无细胞pbs中,并且还使用安培检测。
[0018]
第二方面,所述纳米酶传感器的制备方法,包括以下步骤:
[0019]
(1)对工作电极进行表面预处理。
[0020]
(2)将金属有机骨架结合au@pt纳米花的溶液滴加到步骤(1)表面预处理后的工作电极表面,室温晾干。
[0021]
(3)将牛血清白蛋白溶液滴加到步骤(2)处理后的电极表面,室温晾干,得修饰电极。
[0022]
(4)将步骤(3)所得修饰电极与所述参比电极和所述对电极组成三电极体系,即得所构建的电化学检测h2o2物纳米酶传感器。
[0023]
其中,所述金属有机骨架结合au@pt纳米花溶液和牛血清白蛋白溶液的滴加量体积比为1:1:1。
[0024]
优选的,步骤(1)中,所述工作电极表面预处理的步骤为:将工作电极依次使用0.3μm和0.05μm的氧化铝粉末在抛光布上抛光成镜面,再用超纯水冲洗,然后在超纯水中超声处理1min,然后置于铁氰化钾溶液中进行活化处理,取出,用超纯水冲洗,氮气吹干。
[0025]
第三方面,上述生物传感器在人体血浆中h2o2定量检测中的应用,线性检测范围为0.8~3mm,检出限为86nm。
[0026]
与现有技术相比,本发明的有益效果在于:
[0027]
(1)本发明采用超声辅助法制备了zif
‑
67材料,所构建的电化学生物传感器具有良好的电化学信号,合成的mof材料呈现微孔网络结构,可以给au@pt纳米花提供更多的结合位点,有助于催化剂的嵌入以及活性位点的保留。
[0028]
(2)au@pt纳米花复合膜具有良好的电子转移效应,mof/au@pt纳米花复合膜对h2o2具有良好的催化作用,能够实时监测催化电流的变化,如图3所示,可在5~50
°
的2θ范围内扫描并识别出mof晶体结构,特别是在7
°
、10
°
、16
°
附近有几个非常尖锐的主要衍射特征峰,表征了其晶体结构,图4中材料的eds图像显示了各元素的比例,以上结果表明,本构建方法中的mof材料已成功制备。
[0029]
(3)本发明所构建的电化学生物传感器具备优良的电子转移效率,图5为通过电子阻抗(eis)表征了本发明所构建的传感器电极在k3[fe3(cn)6]溶液中的电化学性能,在阻抗谱图中,高频半圆对应于电子转移过程,其直径等于电子转移电阻(rct),修饰mof
‑
au@pt材料后裸电极的rct明显大于裸gce电极,表明mof
‑
au@pt复合膜材料具有良好的导电性。
[0030]
(4)本发明所构建的电化学生物传感器具备优良的h2o2催化作用,图6为本发明所构建的传感器在pbs缓冲液中有h2o2(b)和没有h2o2(a)的dpv图像,差分脉冲循环伏安扫描速率为100mv/s,当注入3μm h2o2时,电流显著增加,表明电极表面发生催化反应,所构建的mof
‑
au@pt电极对h2o2有显著的催化作用。
[0031]
(5)本发明对au@pt中比值进行了优化,所构建的生物传感器具有良好的选择性,可对h2o2进行准确检测,构建时的au@pt的比值也影响其催化效率,不同比例的贵金属纳米粒子形成不同的核壳结构,也会影响其对h2o2的催化氧化效果。本发明通过优化不同的配比,成功验证当au/pt两种贵金属的配比为3:2,氯铂酸与氯金酸的最佳配比为3:2时,峰值电流最高。
[0032]
(6)本发明所构建的传感器能灵敏地检测过氧化氢催化氧化过程中电流的变化,能够连续、稳定地检测活细胞中的h2o2,图8为本发明所构建的mof
‑
au@pt传感器在
‑
0.12v的固定电位下,在pbs缓冲液中连续添加h2o2时的电化学时间
‑
电流曲线图,每30s加入3ul h2o2(3umol/l)得出的梯度曲线表明固定在电极上的mof
‑
au@pt纳米花保持了其催化活性,图9为每30s加入3μl的n
‑
甲酰基甲硫酰亮氨酸(fmlp,97%,aldrich)刺激物及活细胞缓冲液后的梯度曲线,同时检测到在没有活细胞和其他条件的缓冲液中加入刺激物后没有电流变化,结果表明,该传感器能够连续、稳定地检测活细胞中的h2o2。
[0033]
(7)图10显示了基于mof
‑
au@pt纳米花传感器的响应电流和h2o2浓度的标准曲线,线性范围为0.8~3mm,相关系数为0.9936,mof
‑
au@pt传感器的检测限(lod)为86nm(s/n=3)。
[0034]
(8)本发明所构建的传感器具备良好的抗干扰能力,如图11的电化学时间
‑
电流响应曲线所示,当向pbs缓冲液中添加5μm h2o2时,电流信号变大,表明其产生了电化学催化反应,当加入多巴胺、尿酸、l
‑
半胱氨酸、抗坏血酸等干扰物质时,没有电流响应,表明该传感器具有良好的抗干扰能力,本发明构建的传感器在4℃的冰箱中储存两周,其仍然保持了95%的原始活性,结果表明,该传感器具有良好的抗干扰能力及重复性。
附图说明
[0035]
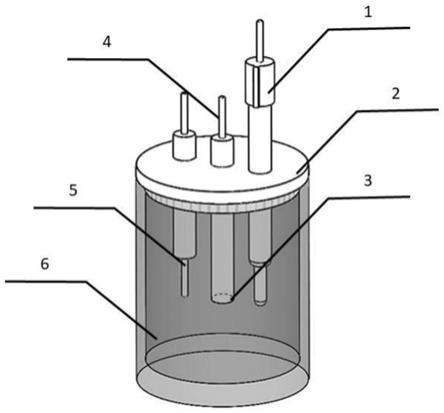
图1是本发明中纳米酶生物传感器及电解池的整体结构示意图。
[0036]
图2是本发明中纳米酶生物传感器工作电极的构建原理图。
[0037]
图3是x射线衍射图谱,在7
°
、10
°
、16
°
附近有几个非常尖锐的主要衍射特征峰,扫描表征了其mof晶体结构。
[0038]
图4为eds图谱,显示了各元素比例,结果表明本构建方法中的mof材料已成功制备。
[0039]
图5为电子阻抗(eis)图,表征了本发明所构建的传感器电极在k3[fe3(cn)6]溶液中的电化学性能,a为裸gce电极在含有5mm k3[fe3(cn)6]的溶液中的阻抗谱,b为修饰有mof
‑
au@pt改性材料的gce电极在含有5mm k3[fe3(cn)6]的溶液中的阻抗谱。
[0040]
图6为本发明所构建的传感器在pbs缓冲液中有h2o2(b)和没有h2o2(a)的dpv图像。
[0041]
图7是优化au/pt配比图,其au/pt两种贵金属的配比为3:2时达到最佳。
[0042]
图8为本发明所构建的mof
‑
au@pt传感器在
‑
0.12v的固定电位下,在pbs缓冲液中连续添加h2o2时的电化学时间
‑
电流曲线图。
[0043]
图9为每30s加入3μl的n
‑
甲酰基甲硫酰亮氨酸(fmlp,97%,aldrich)刺激物及活细胞缓冲液后的梯度曲线。
[0044]
图10为检测标准曲线。
[0045]
图11为电化学时间
‑
电流响应曲线,测试了本发明所构建的传感器的抗干扰能力。
具体实施方式
[0046]
下面结合实例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
[0047]
本发明所构建的mof
‑
au@pt传感器,在活细胞悬液中加入10倍浓度的抗坏血酸、l
‑
半胱氨酸、尿酸、多巴胺干扰物质的适量刺激下进行加标回收试验,加标率为97%~102%,研究表明,所构建的传感器可以用于具体实施检测h2o2,检测结果准确可靠。
[0048]
实施例1
[0049]
检测人体中h2o2的纳米酶生物传感器,整个构造如图1所示,由参比电极1、对电极5及工作电极4组成,工作电极4由固化在玻碳电极表面的催化反应膜3组成,其中,对h2o2的催化敏感的催化反应膜3由mof
‑
au@pt及牛血清白蛋白溶液构建而成,将上述纳米酶生物传感器放入待测液6中,可检测待测液6中h2o2的含量。
[0050]
修饰电极4的装配过程如图2所示,具体制备方法步骤为:
[0051]
(1)工作电极预处理:将工作电极依次使用直径为0.3μm与0.05μm的氧化铝粉末在抛光布上抛光成镜面,再用超纯水冲洗,然后在超纯水中超声处理1min,晾干后,再将玻碳电极置于铁氰化钾溶液(由k3[fe(cn)6]、k4[fe(cn)6]和kcl按摩尔比为1:1:100组成的混合溶液)中,在
‑
0.2~0.6v下采用循环伏安法扫描4圈进行电极活化,取出用超纯水冲洗,氮气吹干后得到预处理的玻碳电极。
[0052]
(2)在工作电极表面构建检测h2o2的复合材料:滴加mof
‑
au@pt复合材料液,在预处理后的电极表面滴加5μlmof
‑
au@pt溶液,将收集的细胞分布在30mln2饱和的pbs溶液(ph=7.4)中以供使用,并用
‑
0.12v电压下实时检测细胞中产生的h2o2,刺激剂诱导细胞产生
h2o2,将其添加到无细胞pbs中,并且还使用安培检测。
[0053]
(3)滴加牛血清白蛋白溶液封闭:待电极表面滴加的复合膜溶液干燥后,滴加5μl牛血清白蛋白溶液,干燥后即制得修饰后的工作电极。
[0054]
将上述工作电极1、参比电极2和对电极3与恒电位仪共同组成三电极体系,即得到检测h2o2的生物传感器。
[0055]
制备的mof
‑
au@pt纳米酶传感器用于检测人体细胞中的h2o2,mof材料选用zif
‑
67,典型的十二面体结构,为au@pt纳米花的负载提供了充足的比表面积。au与pt是常用的贵金属催化剂,根据电荷和粒径不同将他们复合成au@pt纳米花双金属纳米材料,相对于单种贵金属材料极大的提高了催化性。方法中制备的mof
‑
au@pt纳米酶可以代替传统生物酶辣根过氧化酶对h2o2的催化性,相对于生物酶更容易获取成本更低,可代替应用于生物酶无法使用的不利环境。
[0056]
实施例2
[0057]
一种应用差分脉冲伏安法用于检测人体细胞中释放的的纳米酶生物传感器,其制备步骤如下:
[0058]
(1)将直径为3mm的玻碳电极依次使用直径为0.3μm与0.05μm的氧化铝粉末在抛光布上抛光成镜面,再用超纯水冲洗,然后在超纯水中超声处理1min,晾干后,再将玻碳电极置于铁氰化钾溶液(由k3[fe(cn)6]、k4[fe(cn)6]和kcl按摩尔比为1:1:100组成的混合溶液)中,在
‑
0.4~0.5v下采用差分脉冲伏安法扫描4圈进行电极活化,取出用超纯水冲洗,氮气吹干后得到预处理的玻碳电极。
[0059]
(2)滴加5μlmof
‑
au@pt复合溶液:将收集的细胞分布在30mln2饱和的pbs溶液(ph=7.4)中以供使用,并用
‑
0.12v电压下实时检测细胞中产生的h2o2,刺激剂诱导细胞产生h2o2,将其添加到无细胞pbs中。
[0060]
(3)滴加牛血清白蛋白溶液封闭:待电极表面滴加的复合膜溶液干燥后,滴加5μl牛血清白蛋白溶液,干燥后即制得修饰后的工作电极。
[0061]
(4)进行电化学表征测试:室温下,将修饰好的工作电极放入pbs缓冲溶液中,采用差分脉冲伏安法进行电化学测试,扫描电位范围
‑
0.4~0.5v。
[0062]
实施例3
[0063]
一种应用循环伏安法实时定量检测人体细胞中释放的h2o2的电化学纳米酶生物传感器,其构建过程如下:
[0064]
(1)将直径为3mm的玻碳电极依次使用直径为0.3μm与0.05μm的氧化铝粉末在抛光布上抛光成镜面,再用超纯水冲洗,然后在超纯水中超声处理1min,晾干后,再将玻碳电极置于铁氰化钾溶液(由k3[fe(cn)6]、k4[fe(cn)6]和kcl按摩尔比为1:1:100组成的混合溶液)中,在
‑
0.2~0.6v下采用循环伏安法扫描4圈进行电极活化,取出用超纯水冲洗,氮气吹干后得到预处理的玻碳电极。
[0065]
(2)滴加5μlmof
‑
au@pt复合溶液:将收集的细胞分布在30mln2饱和的pbs溶液(ph=7.4)中以供使用,并用
‑
0.12v电压下实时检测细胞中产生的h2o2,刺激剂诱导细胞产生h2o2,将其添加到无细胞pbs中。
[0066]
(3)滴加牛血清白蛋白溶液封闭:待电极表面滴加的复合膜溶液干燥后,滴加5μl牛血清白蛋白溶液,干燥后即制得修饰后的工作电极。
[0067]
(4)进行电化学表征测试:室温下,将修饰好的工作电极放入pbs缓冲溶液中,采用循环伏安法进行电化学测试,扫描电位范围为
‑
0.2~0.6v。
[0068]
本领域技术人员可以理解,尽管已经参照本公开的特定示例性实施例示出并描述了本公开,但是本领域技术人员应该理解,在不背离所附权利要求及其等同物限定的本公开的精神和范围的情况下,可以对本公开进行形式和细节上的多种改变,因此,本公开的范围不应该限于上述实施例,而是应该不仅由所附权利要求来进行确定,还由所附权利要求的等同物来进行限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1