基于金-石墨烯量子点的电化学生物传感器在检测细胞中ctDNA中的应用的制作方法
本发明属于电化学生物传感器技术领域,具体涉及一种基于金-石墨烯量子点的电化学生物传感器在检测细胞中ctdna中的应用。
背景技术:
循环肿瘤dna(ctdna)是随细胞凋亡、坏死而释放到外周血、脑脊液等体液中的,由肿瘤原发灶或循环肿瘤细胞衍生的单链或双链dna片段。多项研究表明,ctdna作为一种极具临床应用前景的肿瘤生物标记物,在肿瘤评估等方面备受关注。例如,kras基因点突变与包括肺癌、结直肠癌和卵巢癌等在内的多种癌症密切相关。因此,ctdna的定量分析在肿瘤的早期诊断、病程进展和预后监测等方面发挥着至关重要的作用。然而,ctdna定量检测面临的最大挑战是体液中的ctdna含量极低,需要极高的灵敏度才能实现定量分析与检测。
目前,ctdna的分析方法主要有无酶pcr反应、dna测序、基因芯片和酶辅助的pcr扩增,这些技术相对成熟,却仍然存在诸多不足。基于无酶pcr的技术,如数字pcr和微滴式数字pcr(ddpcr),已成功应用于ctdna检测,却易被化学物质影响而产生假阴性或假阳性。dna测序是检测基因突变的金标准技术,但具有仪器设备昂贵、耗时长等不可避免的缺点。基因芯片的测序原理是杂交测序方法,即通过与一组已知序列的核酸探针杂交进行核酸序列测定的方法,在一块基片表面固定了序列已知的八核苷酸的探针。当溶液中带有荧光标记的核酸序列tatgcaatctag,与基因芯片上对应位置的核酸探针产生互补匹配时,通过确定荧光强度最强的探针位置,获得一组序列完全互补的探针序列。据此可重组出靶核酸的序列。但是,该技术成本昂贵、复杂,检测灵敏度较低,重复性差,分析泛围较狭窄。为了提高检测灵敏度,各种酶辅助信号扩增方法包括滚环扩增(rca)、解旋酶依赖性扩增(hda)和指数扩增反应已被用来克服标准pcr技术的局限性,在这些策略中使用酶可以显著提高检测灵敏度,但是,它可能会导致非特异性和假阳性信号,同时酶又是很昂贵的,并且控制反应条件以确保最佳的酶活性是具有挑战性的。因此,亟需发展一种经济实用、简单快速、灵敏度高的ctdna分析方法以适应临床诊断治疗需要。
电化学dna传感器因其具有高灵敏度、高特异性、低成本和良好便携性等独特优点吸引了国内外研究者的广泛兴趣,已经成为包括临床诊断、微生物检测和环境监测等许多重要领域的定量分析工具。在经典核酸传感器中,生物识别过程涉及互补核酸链碱基之间的非共价相互作用,表现为捕获探针和互补靶标序列之间的杂交。固定化核酸可以是茎环探针(slp),也可以是线形探针(lp)。对于典型电化学dna生物传感器的构建,一般将dna识别探针固定在电极上,通过特异性杂交捕获靶标dna分子,随后传感器将相应变化转换成电化学信号。目前,对于肿瘤细胞中的标志物循环dna的检测大部分都是采用基因芯片,pcr扩增的手段进行检测,而使用电化学dna传感器的检测报道很少。
为了进一步提高电化学dna生物传感器的灵敏度,近年来已使用了纳米材料,如中孔二氧化硅,金属纳米材料和石墨烯等。石墨烯量子点不仅继承了石墨烯的优点,而且具有独特的小粒径,丰富的边缘位点和各种官能团,对电解质离子有很强的吸附能力,因而在电化学领域展现出巨大的发展潜质。特殊功能化的石墨烯量子点还具有还原性,利用其作为还原剂与贵金属纳米粒子紧密结合。石墨烯量子点与贵金属的结合可以实现优势互补和相互协同。石墨烯量子点表面的疏水基团可以避免贵金属纳米粒子的聚集。不掺杂杂原子的石墨烯量子点的电活性显著下降,而贵金属纳米材料具有卓越的电导率和优异的电催化能力,两者结合后的复合材料不仅具有良好的电学性质,且具有良好的空间结构和形貌特征,能有效提高检测物的分析灵敏度。
技术实现要素:
针对现有技术中的不足,本发明的首要目的是提供一种基于金-石墨烯量子点复合材料的电化学生物传感器在检测细胞中ctdna中的应用,即为了弥补传统检测方法的缺陷,本发明构建了无酶循环扩增的电化学dna传感器用于ctdna的超灵敏检测。
本发明的第二个目的是提供上述基于金-石墨烯量子点复合材料的电化学生物传感器的制备方法。
为达到上述首要目的,本发明的解决方案是:
一种基于金-石墨烯量子点复合材料的电化学生物传感器在检测细胞中循环肿瘤dna中的应用。
为达到上述第二个目的,本发明的解决方案是:
一种上述的基于金-石墨烯量子点复合材料的电化学生物传感器的制备方法,其包括如下步骤:
(1)、称取摩尔比3:1:2的柠檬酸、组氨酸和色氨酸混合均匀,加入蒸馏水后超声10-30min溶解得到反应液,将反应液放入烘箱内,设置温度为150-200℃,加热反应0.5-2h,反应结束后得到组氨酸/色氨酸石墨烯量子点固体产物,并配制成20-100mg/ml的水溶液,然后将配制的水溶液用0.25μm的滤膜过滤2h得到粒径均一的组氨酸/色氨酸石墨烯量子点溶液;
(2)、将2-20ml浓度为0.2-1mg/ml的氯金酸溶液在60-100℃水浴锅下加热至沸腾,然后加入步骤(1)的0.1-0.5ml组氨酸/色氨酸石墨烯量子点溶液中,该溶液迅速由微黄色变成红色,反应在1min之内完成,之后将反应结束的溶液经过3000-10000rpm离心5-30min,过滤,收集得到组氨酸/色氨酸石墨烯量子点-金杂合物(ht-gqds/au),用超纯水清洗2-5次,然后分散在0.5-2.0ml、ph值为6.5-8.5的三羟甲基氨基甲烷盐酸盐(tris-hcl)缓冲液中,得到组氨酸/色氨酸石墨烯量子点-金储备液;
(3)、配制dna储备液:将20-50mmol/l的三羟甲基氨基甲烷(tris)、1-5mmol/l的氯化镁(mgcl2)、1-5mmol/l的氯化钙(cacl2)、2-20mmol/l的氯化钾(kcl)和目标dna反应得到dna储备液,ph值为7.0-8.0;
(4)、将定制dna的h2序列(用于与目标dna反应的探针)和定制dna的h1序列(用于与h2反应的发夹探针)分别溶解在步骤(3)的dna储备液中,将溶解的h1序列和h2序列在60-100℃下加热5-20min,并以1℃/min的速率缓慢冷却至室温,形成稳定的h1发夹结构和h2发夹结构;称取0.01-0.1g的硫堇加入1-10ml的步骤(3)的dna储备液中,得到0.01-0.1g/ml的硫堇(thi)溶液;
(5)、将步骤(4)中h1发夹结构和h2发夹结构分别加入10-100μl的1-10mmol/l盐酸三-(2-羧乙基)膦(tcep)溶液以激活发夹中的巯基基团,得到巯基(-sh)基团活化的h1发夹溶液和h2发夹溶液;将h2发夹溶液与步骤(2)0.1-1ml的组氨酸/色氨酸石墨烯量子点-金(ht-gqds/au)储备液混合,得到第一混合液,将1-10mol/l的氯化钠(nacl)和1-10%的十二烷基硫酸钠(sds)分别加入第一混合液中,得到含有0.1-1mol/l的氯化钠(nacl)和0.01-0.1%十二烷基硫酸钠(sds)的第二混合液,并将第二混合液在15-30℃下孵育6-48h,然后以5000-16000rpm离心5-30min,用步骤(3)的dna储备液洗涤2-5次,去除未反应的物质,将收集的h2-组氨酸/色氨酸石墨烯量子点-金(h2-ht-gqds/au)杂合物固体重新分散在1-2ml的步骤(3)中的dna储备液中,最后将此溶液超声20-60s得到h2-组氨酸/色氨酸石墨烯量子点-金(h2-ht-gqds/au)杂合物溶液;
(6)、将0.1-1ml的步骤(5)中h2-组氨酸/色氨酸石墨烯量子点-金(h2-ht-gqds/au)杂合物溶液加入5-20μl、5-20mg/ml的1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)溶液和5-20μl、5-20mg/ml的n-羟基琥珀酰亚胺(nhs)溶液中,然后在空气浴振动器中以15-37℃和150-500rpm的条件下孵育50-120min,得到活化的h2-组氨酸/色氨酸石墨烯量子点-金(h2-ht-gqds/au)杂合物溶液,将活化的h2-组氨酸/色氨酸石墨烯量子点-金杂合物溶液加入0.1-1ml的步骤(4)的硫堇溶液中,然后在空气浴振动器中以15-37℃和150-500rpm的条件下孵育6-20h,之后以5000-16000rpm离心5-30min收集,得到h2-组氨酸/色氨酸石墨烯量子点-金-硫堇(h2-ht-gqds/au-thi)固体,并用步骤(3)的dna储备液洗涤2-5次,将清洗的h2-组氨酸/色氨酸石墨烯量子点-金-硫堇(h2-ht-gqds/au-thi)固体再分散在0.1-1ml的步骤(3)的dna储备液中,然后超声20-60s得到h2-组氨酸/色氨酸石墨烯量子点-金-硫堇(h2-ht-gqds/au-thi)原液;
(7)、将目标dna和步骤(6)的h2-组氨酸/色氨酸石墨烯量子点-金-硫堇(h2-ht-gqds/au-thi)原液混合10-30min,得到目标dna和h2-组氨酸/色氨酸石墨烯量子点-金-硫堇(h2-ht-gqds/au-thi)混合液;
(8)、将金电极用麂皮打磨,接下来用乙醇和超纯水清洗干净,然后用氮气吹干,在干净的金电极上滴加3-10μl的步骤(5)中的巯基(-sh)基团活化的h1发夹溶液,温育孵化30-80min,接着在电极上滴加3-10μl的6-巯基己-1-醇(mch)孵育30-80min,封闭电极上未反应的活性位点,孵育结束后用20-50mmol/l的pbs缓冲液清洗电极并用氮气吹干得到适体传感器;
(9)、将步骤(7)中6μl的目标dna和h2-组氨酸/色氨酸石墨烯量子点-金-硫堇(h2-ht-gqds/au-thi)混合液滴加到适体传感器上,温育孵化60min后,用磷酸缓冲液洗涤并用氮气干燥,得到基于金-石墨烯量子点复合材料的电化学生物传感器。
作为本发明的一种优选实施例,步骤(5)中,h2-组氨酸/色氨酸石墨烯量子点-金杂合物固体和步骤(8)中制备的适体传感器在使用前需保存在2-8℃的冰箱中。
作为本发明的一种优选实施例,步骤(3)和步骤(7)中,目标dna的序列为:5´-actctggatcccagaaggtgaga-3´,如seqidno.1所示。
作为本发明的一种优选实施例,步骤(4)中,定制dna的h1序列为:5´-sh-(ch2)3-gtcagtctcaccttctgggtgtcaggggcgtacggcctttgacgcccctgacaccctgac-3´,如seqidno.2所示。
作为本发明的一种优选实施例,步骤(4)中,定制dna的h2序列为:5´-sh-(ch2)3-ggtgtcaggggcgtcaaaggccgtacgcccctgacacccagaaggtgaga-3´。[0014]由于采用上述方案,本发明的有益效果是:
第一、本发明的电化学生物传感器通过发夹自组装,一个目标dna可以诱导许多氧化还原探针进入金电极表面进一步提高传感器的的信号放大能力。通过金/石墨烯量子点和无酶循环扩增的双重信号放大策略,使得该电化学传感器检测循环dna具有超高的灵敏度,达到检测限低至亚皮摩尔水平;同时其检测重复性好,稳定性优良。
第二、本发明使用柠檬酸为碳源,色氨酸和组氨酸为氮源,制备了双氨基酸石墨烯量子点,以石墨烯量子点为模板还原纳米金颗粒,其合成方法简单快捷。
第三、合成的组氨酸/色氨酸石墨烯量子点-金纳米复合材料,具有良好的比表面积、空间结构和稳定的形貌特征,应用于电化学传感器可表现出更高的催化活性。
第四、基于组氨酸/色氨酸石墨烯量子点-金复合材料构建的无酶循环扩增的电化学传感器,相对于常规pcr、基因芯片等方法,对ctdna的检测具有更高的灵敏度,更宽的线性范围,更好的稳定性和更快的检测速度。
附图说明
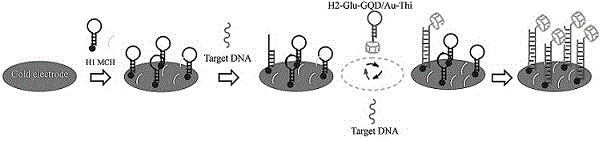
图1为本发明的金电极和h2-ht-gqds/au-thi反应流程图。
图2为本发明的ht-gqds/au的制备过程中反应体系的紫外吸收光谱图(横坐标wavelength为波长,纵坐标absorbance为吸光度)
图3为本发明的ht-gqds/au的制备过程中紫外吸收光谱在546nm处吸光度与反应时间的关系曲线图(横坐标time为时间,纵坐标absorbance为吸光度)。
图4为本发明的ht-gqds/au的制备过程中反应体系的荧光光谱在1.0min(a)和0.0min(b)的曲线图(横坐标wavelength为波长,纵坐标fluorescenceintensity为荧光强度)。
图5为本发明的ht-gqds/au的制备过程中峰值荧光强度与反应时间的关系曲线图(横坐标time为时间,纵坐标peakfluorescenceintensity为峰值荧光强度)。
图6为本发明的ht-gqds/au的sem图。
图7为本发明的ht-gqds/au的tem图。
图8为本发明的ht-gqds/au的n元素分析示意图。
图9为本发明的ht-gqds/au的au元素分析示意图。
图10为本发明的ht-gqds/au的xrd示意图(图中纵坐标intensity为强度)。
图11为本发明的ht-gqds/au的和ir示意图(图中横坐标wavenumber为波数,纵坐标transmittancr为透过率)。
图12为本发明的电化学生物传感器反应的cv曲线示意图(图中横坐标potential为电势值,纵坐标current为电流值;裸金电极(a)、h1修饰的金电极(b)、mch、0.5μmol/l的h1和h2-ht-gqds/au-thi与t-dna孵化60min的混合溶液修饰的金电极(c)、mch和0.5μmol/l的h1修饰的金电极(d)和mch、0.5μmol/l的h1和h2-ht-gqds/au-thi修饰的金电极(e))。
图13为本发明的电化学生物传感器反应的eis曲线示意图(裸金电极(a)、h1修饰的金电极(b)、mch、0.5μmol/l的h1和h2-ht-gqds/au-thi与t-dna孵化60min的混合溶液修饰的金电极(c)、mch和0.5μmol/l的h1修饰的金电极(d)和mch、0.5μmol/l的h1和h2-ht-gqds/au-thi修饰的金电极(e))。
图14为本发明中基于ht-gqds/au纳米材料构建的电化学适体传感器在金电极上检测目标dna时,发夹h1的浓度与电流的关系图。
图15为本发明中基于ht-gqds/au纳米材料构建的电化学适体传感器在金电极上检测目标dna时,t-dna在电极上的孵育时间图。
图16为本发明中电极上不同浓度的dna电势与电流的关系图(浓度从a到k依次是0fm、1fm、10fm、20fm、80fm、200fm、800fm、2000fm、5000fm、10000fm和100000fm)。
图17为本发明中dpv峰值电流与t-dna浓度的对数关系曲线图。
具体实施方式
本发明提供了一种基于金-石墨烯量子点复合材料的电化学生物传感器在检测细胞中ctdna中的应用。
本发明所用的电化学工作站是上海辰华chi660d;日本电子株式会社s-4800扫描电子显微镜;德国布鲁克科技有限公司d8advancex射线衍射仪;美国赛默飞世尔科技公司nicolet6700全反射傅立叶红外光谱仪;北京普析通用仪器公司tu-1901双光束紫外可见分光光度计。
一水合柠檬酸、色氨酸、组氨酸、氯金酸、硫堇(thi)、三(2-羧乙基)膦盐酸盐(tcep)和6-巯基己-1-醇(mch)购自sigma-aldrich(中国大陆)。制备磷酸盐缓冲盐水(na2hpo4-kh2po4-nacl-kcl,0.01m)(pbs,ph值为7.4)。所有寡核苷酸均由sangonbiotechnologyco.,ltd合成和纯化,其序列于下:
目标dna(t-dna)的序列为:5´-actctggatcccagaaggtgaga-3´,如seqidno.1所示。
定制dna的h1序列为:5´-sh-(ch2)3-gtcagtctcaccttctgggtgtcaggggcgtacggcctttgacgcccctgacaccctgac-3´,如seqidno.2所示。
定制dna的h2序列为:5´-sh-(ch2)3-ggtgtcaggggcgtcaaaggccgtacgcccctgacacccagaaggtgaga-3´,如seqidno.3所示。
其中,在上述的h1序列中,因为h1要固定在金电极上,就是通过au-s实现的,(ch2)3主要是制备过程中留下的,保证-sh的稳定性。在h2序列中,因为h2要和上面合成的金-石墨烯量子点复合材料连接,也是通过au-s实现的,(ch2)3主要是制备过程中留下的,保证-sh的稳定性。
由图1可知,目标dna和h2-ht-gqds/au-thi混合液滴在金电极上时,目标dna先和金电极上的h1发夹结构优先反应得到直链结构,然后电极上打开的h1发夹结构才能和h2-ht-gqds/au-thi中的h2反应,将目标dna和h2-ht-gqds/au-thi混合会加快反应实现目标dna快速循环,得到稳定的电化学生物传感器,从而节省了金电极上先孵育目标dna,再孵育h2-ht-gqds/au-thi的时间,电化学生物传感器的制备和上述反应是同时进行的。其中,h2-glu-gqds/au-thi为h2-ht-gqds/au-thi,targetdna为目标dna。
以下结合实施例对本发明作进一步的说明。
实施例1:
本实施的基于金-石墨烯量子点复合材料的电化学生物传感器的制备方法包括如下步骤:
(1)、称取摩尔比3:1:2的柠檬酸、组氨酸和色氨酸混合均匀,加入蒸馏水后超声10min溶解得到反应液,将反应液放入烘箱内,设置温度为150℃,加热反应1h,反应结束后得到组氨酸/色氨酸石墨烯量子点固体产物,并配制成20mg/ml的水溶液,然后将配制的水溶液用0.25μm的滤膜过滤2h得到粒径均一的组氨酸/色氨酸石墨烯量子点溶液;
(2)、将2ml浓度为0.2mg/ml的氯金酸溶液在60℃水浴锅下加热至沸腾,然后加入步骤(1)的0.1ml组氨酸/色氨酸石墨烯量子点溶液中,该溶液迅速由微黄色变成红色,反应在1min之内完成,之后将反应结束的溶液经过3000rpm离心5min,过滤,收集得到组氨酸/色氨酸石墨烯量子点-金杂合物(ht-gqds/au),用超纯水清洗2次,然后分散在0.5ml、ph值为6.5的tris-hcl缓冲液中,得到ht-gqds/au储备液;
(3)、配制dna储备液:将20mmol/l的tris、1mmol/l的mgcl2、1mmol/l的cacl2、2mmol/l的kcl和目标dna反应得到dna储备液,ph值为7.0;
(4)、将定制dna的h2序列(用于与目标dna反应的探针)和定制dna的h1序列(用于与h2反应的发夹探针)分别溶解在步骤(3)的dna储备液中,将溶解的h1序列和h2序列在60℃下加热5min,并以1℃/min的速率缓慢冷却至室温,形成稳定的h1发夹结构和h2发夹结构;称取0.01g的硫堇加入1ml的步骤(3)的dna储备液中,得到0.01g/ml的thi溶液;
(5)、将步骤(4)中h1发夹结构和h2发夹结构分别加入10μl的1mmol/l的tcep溶液以激活发夹中的巯基基团,得到-sh基团活化的h1发夹溶液和h2发夹溶液;将h2发夹溶液与步骤(2)中0.1ml的ht-gqds/au储备液混合,得到第一混合液,将1mol/l的nacl和1%的sds分别加入第一混合液中,得到含有0.1mol/l的nacl和0.01wt%的sds的第二混合液,并将第二混合液在15℃下孵育6h,然后以5000rpm离心5min,用步骤(3)的dna储备液洗涤2次,去除未反应的物质,将收集的h2-ht-gqds/au杂合物固体重新分散在1ml的步骤(3)中的dna储备液中,最后将此溶液超声20s得到h2-ht-gqds/au杂合物溶液;
(6)、将0.1ml的步骤(5)中h2-ht-gqds/au杂合物溶液加入5μl、5mg/ml的edc溶液和5μl、5mg/ml的nhs溶液中,然后在空气浴振动器中以15℃和150rpm的条件下孵育50min,得到活化的h2-ht-gqds/au杂合物溶液,将活化的h2-ht-gqds/au杂合物溶液加入0.1ml的步骤(4)的thi溶液中,然后在空气浴振动器中以15℃和150rpm的条件下孵育6h,之后以5000rpm离心5min收集,得到h2-ht-gqds/au-thi固体,并用步骤(3)的dna储备液洗涤2次,将清洗的h2-ht-gqds/au-thi固体再分散在0.1ml的步骤(3)的dna储备液中,然后超声20s得到h2-ht-gqds/au-thi原液;
(7)、将目标dna和步骤(6)的h2-ht-gqds/au-thi原液混合10min,得到目标dna和h2-ht-gqds/au-thi混合液;
(8)、将金电极用麂皮打磨,接下来用乙醇和超纯水清洗干净,然后用氮气吹干,在干净的金电极上滴加3μl的步骤(5)中的-sh基团活化的h1发夹溶液,温育孵化30min,接着在电极上滴加3μl的mch孵育30min,封闭电极上未反应的活性位点,孵育结束后用20mmol/l的pbs缓冲液清洗电极并用氮气吹干得到适体传感器;
(9)、将步骤(7)中6μl的目标dna和h2-ht-gqds/au-thi混合液滴加到适体传感器上,温育孵化60min后,用磷酸缓冲液洗涤并用氮气干燥,得到基于金-石墨烯量子点复合材料的电化学生物传感器。
实施例2:
本实施的基于金-石墨烯量子点复合材料的电化学生物传感器的制备方法包括如下步骤:
(1)、称取摩尔比3:1:2的柠檬酸、组氨酸和色氨酸混合均匀,加入蒸馏水后超声30min溶解得到反应液,将反应液放入烘箱内,设置温度为200℃,加热反应2h,反应结束后得到组氨酸/色氨酸石墨烯量子点固体产物,并配制成100mg/ml的水溶液,然后将配制的水溶液用0.25μm的滤膜过滤2h得到粒径均一的组氨酸/色氨酸石墨烯量子点溶液;
(2)、将20ml浓度为1mg/ml的氯金酸(haucl4)溶液在100℃水浴锅下加热至沸腾,然后加入步骤(1)的0.5ml组氨酸/色氨酸石墨烯量子点溶液,该溶液迅速由微黄色变成红色,反应在1min之内完成,之后将反应结束的溶液经过10000rpm离心30min,过滤,收集得到组氨酸/色氨酸石墨烯量子点-金杂合物(ht-gqds/au),用超纯水清洗5次,然后分散在2.0ml、ph值为8.5的tris-hcl缓冲液中,得到ht-gqds/au储备液;
(3)、配制dna储备液:将50mmol/l的tris、5mmol/l的mgcl2、5mmol/l的cacl2、20mmol/l的kcl和目标dna反应得到dna储备液,ph值为8.0;
(4)、将定制dna的h2序列(用于与目标dna反应的探针)和定制dna的h1序列(用于与h2反应的发夹探针)分别溶解在步骤(3)的dna储备液中,将溶解的h1序列和h2序列在100℃下加热20min,并以1℃/min的速率缓慢冷却至室温,形成稳定的h1发夹结构和h2发夹结构;称取0.1g的硫堇加入10ml的步骤(3)的dna储备液中,得到0.01g/ml的thi溶液;
(5)、将步骤(4)中h1发夹结构和h2发夹结构分别加入100μl的10mmol/l的tcep溶液以激活发夹中的-sh基团,得到-sh基团活化的h1发夹溶液和h2发夹溶液;将h2发夹溶液与步骤(2)1ml的ht-gqds/au储备液混合,得到第一混合液,将10mol/l的nacl和10%的sds分别加入第一混合液中,得到含有1mol/l的nacl和0.1%的sds的第二混合液,并将第二混合液在30℃下孵育48h,然后以16000rpm离心30min,用步骤(3)的dna储备液洗涤5次,去除未反应的物质,将收集的h2-ht-gqds/au杂合物固体重新分散在2ml的步骤(3)中的dna储备液中,最后将此溶液超声60s得到h2-ht-gqds/au杂合物溶液;
(6)、将1ml的步骤(5)中h2-ht-gqds/au杂合物溶液加入20μl、20mg/ml的edc溶液和20μl、20mg/ml的nhs溶液中,然后在空气浴振动器中以37℃和500rpm的条件下孵育120min,得到活化的h2-ht-gqds/au杂合物溶液,将活化的h2-ht-gqds/au杂合物溶液加入1ml的步骤(4)的thi溶液中,然后在空气浴振动器中以37℃和500rpm的条件下孵育20h,之后以16000rpm离心30min收集,得到h2-ht-gqds/au-thi固体,并用步骤(3)的dna储备液洗涤5次,将清洗的h2-ht-gqds/au-thi固体再分散在1ml的步骤(3)的dna储备液中,然后超声60s得到h2-ht-gqds/au-thi原液;
(7)、将目标dna和步骤(6)的h2-ht-gqds/au-thi原液混合30min,得到目标dna和h2-ht-gqds/au-thi混合液;
(8)、将金电极用麂皮打磨,接下来用乙醇和超纯水清洗干净,然后用氮气吹干,在干净的金电极上滴加10μl的步骤(5)中的-sh基团活化的h1发夹溶液,温育孵化80min,接着在电极上滴加10μl的mch孵育80min,封闭电极上未反应的活性位点,孵育结束后用50mmol/l的pbs缓冲液清洗电极并用氮气吹干得到适体传感器;
(9)、将步骤(7)中6μl的目标dna和h2-ht-gqds/au-thi混合液滴加到适体传感器上,温育孵化60min后,用磷酸缓冲液洗涤并用氮气干燥,得到基于金-石墨烯量子点复合材料的电化学生物传感器。
<应用>
将上述实施例的基于金-石墨烯量子点复合材料的电化学生物传感器在肿瘤细胞中进行标志物循环dna的检测:
将实施例的基于金-石墨烯量子点复合材料的电化学生物传感器浸入20mmol/l,ph值为7.4的磷酸缓冲液中,采用差分脉冲伏安法进行测量,设置参数如下:50mv的脉冲幅度,4mv·s-1的扫描速度,20ms的脉冲宽度和-0.2v的初始电位,记录其在-0.6v和0.2v之间的差分脉冲伏安曲线。
为了获得高灵敏度的电化学响应,基于发夹催化自组装表面程序链反应,将具有电催化剂的氧化还原探针h2-ht-gqds/au-thi设计成目标dna(t-dna)生物传感纳米平台。在h2-ht-gqds/au-thi中,硫堇(thi)是用于检测t-dna过程中产生电化学信号的氧化还原探针,并且au纳米颗粒充当电催化剂来加速电极表面上的硫堇发生氧化还原,导致检测信号的放大。为了进一步提高催化活性,开发了一种制备au纳米颗粒的新策略。这里,ht-gqds/au是通过氯金酸与组氨酸、色氨酸官能化石墨烯量子点(gqds)的一步反应制备的,不使用额外的还原剂和表面活性剂。图2、图3、图4和图5表明,在将gqds引入haucl4溶液后,反应体系迅速变为深红葡萄酒色,表明ht-gqds/au的形成。为了研究反应时间对合成的影响,分别在不同时间测量加入gqds的反应体系的紫外-可见吸收光谱和荧光发射光谱。图3表明,当时间小于1.0min时,由于形成更多的au纳米晶体,吸光度随着反应时间的增加而增加。吸光度在1.0min达到其最大值,然后几乎保持不变,证实au纳米晶体的生长已经完成。随着au纳米晶体的形成,gqds的荧光发射强度将显著淬灭。事实证明,au纳米晶体与gqds的混合物可以诱导从石墨烯片到au纳米晶体的超快电子转移。由于au和gqds的独特电学性质,超快电子转移有助于极大地增强au纳米颗粒对硫堇的电催化活性。
图6、图7、图8和图9是对制备的ht-gqds/au进行了扫描电子显微镜(sem)、透射电子显微镜(tem)和高分辨mapping表征,图6显示出ht-gqds/au尺寸均一、分布均匀,没有明显的堆积现象。图7中tem图像呈规则的六边形的类石墨烯结构,其0.23nm的晶面间距对应于纳米金的(111)面。图8和图9中mapping说明了ht-gqds/au中氮(n)和金(au)的空间分布,可以看出氮在纳米金表面均匀的分布,这说明纳米金颗粒aunps与gqds实现了复合。
图10和图11是对ht-gqds/au进行了x射线衍射(xrd)和红外分光光度分析(ir),图10中xrd图谱在38.2°、44.3°、66.1°和78.4°处有四个衍射峰,这些峰分别对应于aunps晶体的(111)、(200)、(220)和(311)平面。这四个衍射峰明显而尖锐,说明其中aunps结晶度较高。石墨烯一般在25°左右会有微弱的宽衍射峰,但ht-gqds/au中gqds含量较低,并且没有经过高温煅烧,结晶度不高,因而进一步降低了石墨烯衍射峰的强度。gqds的衍射峰相对于aunps的强衍射峰非常微弱,所以在xrd中无法观察到它的存在。在图11的ir光谱中,3600cm-1和3425cm-1之间的吸收峰来自于-nh和-oh的伸缩振动,1705cm-1处的吸收峰来自-c=o键的伸缩振动,1375cm-1处的是由于-ch键的伸缩振动,1210cm-1处的吸收峰来自-c-n的伸缩振动,748cm-1处的吸收峰是由于-ch2的面内摇摆,ir分析的结果进一步证实了ht-gqds/au中存在gqds。
图12和图13是研究了电化学dna传感平台的可行性,在含有5mm的k3fe(cn)6的ph=7.0的pbs中测量了不同电极的cv曲线和奈奎斯特光谱(eis),显示结果:裸金电极在cv曲线中显示最高电流和在eis中最小的电荷转移电阻(rct)(117.3ω),表明快速的电子转移过程。这归因于高电导率和金在电极表面上对fe(cn)63-/4-的催化活性。在h1固定在金电极表面上之后,cv曲线中的电流响应随着rct值(371.8ω)的增加而减小。一方面,电极表面上的h1单层的带负电荷的磷酸骨架防止fe(cn)63-/4-由于其强静电排斥而接近电极表面。另一方面,h1的存在部分地阻止了电极和电解质之间的电子/离子传输。上述两个因素导致cv电流减小和rct值增加。因为用mch阻挡表面将进一步增加ret值(1169ω),所以与h1修饰电极相比,h1和mch修饰电极显示出更低的cv电流响应。结果还证明了电化学生物传感器的成功制备。在不存在t-dna的情况下,h2-ht-gqds/au-thi不能与电极上的h1结合进入电极的表面,生物传感器的cv响应和ret(1122ω)几乎保持不变(图13中未显示)。然而,生物传感器在t-dna和h2-ht-gqds/au-thi的混合物中孵育后,随着rct值(468.4ω)的降低,cv曲线中的电流响应可以明显增强。由于h2-ht-gqds/au-thi氧化还原探针中ht-gqds/au的高电导率和催化活性,电化学响应得到极大改善。上述结果表明,由于无酶循环扩增的形成,仅t-dna可以诱导发夹自组装进行链式反应,并导致显著的信号放大。
图14和图15是对于该检测t-dna的电化学传感器的构建进行了以下参数的优化。优化的结果如图14和图15所示。图14中发夹h1的浓度优化过程中分别使用了0.1μm、0.2μm、0.3μm、0.4μm、0.5μm、0.6μm、0.7μm和0.8μm的h1修饰金电极,并将其在10mm的pbs中进行dpv测试,峰值电位一开始随h1浓度的增加而增加,当h1浓度达到0.5μm时,dpv的电流响应不再增强,因此0.5μm为h1的最佳浓度。图15中t-dna在电极上的孵育时间的优化中,分别选择将t-dna在金电极上孵育20min、30min、50min、60min、80min和100min,并将其用置于10mm的pbs测试dpv行为,峰值电位先随孵育时间的增加而增高,当孵育时间达60min时,峰值电位不再增加,因此最佳孵育时间为60min。条件优化的结果为:(图14)最佳发夹h1浓度:0.4μm;(图15)最佳孵育时间:60min。
图16和图17是通过改变t-dna的浓度,研究了在金电极上制备的电化学传感平台对t-dna的时差脉冲法dpv行为。不同浓度t-dna与等量h2-ht-gqds/au-thi混合孵育后,在用h1和mch修饰的电极上的dpv曲线以及dpv峰值电流与t-dna浓度的对数的关系如图16所示。t-dna浓度分别为0fm、1fm、10fm、20fm、80fm、200fm、800fm、2000fm、5000fm、10000fm和100000fm,从图17中可以看出,dpv响应取决于t-dna的浓度,并且在t-dna浓度在1.0×10-15到1.0×10-10m之间时,dpv峰值电流与t-dna浓度的对数存在良好的线性关系。线性回归方程为:ip(na)=3.1443log[ct-dna,fm]+1233.3,r2=0.9877,(信噪比s/n=3),检测限(lod)为3.33×10-16m。上述数据表明,与先前报道的检测t-dna的分析方法相比,该电化学传感器有更高的灵敏度和更宽的线形范围。
通过用10个生物传感器检测1.0×10-12mol/l的t-dna来检查电极的重现性。二十次重复测量的相对标准偏差为约2.8%,表明所提出的生物传感器的良好再现性。通过将其在4℃下储存30天来测试生物传感器的稳定性。生物传感器仍然保持其初始dpv响应的97.1%,验证了高稳定性。
本发明首次公开了一种色氨酸和组氨酸功能化石墨烯量子点还原纳米金的制备方法,同时公开了一种基于自带催化能力的氧化还原探针h2-ht-gqds/au-thi构建的无酶循环扩增的电化学传感器,用于循环肿瘤dna的超灵敏检测。在本发明中,ht-gqds/au纳米复合材料作为氧化还原探针硫堇thi的催化剂,以其优良的形貌和极高的催化活性,可原位催化thi的氧化还原来增强传感器的检测信号;通过发夹自组装,一个目标dna可以诱导许多氧化还原探针进入金电极表面进一步提高传感器的的信号放大能力。通过金/石墨烯量子点和无酶循环扩增的双重信号放大策略,使得该电化学传感器检测循环dna具有超高的灵敏度,达到检测限低至亚皮摩尔水平。同时其检测重复性好,稳定性优良。
上述对实施例的描述是为了便于该技术领域的普通技术人员能理解和使用本发明。熟悉本领域技术人员显然可以容易的对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中,而不必经过创造性的劳动。因此,本发明不限于上述实施例。本领域技术人员根据本发明的原理,不脱离本发明的范畴所做出的改进和修改都应该在本发明的保护范围之内。
序列表
<110>上海执诚生物科技有限公司
<120>基于金-石墨烯量子点的电化学生物传感器在检测细胞中ctdna中的应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>23
<212>dna
<213>人工序列()
<400>1
actctggatcccagaaggtgaga23
<210>2
<211>60
<212>dna
<213>人工序列()
<400>2
gtcagtctcaccttctgggtgtcaggggcgtacggcctttgacgcccctgacaccctgac60
<210>3
<211>50
<212>dna
<213>人工序列()
<400>3
ggtgtcaggggcgtcaaaggccgtacgcccctgacacccagaaggtgaga50
- 还没有人留言评论。精彩留言会获得点赞!