微流控芯片及其制作方法、测试生化需氧量的方法及装置
本公开属于生物或化学微纳传感器领域,涉及一种用于生化需氧量电化学检测的微流控芯片及其制作方法,还涉及一种基于微流控芯片测试样品生化需氧量的方法及装置。
背景技术:
生化需氧量(biochemicaloxygendemand,bod),是指在规定条件下,微生物分解水中某些可氧化性物质、特别是有机物所进行的生物化学过程中消耗溶解氧的量,单位为mg/l。生化需氧量值越高,表明微生物代谢有机污染物消耗溶解氧的量越高,水中有机污染物含量越高,污染越严重。
我国生化需氧量测定的标准方法是稀释与接种法。目前的商业化仪器通常采用测压法,如哈希公司的bodtraktm生化需氧量分析仪,美国globalwater公司的oxitopbod测量仪等。以上方法最主要的缺点是测定周期长,需要5天或(2+5)天的培养阶段,难以进行在线和实时监测,同时存在操作过程繁琐、重现性差等问题。
针对生化需氧量测定周期长的问题,近年来发展起来的生化需氧量微生物传感器受到了广泛关注和研究。目前,虽然已有大量研究围绕用于bod快速检测的微生物传感器展开,但bod检测的快速性仍需要进一步提高。此外,虽然样品的检测时间大大缩短,但检测过程复杂。首先,bod值的测定是溶解氧消耗量的测定,需要分别测定对照组和样品中的溶解氧含量,测定时需要反复更换待测液;其次,bod检测过程中应用了微生物,每次测试前需要用缓冲液进行微生物活化,每次测试后需要用缓冲液进行微生物再次活化,以保证每次测试前微生物的状态一致。微生物在不使用的时候需要浸泡于缓冲液中。这些检测及操作过程非常复杂,且对操作人员要求高。
因此,研究开发一套集成化且能够实现生化需氧量的快速检测的bod检测系统是bod检测领域的迫切需求。
技术实现要素:
(一)要解决的技术问题
本公开提供了一种微流控芯片及其制作方法、测试生化需氧量的方法及装置,以至少部分解决以上所提出的技术问题。
(二)技术方案
本公开的第一个方面提供了一种用于生化需氧量电化学检测的微流控芯片。上述微流控芯片包括:流道层,以及集成于上述流道层下方的电化学检测层。上述流道层内设置有生化反应区、微流道、进样区和出样区。上述生化反应区具有三维结构阵列形式的内表面,上述内表面固定有用于代谢有机物的微生物,上述微流道包括第一微流道和第二微流道,上述进样区通过上述第一微流道与上述生化反应区的一侧连通,上述出样区通过上述第二微流道与上述生化反应区的另一侧连通。上述电化学检测层与上述生化反应区之间具有容置空间,上述容置空间用于盛放缓冲液或待测样品溶液,上述电化学检测层包括:与上述生化反应区的位置对应的检测电极。
根据本公开的实施例,上述流道层包括流道层主体,上述流道层主体内具有上述容置空间和与上述容置空间连通的微流道,上述容置空间的顶部为生化反应区,上述容置空间的底部为检测电极;上述进样区和上述出样区设置于上述流道层主体上,用于实现上述微流道与外部的连通。
根据本公开的实施例,上述电化学检测层还包括检测层主体,上述检测电极设置于上述检测层主体上,上述检测层主体与上述流道层主体键合。
根据本公开的实施例,上述三维结构阵列包括棱锥阵列。
根据本公开的实施例,上述三维结构阵列的内表面通过化学交联法固定有用于代谢有机物的微生物,以形成用于生化信号转换的微生物三维敏感表面。
根据本公开的实施例,上述检测电极为三电极体系,包括:工作电极、参比电极和对电极,上述工作电极为超微电极阵列,上述超微电极阵列中的超微电极单元为超微圆环形电极,上述参比电极和上述对电极呈弧形并间隔环绕于所述超微电极阵列的外围。
根据本公开的实施例,上述生化反应区的半径大于上述检测电极的半径。
根据本公开的实施例,上述微流控芯片还包括:集成于上述电化学检测层下方的pcb电路板,该pcb电路板与电化学检测层的检测电极之间电性连接。
本公开的第二个方面提供了一种如上所述的用于生化需氧量电化学检测的微流控芯片。上述制作方法包括:制作流道层,上述流道层内设置有生化反应区、微流道、进样区和出样区,上述生化反应区具有三维结构阵列形式的内表面,上述内表面固定用于代谢有机物的微生物,上述微流道包括第一微流道和第二微流道,上述进样区通过上述第一微流道与上述生化反应区的一侧连通,上述出样区通过上述第二微流道与上述生化反应区的另一侧连通;制作电化学检测层,上述电化学检测层包括:与上述生化反应区的位置对应的检测电极;以及在上述流道层下方集成电化学检测层,以在上述电化学检测层与上述生化反应区之间形成容置空间,该容置空间用于盛放缓冲液或待测样品溶液。
根据本公开的实施例,上述制作方法还包括:在上述电化学检测层下方集成pcb电路板,该pcb电路板与上述电化学检测层的检测电极之间电性连接。
根据本公开的实施例,上述制作流道层包括:在干净的硅基底上形成图形化掩膜,上述图形化掩膜的图案用于暴露出待形成第一三维结构阵列中的三维结构的位置;对上述待形成第一三维结构阵列中的三维结构的位置进行各向异性湿法腐蚀,以在上述硅基底上形成具有第一三维结构阵列的表面;去除上述具有第一三维结构阵列的表面上的图形化掩膜;基于光刻工艺在上述硅基底的第一三维结构阵列之外的区域刻蚀预设深度,以形成微流道的倒模结构;在形成微流道的倒模结构的硅基底的上表面生长不粘涂层和在下表面粘合玻璃片,得到模具;基于注塑成型方法在上述模具上形成与该硅基底的表面互补的pdms结构,上述pdms结构上形成第二三维结构阵列和微流道,该第二三维结构阵列为生化反应区表面的三维结构阵列;在上述pdms结构的第二三维结构阵列之外的区域形成连通上述pdms结构的上表面和微流道的通孔,上述通孔包括:进样区和出样区,得到流道层。
根据本公开的实施例,上述制作方法还包括:采用化学交联法在上述三维结构阵列形式的内表面固定用于代谢有机物的微生物,以形成用于生化信号转换的微生物三维敏感表面。其中,上述采用化学交联法在上述三维结构阵列形式的内表面固定用于代谢有机物的微生物,包括:将上述流道层的下表面进行氧等离子体刻蚀处理,上述流道层为pdms层;采用edc和nhs活化上述pdms层的生化反应区的表面;以及将微生物溶液滴入上述pdms层的生化反应区,静置预设时长,实现微生物与pdms的交联固定。
根据本公开的实施例,上述制作电化学检测层包括:在干净的玻璃基底上基于光刻工艺形成预备工作电极及其引线和焊点,该预备工作电极呈圆形;在形成有预备工作电极及其引线和焊点的基底上,基于光刻工艺形成参比电极及其引线和焊点,和对电极及其引线和焊点,上述参比电极和上述对电极呈弧形并间隔环绕于预备工作电极的外围;在形成有预备工作电极及其引线和焊点、参比电极及其引线和焊点和对电极及其引线和焊点的基底上形成绝缘层;以及基于光刻工艺将上述绝缘层进行处理,以暴露出预备工作电极的部分区域,该部分区域为呈超微电极阵列形式的工作电极,该超微电极阵列中的超微电极单元为超微圆环形电极,同时还暴露出参比电极和对电极,以及预备工作电极、参比电极和对电极这三个电极各自的对应焊点,连接于这三个电极和对应焊点之间的引线被绝缘层所覆盖,从而得到电化学检测层。该电化学检测层中,起到检测功能的为检测电极,该检测电极指的是工作电极、参比电极和对电极。检测电极暴露于检测层主体表面,该检测层主体的表面还暴露有焊点,检测电极和焊点的周围分布有绝缘层,检测电极和焊点通过被绝缘层遮挡的引线连接。
根据本公开的实施例,上述制作方法还包括:将pcb电路板(下层)、电化学检测层(中间层)和流道层(上层)进行集成。具体包括:对制备好的电化学检测层进行划片,并用ab胶固定于pcb电路板之上,电化学检测层的电极引出的焊点与pcb电路板上的导电点进行压焊和ab胶封装,完成电化学检测层和pcb电路板的连接。将集成后的pcb电路板和电化学检测层进行清洗,烘干,用氧等离子体清洗流道层预设时间(例如20s),使其表面产生硅羟基基团;将清洗后的流道层与电化学检测层对准,轻轻按压,使二者紧密结合,实现pcb电路板、电化学检测层和流道层的集成。
本公开的第三个方面还提供了一种基于上述微流控芯片测试生化需氧量的方法。上述方法包括:通过在流道层内注入用于空白对照的缓冲液,使得上述缓冲液通过第一微流道进入至容置空间,由检测电极测试得到第一溶解氧浓度;在流道层内注入待测样品溶液,使得上述待测样品溶液充满容置空间,经过预设时长之后,由上述检测电极测试得到第二溶解氧浓度;计算上述第二溶解氧浓度和上述第一溶解氧浓度的差值,该差值用于表征待测样品溶液的生化需氧量。
本公开的第四个方面还提供了一种用于生化需氧量检测的装置。该装置包括如上所述的微流控芯片;注射泵,与微流控芯片的进样区连接,用于向流道层内注入用于空白对照的缓冲液,或注入待测样品溶液;以及分析检测仪,与pcb电路板电性连接,用于通过pcb板向检测电极施加电压并测定电流,实现溶解氧的检测,进而实现生化需氧量的检测。
(三)有益效果
从上述技术方案可以看出,本公开提供的微流控芯片及其制作方法、测试生化需氧量的方法及装置,具有以下有益效果:
(1)该微流控芯片将生化反应区、电化学检测层、进出样区和微流道集成于一块微型芯片中,实现了生化需氧量传感检测的微型化和集成化。
(2)该微流控芯片流道层的生化反应区具有三维结构阵列形式的内表面,可以提高微生物固定效率和固定稳定性,从而提高生化信号转换效率。
(3)该微流控芯片流道层的生化反应区中,在三维结构阵列形式的内表面通过化学交联法固定微生物,实现了微生物的牢固固定,无需再使用半透膜或包埋物质等,有效降低了物质的传质阻力,提高了传质速率,有利于生化需氧量的快速检测。
(4)该微流控芯片的电化学检测层中,工作电极设置为超微电极阵列,使得工作电极既具有超微电极的非线性扩散特性,又具有足够大的输出信号,提高了检测的灵敏度和抗干扰能力。
(5)该微流控芯片可以采用微加工工艺制备,能够实现批量化制备,制备的芯片一致性较好。
附图说明
图1a为根据本公开一实施例所示的微流控芯片的结构示意图。
图1b为根据本公开另一实施例所示的微流控芯片的结构示意图。
图2为根据本公开一实施例所示的流道层从斜上方观察的结构示意图。
图3为根据本公开一实施例所示的流道层从底部观察的结构示意图。
图4为图3所示的流道层沿着a-a线剖开之后自上而下观察的结构示意图。
图5为根据本公开一实施例所示的电化学检测层的结构示意图。
图6为根据本公开一实施例所示的微流控芯片的流程图。
图7为根据本公开一实施例所示的制作流道层的详细制作过程示意图。
图8为根据本公开实施例中用于形成微流道的倒模结构的图形化掩膜的俯视图。
图9为根据本公开一实施例所示的电化学检测层的详细制作过程示意图。
图10为根据本公开实施例得到的图形化的预备工作电极及其引线和焊点的俯视图。
图11为根据本公开实施例得到的参比电极及其引线和焊点,和对电极及其引线和焊点的俯视图。
图12为根据本公开实施例得到的图形化的光刻胶的曝光区域的俯视图。
图13为根据本公开一实施例所示的基于微流控芯片测试生化需氧量的方法的流程图。
图14为根据本公开一实施例所示的用于生化需氧量检测的装置的结构框图。
【符号说明】
1-微流控芯片;
11-流道层;
111-流道层主体;110-容置空间;
1111-生化反应区;1112-三维结构阵列;
112-微流道;
1121-第一微流道;1122-第二微流道;
113-进样区;114-出样区;
301-用于制作流道层的倒模结构的基底;
302-用于形成第一三维结构阵列的图形化掩膜;
303-第一三维结构阵列;
304-用于形成微流道的倒模结构的图形化掩膜;
3041-生化反应区图形掩膜部分;
3042-第一微流道图形掩膜部分;
3043-第二微流道图形掩膜部分;
305-被刻蚀区域;
306-凸起结构;
307-平台;
308-不粘涂层;
309-玻璃片;
310-pdms结构;
12-电化学检测层;
120-检测层主体;401-用于制作电化学检测层的基底;
402-用于形成预备工作电极及其引线和焊点的图形化光刻胶;
121-检测电极;
1211-工作电极;
1212-参比电极;
1213-对电极;
403’-沉积的预备工作电极;
403-图形化的预备工作电极及其引线和焊点;
403a-预备工作电极;
403b-预备工作电极引线;
403c-预备工作电极焊点;
404-图形化的参比电极及其引线和焊点;
404a-参比电极;
404b-参比电极引线;
404c-参比电极焊点;
405-图形化的对电极及其引线和焊点;
405a-对电极;
405b-对电极引线;
405c-对电极焊点;
406-绝缘层;
407a-保留下的图形化的光刻胶;
407b-光刻胶的曝光区域;
4071b-超微电极阵列图案光刻胶部分;
4072b-工作电极焊点图案光刻胶部分;
4073b-参比电极图案光刻胶部分;
4074b-参比电极焊点图案光刻胶部分;
4075b-对电极图案光刻胶部分;
4076b-对电极焊点图案光刻胶部分;
13-pcb电路板;
500-生化需氧量检测的装置;
501-微流控芯片;
502-注射泵;
503-分析检测仪。
具体实施方式
本公开的实施例提供了一种用于生化需氧量电化学检测的微流控芯片及其制作方法,还提供一种基于微流控芯片测试样品生化需氧量的方法,还提供一种用于生化需氧量检测的装置,该微流控芯片将生化反应区、电化学检测层、进出样区和微流道集成于一块微型芯片中,实现了生化需氧量传感检测的微型化和集成化,同时该微流控芯片流道层的生化反应区具有三维结构阵列形式的内表面,可以提高微生物固定效率和固定稳定性,从而提高信号转换效率。
为使本公开的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本公开进一步详细说明。
本公开的第一个示例性实施例提供了一种用于生化需氧量电化学检测的微流控芯片。
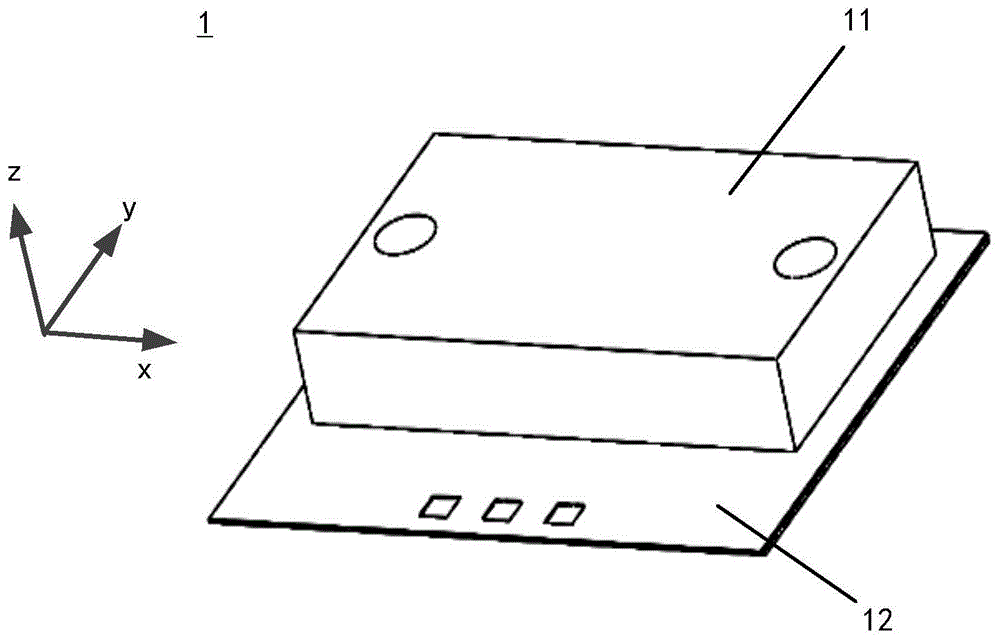
图1a为根据本公开一实施例所示的微流控芯片的结构示意图。图2为根据本公开一实施例所示的流道层从斜上方观察的结构示意图。图3为根据本公开一实施例所示的流道层从底部观察的结构示意图。图4为图3所示的流道层沿着a-a线剖开之后自上而下观察的结构示意图。图4中以斜线示意了剖面线。图2主要展示整体的流道层结构,其内部结构以虚线示意,后续在图3和图4中对图2的内部结构进行了详细示意。
参照图1a所示,本公开的实施例提供的微流控芯片1包括:流道层11,以及集成于流道层11下方的电化学检测层12。
图1b为根据本公开另一实施例所示的微流控芯片的结构示意图。
根据本公开的实施例,参照图1b所示,上述微流控芯片1除了集成有流道层11和电化学检测层12之外,还包括:集成于上述电化学检测层12下方的pcb电路板13。
参照图2~图4所示,流道层11内设置有生化反应区1111、微流道112、进样区113和出样区114。生化反应区1111具有三维结构阵列1112形式的内表面,该内表面固定有用于代谢有机物的微生物,微流道112包括第一微流道1121和第二微流道1122,进样区113通过第一微流道1121与生化反应区1111的一侧连通,出样区114通过第二微流道1122与生化反应区1111的另一侧连通。
结合图2~图4所示,上述流道层11包括流道层主体111,该流道层主体111的内部具有容置空间110,该容置空间110的顶部为生化反应区1111。该流道层主体111内设置有与容置空间110连通的微流道112;该流道层主体111上设置有用于连通微流道112与外部的进样区113和出样区114。上述容置空间110用于盛放缓冲液或待测样品溶液。
在一实施例中,参照图4所示,在流道层主体111的容置空间110的顶壁为呈圆形的生化反应区1111,该生化反应区1111的表面设置有三维结构阵列1112。三维结构阵列1112整体呈圆形或矩形。三维结构阵列1112可以分布于生化反应区1111的全部区域或部分区域。微流道112作为连通上述容置空间110和进、出样区的通道,其中,第一微流道1121连通进样区113和容置空间110顶部的生化反应区1111,第二微流道1122连通出样区114和容置空间110顶部的生化反应区1111。
参照图5所示,上述检测电极121为三电极体系,包括:工作电极1211、参比电极1212和对电极1213。在一示例性实施例中,上述工作电极1211为超微电极阵列,该阵列中的每个超微电极单元为超微圆环形电极。在一示例性实施例中,超微电极阵列整体排布为圆形或多边形,例如为六角形。在超微电极阵列形式的工作电极1211的外围间隔设置有呈弧形的参比电极1212和对电极1213。上述参比电极1212和上述对电极1213呈弧形并间隔环绕于所述超微电极阵列的外围。在一实例中,对电极1213的弧长大于参比电极1212的弧长,对电极1213的弧长与参比电极1212的弧长之和小于圆周总长,即在对电极1213与参比电极1212之间还留有未闭合的空隙,该空隙用于制作工作电极1211的引线,工作电极1211通过上述引线延伸至外部的焊点,在流道层11与电化学检测层12之间键合之后,焊点会暴露在外部,以便于后续与pcb电路板进行电性连接的操作。
超微电极(ultramicro-electrode,ume)是指在某一维度达到微米或纳米尺度的电极。
pcb电路板13与电化学检测层12的检测电极121的三个电极电性连接。在进行生化需氧量的检测时,可以通过pcb板与外部的分析检测仪进行连接,分析检测仪可以通过pcb板向检测电极施加电压并测定电流,实现生化需氧量的检测。具体而言,电性连接的方式为:pcb电路板13与电化学检测层12的外部的焊点进行电性连接。
图5为根据本公开一实施例所示的电化学检测层的结构示意图。
在本公开的一实施例中,参照图5所示,电化学检测层12包括:检测层主体120,以及设置于检测层主体120上的检测电极121。该检测电极121的设置位置与生化反应区1111的位置相对应。该检测层主体120为承载检测电极121的部分,检测层主体包括位于检测电极121周围的绝缘层,检测层主体120的表面还暴露有焊点,参照图5中的小方格所示。检测电极121和焊点的周围分布有绝缘层,检测电极和焊点通过引线连接,图5中引线被绝缘层所遮挡,因此看不到引线。
参照图4和图5所示,流道层11与电化学检测层12之间通过流道层主体111和检测层主体120进行键合,实现下方的电化学检测层12与上方的流道层11之间的封装。在一实施例中,检测电极121设置于生化反应区1111的正下方。结合图2~图5所示,电化学检测层12与生化反应区1111之间的中空区域即为上述容置空间110。即,上述容置空间110的顶部为生化反应区1111,容置空间110的底部为检测电极121。
该微流控芯片不使用时,向上述容置空间110中注入缓冲液,使得缓冲液充满容置空间110和微流道112,以保持微流控芯片1中固定于生化反应区的微生物的生物活性。在该微流控芯片1用于生化需氧量检测时,将待测样品溶液和用于空白对照的缓冲液分别注入至上述容置空间110中。
生化反应区1111用于实现生化信号转换过程,即通过微生物的代谢,将样品中的可代谢有机污染物的量转换为水中溶解氧浓度的变化。在进行生化需氧量检测时,待测样品溶液与容置空间110顶部的固定有微生物的生化反应区1111进行反应,固定于上述容置空间110顶部的生化反应区1111表面的微生物代谢待测样品溶液中的有机物,代谢反应产生的溶解氧浓度的变化由容置空间110底部的检测电极121进行检测。
为了实现生化信号的高效转换,大量微生物被固定于生化反应区。本公开的实施例提供了一种具有三维结构阵列形式的内表面的生化反应区1111。三维结构的表面积较平面结构大大增加,增大了微生物固定的有效面积;同时三维结构增加了表面粗糙度,有利于提高微生物固定的稳定性。由于该微流控芯片流道层的生化反应区的内表面是具有三维结构阵列形式的内表面,因此可以提高微生物固定效率和固定稳定性,从而提高信号转换效率。
在一实施例中,上述三维结构阵列包括棱锥阵列。例如在一具体实例中,三维结构为四棱锥结构,四棱锥的边长介于80μm~120μm,例如为100μm,各四棱锥横竖对齐排列,并保持15μm~25μm的间距,例如间距为20μm。在一实例中三维结构呈四棱锥,且该四棱锥侧视图底角的度数为54.74°。
根据本公开的实施例,上述三维结构阵列的内表面通过化学交联法固定有用于代谢有机物的微生物,以形成用于生化信号转换的微生物三维敏感表面。在不进行检测的状态下,上述微流道和容置空间内充满缓冲液,以保持微生物的活性。在用于生化需氧量的测试时,在上述微流道和容置空间内充满待测样品溶液或用于空白对照的缓冲液。
例如,在上述生化反应区的具有四棱锥结构的三维表面通过化学交联法固定代谢有机物能力强、无毒、分布广泛的枯草芽孢杆菌,形成三维的微生物敏感表面,用于生化信号的转换。
在相关技术中采用的实现生化需氧量电化学检测的传感器芯片中,采用包埋法固定微生物,有机物和溶解氧的传质阻力较大,增加了有机物的传质阻力;采用pe-pp膜,增大了溶解氧的传质阻力,因此不利于生化需氧量的快速检测。本公开的实施例提供的微流控芯片中,流道层的生化反应区的三维结构阵列形式的内表面通过化学交联法固定微生物,实现了微生物的牢固固定,无需再使用半透膜或包埋物质等,有效降低了物质的传质阻力,提高了传质速率,有利于生化需氧量的快速检测。
相关技术中,有的微流道芯片适用的检测方法是光学检测方法,存在光学检测设备不易集成化、设备成本高等问题,不利于检测系统的集成化和微型化。本公开的实施例提供的微流控芯片中,电化学检测层的工作电极设置为超微电极阵列,使得工作电极既具有超微电极的非线性扩散特性,又具有足够大的输出信号,提高了检测的灵敏度和抗干扰能力,同时还实现了整体芯片结构的集成化和微型化。
在本公开的实施例中,为确保经微生物代谢反应之后的化学信号,即溶解氧浓度变化,能够被检测电极121检测到,因此设置生化反应区的半径大于检测电极(三电极体系)的半径,以保证溶解氧浓度的变化能够被工作电极感知。
在一实例中,生化反应区1111为圆形,其半径为3600μm,对应容置空间110呈空心圆柱体。生化反应区1111两侧的微流道112(包括第一微流道1121和第二微流道1122)用于样品进出,这里设置第一微流道1121和第二微流道1122为对称结构,二者的宽度(沿着y方向)均为400μm,深度(沿着z方向)为150μm,长度(沿着x方向)为5mm。两端的进样区113和出样区114均为空心柱体结构,二者的直径均为600μm。该流道层11的外部呈长方体,沿着x方向和y方向的长×宽尺寸为25mm×12.5mm。
电化学检测层12用于实现水中溶解氧的电化学检测。电化学检测层集成了三电极体系形式的检测电极121。检测电极121和上层的流道层11中的生化反应区1111的位置相对应。在一实例中,工作电极为金(au)超微圆环形电极阵列,单个圆环宽度设计为10μm,半径均值设计为25μm,单个圆环的面积为0.00157mm2。工作电极中超微圆环形电极之间的间距:工作电极半径均值=10∶1。超微圆环形电极阵列呈六角形(多边形的一种示例)形式排列,总面积为0.2mm2,共有圆环电极127个。对电极和参比电极均为铂电极,围绕着工作电极。对电极内径2.0mm,外径2.8mm,环绕角度210°。对电极总面积7.0mm2,满足远大于工作电极面积的要求。参比电极内径2.0mm,外径2.8mm,环绕角度90°。参比电极总面积3.0mm2。为配合芯片流道层11的尺寸,电化学检测层12的长×宽尺寸为27mm×16mm。
本公开的第二个示例性实施例提供了一种微流控芯片。
图6为根据本公开一实施例所示的微流控芯片的流程图。
参照图6中实线框所示,本公开实施例提供的微流控芯片制作方法包括以下操作:s21、s22、s23。
在操作s21,制作流道层,上述流道层内设置有生化反应区、微流道、进样区和出样区,上述生化反应区具有三维结构阵列形式的内表面,上述微流道包括第一微流道和第二微流道,上述进样区通过上述第一微流道与上述生化反应区的一侧连通,上述出样区通过上述第二微流道与上述生化反应区的另一侧连通。
在操作s22,制作电化学检测层,上述电化学检测层包括:与上述生化反应区的位置对应的检测电极,还包括与检测电极连接的检测电极引线和检测电极焊点。
在操作s23,在上述流道层下方集成电化学检测层,以在上述电化学检测层与上述生化反应区之间形成容置空间,该容置空间用于盛放缓冲液或待测样品溶液。
基于上述操作s21~s23,可以制备得到第一实施例中图1a所示意的微流控芯片1的结构,该微流控芯片1包括:流道层11,以及集成于流道层11下方的电化学检测层12。
根据本公开的实施例,参照图6中虚线框所示,上述制作方法除了包括上述操作s21~s23之外,还可以包括操作s24:在上述电化学检测层下方集成pcb电路板。
该pcb电路板13与电化学检测层12的检测电极121中的三个电极通过焊点电性连接。
基于上述操作s21~s24制备得到的微流控芯片1的结构可以参照图1b所示,该pcb电路板13与电化学检测层12的检测电极121的三个电极电性连接。
根据本公开的实施例,上述制作方法还包括:将pcb电路板(下层)、电化学检测层(中间层)和流道层(上层)进行集成。具体包括:对制备好电化学检测层进行划片,并用ab胶固定于pcb电路板之上,电化学检测层的电极引出的焊点与pcb电路板上的导电点进行压焊和ab胶封装,完成电化学检测层和pcb电路板的连接。将集成后的pcb电路板和电化学检测层进行清洗,烘干,用氧等离子体清洗流道层预设时间(例如20s),使其表面产生硅羟基基团;将清洗后的流道层与电化学检测层对准,轻轻按压,使二者紧密结合,实现pcb电路板、电化学检测层和流道层的集成。
图7为根据本公开一实施例所示的制作流道层的详细制作过程示意图。
根据本公开的实施例,参照图7所示,上述制作流道层的操作s21包括以下子操作:s211~s216。
在子操作s211,准备基底301,如图7中(a)所示。本实施例中,基底采用硅基底,该子操作s211包括:清洗硅基底。例如选用500μm厚度的3寸硅片((100)晶向)。按照标准清洗工艺,对硅片进行清洗。
在子操作s212,制作生化反应区的倒模结构,以得到包含生化反应区图案结构的硅基底。
在干净的硅基底301上形成图形化掩膜302,如图7中(b)所示,上述图形化掩膜的图案用于暴露出待形成第一三维结构阵列中的三维结构的位置。在一实施例中,上述图形化掩膜为硬掩膜,例如硬掩膜的材料为si3n4。例如通过低压化学气相沉积(lowpressurechemicalvapordeposition,lpcvd)生长
基于图形化掩膜302对上述待形成第一三维结构阵列中的三维结构的位置进行各向异性湿法腐蚀,如图7中(c)所示,以在上述硅基底301上形成具有第一三维结构阵列303的表面。例如,配制浓度为33wt%(质量分数)的koh溶液,水浴85℃下放入硅片,控制时间(30~90分钟)进行各向异性湿法腐蚀。
去除上述具有第一三维结构阵列303的表面上的图形化掩膜302,如图7中(d)所示。例如采用等离子体刻蚀的方法刻蚀掉剩余的氮化硅掩膜,由此,得到包含生化反应区的倒模结构的硅基底,基于该生化反应区的倒模结构,后续可以形成与之互补的形状作为三维结构阵列。
在子操作s213,制作微流道的倒模结构。
基于光刻工艺在上述硅基底的第一三维结构阵列之外的区域刻蚀预设深度,以形成微流道的倒模结构,即该微流道的倒模结构中,要形成微流道的位置为实体的结构,微流道位置之外的结构为空心结构,例如图7中(e)示例的通过在具有第一三维结构阵列303的表面的硅基底301之上形成另一图形化掩膜304,这里的图形化掩膜304为光刻胶。
图8为根据本公开实施例中用于形成微流道的倒模结构的图形化掩膜的俯视图。例如在一实施例中,参照图8所示,图形化掩膜304包括:生化反应区图形掩膜部分3041,第一微流道图形掩膜部分3042和第二微流道图形掩膜部分3043,本实施例中的图形化掩膜304下方的部分用于被保留,掩膜之外的区域被刻蚀,从而形成微流道的倒模结构。
例如通过甩正胶az4620,经前烘、曝光、显影、后烘等在包含生化反应区图案结构的硅基底的表面套刻出微流道的图形;接着基于上述图形化掩膜304深刻蚀出微流道的倒模结构,刻蚀深度为150μm,最后将刻蚀完成的硅片浸泡于丙酮溶液中,进行剥离(lift-off),去除光刻胶,形成微流道的倒模结构,用去离子水反复清洗,并在80℃烘箱中烘干。即,在硅基底301中形成相对于被刻蚀后的平台307向上突出的具有第一三维结构阵列303的表面的凸起结构306(对应于微流道位置的实体区域,作为倒模),被刻蚀区域为305(对应于微流道位置之外的空心结构),如图7中(f)所示。
在子操作s214,在形成微流道的倒模结构的硅基底的上表面生长不粘涂层和在下表面粘合玻璃片,得到模具。
上述子操作可以分为两个步骤单独实施。例如先在形成微流道的硅基底301的上表面生长不粘涂层308,如图7中(g)所示,然后在硅基底301的下表面粘合玻璃片309,如图7中(h)所示。例如,在形成微流道的硅基底表面生长200nm厚的聚四氟乙烯,作为不粘图层;使用pdms将干净的3寸玻璃片粘附在硅基底(硅片)背面,并在80℃烘箱中烘干。
在操作s215,基于注塑成型方法在上述模具上形成与该硅基底的表面互补的pdms结构,上述pdms结构的与第一三维结构阵列对应的位置形成第二三维结构阵列。该第二三维结构阵列形成后续流道层的生化反应区表面的三维结构阵列。上述pdms结构的与微流道的倒模结构对应的位置形成微流道。
例如,先配制pdms混合剂:将pdms的两种成分(固化剂和树脂)按质量比10∶1进行充分混合,在真空环境中除气。然后,在水平实验台上,把模具放置于一次性培养皿中,将除气后的pdms缓慢浇铸到模具表面,达到想要的厚度(1-2mm)。在浇铸的过程中,会产生气泡,则需要再一次除气,并静置30min。接着,待硅片表面没有气泡时,将浇铸好的pdms的培养皿放置于70℃烘箱中三个小时,使其固化成型,得到固化成型的pdms结构310如图7中(i)所示。在此过程中,需保证培养皿处于水平,否则会导致pdms厚度不均匀。最后,使用洁净的手术刀片将固化成型的pdms从硅模具上取下,脱模后的pdms结构310沿着中轴线得到的剖视结构图如图7中(j)所示,其中采用斜线示意剖面线,结合图8和图7中(j)所示,在生化反应区图形掩膜部分3041所对应的pdms模具为空心部分,形成容置空间110,该容置空间110的顶部为生化反应区1111,生化反应区1111的内表面为三维结构阵列1112。在第一微流道图形掩膜部分3042和第二微流道图形掩膜部分3043所对应的pdms模具为空心部分,形成第一微流道1121和第二微流道1122。
接着,在操作s216,在上述pdms结构上形成连通微流道与外部的进样区和出样区。
例如,参照图7中(k)所示,按照位置标记线对pdms结构310进行切割,使用平头空心针在流体进出口处制作进样区113和出样区114,该pdms结构整体为流道层主体111,流道层主体111的内部制作有生化反应区1111和微流道112,该流道层主体111上设置有用于连通微流道112与外部的进样区113和出样区114,从而实现流道层11的制作。上述容置空间110用于盛放缓冲液或待测样品溶液。在流道层主体111的容置空间110的顶壁为呈圆形的生化反应区1111,该生化反应区1111的表面设置有三维结构阵列1112。三维结构阵列外围的形状可以是圆形或者是矩形(包括正方形)。微流道112作为连通上述容置空间和进、出样区的通道。在脱模和打孔时会产生pdms的碎屑,需要对pdms结构进行丙酮、乙醇清洗。
根据本公开的实施例上述制作方法还包括以下操作s25:采用化学交联法在上述三维结构阵列形式的内表面固定用于代谢有机物的微生物,以形成用于生化信号转换的微生物三维敏感表面。该操作s25可以在操作s21之后执行,并在操作s23之前执行,操作s25与操作s22的执行顺序不限定。
其中,上述采用化学交联法在上述三维结构阵列形式的内表面固定用于代谢有机物的微生物,包括:将上述流道层的下表面进行氧等离子体刻蚀处理,上述流道层为pdms层;采用edc和nhs活化上述pdms层的生化反应区的表面;以及将微生物溶液(例如微生物溶液的浓度为6×107cfu/ml~6×109cfu/ml)滴入上述pdms层的生化反应区,静置预设时长(2h~12h),实现微生物与pdms的交联固定。
图9为根据本公开一实施例所示的电化学检测层的详细制作过程示意图。
根据本公开的实施例,上述制作电化学检测层的操作s22包括以下子操作:s221~s224。
在子操作s221,在干净的基底上基于光刻工艺形成预备工作电极及其引线和焊点。
在子操作s222,在上述形成有预备工作电极及其引线和焊点的基底上,基于光刻工艺形成参比电极及其引线和焊点,和对电极及其引线和焊点。
在子操作s223,在形成有预备工作电极及其引线和焊点、参比电极及其引线和焊点、和对电极及其引线和焊点的基底上形成绝缘层。
在子操作s224,基于光刻工艺将上述绝缘层进行处理,以暴露出部分预备工作电极作为工作电极,暴露出参比电极、对电极以及各个电极的对应焊点,得到电化学检测层。
在一具体实例中,先准备基底401。例如,选择3寸玻璃片,采用标准微电子工艺清洗玻璃片,参照图9中(a)所示。
然后进行光刻步骤:旋涂正胶az1500,经前烘、曝光、显影、后烘等步骤,将掩膜板的图形转移到基底401表面的光刻胶上,然后采用氧等离子体刻蚀工艺清洗未被光刻胶保护的基底表面,去除显影残留的光刻胶,得到图形化光刻胶402,参照图9中(b)所示。
接着进行生长步骤,采用磁控溅射工艺在图形化光刻胶402上沉积钽/金复合层,例如为ta
然后进行剥离步骤,将图9中(c)中的带有沉积的预备工作电极403’的基底401浸泡于丙酮溶液中,剥离掉光刻胶以形成图形化的预备工作电极及其引线和焊点403,如图9中(d)所示。然后烘干并采用氧等离子体刻蚀工艺清洁表面,以除去残留的光刻胶。
图10为根据本公开实施例得到的图形化的预备工作电极及其引线和焊点的俯视图。
参照图10所示,通过光刻工艺,在基底401上形成了图形化的预备工作电极及其引线和焊点403,该图形化的预备工作电极及其引线和焊点403包括依次连接的预备工作电极403a、预备工作电极引线403b以及预备工作电极焊点403c。示例性的,预备工作电极403a呈圆形,预备工作电极引线403b呈延伸的细线形式,预备工作电极焊点403c呈矩形,参照图10所示。该过程中描述的预备工作电极403a与后续得到的微流控芯片中的工作电极(在图5中示意的1211)不是同一个,本操作步骤中形成的预备工作电极在后续需要沉积绝缘层、并刻蚀掉图形化的绝缘层后使得预备工作电极发的部分区域被暴露出来,得到具有超微电极阵列形式的工作电极。本步骤中的预备工作电极引线403b后续被绝缘层遮挡,本步骤中的预备工作电极焊点403c后续经过沉积绝缘层、并刻蚀掉图形化绝缘层后被暴露出来,用作pcb电路板与工作电极进行电性连接的焊点。
接着重复上述光刻和生长步骤,将生长步骤中采用磁控溅射au(金)改成磁控溅射pt(铂)。重复剥离步骤得到图形化的参比电极及其引线和焊点404和图形化的对电极及其引线和焊点405,如图9中(e)所示。
图11为根据本公开实施例得到的参比电极及其引线和焊点和对电极及其引线和焊点的俯视图。
参照图11所示,通过光刻工艺,在基底401上形成了图形化的参比电极及其引线和焊点404和图形化的对电极及其引线和焊点405,该图形化的参比电极及其引线和焊点404包括依次连接的参比电极404a、参比电极引线404b以及参比电极焊点404c。该图形化的对电极及其引线和焊点405包括依次连接的对电极405a、对电极引线405b和对电极焊点405c。上述参比电极404a和对电极405a均为弧形,相互间隔设置,参比电极404a和对电极405a用于环绕于预备工作电极403a的外围,参比电极404a和对电极405a对应同一个圆周且参比电极404a和对电极405a的总弧长小于该圆周的周长,以预留出参比电极404a和对电极405a之间的空隙来放置预备工作电极引线403b,该预备工作电极引线403b也作为后续形成的工作电极的引线。
接着进行绝缘层的制备:采用等离子体增强化学气相沉积(pecvd)工艺沉积1μm厚度的氮化硅sinx,用作超微电极阵列单元之间以及工作电极与对电极和参比电极之间的绝缘层406,如图9中(f)所示。
之后进行另一光刻步骤:在正面套刻出超微圆环形电极阵列、参比电极、对电极和三个电极的焊点的图形,显影后的光刻胶用作反应离子刻蚀的掩膜,得到另一图形化的光刻胶407a,具体细节可以参照前述光刻步骤。
之后进行刻蚀步骤:采用三氟甲烷(chf3)等离子体反应离子刻蚀(rie)加工氮化硅(sinx)绝缘层,以暴露出金(au)超微圆环形电极阵列形式的工作电极,以及对电极和参比电极,结构可以参照图9中(g)所示的结构上带有另一图形化光刻胶407a的形式。
图12为根据本公开实施例得到的图形化的光刻胶的曝光区域的示意图,这里采用附图标记407b来示意光刻胶的曝光区域,该曝光区域407b后续被去除,前述图9中(g)所示的图形化的光刻胶407a为去除曝光区域407b之后保留下来的光刻胶部分。
参照图12所示,一种示例性的图形化的光刻胶的曝光区域407b包括:超微电极阵列图案光刻胶部分4071b、工作电极焊点图案光刻胶部分4072b、参比电极图案光刻胶部分4073b、参比电极焊点图案光刻胶部分4074b、对电极图案光刻胶部分4075b和对电极焊点图案光刻胶部分4076b。光刻胶经曝光、显影后,图12示意的图形化的光刻胶的曝光区域407b溶解,溶解位置对应下方的绝缘层经刻蚀后,暴露出预备工作电极403a中对应于超微电极阵列图案光刻胶部分4071b下方的区域,暴露出来的即为最终得到微流控芯片中的工作电极,其他区域的预备工作电极403a被绝缘层所遮挡,不作为最终得到的微流控芯片的用于检测的工作电极,还暴露出呈弧形的参比电极404a、呈弧形的对电极405a以及三个电极的焊点:工作电极焊点403c、参比电极焊点404c和对电极焊点405c。
最后进行去胶清洗步骤:将玻璃片浸泡于丙酮溶液中,去除光刻胶,并用氧等离子体刻蚀去除残余光刻胶,参照图9中(h)所示。
本实施例提供的微流控芯片可以采用微加工工艺制备,能够实现批量化制备,制备的芯片一致性较好。
本公开的第三个示例性实施例还提供了一种基于上述微流控芯片测试生化需氧量的方法。
图13为根据本公开一实施例所示的基于微流控芯片测试生化需氧量的方法的流程图。
参照图13所示,本实施例的基于微流控芯片测试生化需氧量的方法,包括以下操作:s31、s32和s33。
在操作s31,通过在流道层注入用于空白对照的缓冲液,使得上述缓冲液通过第一微流道进入至容置空间,由检测电极测试得到第一溶解氧浓度。
在操作s32,在上述流道层内注入待测样品溶液,使得上述待测样品溶液充满上述容置空间,经过预设时长之后,由上述检测电极测试得到第二溶解氧浓度。
在操作s33,计算上述第二溶解氧浓度和上述第一溶解氧浓度的差值,该差值用于表征待测样品溶液的生化需氧量。
本公开的第四个示例性实施例还提供了一种用于生化需氧量检测的装置。
图14为根据本公开一实施例所示的用于生化需氧量检测的装置的结构框图。
参照图14所示,本实施例用于生化需氧量检测的装置500包括:微流控芯片501,注射泵502和分析检测仪503。其中微流控芯片501可以是第一实施例所描述的微流控芯片1。
上述注射泵502与微流控芯片501的进样区连接,用于向流道层和容置空间内注入用于空白对照的缓冲液或待测样品溶液。
上述分析检测仪503与微流控芯片501的pcb电路板电性连接,用于向该微流控芯片501施加电压并测定电流,实现溶解氧的检测,进而实现生化需氧量的检测。
综上所述,本公开的实施例提供了一种微流控芯片及其制作方法、测试生化需氧量的方法及装置,该微流控芯片将生化反应区、电化学检测层、进出样区和微流道集成于一块微型芯片中,实现了生化需氧量传感检测的微型化和集成化。该微流控芯片流道层的生化反应区具有三维结构阵列形式的内表面,可以提高微生物固定效率和固定稳定性,从而提高信号转换效率。该微流控芯片流道层的生化反应区中,在三维结构阵列形式的内表面通过化学交联法固定微生物,实现了微生物的牢固固定,无需再使用半透膜或包埋物质等,有效降低了物质的传质阻力,提高了传质速率,有利于生化需氧量的快速检测。该微流控芯片的电化学检测层的检测电极中,工作电极设置为超微电极阵列,使得工作电极既具有超微电极的非线性扩散特性,又具有足够大的输出信号,提高了检测的灵敏度和抗干扰能力。该微流控芯片可以采用微加工工艺制备,能够实现批量化制备,制备的芯片一致性较好。
需要说明的是,虽然结合附图对本公开进行了说明,但是附图中公开的实施例旨在对本公开优选实施方式进行示例性说明,而不能理解为对本公开的一种限制。附图中的尺寸比例仅仅是示意性的,并不能理解为对本公开的限制。实施例中提到的方向用语,例如“上”、“下”、“前”、“后”、“左”、“右”等,仅是参考附图的方向,并非用来限制本公开的保护范围。贯穿附图,相同的元素由相同或相近的附图标记来表示。在可能导致对本公开的理解造成混淆时,将省略常规结构或构造。
并且图中各部件的形状和尺寸不反映真实大小和比例,而仅示意本公开实施例的内容。另外,在权利要求中,不应将位于括号之间的任何参考符号构造成对权利要求的限制。
说明书与权利要求中所使用的序数例如“第一”、“第二”、“第三”等的用词,以修饰相应的元件,其本身并不意味着该元件有任何的序数,也不代表某一元件与另一元件的顺序、或是制造方法上的顺序,该些序数的使用仅用来使具有某命名的一元件得以和另一具有相同命名的元件能做出清楚区分。
再者,单词“包含”或“包括”不排除存在未列在权利要求中的元件或步骤。位于元件之前的单词“一”或“一个”不排除存在多个这样的元件。
除非存在技术障碍或矛盾,本公开的上述各种实施方式可以自由组合以形成另外的实施例,这些另外的实施例均在本公开的保护范围中。
以上所述的具体实施例,对本公开的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本公开的具体实施例而已,并不用于限制本公开,凡在本公开的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本公开的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!