一种头孢噻呋油混悬注射液的无菌检测方法与流程
1.本发明属于药物分析技术领域,具体涉及一种兽用药物制剂的无菌检测方法,尤其涉及头孢噻呋油混悬注射液的无菌检测方法。
背景技术:
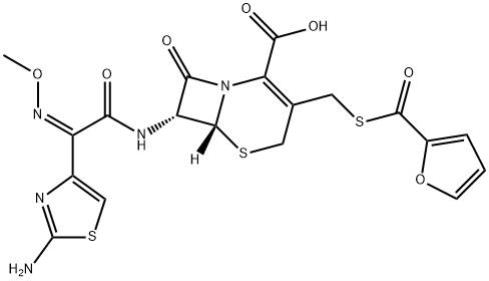
2.头孢噻呋(ceftiofur)别名赛得福,是美国于20 世纪80 年代开发成功的兽医专用的第三代头孢菌素,该药1988 年在美国首次上市,由于其优良的抗菌活性和药动学特征,已陆续被美国、加拿大、日本及欧洲一些国家正式批准用于肉牛、奶牛、马、猪、羊的呼吸道疾病的治疗。其化学名称为(6r,7r)
‑7‑
[2
‑
(2
‑
氨基噻唑
‑4‑
基)(甲氧基亚胺基)乙酰胺基]
‑3‑
[(2
‑
呋喃基羰基)硫甲基]
‑8‑
氧代
‑5‑
硫杂
‑1‑
氮杂双环[4.2.0]辛
‑2‑
烯
‑2‑
甲酸,分子式c19h17n5o7s3,分子量523.56,化学结构式见如下图。头孢噻呋具有氨基和羧基,故为两性化合物,其在强酸、强碱及高温条件下易分解,但其钠盐及盐酸盐较稳定。
[0003]
头孢噻呋是动物专用的第三代头孢菌素类抗生素,其抗菌谱广,抗菌活性强,对革兰阳性菌、革兰阴性菌及厌氧菌均有强大的抗菌活性,其中对革兰阳性菌与第一代头孢菌素比较相近或较弱,对革兰阴性菌如大肠杆菌、伤寒沙门杆菌、多杀性和溶血性巴氏杆菌、链球菌等具有强大的抗菌活性。适用于各种敏感菌引起的呼吸道、泌尿道等感染,尤其适用于防治大肠杆菌、沙门杆菌、绿脓杆菌、葡萄球菌等引起的鸡苗早期死亡,初生仔猪的剪脐带、打耳号、剪齿、剪尾等引起的伤口感染,以及嗜血性放线杆菌引起的猪传染性胸膜肺炎、猪链球菌病、猪肺疫及仔猪黄白痢等。
[0004]
将头孢噻呋与注射用油配制成混悬型注射液,具有良好的抗菌作用,被广泛用于临床应用,目前国家批准的头孢噻呋油混悬制剂主要有盐酸头孢噻呋油混悬注射液、头孢噻呋油混悬注射液和头孢噻呋晶体注射液三种。作为注射用药,按照《中华人民共和国兽药典》2015版相关要求,需要检测无菌。无菌检查法包括滤膜过滤法和直接接种法,头孢噻呋油混悬注射液属于β
‑
内酰胺类的混悬液,若采用滤膜法,头孢噻呋无法通过滤膜,所以头孢
噻呋油混悬注射液的无菌检查方法采用直接接种法,利用青霉素酶解头孢噻呋,使其失活,然后采取直接接种法进行无菌检查。目前有文件(cn201310665166.0)记载了头孢噻呋类油混悬型注射液无菌检测方法采用0.1%吐温
‑
80%的蛋白胨溶液进行前处理,这种处理方式在药物无菌检测培养14天时,观察现象不明显,无法准确判断阴性或阳性结果,需要再进行一步接菌处理,即取培养液接种于斜面培养基上,细菌培养2日,真菌培养3日,依法检查。不仅耗费人力,增加污染的风险,也延长了检测周期。针对头孢噻呋油混悬注射液,需要建立一种准确度高、操作便捷的无菌检测方法。
技术实现要素:
[0005]
基于以上存在的问题,本发明旨在提供一种头孢噻呋油混悬注射液的无菌的检测方法。该检测方法为直接接种法,操作便捷,灵敏度高,试验结果容易观察判断、实用性强。
[0006]
本发明提供的一种头孢噻呋油混悬注射液无菌检测方法是先进行预处理:将头孢噻呋摇匀后加入青霉素酶,混合均匀,制得混合液;将混合液分别加入到含吐温
‑
80的硫乙醇酸盐流体培养基和含吐温
‑
80的改良马丁培养基中,再次摇匀后进行恒温处理,得供试品溶液。将前置处理得到的供试品溶液恒温处理后直接接种于适合相应菌生长的培养基中,培养后依法检测,具体检测方法依据中国兽药典相关规定进行。该无菌检测方法对含量为5%和10%的头孢噻呋油混悬注射液效果最佳。
[0007]
本发明提供的一种头孢噻呋油混悬注射液无菌检测方法的预处理步骤包括:(1)将头孢噻呋油混悬注射液摇匀后与青霉素酶充分混匀,配制成每1mg头孢噻呋加青霉素酶≥20000单位的混合液。
[0008]
(2)取混合液加入到含2%~8%吐温
‑
80的硫乙醇酸盐流体培养基中,混合均匀,制得硫乙醇酸盐供试品溶液,所述混合液与硫乙醇酸盐流体培养基的体积比为1:5~10;另取混合液加入到含2%~8%吐温
‑
80的改良马丁培养基中,混合均匀,制得改良马丁供试品溶液,所述混合液与改良马丁培养基的体积比为1:5~10。
[0009]
(3)将硫乙醇酸盐供试品溶液和改良马丁供试品溶液恒定37℃保温1~4小时。
[0010]
优选地,预处理配置混合液时,硫乙醇酸盐流体培养基中采用含量为6%的吐温
‑
80,改良马丁培养基中也采用含量为6%的吐温
‑
80。
[0011]
优选地,步骤(2)中,配置供试品溶液时,混合液与硫乙醇酸盐流体培养基体积比为1:9,混合液与改良马丁培养基的体积比也为1:9。
[0012]
更进一步地,将30ml混合液加入到270ml硫乙醇酸盐流体培养基,混匀后制得硫乙醇酸盐供试品溶液,另将30ml混合液加入到270ml改良马丁培养基培养基中制得改良马丁供试品溶液。
[0013]
优选步骤(3)中,将硫乙醇酸盐供试品溶液和改良马丁供试品溶液恒温37℃保温1小时。
[0014]
本发明的无菌检测预处理方法适用头孢噻呋含量为5%和10%的头孢噻呋油溶混悬注射液。基于上述本发明提供的一种头孢噻呋油混悬注射液无菌检测方法的预处理,具体的头孢噻呋油混悬注射液无菌检测方法包括以下步骤:(1)将头孢噻呋油混悬注射液摇匀后与青霉素酶充分混匀,配制成每1mg头孢噻呋加青霉素酶≥20000单位的混合液。
[0015]
(2)取混合液加入到含2%~8%吐温
‑
80的硫乙醇酸盐流体培养基中,混合均匀,制得硫乙醇酸盐供试品溶液,所述混合液与硫乙醇酸盐流体培养基的体积比为1:5~10;另取混合液加入到含2%~8%吐温
‑
80的改良马丁培养基中,混合均匀,制得改良马丁供试品溶液,所述混合液与改良马丁培养基的体积比为1:5~10。
[0016]
(3)将硫乙醇酸盐供试品溶液和改良马丁供试品溶液恒定37℃保温1~4小时。
[0017]
(4)取恒温后的硫乙醇酸盐供试样品溶液和改良马丁供试样品溶液分别直接接种于适合相应菌生长的培养基中,或者是药典中注明的适宜的培养基中,培养14天;直接观察,判断是否无菌。
[0018]
一种较优选的头孢噻呋油混悬注射液无菌检测的具体步骤包括:(1)将头孢噻呋油混悬注射液摇匀后与青霉素酶充分混匀,配制成每1mg头孢噻呋加青霉素酶≥20000单位的混合液。
[0019]
(2)取混合液加入到含6%吐温
‑
80的硫乙醇酸盐流体培养基中,混合均匀,制得硫乙醇酸盐供试品溶液,所述混合液与硫乙醇酸盐流体培养基的体积比为1:9;另取混合液加入到含6%吐温
‑
80的改良马丁培养基中,混合均匀,制得改良马丁供试品溶液,其中混合液与改良马丁培养基的体积比为1:9。
[0020]
(3)将硫乙醇酸盐供试品溶液和改良马丁供试品溶液恒定37℃保温1小时。
[0021]
(4)取恒温后的硫乙醇酸盐供试样品溶液和改良马丁供试样品溶液分别直接接种于适合相应菌生长的培养基中,或者是药典中注明的适宜的培养基中,培养14天;直接观察,判断是否无菌。
[0022]
更具体的步骤为:(1)将头孢噻呋油混悬注射液摇匀后与青霉素酶充分混匀,配制成每1mg头孢噻呋加青霉素酶≥20000单位的混合液。
[0023]
(2)将30ml混合液加入到270ml含6%吐温
‑
80的硫乙醇酸盐流体培养基中,混合均匀,制得硫乙醇酸盐供试品溶液;将30ml混合液加入到270ml含6%吐温
‑
80的改良马丁培养基培养基中,混合均匀,制得改良马丁供试品溶液。
[0024]
(3)将硫乙醇酸盐供试品溶液和改良马丁供试品溶液恒定37℃保温1小时。
[0025]
(4)取恒温后的硫乙醇酸盐供试样品溶液和改良马丁供试样品溶液分别直接接种于适合相应菌生长的培养基中,或者是药典中注明的适宜的培养基中,培养14天;直接观察,判断是否无菌。
[0026]
有益效果:本发明所提供的头孢噻呋油混悬注射液的无菌检测方法,具有以下优点:1、处理方法操作方便快捷、实验结果目测即可判断。
[0027]
2、在供试品预处理方法中选择的培养基针对性好,溶解充分,青霉素酶的使用使得灭活效果更佳,有助于避免后续直接接种培养过程中的干扰。
[0028]
3、基于本发明的预处理方法的无菌检测方法,培养基培养14天后无需再次进行接种培养,即可眼观直接判断试验结果,缩短检测周期,避免二次污染的问题。
[0029]
4、本发明的检测方法专属性好,油性辅料对无菌检查无干扰。
具体实施方式
[0030]
下面将通过实施例对本发明作进一步的描述,这些描述并不是对本发明内容作进一步的限定。本领域的技术人员应理解,对本发明的技术特征所作的等同替换,或相应的改进,仍属于本发明的保护范围之内。
[0031]
实施例1头孢噻呋油混悬注射液无菌检测的方法建立(1)试验用培养基包括硫乙醇酸盐流体培养基、胰酪大豆胨液体培养基、沙氏葡萄糖液体培养基和沙氏葡萄糖琼脂等培养基。本发明实施例中所使用的各种培养基均按照中国兽药典方法配制、灭菌。试验用菌菌种均由中国药品生物制品检验所监制。
[0032]
(2)培养基无菌性检查结果上述培养基随机取出5瓶,各培养基置规定的温度下,进行14日培养,结果见下表1所示。从表中可以看出,上述空白培养基培养14天均无菌生长,符合无菌验证试验的要求。
[0033]
表1培养基无菌性检查结果(3)试验菌液的制备接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的新鲜培养物至胰酪大豆胨液体培养基或胰酪大豆胨琼脂培养斜面上,接种生孢梭菌的新鲜培养物至硫乙醇酸盐流体培养基中,30℃~35℃培养18~24小时;接种白色念珠菌的新鲜培养物至沙氏葡萄糖液体培养基或沙氏葡萄糖琼脂培养基,20℃~25℃培养24~48小时。上述培养物用ph7.0的无菌氯化钠
‑
蛋白胨缓冲液或0.9%无菌氯化钠溶液制成每1ml含菌数小于100cfu(菌落形成单位)的菌悬液。
[0034]
接种黑曲霉的新鲜培养物至沙氏葡萄糖琼脂培斜面养基,20℃~25℃培养5~7天,加入3~5ml含0.05%(ml/ml)聚山梨酯80的ph7.0无菌氯化钠
‑
蛋白胨缓冲液或0.9%的无菌氯化钠溶液,将孢子洗脱,然后采用适宜的方法吸出孢子悬液至无菌试管内,用含0.05%(ml/ml)聚山梨酯80的ph7.0无菌氯化钠
‑
蛋白胨缓冲液或0.9%的无菌氯化钠溶液制成每1ml含孢子数小于100cfu的孢子悬液。
[0035]
(4)培养基灵敏度检查取每管装量为12ml的硫乙醇酸盐流体培养基7支,分别接种金黄色葡萄球菌、铜绿假单胞菌、生孢梭菌各2支,另1支不接种作为空白对照,培养3天;取每管装量为9ml的胰酪大豆胨液体培养基7支,分别接种小于100cfu枯草芽孢杆菌、白色念珠菌、黑曲霉各2支,另1支不接种作为空白对照,培养5天,逐日观察结果,结果见下表。
[0036] 表2 培养基灵敏度检查结果
实施例2 头孢噻呋油混悬注射液的无菌检测方法及验证无菌检测处理过程中选用6%吐温
‑
80的硫乙醇酸盐流体培养基的和含6%吐温
‑
80的改良马丁培养基时,反应温度控制在37℃是在青霉素酶最佳反应活性条件范围内,培养基中加入吐温
‑
80的目的是可使油相均匀分散在缓冲液中,而青霉素酶的用量经过酶活性及青霉素酶转换数等相关计算的推论,理论上在37℃,4小时内,此添加量足以使得全量的头孢噻呋全部灭活。同时,在试验室内设计无菌检测验证方案,论证了无菌检测方法操作的的可行性。具体验证方法如下:本验证试验分为四组:第一组:供试品组。按本发明无菌检测方法,取头孢噻呋油混悬注射液适量摇匀,与青霉素酶溶液混合(每1mg头孢噻呋加青霉素酶不得少于2万单位),分别取30ml混合液加入270ml含6%吐温
‑
80的硫乙醇酸盐流体培养基和270ml 6%吐温
‑
80的改良马丁培养基中,将供试品置于37℃恒温水浴中放置1小时;取供试品溶液适量,分别依法接种于20ml硫乙醇酸盐流体培养基和20ml胰酪大豆胨液体培养基中,接种后的硫乙醇酸盐流体培养基在30℃~35℃培养14天,接种后的胰酪大豆胨液体培养基在20℃~25培养14天,进行观察,结果填入下表中。
[0037]
第二组:方法验证组。按本发明无菌检测方法,将头孢噻呋油混悬注射液摇匀后取30ml加入青霉素酶溶液适量,每1mg头孢噻呋加青霉素酶不得少于2万单位,加入270ml含6%吐温
‑
80的硫乙醇酸盐流体培养基和270ml 6%吐温
‑
80的改良马丁培养基中,将供试品置37℃恒温水浴中放置1小时;取供试品溶液适量进行无菌检测,分为ⅰ、ⅱ、ⅲ、ⅳ、
ⅴ
、
ⅵ
六组,每组平行样品为2个;ⅰ、ⅱ、ⅲ组为含20ml硫乙醇酸盐流体培养基组,ⅳ、
ⅴ
、
ⅵ
组为含20ml胰酪大豆胨液体培养基组,各组混合均匀后加入小于100cfu的不同的标准菌液,ⅰ组加入金黄色葡萄球菌;ⅱ组加入铜绿假单胞菌;ⅲ组加入生孢梭菌;ⅳ组加入枯草芽孢杆菌;
ⅴ
组加入白色念珠菌;
ⅵ
组加入黑曲霉,摇匀后,
ⅰ‑ⅲ
组在30℃~35℃培养14天,
ⅳ‑ⅵ
组在20℃~25培养14天,进行观察,结果填入下表中。
[0038]
表3头孢噻呋油混悬注射液无菌检测方法验证结果
验证试验结果表明,与对照管比较,第二组(供试品组)各管中的试验菌均生长良好。证明供试品的该检验量在该检验条件下无抑菌作用,青霉素酶的用量足以使供试品全部灭活,另外吐温
‑
80的用量可使油相均匀分散,无抑菌作用,青霉素酶及吐温
‑
80的用量是适合该供试品检验的。该无菌检测方法能够充分验证供试品的无菌检测符合规定,可照此检验法和检验条件进行供试品的无菌检测。
[0039]
实施例3 5%头孢噻呋油混悬注射液无菌检测方法对比实验试验样品:选择头孢噻呋油混悬注射液,含量规格为5%。
[0040]
试验方案:选择两种检测方式进行无菌对比检测,分别为:方法
①ꢀ
取头孢噻呋油混悬注射液适量摇匀,与青霉素酶溶液适量混匀,配成每1mg头孢噻呋加青霉素酶不得少于2万单位的混合液,分别取30ml混合液加入到270ml含6%吐温
‑
80的硫乙醇酸盐流体培养基和270ml 6%吐温
‑
80的改良马丁培养基中,将供试品置于37℃恒温水浴中放置1小时;取供试品溶液适量,分别依法对应地接种于20ml硫乙醇酸盐流体培养基和20ml胰酪大豆胨液体培养基中,接种后的硫乙醇酸盐流体培养基在30℃~35℃培养14天,接种后的胰酪大豆胨液体培养基在20℃~25培养14天,进行观察,结果填入下表中。
[0041]
方法
②ꢀ
取头孢噻呋油混悬注射液25ml,加入无菌1%吐温
‑
80与0.1%蛋白胨溶液250ml,充分振摇使分散,加入青霉素酶溶液(每1mg头孢噻呋加青霉素酶不少于20000单位),充分振摇30分钟,混匀,取混合液10ml,分别加入10ml硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基中,在相应条件下摇床培养14日,取培养液接种于斜面培养基上,培养3日,依法检查,结果应符合规定。
[0042]
表4 两种检测方法的试验结果
方法
①
方案培养14天后观察判断时硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基溶液呈现明显的阴性反应,无浑浊或其他现象干扰判断结果。方法
②
培养14天后观察判断时硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基溶液呈现浑浊状态,无法进行准确判断,继续取培养液接种于同种新鲜培养基上,培养3日,依法检查,结果判断为阴性,说明方法
②
处理过程对结果判断具有干扰性。
[0043]
实施例4 10%头孢噻呋油混悬注射液无菌检测方法对比实验试验样品:选择头孢噻呋油混悬注射液,含量规格为10%。
[0044]
试验方案:选择两种检测方式进行无菌对比检测,分别为:方法
①ꢀ
取头孢噻呋油混悬注射液适量摇匀,与青霉素酶溶液适量混匀,配成每1mg头孢噻呋加青霉素酶不得少于2万单位的混合液,分别取30ml混合液加入到270ml含6%吐温
‑
80的硫乙醇酸盐流体培养基和270ml 6%吐温
‑
80的改良马丁培养基中,将供试品置37℃恒温水浴中放置1小时;取供试品溶液适量,依法检查,进行观察。
[0045]
方法
③
取头孢噻呋油混悬注射液适量摇匀,与青霉素酶溶液适量混匀,配成每1mg头孢噻呋加青霉素酶不得少于2万单位的混合液,分别取30ml混合液加入到270ml含1%吐温
‑
80的硫乙醇酸盐流体培养基和270ml 1%吐温
‑
80的改良马丁培养基中,将供试品置37℃恒温水浴中放置1小时;依法检查,进行观察。
[0046]
方法
④ꢀ
取头孢噻呋油混悬注射液适量摇匀,与青霉素酶溶液适量混匀,配成每1mg头孢噻呋加青霉素酶不得少于2万单位的混合液,分别取30ml混合液加入270ml含6%吐温
‑
80的0.1%蛋白胨溶液,将供试品置于37℃恒温水浴中放置1小时;依法检查,进行观察。
[0047]
表5 三种检测方法的试验结果
检测方法方法
①
方法
③
方法
④
硫乙醇酸盐流体培养基阴性14天观察时,溶液呈现浑浊状态,无法进行判断,继续接种培养后判断为阴性。14天观察时,溶液呈现浑浊状态,无法进行判断,继续接种培养后判断为阴性。胰酪大豆胨液体培养基阴性14天观察时,溶液呈现浑浊状态,无法进行判断,继续接种培养后判断为阴性。14天观察时,溶液呈现浑浊状态,无法进行判断,继续接种培养后判断为阴性。
方法
①
培养14天后观察判断时,硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基溶液呈现明显的阴性反应,无浑浊或其他现象干扰判断结果。方法
③
和方法
④
培养14天后观察判断时,硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基溶液溶液呈现浑浊状态,无法进行准确判断,1%浓度的吐温
‑
80无法更好的乳化油性注射液,同时,6%吐温
‑
80的0.1%蛋白胨溶液的培养基并不适合头孢噻呋油混悬注射液的无菌检测,14天后需继续取培养液接种于斜面培养基上,培养3日,依法检查,结果判断为阴性,说明方法
③
和方法
④
处理过程对结果判断具有干扰性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1