一种基于滚环扩增产物自组装DNA水凝胶的适配体传感器及其应用
本发明涉及食品安全检测技术领域,尤其是涉及一种基于滚环扩增产物自组装dna水凝胶的适配体传感器及其应用。
背景技术:
赭曲霉毒素a(ota)是食品和农产品中最常见的危害物质之一,常存在于酒类、坚果、咖啡、谷类食品中。ota是一种由曲霉和青霉所产生的次级代谢产物,具有肾毒性、免疫毒性、致畸性和致癌性。食品中ota的常见检测方法有可视化生物传感器检测方法、荧光生物传感器检测方法、电化学生物传感器检测方法、高效液相色谱法(hplc)、表面增强拉曼散射检测(sers)等。其中,可视化检测以其最易实现肉眼检测而被认为是最有前途的现场快速检测方法之一。
dna水凝胶是一种新兴的以dna为主的三维宏观生物材料,dna水凝胶以其宏观可视化的特性而使其在可视化检测领域具有极大的优势。目前已有基于dna水凝胶的可视化检测的报道,这些检测方法多通过将dna水凝胶的化学或物理变化转化为光信号进而实现可视化检测。首先将目标物适配体序列与其他序列一并组装得到dna水凝胶,在目标物存在时,目标物会与dna水凝胶中的适配体序列结合而导致凝胶结构塌陷。然而,这种根据目标物引起的dna水凝胶结构变化而设计的生物传感器的信号变化来自于dna水凝胶降解过程中释放的信号分子中。因此,在这种检测模式下,少量目标分子只能引起dna水凝胶的微小变化,释放的信号分子变化也十分微小,从而导致较高的检测限,无法满足赭曲霉毒素a的现场快速检测。
滚环扩增技术是一种等温信号放大技术,可在恒定温度下,通过设计特定引物序列和环状模板序列,在特定dna聚合酶的作用下,对模板dna进行等温扩增,可得到由重复序列组成的长链dna产物。而这种长链dna产物可在一定条件性进行dna自组装,进而可形成滚环扩增产物自组装的dna水凝胶。可将适配体技术于滚环扩增信号放大技术相结合,通过设计滚环扩增反应模板序列,利用适配体、引物和目标物之间的竞争性结合作用,可实现在目标物存在时,才会启动滚环扩增反应,进而得到dna水凝胶。在这种检测模式下,少量目标物存在时,即可引发滚环扩增反应,进而得到滚环扩增产物自组装dna水凝胶,可实现对目标分子的高灵敏度检测。
但目前,基于滚环扩增产物dna水凝胶的可视化检测中,需要对纳米金进行dna修饰,通过修饰在纳米金表面的dna与dna水凝胶中dna之间的碱基互补配对使纳米金与dna水凝胶相结合。上述纳米金的dna修饰和纳米金表面dna与水凝胶种dna之间的结合为dna水凝胶可视化检测带来诸多不便。
技术实现要素:
针对现有技术存在的上述问题,本发明申请人提供了一种基于滚环扩增产物自组装dna水凝胶的适配体传感器及其应用。本发明通过增加滚环扩增反应锁式探针dna序列中的t碱基数量,将纳米金直接组装到dna水凝胶中,而无需对纳米金进行dna序列修饰,为实现赭曲霉毒素a的现场及快速检测提供诸多便利。
本发明的技术方案如下:
一种基于滚环扩增产物自组装dna水凝胶的适配体传感器,所述适配体传感器包括ota适配体、目标物、sh-peg功能化纳米金、引物、核酸外切酶ⅰ、锁式探针、t4dna连接酶和phi29dna聚合酶;
所述ota适配体序列如seqno.1所示;
所述引物序列如seqno.2所示;
所述锁式探针序列如seqno.3所示。
所述sh-peg功能化纳米金的制备方法为:
(1)将0.5ml1%的haucl4·4h2o水溶液加入50ml纯水中,在搅拌下加热至沸腾;
(2)向其中加入0.4ml5%的柠檬酸钠水溶液,保持沸腾30min,将制备得到的酒红色溶液冷却至室温,避光保存于4℃备用;
(3)取5ml步骤(2)制备得到的酒红色溶液,向其中加入0.25ml浓度为5×10-5m的sh-peg,在37℃下孵育12h,然后以10000rpm离心10min,弃去上清液,制得沉淀即为sh-peg功能化纳米金,将沉淀分散在30μl纯水中备用。
步骤(1)中,1%haucl4·4h2o水溶液的配制方法为:将1ghaucl4·4h2o溶解并定容于100ml纯水中。
一种所述适配体传感器的制备方法,所述制备方法包括以下步骤:
(1)制备sh-peg功能化纳米金;
(2)制备dna水凝胶;
(3)将制备的sh-peg功能化纳米金加入到dna水凝胶中得到aunps/dna水凝胶;在90℃孵育30min,然后冷却至室温;
(4)将aunps/dna水凝胶在2000rpm条件下离心10min,用uv-1800紫外分光光度计测定其在530nm处的吸光度。
所述dna水凝胶的制备方法为:
(1)将20μl10-5mota适配体和20μl10-5m引物混合并在95℃下退火10min,后采用梯度降温法进行杂交以获得适配体-引物杂交复合物;
(2)向其中加入5μl核酸外切酶ⅰ以酶解未结合的dna单链,制备得到纯化后的适配体-引物杂交复合物;
(3)取10.5μl步骤(2)所得纯化后的适配体-引物杂交复合物,加入待测ota浓度的目标物,再向其中加入10.5μl10-5m锁式探针及1.0μlt4dna连接酶混合均匀并在37℃下孵育45min;t4dna连接酶的酶活为5.0u/ml;
(4)随后向其中加入6.4μl10mmdntps、2.0μl10u/mlphi29dna聚合酶,混合均匀后于37℃孵育2.5h,此后置于4℃孵育12h,对所得产物用纯水洗涤2次后得到dna水凝胶。
步骤(1)中,梯度降温法进行杂交的条件为95℃反应10min,然后自然降温至25℃;步骤(2)中,酶解的条件为37℃反应30min后,于80℃反应15min。
步骤(3)中,sh-peg功能化纳米金与dna水凝胶的用量比例为:5mlsh-peg功能化纳米金加入30μldna水凝胶体系中。
一种基于滚环扩增产物自组装dna水凝胶的适配体传感器的应用,所述适配体传感器用于检测赭曲霉毒素a。
使用所述适配体传感器检测赭曲霉毒素a的方法为:
(1)将20μl10-5mota适配体和20μl10-5m引物混合并在95℃下退火10min,后采用梯度降温法进行杂交以获得适配体-引物杂交复合物;
(2)向其中加入5μl核酸外切酶ⅰ以酶解未结合的dna单链,制备得到纯化后的适配体-引物杂交复合物;
(3)取10.5μl步骤(2)所得纯化后的适配体-引物杂交复合物,加入待测ota浓度的目标物,再向其中加入10.5μl10-5m锁式探针及1.0μlt4dna连接酶混合均匀并在37℃下孵育45min;t4dna连接酶的酶活为5.0u/ml;
(4)随后向其中加入6.4μl10mmdntps、2.0μl10u/mlphi29dna聚合酶,混合均匀后于37℃孵育2.5h,此后置于4℃孵育12h,对所得产物用纯水洗涤2次后得到dna水凝胶;
(5)将制备的sh-peg功能化纳米金加入到dna水凝胶中得到aunps/dna水凝胶;在90℃孵育30min,然后冷却至室温;
(6)将aunps/dna水凝胶在2000rpm条件下离心10min,用uv-1800紫外分光光度计测定其在530nm处的吸光度;计算其ota浓度。
检测目标产物ota浓度之前需要以已知浓度的ota溶液制备标准曲线,标准曲线为:y=5722-0.1911*x,r2=0.9941;已知浓度的ota溶液的浓度分别为0、0.05ng/ml、0.1ng/ml、0.5ng/ml、1ng/ml、5ng/ml、10ng/ml。
本发明有益的技术效果在于:
本发明利用赭曲霉毒素a适配体互补序列和赭曲霉毒素a对其适配体的竞争性结合,可释放出游离的互补序列,体系中游离的互补序列可作为滚环扩增反应的触发链而启动滚环扩增反应。因此,只有在赭曲霉毒素a存在的情况下,滚环扩增反应才会启动,dna水凝胶才会形成。此后,将纳米金加入dna水凝胶中,形成纳米金功能化的dna水凝胶,通过向滚环扩增反应的锁式探针序列中引入polyt序列,可使纳米金直接被固定在dna水凝胶中。在固定纳米金添加量的条件下,赭曲霉毒素a的浓度越高,dna水凝胶生成越多,溶液中纳米金越少,溶液吸光度越低。因此,可以通过测定上清液的吸光度来测定赭曲霉毒素a的浓度。此外,也将该传感器用于实际样品检测,检测结果与商业化elisa检测方法所得到的结果类似,证明了该传感器的优良性能。所构建的检测方法具有操作简单、选择性和特异性高等优点,在食品安全检测领域尤其是多组分检测方面具有较大的应用潜力。
本发明利用适配体技术结合滚环扩增技术构建赭曲霉毒素a响应的dna水凝胶,构建赭曲霉毒素a存在时才生成dna水凝胶的检测模式,可提高赭曲霉毒素a的检测灵敏度。
本发明通过改变滚环扩增反应锁式探针序列可增加dna水凝胶对纳米金的吸附性,从而无需对纳米金进行dna序列修饰而可使纳米金直接与dna水凝胶结合,简化了实验操作。
附图说明
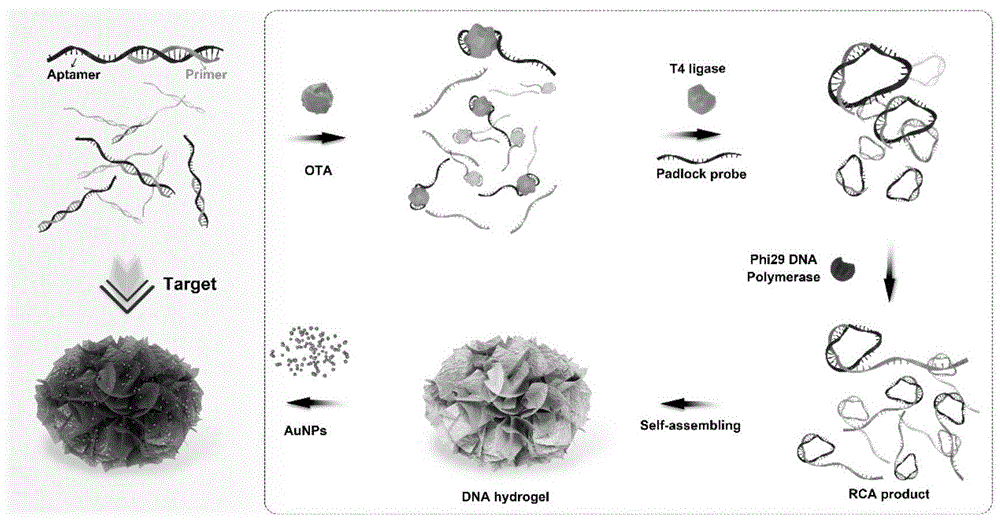
图1.为比色法dna水凝胶适配体传感器用于检测ota的原理图;
图2a为实施例1制得纳米金的紫外可见吸收光谱(a)和sh-peg功能化纳米金的紫外可见吸收光谱(b);
图2b为实施例1制得纳米金的透射电镜图;
图2c为实施例1制得sh-peg功能化纳米金的透射电镜图;
图3a为实施例2制得dna水凝胶的透射电镜图;
图3b为实施例2制得dna水凝胶能谱图;
图3c为实施例2制得dna水凝胶的场发射扫描电镜图及场发射扫描电镜-能谱元素分布谱图;
图3d为实施例3制得aunps/dna水凝胶的透射电镜图;
图3e为实施例3制得dna水凝胶的照片(a)和aunps/dna水凝胶的照片(b);
图4a为不同ota浓度条件下检测上清液中的紫外可见吸收图谱;
其中,以ota的对数浓度为横坐标,体系吸光度为纵坐标,标准曲线为y=0.5722-0.1911*x,r2=0.9941;
图4b为不同ota浓度条件下所得dna水凝胶(a)和体系上清液(b)的照片,
图4c为对ota及其他可能共存物或结构类似物的检测结果(a:otb,b:afb1,c:zen,d:t-2,e:ota)
具体实施方式
下面结合附图和实施例,对本发明进行具体描述。
图1为基于滚环扩增产物自组装的dna适配体传感器检测赭曲霉毒素a的原理,首先将适配体和引物孵育得到适配体-引物杂交复合物,然后加入核酸外切酶ⅰ对未结合的单链适配体和引物进行酶解,以对适配体-引物杂交复合物进行纯化。在ota存在的情况下,ota会与适配体-引物复合物中的适配体结合,引起适配体-引物杂交复合物的解链。由此释放处游离的引物,在锁式探针及dna酶存在的情况下可启动滚环扩增反应,得到滚环扩增产物。滚环扩增产物进一步自组装形成dna水凝胶。因此,dna水凝胶产生量是由ota浓度决定的,ota浓度越高,dna水凝胶的产量越大。相反,在ota不存在的情况下,适配体-引物杂交复合物无法产生游离的引物,从而不能形成dna水凝胶。向dna水凝胶中加入纳米金后,纳米金可被包裹在dna水凝胶中形成aunps/dna水凝胶,且dna水凝胶越多,上清液中的aunps越少。因此,可以通过测定上清液的吸光度来实现对ota的测定。
实施例1sh-peg功能化纳米金的制备:
(1)将1ghaucl4·4h2o溶解并定容于100ml纯水中,制得1%的haucl4·4h2o水溶液;取0.5ml1%的haucl4·4h2o水溶液加入50ml纯水中,在搅拌下加热至沸腾;
(2)向其中加入0.4ml5%的柠檬酸钠水溶液,保持沸腾30min,将制备得到的酒红色溶液冷却至室温,避光保存于4℃备用;所得纳米金的紫外可见吸收光谱及透射电镜图分别如图2a和2b所示;
(3)取5ml步骤(2)制备得到的酒红色溶液,向其中加入0.25ml浓度为5×10-5m的sh-peg,在37℃下孵育12h,然后以10000rpm离心10min,弃去上清液,制得沉淀即为sh-peg功能化纳米金,将沉淀分散在30μl纯水中备用。所得sh-peg功能化纳米金的紫外可见吸收光谱及透射电镜图分别如图2a和2c所示;
在制备纳米金之前先将所有泳道的玻璃器皿在王水(3份hcl,1份hno3)中浸泡以彻底清洁,此后用纯水冲洗,并烘干备用;
如图2所示,在520nm处出现的尖锐紫外吸收峰表明aunps的制备成功(图2a中曲线a)。将sh-peg功能化的纳米金分散于t4连接酶缓冲液和phi29dna聚合酶缓冲液中,以保证其在dna水凝胶中的稳定性。如图2a中曲线b所示,纳米金的紫外吸收峰从520nm处移动到530nm处,这表明成功制备了sh-peg功能化的纳米金。此外,通过透射电镜对纳米金和sh-peg功能化纳米金进行表征,透射电镜结果表明,本实施例制备得到的纳米金(图2b)和sh-peg功能化纳米金(图2c)均为直径约14nm的球体,分散性良好。
实施例2dna水凝胶的制备:
(1)将20μl10-5mota适配体和20μl10-5m引物混合并在95℃下退火10min,后采用梯度降温法进行杂交以获得适配体-引物杂交复合物;梯度降温法进行杂交的条件为95℃反应10min,然后自然降温至25℃。
(2)向其中加入5μl核酸外切酶ⅰ以酶解未结合的dna单链,制备得到纯化后的适配体-引物杂交复合物;酶解的条件为37℃反应30min后,于80℃反应15min。
(3)取10.5μl步骤(2)所得纯化后的适配体-引物杂交复合物,加入浓度为10ng/ml的ota,并向其中加入10.5μl10-5m锁式探针及1.0μlt4dna连接酶混合均匀并在37℃下孵育45min;t4dna连接酶的酶活为5.0u/ml;
(4)随后向其中加入6.4μl10mmdntps、2.0μl10u/mlphi29dna聚合酶,混合均匀后于37℃孵育2.5h,此后置于4℃孵育12h,对所得产物用纯水洗涤2次后得到dna水凝胶。其测试结果如图3所示。
改变ota浓度,分别为0、0.05ng/ml、0.1ng/ml、0.5ng/ml、1ng/ml、1ng/ml,制不同ota浓度的一系列dna水凝胶。
通过场发射扫描电镜和透射电镜对dna水凝胶的形貌和内部结构进行分析,如图3a所示,本实施例得到的dna水凝胶内部结构呈花状,且结构疏松多孔,粒径为微米级。通过场发射扫描电镜-能谱对dna水凝胶的表面组成元素进行元素分布和元素组成分析,如图3b和图3c所示,dna水凝胶由c、n、o、mg和p元素组成,其中c、n、o和p是构成dna的主要元素,而mg元素的存在可能表明dna水凝胶的形成机制与mg2ppi晶体有关。通过将c、mg和n、mg的元素分布进行合并,可以很容易地发现mg在中心的分布比c、n多,而在边界的分布比c、n少,因此,可能的形成机制是先形成mg2ppi晶体,然后dna与mg2ppi晶体结合形成络合物然后形成dna水凝胶。
实施例3
一种所述适配体传感器的制备方法,所述制备方法包括以下步骤:
将实施例1制备的5μlsh-peg功能化纳米金加入到0.03μl实施例2制备的dna水凝胶(10ng/ml)中得到aunps/dna水凝胶;在90℃孵育30min,然后冷却至室温;
将aunps/dna水凝胶在2000rpm条件下离心10min,用uv-1800紫外分光光度计测定其在530nm处的吸光度。
aunps/dna水凝胶的透射电镜图和照片分别如图3d、3e所示。由图3d可以看出,aunps/dna水凝胶的形态与dna水凝胶相似,呈花状,大小同样为微米级,可以看到纳米金被dna水凝胶包裹在内部。dna水凝胶和aunps/dna水凝胶的照片如图3e所示,可以看到aunps/dna水凝胶呈红色,也说明aunps被dna水凝胶包裹而形成aunps/dna水凝胶。
改变ota浓度的dna水凝胶,重复上述操作,测试结果如图4a和图4b所示,随着ota浓度的增加,上清液在530nm处的吸光度降低。在最佳条件下,δod(δod=od0-od,od0和od分别代表ota浓度为0时的吸光度和ota存在时的吸光度)与ota浓度的对数线性负相关。线性范围为0.05ng/ml-10ng/ml(y=5722-0.1911*x,r2=0.9941)。ota的检测限为0.005ng/ml。
特异性是生物传感器最重要的特性之一,为了验证本实验方法的特异性,本发明申请所构建的dna水凝胶适配体传感器对赭曲霉毒素b(otb)、黄曲霉毒素b1(afb1)、玉米赤霉烯酮(zen)和t-2毒素(t-2)的响应。结果用相对吸光度比(δod)表示δod=(od0-od)/(od0-oda),od0为空白样品上清液吸光度,od为其它四种毒素上清液吸光度,oda为ota上清液吸光度。结果如图4c所示,与ota引起的荧光信号响应相比,其他四种毒素引起的吸光度信号响应可忽略不计。结果表明,本发明对ota具有良好的特异性,这主要是因为ota适配体具有良好的特异性和适体传感器的合理设计。
测试例:
实际样品检测及加标回收率测试:
用本方法对市售啤酒样品中的ota含量进行测定,再用本方法和elisa方法分别进行加标回收率测试。样品进行如下预处理,首先将啤酒样品置于4℃保存30min,对啤酒样品进行超声脱气处理。然后,用2.57mol/lnacl和0.24mol/lnahco3配制检测缓冲液。在10ml啤酒样品中加入10ml检测缓冲液。最后在啤酒样品中加入不同浓度的ota,进行相对标准差(rsd)测定和加标回收实验,利用利用本发明方法和酶联免疫方法分别测定其中赭曲霉毒素a的含量,结果见表1,两种方法检测结果一致,无明显差异,且可以看到回收率在92.8%~103.5%,说明本发明稳定,灵敏,准确,适用啤酒样品中赭曲霉毒素a的检测。
表1.本实验方法与elisa检测方法对啤酒样品中ota的检测结果比较
sequencelisting
<110>上海理工大学
<120>一种基于滚环扩增产物自组装dna水凝胶的适配体传感器及其应用
<130>1
<160>3
<170>patentinversion3.5
<210>1
<211>36
<212>dna
<213>适配体
<400>1
gatcgggtgtgggtggcgtaaagggagcatcggaca36
<210>2
<211>15
<212>dna
<213>引物
<400>2
tgtccgatgctccct15
<210>3
<211>72
<212>dna
<213>锁式探针
<400>3
atcggacagcacgtacagaactttttttttttttgtcggcttagcctcaacccccaaggc60
tttttagggagc72
- 还没有人留言评论。精彩留言会获得点赞!