一种免疫荧光胶体金纳米微球材料的制作方法
1.本发明涉及体外诊断领域,具体为一种具有定性和定量并存的免疫荧光 胶体金纳米微球材料。
背景技术:
2.体外诊断,即ivd(in vitro diagnosis),是指在人体之外,通过对人体 样本(血液、体液、组织等)进行检测而获取临床诊断信息,进而判断疾病或 机体功能的产品和服务。
3.体外诊断行业与检验医学构成了既相互区别又相互紧密联系的有机整体。 体外诊断行业是检验医学的“工具”和“兵器”,同时检验医学是体外诊断行 业的“用户”和“市场”,两者的共同目的是实施体外诊断。临床诊断信息的 80%左右来自体外诊断,而其费用占医疗费用不到20%。体外诊断已经成为人 类疾病预防、诊断、治疗日益重要的组成部分。
4.纳米聚合微球的种类多种多样,用在不同的领域中;在ivd领域,侧向 层析技术已经发展多年,以胶体金为代表的定性检测,已不能满足人们的需求, 定量检测逐渐开始发展。而在侧向层析方向,多用荧光微球作为载体材料,进 行定量检测。
5.荧光微球是一类特殊的功能性微球,其通常具有纳米级至微米级的直径, 并且在表面包覆有荧光物质或者在结构内附载有荧光物质,在激发光下可以发 射出荧光。由于结构稳定以及发光效率稳定等特点,荧光微球现已广泛地应用 在标记、示踪、检测、体内成像、免疫医学、高通量药物筛选等领域中。
6.在ivd领域,胶体金检测试纸条的结果易判读特点,检测成本低,使得 胶体金能够进入到日常的家庭生活中,但荧光定量检测的侧向层析则不能满足 这一要求,由于需要配套的定量检测设备,也使得成本大幅增加。
7.而在以胶体金为载体的侧向层析检测中,定量以及灵敏度的问题一直困 扰着各大体外诊断试剂盒研发厂家。但是既能实现定性简单易判读又能辅助提 升灵敏度,以及实现定量的固相载体材料,市场上没有实现。
8.目前有些厂家为了能够同时实现定性与定量的功能,通常将胶体金标记 物与荧光标记物进行混合,虽能实现定性与定量的功能,但是会造成活性材料 的投入加倍,同时人工等成本由于两种材料的标记和使用,而成倍增加。
技术实现要素:
9.鉴于现有技术中所存在的问题,本发明公开了一种免疫荧光胶体金纳米 微球材料,采用的技术方案是,包括胶体金纳米微球、荧光量子点纳米微球、 纳米微球表面聚合物修饰基团,所述胶体金纳米微球表面官能化,并通过化学 键与荧光量子点纳米微球偶联,直径可以为10
‑
500nm,荧光发射波长范围 400
‑
800nm,在此基础上,仍保留胶体金纳米微球的显色特征。
10.作为本发明的一种优选技术方案,所述胶体金纳米微球表面的官能团可 以为羧
基、氨基、醛基、环氧基、磺酸基、氯甲基、羟基等;本纳米微球可以 用于ivd领域中,作为侧向层析的固相载体材料,可以通过其表面的官能团, 与蛋白质、核酸等偶联反应,并在侧向层析中,既能通过胶体金的性能实现定 性判定,也能通过检测量子点的发射光进行定量读数。
11.作为本发明的一种优选技术方案,所述荧光量子点纳米微球偶联在所述 胶体金纳米微球表面。
12.作为本发明的一种优选技术方案,所述胶体金纳米微球偶联在所述荧光 量子点纳米微球表面。
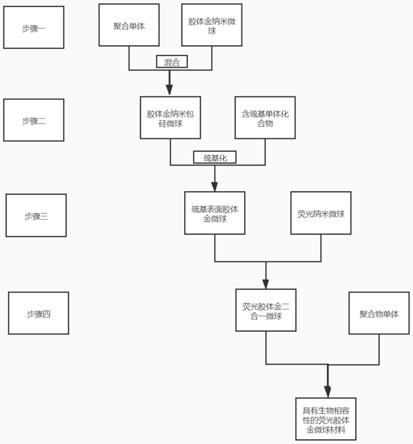
13.本发明公开了一种免疫荧光胶体金纳米微球材料的制备方法,采用的技 术方案是,包括以下步骤:步骤a,对胶体金纳米微球表面进行覆膜保护;步骤b,对步骤a中所得的胶体金纳米微球表面进行官能化修饰;步骤c,将步骤b所得胶体金纳米微球与荧光量子点纳米微球进行偶联;步骤d,对步骤c中所得二合一纳米微球进行表面修饰。
14.作为本发明的一种优选技术方案,所述步骤a中的覆膜保护可以但不局 限于包硅壳处理;使用单体聚合物,与胶体金等纳米微球发生反应后,胶体金 等纳米微球覆上保护层;在保护保护胶体金等纳米材料的同时,赋予胶体金稳 定的结构,保护材料的球型形态以及结构。
15.在具体的实施过程中,采取以下步骤:步骤1,取高浓度胶体金溶液(≥1od),加入质量体积比为1:1的高分子聚 合物水溶液,这些高分子材料可以为pvp(聚乙烯吡咯烷酮)、pva(聚乙烯 醇)、泊洛沙姆等;胶体金与高分子材料混匀后,静置反应得到溶液a;其中, 经过反复验证确认,胶体金的浓度越高,聚合物附膜的效率越高;步骤2,向所述步骤1中得到的溶液a中加入体积比为1:19的氨水—乙醇或氨 水—甲醇、氨水
‑
异丙醇等溶液,搅拌或者震荡混匀,得到溶液b;步骤3,向所述步骤2中得到的溶液b中添加含硅酸类化合物溶液,此处溶剂 应与溶液b的溶剂保持一致,相应的应该为甲醇、乙醇或者异丙醇等;进一步 的,硅酸类与溶剂的体积比一般为1:9;得到溶液c;步骤4,将所述步骤3中得到的溶液c离心处理去除上清液,离心力采用 10000g,优选相应的溶剂反复清洗4
‑
5次后,复溶并分散,得到表面附有硅壳 类的胶体金纳米材料;清洗时,先离心弃去上清液,然后用溶剂复溶,再次离 心去上清液后复溶,此为完整的一次清洗过程。
16.作为本发明的一种优选技术方案,所述步骤b中的所述官能化修饰,可 以但不局限为巯基化修饰。
17.具体实施过程中,采用以下步骤:步骤1,将步骤a中得到的表面附有硅壳的胶体金纳米微球与含有巯基类的硅 烷偶联剂溶液反应,此处溶剂为1:19的氨水—乙醇、氨水
‑‑
甲醇或者氨水
‑ꢀ
异丙醇混合液,相应地,溶剂应与表面硅壳类胶体金纳米材料保持一致,得到 溶液d;步骤2,将所述步骤1中得到的溶液d在10000g条件下离心,去除上清液后, 优选
dmso(二甲基亚砜)或者dmf(二甲基甲酰胺)溶液复溶,并在相同条件 下清洗3
‑
4次,最后一次复溶后,采用超声分散悬浊,得到表面修饰巯基的胶 体金溶液e。
18.作为本发明的一种优选技术方案,所述步骤c中的偶联方式可以但不局 限于硅烷偶联。
19.具体实施过程中,将荧光量子点溶液与步骤b中得到的胶体金溶液e反 应,即可得到胶体金
‑
荧光量子点偶联微球,此处荧光量子点应溶于dmso或 dmf中,进一步地,应与溶液e的溶剂保持一致,在10000g条件下离心,反复 清洗3
‑
4次后,最终复溶,得到溶液f。
20.作为本发明的一种优选技术方案,所述步骤d中,二合一纳米微球的表 面修饰可以但不限于羧基、氨基、醛基、磺酸基等的修饰。
21.具体实施过程中,采用以下步骤:步骤1,向步骤c中得到的溶液f内加入聚合物单体溶液,这些聚合物可以是 聚乙烯亚胺、聚丙烯酸、聚甲基丙烯酸、丙烯酸与苯乙烯共聚物、丙烯酸与烯 烃共聚物、马来酸酐与烯烃共聚物等,进行反应,反应温度可以为30
‑
90℃。 得到表面修饰有官能团的胶体金荧光量子点二合一微球混合液g;步骤2,将所述步骤1得到的混合液g,在10000g条件下离心并去上清液后, 用0.01m的氢氧化钠溶液进行清洗3
‑
4次,进一步地,再用纯化水清洗3
‑
4次, 最终超声分散,得到表面修饰的胶体金荧光量子点二合一纳米微球。
22.本发明的有益效果:本发明通过将胶体金纳米微球和荧光量子点纳米微 球通过化学键偶联得到的二合一微球,作为侧向层析主要固相载体,可以通过 其表面的官能团,与蛋白质、核酸等偶联反应,既有胶体金显色特性,能够实 现侧向层析操作简单,结果易判读的特点;又有量子点光学特征,能实现定量 检测,以及解决定性产品灵敏度低的问题,同时在实现双重功能的情况下,减 少活材以及人工成本。
23.进一步的,对于研发厂家而言,所开发的产品有更多的选择方案,对于 开发的同一个产品,既可以选择做为定性产品推广,也可以选择做为定量产品 推广,即两个产品只用一次开发,减少产品开发的周期以及产品投入。
24.进一步的,针对于使用者来说,低值区也就是“灰区”,单纯的胶体金 法通过肉眼不能准确判断出阴性或者阳性,但是通过光学性质的检测,能够做 到这一点,降低漏检的概率。
25.进一步的,胶体金标记抗体是物理吸附的过程,通常物理吸附标记抗体 标记效率低并且不稳定,而胶体金荧光量子点微球则是表面修饰官能团,可以 通过化学偶联标记抗体,标记效率高,且稳定,提升产品品质。
26.进一步的,可以在同时满足定性以及定量的情况下,能够大幅减少活性 材料的使用,并能提升反应性能,且在满足定量的同时,可以不增加仪器设备 投入使用,降低定量产品成本的投入。
附图说明
27.图1为胶体金荧光量子点纳米材料结构简图。
28.图2为免疫荧光胶体金纳米微球材料的制备方法流程图。
具体实施方式
29.实施例1
30.如图1、图2所示,本发明公开了一种免疫荧光胶体金纳米微球材料, 采用的技术方案是,包括胶体金纳米微球、荧光量子点纳米微球、纳米微球表 面聚合物修饰基团,所述胶体金纳米微球表面官能化,并通过化学键与荧光量 子点纳米微球偶联。
31.作为本发明的一种优选技术方案,所述胶体金纳米微球表面的官能团可 以为羧基、氨基、醛基、环氧基、磺酸基、氯甲基、羟基。
32.作为本发明的一种优选技术方案,所述荧光量子点纳米微球偶联在所述 胶体金纳米微球表面。
33.本发明公开了一种免疫荧光胶体金纳米微球材料的制备方法,采用的技 术方案是,包括以下步骤:步骤a,对胶体金纳米微球表面进行覆膜保护;步骤b,对步骤a中所得的胶体金纳米微球表面进行官能化修饰;步骤c,将步骤b所得胶体金纳米微球与荧光量子点纳米微球进行偶联;步骤d,对步骤c中所得二合一纳米微球进行表面修饰。
34.作为本发明的一种优选技术方案,所述步骤a中的覆膜保护采用包硅壳 处理,具体采用以下步骤:步骤1,取500μl 200od 40nm粒径的胶体金溶液,加入浓度为50%的pvp水 溶液100μl,混匀后静置反应15分钟;步骤2,加入含5%teos的乙醇溶液100μl,混匀,震荡反应0.5小时;步骤3,用无水乙醇离心清洗4次(离心力10000g,10min/次,清洗的复溶过 程中采用超声分散);步骤4,超声分散溶解至500μl乙醇中备用。
35.作为本发明的一种优选技术方案,所述步骤b中的所述官能化修饰为巯 基化修饰,具体采用以下步骤:步骤5,将包硅后的胶体金逐滴加入1%的(3
‑
巯基丙基)三甲氧基硅烷60μl,室 温搅拌1小时;步骤6,离心弃去上清液,用dmso溶液清洗复溶至500ul。
36.作为本发明的一种优选技术方案,所述步骤c中的偶联方式采用硅烷偶 联,具体采用以下步骤:步骤7,将油溶性量子点用dmso溶解至5mg/ml,取100μl加入到表面巯基 化的胶体金中,室温反应0.5小时;步骤8,将所述步骤1中所得产物离心清洗后分散于500μl的dmso溶液中, 得到胶体金、量子点复合功能材料。
37.作为本发明的一种优选技术方案,所述步骤d中,二合一纳米微球的表 面修饰采用以下步骤:步骤9,将聚丙烯酸用dmso溶液溶解至10mg/ml,加入到上面溶液中,升温 至90℃,氮气保护下反应4小时;步骤10,离心去除上清液,用0.01m氢氧化钠水溶液清洗4次(离心力 10000g,
10min/次,清洗的复溶过程中采用超声分散);步骤11,沉淀分散于500μl纯化水中,即得到表面羧基官能化的胶体金、量子 点复合微球功能材料,即为免疫荧光胶体金纳米材料。
38.实施例2
39.本实施例与实施例1的区别在于:所述胶体金纳米微球偶联在所述荧光 量子点纳米微球表面。
40.步骤1,取500μl 200od 40nm粒径的胶体金溶液,加入浓度为50%的 泊洛沙姆水溶液100μl,混匀后静置反应15分钟;
41.所述步骤9中,将聚甲基丙烯酸用dmso溶解至10mg/ml,加入到上 面溶液中,升温至90℃,氮气保护下反应4小时。
42.实施例3
43.本实施例与实施例1的区别在于:步骤2,加入含5%teos的异丙醇溶 液100μl,混匀,震荡反应0.5小时;
44.步骤3,用无水异丙醇离心清洗4次(离心力10000g,10min/次,清洗 的复溶过程中采用超声分散);
45.步骤4,超声分散至500μl异丙醇中备用;
46.步骤9,将聚乙烯亚胺用dmso溶解至10mg/ml,加入到上面溶液中, 升温至90℃,氮气保护下反应4小时。
47.实施例4,本实施例与实施例1的区别在于:步骤1,取500μl 200od
ꢀꢀ
40nm粒径的胶体金溶液,加入浓度为50%的pva水溶液100μl,混匀后静置 反应15分钟;
48.步骤9,将聚乙烯亚胺用dmso溶解至10mg/ml,加入到上面溶液中, 升温至90℃,氮气保护下反应4小时。
49.实施例5
50.步骤2,加入含5%teos的甲醇溶液100μl,混匀,震荡反应0.5小时;
51.步骤3,用无水甲醇离心清洗4次(离心力10000g,10min/次,清洗的 复溶过程中采用超声分散);
52.步骤4,超声分散至500μl甲醇中备用;
53.步骤9,将丙烯酸与苯乙烯共聚物、丙烯酸与烯烃共聚物、马来酸酐与 烯烃共聚物等用dmso溶解至10mg/ml,加入到上面溶液中,升温至90℃, 氮气保护下反应4小时
54.实施例6
55.本实施例和实施例1的区别在于:步骤9,将甲苯磺酰基,甲苯磺酰氯 和羟基反应产物等用dmso溶解至10mg/ml,加入到上面溶液中,升温至 90℃,氮气保护下反应4小时。对比检测试验
56.制备免疫荧光胶体金纳米微球降钙素原试纸条,步骤如下:1、将得到的免疫荧光胶体金纳米微球通过化学偶联的方式与抗体或者抗原等 活性蛋白结合,得到免疫荧光胶体金偶联物;在本发明中,标记的为鼠源性的 pct抗体;1.1取50ul免疫荧光胶体金纳米微球中添加15mg edc和50mg sulfo
‑
nhs,涡 旋混匀后,37℃反应15min;1.2反应完成后,离心去上清,离心条件(离心力10000g,离心时间8min)。
1.3加入1ml 0.05m tb 8.0,超声分散。1.4加入20μg降钙素原单克隆抗体,置于振荡混匀器上,室温反应2h;1.5然后加入100μl 10%bsa,对未标记的位点进行封闭,置于振荡混匀器上, 室温反应30min;1.6反应结束后,将上述液体10000g离心8min,弃上清,加入保存液(含1% bsa、10%蔗糖、0.5%吐温
‑
20的ph8.0 0.2m tb缓冲液),5ml,超声分散, 至此完成标记;2、用金标三维喷金点膜仪,设置参数4μl/cm,将上述1.6标记复合物,喷于聚 酯纤维dl42上,裁剪7mm*300mm备用,称为荧光纳米微球标记复合物垫; 3、用金标三维喷金点膜仪,以1μl/cm参数,在硝酸纤维素膜上包被另一株降 钙素原单克隆抗体和羊抗鼠igg,37℃干燥16小时,作为反应膜;4、用含0.5%tween
‑
20的0.1m pbs溶液浸泡玻璃纤维,然后37℃干燥16小 时,裁剪17mm
×
300mm为作为样品垫;5、样品垫、荧光纳米微球标记复合物垫、反应膜和吸水纸(22mm
×
300mm) 以层层叠压的形式进行黏贴组装在pvc底板上,切条后,作为降钙素原测定 试纸条。
57.制备对照例:荧光
‑
胶体金混合标记降钙素原试纸条,步骤如下:1、取50ul 5mg/ml表面羧基的荧光量子点微球,添加15mg edc和50mg sulfo
‑ꢀ
nhs,涡旋混匀后,37℃反应15min;反应完成后,离心去上清,离心条件 (10000g,8min);加入1ml 0.05m tb 8.0,超声分散;加入2μg降钙素原单 克隆抗体,置于振荡混匀器上,室温反应2h;然后加入100μl 10%bsa,对 未标记的位点进行封闭,置于振荡混匀器上,室温反应30min;反应结束后, 将上述液体在10000g离心力下离心8min,弃去上清液,加入保存液(含1% bsa、10%蔗糖、0.5%吐温
‑
20的ph8.0 0.2m tb缓冲液),5ml,超声分散; 制备为荧光标记复合物;2、取1ml 1od胶体金溶液,加入20μg降钙素原单克隆抗体,置于振荡混匀 器上,室温反应2h;然后加入100μl 10%bsa,对未标记的位点进行封闭,置 于振荡混匀器上,室温反应30min;反应结束后,将上述液体在10000g的离心 力下离心8min,弃去上清液,加入保存液(含1%bsa、10%蔗糖、0.5%吐温
‑ꢀ
20的ph8.0 0.2m tb缓冲液),5ml,超声分散;制备为荧光标记复合物。3、将上述1、2复合物微球按照1:1比例混合,作为该对照试纸条的混合标 记复合物;4、用金标三维喷金点膜仪,设置参数4μl/cm,将上述3混合标记复合物,喷于 聚酯纤维dl42上,裁剪7mm*300mm备用,称为标记复合物垫。5、用金标三维喷金点膜仪,以1μl/cm参数,在硝酸纤维素膜上包被另一株降 钙素原单克隆抗体和羊抗鼠igg,37℃干燥16小时,作为反应膜。6、用含0.5%tween
‑
20的0.1m pbs溶液浸泡玻璃纤维,然后37℃干燥16小 时,裁剪17mm
×
300mm为作为样品垫。7、将样品垫、荧光纳米微球标记复合物垫、反应膜和吸水纸(22mm
×
300mm) 以层层叠压的形式进行黏贴组装在pvc底板上,切条后,作为降钙素原测定 试纸条。
58.免疫荧光胶体金纳米微球降钙素原定量检测结果为:
59.免疫荧光胶体金纳米微球降钙素原定性判读结果为:
60.荧光
‑
胶体金混合标记降钙素原试纸条定量检测结果为:
61.荧光
‑
胶体金混合标记降钙素原试纸条定性检测结果为:
62.通过上述对比试验可得出以下结论:1、胶体金荧光量子点二合一纳米微球作为固相载体的体外诊断层析试纸条可 以同时实现定性与定量检测。2、与单纯的胶体金定性相比,二合一微球定性方面,灵敏度以及线性复合要 求。3、与单纯的胶体金定性相比,二合一微球定量的方面,大幅提升检测灵敏度。
63.本发明通过化学方法将胶体金以及荧光量子点微球偶联在一起,并对偶 联微球进行表面官能团化修饰,用在ivd领域,侧向层析方面,既解决了胶体 金灵敏度低的问题,同时保留了胶体金易判读的特点,也能进行定量判读。特 别是在特殊使用情况下,如2019
‑
cov新冠检测试剂盒,尤其是对于家庭自检 用户而言,低灵敏度的判断,仅需一把紫外手电筒即可,无需增加配套设备, 减少不必要的花费。
64.上述虽然对本发明的具体实施例作了详细说明,但是本发明并不限于上 述实施例,在本领域普通技术人员所具备的知识范围内,还可以在不脱离本发 明宗旨的前提下做出各种变化,而不具备创造性劳动的修改或变形仍在本发明 的保护范围以内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1