一种有效控制生物组织材料中细菌内毒素的方法与流程
1.本发明涉及生物材料技术领域,尤其涉及一种有效控制生物组织材料中细菌内毒素的方法。
背景技术:
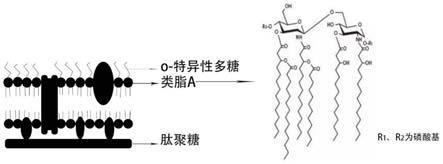
2.内毒素为外源性致热原,它可激活中性粒细胞等,使之释放出一种内源性热原质,作用于体温调节中枢引起发热。内毒素的主要化学成分为脂多糖,存在于包括大肠杆菌在内的大多数革兰氏阴性菌的细胞壁中,通过细胞裂解而被释放出来。脂多糖由多糖o抗原、核心多糖和类脂a三部分组成,位于革兰氏阴性菌外膜外层。其中类脂a是脂化的葡萄胺二糖,通过焦磷酸酯键组成的一种独特的糖脂化合物,具有致热作用,是革兰氏阴性细菌内毒素的毒性成分。内毒素一般以聚体形式存在,其磷酸基团与二价金属离子螯合可进一步稳定内毒素分子间的聚合,促成更大的内毒素复合体。
3.目前在生物制药及医疗器械中,内毒素污染广泛存在,微量的内毒素通过血液进入到人体会引起发热,甚至引起死亡。为了保证生物制品及医疗器械的安全性,现有标准(usp27)规定针对直接或者间接接触心血管系统和淋巴系统的产品,限度是0.5eu/ml或者20eu/每个器械。对于接触脑脊液的器械,限度是0.06eu/ml或者2.15eu/每器械。对于直接或者间接接触眼内环境的器械,一个更低的内毒素限度可能是合适的。
4.医疗器械中的内毒素主要来源于原材料本身及加工过程外界引入。常用的去除内毒素的方法有酸碱水解、活性炭吸附、超滤、离子交换色谱法、高温、氧化物等,但大多是针对溶液或容器表面。目前关于生物组织材料的内毒素清除方法报导较少,所以如何有效地去除生物组织材料中的内毒素对生物组织材料医疗器械的安全性是至关重要的。
5.现有去除生物组织材料中内毒素的相关技术专利仅找到1篇:专利cn105251049 利用离子缓冲溶液对生物医用材料进行浸泡及清洗,此方法虽然操作简单,但对内毒素的清除不能达到更理想的效果。
技术实现要素:
6.本发明的目的是提供一种有效控制生物组织材料中细菌内毒素的方法,该方法通过对生物组织材料进行梯度清洗,最终使生物组织材料医疗器械达到甚至低于内毒素标准。
7.为了解决上述技术问题,本发明通过下述技术方案得以解决:种有效控制生物组织材料中细菌内毒素的方法,包括如下步骤:第一步,运输保存:将采集去除脂肪的新鲜生物组织材料置于运输保存液中低温运输;第二步,梯度清洗:将经过上述处理的新鲜生物组织材料依次放于清洗液ⅰ、清洗液ⅱ、清洗液ⅲ中浸泡清洗;第三步,化学交联固定:将经过上述处理的的生物组织材料放于化学交联溶液中固定。
8.根据一实施例,所述生物组织材料包括各种同种/异种动物真皮组织、心包膜、心脏瓣膜、血管壁等。
9.根据一实施例,所述运输保存液为含有抗生素的等渗离子溶液。
10.根据一实施例,上述所述抗生素优选广谱抗生素。
11.根据一实施例,所述低温为0℃~10℃(不包括0℃)。
12.根据一实施例,所述清洗液ⅰ为含有表面活性剂的等渗离子溶液。
13.在一个优选实施例中,所述清洗液ⅰ中的表面活性剂优选温和型表面活性剂。
14.根据一实施例,所述清洗液ⅰ中的表面活性剂优选吐温80、tritonx
‑
100。
15.根据一实施例,所述清洗液ⅰ中的表面活性剂的浓度为0.001%~0.01%。
16.根据一实施例,所述清洗液ⅱ为含有表面活性剂的等渗离子溶液。
17.根据一实施例,所述清洗液ⅱ中的表面活性剂优选离子型表面活性剂。
18.在一个优选实施例中,上述所述的离子型表面活性剂优选十二烷基硫酸钠。
19.根据一实施例,所述清洗液ⅱ中的表面活性剂的浓度为0.1%~1.0%。
20.根据一实施例,所述清洗液ⅲ为等渗离子溶液。
21.根据一实施例,所述清洗液ⅰ、所述清洗液ⅱ和所述清洗液ⅲ中等渗离子溶液中的阳离子选自下列中的一者:钠离子和钾离子。
22.根据一实施例,所述清洗液ⅰ、所述清洗液ⅱ和所述清洗液ⅲ中等渗离子溶液中的阴离子选自下列中的一者:氯离子;磷酸根离子;磷酸氢根离子;磷酸二氢根离子;碳酸氢根离子;硫酸根离子。
23.根据一实施例,所述化学交联溶液优选戊二醛。
24.与现有技术相比,本发明通过加入梯度清洗处理过程进行生物组织材料内毒素清除,其优点在于:1. 区别于现有技术,本发明的一实施例中在新鲜生物组织材料的运输过程中加入抗生素,抑制细菌繁殖,降低后续去除细菌、内毒素的难度。
25.2. 区别于现有技术,本发明的一实施例中在采用梯度清洗的方法,多次、多方面、深度对生物组织材料含有的细菌进行清除、裂解和抑制,首先将生物组织材料放入含有低浓度表面活性剂的清洗液ⅰ中,处理液中低浓度的表面活性剂可以改变细菌表面对水相对亲和性,使菌体更好地分散在水中,易于菌体洗脱下来;然后再将生物组织材料放入含有高浓度表面活性剂的清洗液ⅱ中,其处理液中高浓度的表面活性剂可以使细菌细胞裂解,蛋白质变性,使大部分细菌裂解死亡;最后将处理后的生物组织材料放入等渗离子溶液清洗,有利于将上述裂解后的细菌内毒素、生物组织细胞内核酸、蛋白质及细胞膜上磷脂等引起热原、免疫及钙化的成分去除,增加材料安全性及耐久性。
26.3. 由于新鲜生物组织材料本身携带的细胞膜含有磷脂,而磷脂是引起生物组织材料钙化的主要因素之一,区别于现有技术,本发明的一实施例中清洗液ⅱ中含有高浓度的表面活性剂在裂解细菌的同时还可以裂解新鲜生物组织本身携带的细胞,达到动物源性生物材料抗原的清除。 本技术的实施例能够实现其它未一一列出的有利技术效果,这些其它的技术效果在下文中可能有部分描述,并且对于本领域的技术人员而言在阅读了本技术后是可以预期和理解的。
附图说明
27.图1革兰氏阴性菌细胞壁结构及类脂a化学式结构。
28.图2为对照组he染色的示意图。
29.图3为试验组he染色的示意图。
具体实施方式
30.下面描述和附图中所阐明的一些具体细节解释了本发明指导下的各个实施方式。相关领域技术人员能够在缺少本文所描述的一个或多个细节的情况 下实施本发明指导下的其他实施方式。因此,申请人的意图并不是将所附权利要求的范围限定或以任何方式限制至细节的具体描述中。虽然下文参照附图有序地对各步骤的实施过程进行了详尽的描述,但所描述的步骤和步骤顺序及其术语不应该认为是实施本发明教导的所有实施方式所必须的。
31.同样,可以理解,本文中所使用的词组和用语是出于描述的目的,而不应当被认为是限制性的。本文中的“包括”、“包含”或“具有”及其变型的使用,旨在开放式地包括其后列出的项及其等同项以及附加的项。
32.下面将参考本技术的若干方面的不同的实施例和示例对本技术进行更详细的描述。
33.本实施例提供一种有效控制生物组织材料中细菌内毒素的方法,该方法包括以下步骤:第一步,运输保存:将采集去除脂肪的新鲜生物组织材料置于运输保存液中低温运输;第二步,梯度清洗:将经过上述处理的新鲜生物组织材料依次放于清洗液ⅰ、清洗液ⅱ、清洗液ⅲ中浸泡清洗;第三步,化学交联固定:将经过上述处理的的生物组织材料放于化学交联溶液中固定。
34.步骤1:获取新鲜的生物组织材料;步骤2:将生物组织材料置于运输保存液中低温运输;步骤3:将上述生物组织材料放于清洗液ⅰ中进行浸泡清洗;步骤4:将经过清洗液ⅰ清洗后的生物组织材料放于清洗液ⅱ中浸泡清洗;步骤5:将经过清洗液ⅱ清洗后的生物组织材料放于清洗液ⅲ中浸泡清洗;步骤6:将经过上述步骤处理后的生物组织材料于化学交联剂溶液中固定处理。
35.根据本发明的有效控制生物组织材料中细菌内毒素的方法,在步骤1中:获取新鲜的生物组织材料,所述新鲜生物组织材料为牛心包、猪心包、猪心脏瓣膜等。
36.在步骤2中:将生物组织材料进行低温运输,所述运输保存溶液为含有青霉素、链霉素等的等渗离子溶液,低温为0℃~10℃(不包括0℃)。
37.在步骤3中:所述清洗液ⅰ浸泡清洗为将上述生物组织材料浸没于含有0.001%~0.01%的吐温80、tritonx
‑
100等表面活性剂的等渗离子溶液中浸泡0.5h~1h,然后震荡(80~120rpm)清洗2~4次。
38.在步骤4中:所述清洗液ⅱ浸泡清洗为将上述经过清洗液ⅰ浸泡清洗生物组织材料浸没于含有0. 1%~1.0%的十二烷基硫酸钠表面活性剂的等渗离子溶液中浸泡0.5h~1h,然后震荡(80~120rpm)清洗2~4次。
39.在步骤5中:所述清洗液ⅲ浸泡清洗为将上述经过清洗液ⅱ浸泡清洗生物组织材
料浸没于生理盐水、pbs等等渗离子溶液中浸泡0.5h~1h,然后震荡(80~120rpm)清洗2~4次。
40.在步骤6中:所述化学交联溶液主要为甲醛、戊二醛等。
41.具体实施例一:牛心包材料初始污染菌及细菌内毒素检测方法:采集20片宁波地区健康的2岁左右雄雌性黄牛心包,擦拭去除脂肪后,分为两组,每组10片,对照组:牛心包进行采集处理后,低温运输,简单清洗,在清洗后随机取出3片进行污染菌数量检测,计数为n1,剩余7片牛心包进行戊二醛固定,固定完成切割成50mm
×
60mm的片状进行内毒素检测;试验组:牛心包进行采集处理后;第一步,置于含有100iu青霉素、100μg/ml链霉素的生理盐水中低温运输;第二步,将上述清洗后剩余的牛心包置于0.1%十二烷基硫酸钠的生理盐水中浸泡30min后,再进行震荡(80rpm)清洗2次,取出3片进行污染菌数量检测,计数为n2;第三步,将上述清洗后的牛心包置于0.1%十二烷基硫酸钠的生理盐水中浸泡30min后,再进行震荡(80rpm)清洗2次;第四步,将上述经过二次清洗后的牛心包置于生理盐水,浸泡30min后,再进行震荡(80rpm)清洗2次;第五步,剩余牛心包置于戊二醛溶液中固定。固定完成切割成50mm
×
60mm的片状进行内毒素检测。
42.结果分析:牛心包生物组织材料经不同方法处理后,试验组的污染菌数量为4.1
×
103cfu/cm2,对照组的污染菌数量为9.2
×
105cfu/cm2,两组具有显著性差异;试验组(50mm
×
60mm)的内毒素不大于2.15eu/件,即不大于0.072eu/cm2,对照组(50mm
×
60mm)的内毒素大于20eu/件,即大于0.67eu/cm2,具有显著性差异。
43.结论:聚山梨酯80能够促进生物组织材料中污染菌的洗脱,通过此发明的处理方法能够有效的控制生物组织材料中的内毒素。
44.具体实施例二:牛心包材料初始污染菌、细胞残留及细菌内毒素检测方法:采集20片河南地区健康的2岁左右雄雌性黄牛心包,擦拭去除脂肪后,分为两组,每组10片,对照组:牛心包进行采集处理后,低温运输,简单清洗,在清洗后随机取出3片进行污染菌数量检测,计数为n1,剩余7片牛心包进行戊二醛固定,固定完成切割成100mm
×
40mm的片状进行内毒素检测,切割成10mm
×
10mm进行he染色观察细胞残留情况;试验组:牛心包进行采集处理后;第一步,置于含有100iu青霉素、100μg/ml链霉素的生理盐水中低温运输;第二步,将上述牛心包置于0.01%吐温80的生理盐水中浸泡1h后,再进行震荡(120rpm)清洗4次,取出3片进行污染菌数量检测,计数为n2;第三步,将上述清洗后的剩余的牛心包置于1.0%十二烷基硫酸钠的生理盐水中浸泡1h后,再进行震荡(120rpm)清洗4次;第四步,将上述经过二次清洗后的牛心包置于生理盐水,浸泡1h后,再进行震荡(120rpm)清洗4次;第五步,牛心包置于戊二醛溶液中固定。固定完成切割成100mm
×
40mm的片状进行内毒素检测,切割成10mm
×
10mm进行he染色观察细胞残留情况。
45.结果分析:牛心包生物组织材料经不同方法处理后,试验组的污染菌数量为3.99
×
103cfu/cm2,对照组的污染菌数量为9.13
×
105cfu/cm2,两组具有显著性差异;试验组(100mm
×
40mm)的内毒素不大于2.15eu/件,即不大于0.054eu/cm2,对照组(100mm
×
40mm)的内毒素大于20eu/件,即大于0.50eu/cm2,具有显著性差异。由图2和图3可知,对照组牛心包经过he染色细胞核较多且清晰可见,试验组牛心包无可见细胞核,说明清除细胞彻底。
46.结论:低浓度表面活性剂能够促进生物组织材料中污染菌的洗脱,高浓度表面活性剂能够有效地去除生物组织材料内的细胞,通过此发明的处理方法能够有效的控制生物组织材料中的内毒素。
47.综上所述,以上内容仅为本发明的较佳实施例,对于本领域的普通技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,本说明书内容不应理解为对本发明的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1