免疫检测载体及其制备方法和应用与流程
1.本发明涉及免疫检测技术领域,特别是涉及一种免疫检测载体及其制备方法和应用。
背景技术:
2.目前用于检测蛋白基生物标志物的技术包括酶联免疫吸附测定法(elisa)、微流控法、免疫层析法、化学发光法等,主要是通过固相载体结合捕获对应的抗体,然后与样本中的待测抗原或标志物发生特异性免疫反应,实现抗原或标志物的检测。如传统elisa法所用固相载体为96孔反应杯,材质为聚苯乙烯(ps)塑料;微流控法可用聚合物塑料(ps、pmma、cop等)或玻璃形成微流道,在层流流道中实现微量样品的有效检测;免疫层析法则是以多孔硝化纤维素薄膜作为固相层析载体包被抗体;而化学发光法常常依靠微米磁珠作为固相载体表面来结合抗体,实现抗原标志物检测。而由于抗体/蛋白质本身对暴露温度和ph等环境变化的敏感性,基于以上市场主流的检测方法,固相表面结合抗体后,产品常常需要低温保存和运输。同时,传统elisa等法还存在低灵敏度和检测限(lod)等局限性。
3.因此,传统的免疫检测载体难以确保结合抗体的稳定性,也就无法降低免疫诊断产品的运输成本,免疫反应的灵敏度也较低。
技术实现要素:
4.基于此,有必要提供一种能够提高结合抗体效力和稳定性,以及增强免疫反应灵敏度的免疫检测载体。
5.一种免疫检测载体的制备方法,其包括以下步骤:
6.提供固相基材;
7.将所述固相基材使用含有多巴胺盐和聚乙烯亚胺的第一溶液进行浸泡;
8.将经过所述第一溶液浸泡的固相基材使用第二溶液进行浸泡,得到所述免疫检测载体,所述第二溶液含有能形成金属有机框架材料的金属离子和有机配体。
9.在其中一个实施例中,在使用所述第二溶液进行浸泡之前,还包括以下步骤:将经过所述第一溶液浸泡的固相基材使用含有戊二醛的第三溶液进行浸泡。
10.在其中一个实施例中,所述第三溶液中,所述戊二醛的浓度为0.5wt%~1.5wt%。
11.在其中一个实施例中,所述第一溶液中,所述多巴胺盐的浓度为0.1wt%~1wt%,所述聚乙烯亚胺的浓度为0.1wt%~1wt%,所述聚乙烯亚胺的分子量为2000~75000da。
12.在其中一个实施例中,所述第二溶液中,所述金属离子的摩尔浓度为0.001m~0.1m,所述有机配体的摩尔浓度为0.5m~2m。
13.在其中一个实施例中,所述金属离子源自对应金属的可溶性的硝酸盐、盐酸盐、硫酸盐和/或醋酸盐,所述金属离子为锌离子、铁离子、铜离子、锰离子、铝离子、镁离子、钾离子、镍离子和铬离子中的一种或多种。
14.在其中一个实施例中,所述有机配体为2
‑
甲基咪唑、2
‑
硝基咪唑、苯并咪唑、2
‑
咪
唑甲醛和4
‑
甲基咪唑
‑5‑
甲醛中的一种或多种。
15.本发明还提供了一种免疫检测载体,其包括依次层叠的固相基材、多巴胺
‑
聚乙烯亚胺层和金属有机框架材料层。
16.本发明还提供了一种免疫检测方法,其包括以下步骤:提供如上所述的免疫检测载体,加入抗体溶液进行孵育,然后使用封闭液进行封闭,洗涤后加入待测样本进行孵育。
17.本发明还提供了一种免疫检测材料,其包括如上所述的免疫检测载体,以及结合于所述免疫检测载体表面的抗体。
18.金属有机框架材料(mof)是一种含有金属离子和有机配体基团的混合材料,mof由有机配体配位的金属原子或原子簇构成一维、二维或三维的结构,在氢气存储、气体吸附与分离、传感器、药物缓释等领域有重要的应用。除了可调谐的孔径外,它还具有很大的比表面积和很高的孔隙度。封装在mofs中的酶或蛋白质表现出有限的结构变化,导致即使在变性条件下也能维持其原本相应的生物活性和功能。同时,mofs的三维和多孔结构,让其具有很大比表面以及可调节的多孔结构,因此相比传统的塑料固相表面,能够提供更多的位点以便于大量的生物分子结合,且三维结构也在一定程度上降低了生物分子之间反应的空间位阻影响,利于增加生物分子的反应活性。本发明的制备方法利用贻贝仿生表面化学,通过多巴胺
‑
聚乙烯亚胺非均匀形核将mof粒子原位生长于固相表面形成薄膜,用于抗体的负载,进而用于抗原标志物的免疫检测反应。如此,可以有效地提升传统固相基材的比表面积以及与抗体等生物分子的结合位点。同时,mof的三维和多孔结构,进一步降低了材料表面大分子之间反应的空间位阻,从而增加了抗体等生物分子的反应活性,充分暴露其表位,提升检测信号及灵敏度。而且,mof负载抗体等生物分子之后,能够较长期保护抗体等生物分子免于外部环境温度变化造成的活性降低等影响。
附图说明
19.图1为实施例1中免疫检测载体的扫描电镜图;
20.图2为实施例1中免疫检测载体结合抗体后的扫描电镜图;
21.图3为实施例1和实施例3中免疫检测载体与传统elisa载体用于检测pct抗原的比较图;
22.图4为实施例2中免疫检测载体结合抗体后免疫检测性能随时间变化的曲线图;
23.图5为实施例3中不同处理情况下载体表面的接触角变化比较图;
24.图6为实施例4中免疫检测载体用于检测pct抗原的免疫检测结果图。
具体实施方式
25.为了便于理解本发明,下面将对本发明进行更全面的描述,并给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
26.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
27.本发明一实施例的免疫检测载体的制备方法,其包括以下步骤s1~s3:
28.s1、提供固相基材;
29.s2、将固相基材使用含有多巴胺盐(pda)和聚乙烯亚胺(pei)的第一溶液进行浸泡;
30.s3、将经过第一溶液浸泡的固相基材使用第二溶液进行浸泡,得到免疫检测载体,第二溶液含有能形成金属有机框架材料的金属离子和有机配体。
31.金属有机框架材料(mof)是一种含有金属离子和有机配体基团的混合材料,除了可调谐的孔径外,它还具有很大的比表面积和很高的孔隙度。封装在mofs中的酶或蛋白质表现出有限的结构变化,导致即使在变性条件下也能维持其原本相应的生物活性和功能。同时,mofs的三维和多孔结构,让其具有很大比表面以及可调节的多孔结构,因此相比传统的塑料固相表面,能够提供更多的位点以便于大量的生物分子结合,且三维结构也在一定程度上降低了生物分子之间反应的空间位阻影响,利于增加生物分子的反应活性。本发明的制备方法利用贻贝仿生表面化学,通过多巴胺
‑
聚乙烯亚胺非均匀形核将mof粒子原位生长于固相表面形成薄膜,用于抗体的负载,进而用于抗原标志物的免疫检测反应。如此,可以有效地提升传统固相基材的比表面积以及与抗体等生物分子的结合位点。同时,mof的三维和多孔结构,进一步降低了材料表面大分子之间反应的空间位阻,从而增加了抗体等生物分子的反应活性,充分暴露其表位,提升检测信号及灵敏度。而且,mof负载抗体等生物分子之后,能够较长期保护抗体等生物分子免于外部环境温度变化造成的活性降低等影响。
32.在一个具体示例中,在使用第二溶液进行浸泡之前,还包括以下步骤:将经过第一溶液浸泡的固相基材使用含有戊二醛的第三溶液进行浸泡。如此,多巴胺固定的聚乙烯亚胺层可与戊二醛进一步发生共价反应,使抗体锚定更加牢固,从而提高反应的稳定性。同时,戊二醛处理后将pda
‑
pei混合层接触角进一步降低,使得mof粒子的非均匀形核更加致密。
33.在一个具体示例中,上述第三溶液中,戊二醛的浓度为0.5wt%~1.5wt%,例如0.8wt%、1wt%、1.2wt%等。在一个具体示例中,经过上述第一溶液浸泡的固相基材使用第三溶液于室温浸泡0.5~2小时。
34.在一个具体示例中,上述第一溶液中,多巴胺盐的浓度为0.1wt%~1wt%,例如0.2wt%、0.4wt%、0.6wt%、0.8wt%等,聚乙烯亚胺的浓度为0.1wt%~1wt%,例如0.2wt%、0.4wt%、0.6wt%、0.8wt%等,聚乙烯亚胺的分子量为2000~75000da,第一溶液呈碱性,例如ph为8.5。在一个具体示例中,将固相基材使用第一溶液于室温浸泡12~24小时。
35.在一个具体示例中,上述第二溶液中,金属离子的摩尔浓度为0.001m~0.1m,例如0.02m、0.04m、0.06m、0.08m等,有机配体的摩尔浓度为0.5m~2m,例如0.6m、1m、1.4m、1.8m等。在一个具体示例中,将经过第一溶液浸泡的固相基材使用第二溶液于室温浸泡1~2小时。
36.在一个具体示例中,金属离子源自对应金属的可溶性的硝酸盐、盐酸盐、硫酸盐和/或醋酸盐,金属离子为锌离子、铁离子、铜离子、锰离子、铝离子、镁离子、钾离子、镍离子和铬离子中的一种或多种。具体的,金属离子源自硝酸锌、氯化钾、硫酸铜、醋酸钠等,但不限于此。
37.在一个具体示例中,有机配体为咪唑类配体,进一步为2
‑
甲基咪唑、2
‑
硝基咪唑、苯并咪唑、2
‑
咪唑甲醛和4
‑
甲基咪唑
‑5‑
甲醛中的一种或多种,但不限于此。
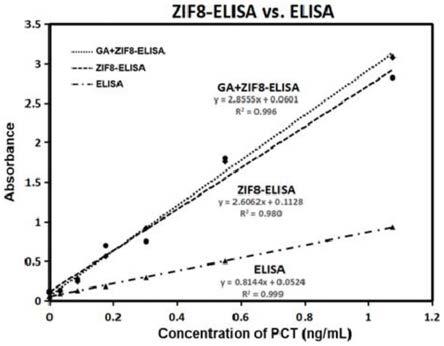
38.在一个具体示例中,上述固相基材为聚合物基材,例如聚苯乙烯(ps)、聚甲基丙烯酸甲酯(pmma)、环烯烃聚合物(cop)等,但不限于此。
39.本发明一实施例的免疫检测载体,其通过上述方法制备得到,包括依次层叠的固相基材、多巴胺
‑
聚乙烯亚胺层和金属有机框架材料层。
40.本发明的免疫检测载体通过多巴胺
‑
聚乙烯亚胺非均匀形核将mof粒子原位生长于固相表面形成薄膜,用于抗体的负载,进而用于抗原标志物的免疫检测反应。如此,可以有效地提升传统固相基材的比表面积以及与抗体等生物分子的结合位点。同时,mof的三维和多孔结构,进一步降低了材料表面大分子之间反应的空间位阻,从而增加了抗体等生物分子的反应活性,充分暴露其表位,提升检测信号及灵敏度。而且,mof负载抗体等生物分子之后,能够较长期保护抗体等生物分子免于外部环境温度变化造成的活性降低等影响。
41.本发明一实施例的免疫检测方法,其包括以下步骤:提供如上所述的免疫检测载体,加入抗体溶液进行孵育,然后使用封闭液进行封闭,洗涤后加入待测样本进行孵育。
42.在一个具体示例中,加入2.5μg/ml~1mg/ml的抗体溶液于35℃~39℃孵育1~3小时,使抗体与免疫检测载体上的位点充分结合。
43.在一个具体示例中,封闭液为胎牛血清溶液,浓度为5wt%~20wt%,于35℃~39℃封闭0.5~2小时,然后使用pbst缓冲液进行洗涤。
44.可选地,待测样本孵育完毕后还可以包括以下步骤:洗涤免疫检测载体,加入待测样本,后加入酶标二抗进行孵育,然后通过显色反应检测反应结果。可以理解,根据不同的检测方式可以采用不同的后续处理步骤。
45.本发明一实施例的免疫检测材料,其包括如上所述的免疫检测载体,以及结合于免疫检测载体表面的抗体。
46.本发明的免疫检测材料通过多巴胺
‑
聚乙烯亚胺非均匀形核将mof粒子原位生长于固相表面形成薄膜,并用于抗体的负载,进而用于抗原标志物的免疫检测反应。如此,可以有效地提升传统固相基材的比表面积以及与抗体等生物分子的结合位点。同时,mof的三维和多孔结构,进一步降低了材料表面大分子之间反应的空间位阻,从而增加了抗体等生物分子的反应活性,充分暴露其表位,提升检测信号及灵敏度。而且,mof负载抗体等生物分子之后,能够较长期保护抗体等生物分子免于外部环境温度变化造成的活性降低等影响。
47.可选地,上述抗体为单克隆抗体,但不限于此。在一个具体示例中,抗体为降钙素原(pct)单克隆抗体,以用于检测待测样本中是否含有降钙素原。
48.以下为具体实施例,以下实施例中,金属有机框架标记为mof,具体形成mof材料薄膜后的产物标记为zif
‑
8薄膜。
49.实施例1
50.(1)使用elisa反应杯(聚苯乙烯ps塑料孔)作为固相表面,使用50mm的tris缓冲液(ph=8.5)配制0.2wt%多巴胺盐酸盐(pda)和0.2wt%聚乙烯亚胺(pei)溶液,二者混合后浸入ps孔,混合比例为1:1,室温下浸泡16小时后洗净备用,并测量记录接触角。
51.(2)使用去离子水配制0.02m的六水合硝酸锌(zn(no3)2·
6h2o)和1.4m的2
‑
甲基咪唑(meim)溶液,二者按1:1体积混合浸泡入上述已经处理过的ps孔,室温下浸泡1小时后,将
已经形成zif
‑
8薄膜的ps孔洗净备用,并测量记录下接触角。如图1所示,为所得免疫检测载体的扫描电镜图。
52.(3)向以上具有薄膜的ps孔中,加入10μg/ml降钙素原pct单克隆抗体100μl,37℃孵育2小时,使用pbst缓冲液洗涤4次后备用。如图2所示,为免疫检测载体结合抗体后的扫描电镜图。
53.(4)向以上包被抗体的薄膜ps孔中,加入250μl 10wt%胎牛血清溶液作为封闭液,37℃封闭1小时,使用pbst缓冲液洗涤4次后备用。
54.(5)在步骤(4)反应后的ps孔内,加入不同浓度的pct抗原蛋白100μl,37℃孵育30min后使用pbst缓冲液洗涤4次,再加入100μl pct酶标二抗37℃温育20min后使用pbst缓冲液洗涤4次,最后加入a、b液37℃显色10min,加50μl终止液终止。使用仪器读取显色od值并记录。
55.如图3所示,为本实施例的免疫检测载体(zif8
‑
elisa)与传统elisa载体(聚苯乙烯ps塑料孔)用于检测pct抗原的比较图,可见,相比传统的elisa载体,使用本实施例的免疫检测载体可获得更强的反应信号强度和灵敏度。
56.实施例2
57.(1)使用elisa反应杯(聚苯乙烯ps塑料孔)作为固相表面,使用50mm的tris缓冲液(ph=8.5)配制0.2wt%多巴胺盐酸盐(pda)和0.2wt%聚乙烯亚胺(pei)溶液,二者混合后浸入ps孔,混合比例为1:1,室温下浸泡16小时后洗净备用,并测量记录接触角。
58.(2)使用去离子水配制0.02m的六水合硝酸锌(zn(no3)2·
6h2o)和1.4m的2
‑
甲基咪唑(meim)溶液,二者按1:1体积混合浸泡入上述已经处理过的ps孔,室温下浸泡1小时后,将已经形成zif
‑
8薄膜的ps孔洗净备用,并测量记录下接触角。
59.(3)向以上具有薄膜的ps孔中,加入10μg/ml降钙素原pct单克隆抗体100μl,37℃孵育2小时,使用pbst缓冲液洗涤4次后备用。
60.(4)向以上包被抗体的薄膜ps孔中,加入250μl 10wt%胎牛血清溶液作为封闭液,37℃封闭1小时,使用pbst缓冲液洗涤4次后备用。
61.(5)将步骤(4)封闭后的负载抗体的ps孔分别密封放置于室温下1个月、2个月、3个月。
62.(6)在步骤(5)放置一定时间后的ps孔内,各加入0.3ng/ml的pct抗原蛋白100μl,37℃孵育30min后使用pbst缓冲液洗涤4次,再加入100μl pct酶标二抗37℃温育20min后使用pbst缓冲液洗涤4次,最后加入a、b液37℃显色10min,加50μl终止液终止。使用仪器读取显色od值并记录。
63.如图4所示,为免疫检测载体结合抗体后免疫检测性能随时间变化的曲线图,可见,使用本实施例的免疫检测载体能够较长期地维持抗体等生物分子的活性和功能。
64.实施例3
65.(1)使用elisa反应杯(聚苯乙烯ps塑料孔)作为固相表面,使用50mm的tris缓冲液(ph=8.5)配制0.2wt%多巴胺盐酸盐(pda)和0.2wt%聚乙烯亚胺(pei)溶液,二者混合后浸入ps孔,混合比例为1:1,室温下浸泡16小时后洗净备用,并测量记录接触角。
66.(2)将步骤(1)中经多巴胺盐酸盐和聚乙烯亚胺处理后的ps孔,室温浸泡1wt%戊二醛(ga)1小时,然后洗净备用,并测量记录接触角。
67.(3)使用去离子水配制0.02m的六水合硝酸锌(zn(no3)2·
6h2o)和1.4m的2
‑
甲基咪唑(meim)溶液,二者按1:1体积混合浸泡入上述已经处理过的ps孔,室温下浸泡1小时后,将已经形成zif
‑
8薄膜的ps孔洗净备用,并测量记录下接触角。
68.(4)向以上具有薄膜的ps孔中,加入10μg/ml降钙素原pct单克隆抗体100μl,37℃孵育2小时,使用pbst缓冲液洗涤4次后备用。
69.(5)向以上包被抗体的薄膜ps孔中,加入250μl 10wt%胎牛血清溶液作为封闭液,37℃封闭1小时,使用pbst缓冲液洗涤4次后备用。
70.(6)在步骤(4)反应后的ps孔内,加入不同浓度的pct抗原蛋白100μl,37℃孵育30min后使用pbst缓冲液洗涤4次,再加入100μl pct酶标二抗37℃温育20min后使用pbst缓冲液洗涤4次,最后加入a、b液37℃显色10min,加50μl终止液终止。使用仪器读取显色od值并记录。
71.如图5所示,为不同处理情况下载体表面的接触角变化比较图,可见,随着处理步骤的进行接触角在不断变化,说明处理后使得表面性质发生一定变化。如图3所示,戊二醛处理后形成的mof载体(ga+zif8
‑
elisa)在免疫反应中表现出比实施例1中更好的线性。
72.实施例4
73.(1)使用聚甲基丙烯酸甲酯pmma塑料注塑的微流控芯片作为固相表面,使用等离子体以掩膜方式在微流控芯片流道表面形成2cm
×
2cm的等离子蚀刻反应区,等离子体参数为50w,蚀刻时间为180s,通入气体为o2/n2(50%/50%)。
74.(2)使用50mm的tris缓冲液(ph=8.5)配制0.2wt%多巴胺盐酸盐(pda)和0.2wt%聚乙烯亚胺(pei)溶液并混合,混合比例为1:1。采用点样方式,在芯片流道2cm
×
2cm反应区浸泡pda
‑
pei混合液2μl,放于湿盒中反应16小时后清洗干净,氮气吹干后备用。
75.(3)配制2mm的六水合硝酸锌(zn(no3)2·
6h2o)和1.4m的二甲基咪唑(meim)溶液,二者按1:1体积混合后,在流道2cm
×
2cm反应区点样锌离子和咪唑混合液2μl,浸泡1小时后将形成zif
‑
8薄膜的流道洗净,氮气吹干备用。
76.(4)向以上具有薄膜的流道反应区中,点样1.0mg/ml降钙素原pct单克隆抗体2μl,37℃孵育2小时。
77.(5)采用封闭液在步骤(4)包被抗体后的微流芯片内37℃封闭1小时。
78.(6)在步骤(5)处理后的微流芯片内,加入不同浓度的pct抗原蛋白,37℃孵育15min后使用荧光扫描仪读取反应数据并记录。
79.如图6所示,为本实施例的免疫检测载体用于检测pct抗原的免疫检测结果图,可见,其同样具有很好的检测性能。
80.综上所述,本发明利用贻贝仿生表面化学,使用多巴胺和聚乙烯亚胺在材料表面原位生长mof,从而可用于负载抗体等生物分子,使其具有免疫反应特性,操作简便且可适用于多种固相表面,具有普适性。同时,与传统的免疫诊断产品或共价或吸附的抗体负载形式相比,本发明的免疫检测载体所负载的抗体能够耐受环境温度变化的影响,较长期保持抗体等生物分子的反应活性。而且,在抗原标志物的检测上,相比传统的elisa法,具备更强的反应信号强度和灵敏度。
81.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存
在矛盾,都应当认为是本说明书记载的范围。
82.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1