一种测定甘胆酸的试剂盒及其制备方法与流程
1.本发明涉及医学检验领域,具体涉及一种测定甘胆酸的试剂盒及其制备方法。
背景技术:
2.甘胆酸(cg)是胆酸与甘氨酸结合而成的结合型胆酸之一,cg在血清中主要以蛋白结合形式存在,溢入体循环的总量小于1%,在正常情况下,外周血中胆酸含量甚微,正常成人无论空腹或餐后,其血清cg浓度均稳定在低水平,当人体肝细胞受损或胆汁淤滞时,就会引起甘胆酸代谢和循环紊乱,甘胆酸值高低与干细胞损害及胆汁酸代谢障碍的严重程度相关,临床上一般用cg检测肝胆损伤疾病和妊娠期肝内胆汁淤积症。
3.目前已知的检测cg的方法有放射免疫分析法(ria)、酶标免疫分析法(elisa)、胶乳免疫比浊分析法以及化学发光分析法。其中ria以及elasa方法操作繁琐,反应时间长,一般用于定性或半定量分析,因此不利于在临床上广泛应用;胶乳免疫比浊法具有灵敏度高,重复性好的特点,但胶乳颗粒具有较强的粘附性,容易污染比色杯并造成交叉污染;而化学发光法灵敏度较高,但需要配套昂贵的检测设备,不利于常规实验室开展,临床应用局限性明显。
4.均相酶免疫技术是一种基于液相均相反应体系的竞争性免疫测定技术,因其具有反应灵敏度高、特异性强的特点。在甘胆酸均相法检测中,样本游离的甘胆酸与葡萄糖六磷酸脱氢酶
‑
甘胆酸偶联物竞争性结合抗甘胆酸特异性抗体位点,当样本中游离的甘胆酸越多,其竞争结合的抗体位点越多,抗体释放出的酶标偶联物就越多。游离出来的甘胆酸酶标偶联物催化β
‑
烟酰胺腺嘌呤二核苷酸氧化型(nad+)转化为β
‑
烟酰胺腺嘌呤二核苷酸还原型(nadh),在340nm波长处测定吸光度的上升与甘胆酸的含量成正比。通过与同样处理的甘胆酸校准品比较,即可计算出样品中cg的含量。而在该方法学中,葡萄糖六磷酸脱氢酶
‑
甘胆酸偶联物的标记效率会直接影响试剂的批间差异和稳定性。
技术实现要素:
5.发明人意外发现,通过限定葡萄糖六磷酸脱氢酶
‑
甘胆酸偶联物的标记时间、限定标记终止液的添加量和加入时间以及通过超滤离心偶联物溶液的方式,可以有效控制标记效率和标记批间差异。
6.为了实现上述目的,本发明采用如下技术手段:一种测定甘胆酸的试剂盒,包括试剂r1以及试剂r2,其特征在于:
7.所述试剂r1包括的成分及相应的含量为:缓冲液50
‑
200mm,酶激活剂10
‑
25mm,保护剂5.0
‑
30g/l,葡萄糖六磷酸盐2.0
‑
8.0g/l,表面活性剂0.5
‑
1.5g/l,甘胆酸
‑
葡萄糖六磷酸脱氢酶偶联物1.0
‑
4.0ul/l;
8.所述试剂r2包括的成分及相应的含量为:缓冲液30
‑
200mm,保护剂5.0
‑
25g/l,nad 0.5
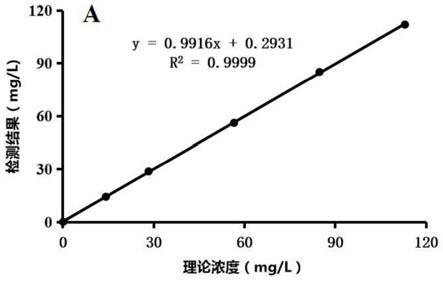
‑
4.0g/l,nadh 0.01
‑
0.1g/l,抗甘胆酸抗体10
‑
30mg/l;
9.所述甘胆酸
‑
葡萄糖六磷酸脱氢酶偶联物的制备过程中,甘胆酸与葡萄糖六磷酸
脱氢酶的标记时间为2
‑
4h,且标记结束后加入终止液终止反应。
10.优选地,所述终止液选自甘氨酸、酪蛋白或bsa中的至少一种,优选为甘氨酸。
11.优选地,所述试剂r1还包括:离子螯合剂5.0
‑
20mm,盐离子20
‑
100mm,防腐剂0.5
‑
1.5g/l;所述试剂r2还包括:盐离子10
‑
40g/l,防腐剂0.5
‑
1.5g/l。
12.优选地,在所述试剂r1中:
13.所述缓冲液选自咪唑、ches、apmso或tris
‑
hcl中的至少一种;所述离子螯合剂选自egta或edta中的至少一种;所述酶激活剂选自氯化镁或氯化钙中的至少一种;所述盐离子选自氯化钠或氯化钾中的至少一种;所述保护剂选自bsa或酪蛋白中的至少一种;所述表面活性剂选自tx
‑
100、brj
‑
58、tx
‑
305或tx
‑
405中的至少一种;所述防腐剂选自叠氮钠或proclin
‑
300中的至少一种;
14.在所述试剂r2中:
15.所述缓冲液选自mes、甘氨酸或hepes中的至少一种;所述盐离子选自氯化钠或氯化钾中的至少一种;所述保护剂选自bsa或酪蛋白中的至少一种;所述防腐剂选自叠氮钠或proclin
‑
300中的至少一种。优选地,所述试剂r1的ph为7
‑
9,优选为8
‑
9;所述试剂r2的ph为5
‑
7,优选为6
‑
6.5。
16.一种测定甘胆酸试剂盒的制备方法,其特征在于,包括如下步骤:
17.(1)葡萄糖六磷酸脱氢酶溶液的制备
18.按照下述配方进行配制:
19.缓冲液50
‑
200mm,葡萄糖六磷酸脱氢酶20
‑
50ku,六水合氯化镁1.0
‑
10mm,盐离子100
‑
200mm,nadh 10
‑
30g/l,葡萄糖六磷酸盐5.0
‑
20g/l,二乙二醇乙醚10
‑
100ml/l,二甲亚砜20
‑
50ml/l;
20.(2)甘胆酸的活化
21.按照下述配方进行配制:
22.甘胆酸5.0
‑
30g/l,n
‑
n二甲基甲酰胺0.5
‑
20ml,1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐5.0
‑
20g/l,n
‑
羟基硫代琥珀酰亚胺5.0
‑
20g/l;
23.冰水浴搅拌条件下将甘胆酸用n
‑
n
‑
二甲基甲酰胺溶解,随后加入羧基活化剂(1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐)进行活化处理40
‑
50min;
24.(3)甘胆酸
‑
葡萄糖六磷酸脱氢酶标记
25.将活化的甘胆酸溶液加入葡萄糖六磷酸脱氢酶溶液中,在冰水浴条件下反应,加入终止液,浓缩提纯;
26.(4)试剂r1的制备
27.试剂r1按照下述配方进行配制:
28.缓冲液50
‑
200mm,离子螯合剂5.0
‑
20mm,酶激活剂10
‑
25mm,盐离子20
‑
100mm,保护剂5.0
‑
30g/l,葡萄糖六磷酸盐2.0
‑
8.0g/l,表面活性剂0.5
‑
1.5g/l,防腐剂0.5
‑
1.5g/l,甘胆酸
‑
葡萄糖六磷酸脱氢酶偶联物1.0
‑
4.0ul/l;
29.所述缓冲液选自咪唑、ches、apmso或tris
‑
hcl中的至少一种;所述离子螯合剂选自egta或edta中的至少一种;所述酶激活剂选自氯化镁或氯化钙中的至少一种;所述盐离子选自氯化钠或氯化钾中的至少一种;所述保护剂选自bsa或酪蛋白中的至少一种;所述表面活性剂选自tx
‑
100、brj
‑
58、tx
‑
305或tx
‑
405中的至少一种;所述防腐剂选自叠氮钠或
proclin
‑
300中的至少一种;
30.(5)试剂r2的制备
31.试剂r2按照下述配方进行配制:
32.缓冲液30
‑
200mm,盐离子10
‑
40g/l,保护剂5.0
‑
25g/l,nad 0.5
‑
4.0g/l,nadh 0.01
‑
0.1g/l,抗甘胆酸抗体10
‑
30mg/l,防腐剂0.5
‑
1.5g/l;
33.所述缓冲液选自mes、甘氨酸或hepes中的至少一种;所述盐离子选自氯化钠或氯化钾中的至少一种;所述保护剂选自bsa或酪蛋白中的至少一种;所述防腐剂选自叠氮钠或proclin
‑
300中的至少一种。
34.优选地,在所述步骤(1)中,所述缓冲液选自咪唑、ches、apmso或tris
‑
hcl中的至少一种,所述盐离子选自氯化钠或氯化钙中的至少一种。
35.优选地,在所述步骤(3)中,所述甘胆酸
‑
葡萄糖六磷酸脱氢酶的标记时间为2
‑
4h。
36.优选地,在所述步骤(3)中,所述终止液选自甘氨酸、酪蛋白或bsa中的至少一种,优选为甘氨酸。
37.优选地,在步骤(3)中,所述浓缩提纯为:以tris
‑
hcl缓冲液作为洗脱液,使用超滤浓缩管6000
‑
9000rpm,4
‑
10℃条件下离心10
‑
20min,离心洗脱4
‑
6次。
38.本发明的有益效果在于:本发明通过限定葡萄糖六磷酸脱氢酶
‑
甘胆酸偶联物的标记时间、限定标记终止液的添加量和加入时间,有效控制了标记效率和标记批件差异,从而有效控制了试剂的批间差异,以及显著提升了试剂的热稳定性和检测性能。于此同时,本发明中通过采用超滤浓缩的方式提纯甘胆酸
‑
葡萄糖六磷酸脱氢酶偶联物,简化了制备工艺,缩短了生产用时,大大提升了试剂的生产效率。
附图说明
39.图1为根据本发明实施例4所提供的甘胆酸赋值样本理论浓度与a组试剂盒测定值的线性关系图;
40.图2为根据本发明实施例4所提供的甘胆酸超高赋值样本理论浓度与b组试剂盒测定值的线性关系图;
41.图3为根据本发明实施例4所提供的甘胆酸超高赋值样本理论浓度与c组试剂盒测定值的线性关系图;
具体实施例
42.本文包括以下的实施例,用于以例证的方式更清楚、明确地阐述本发明的技术方案。本领域技术人员根据本文的公开应当理解,可以在所公开的特定的实施方式中进行许多改变但是仍然获得相似或类似的结果,而不偏离本发明的思想和范围。本发明的具体实施方式仅用于解释本发明,而非意图通过任何方式限制本发明。
43.实施例1葡萄糖六磷酸脱氢酶
‑
甘胆酸偶联物的制备
44.(1)葡萄糖六磷酸脱氢酶溶液的制备
45.按照下述配方进行配制:
[0046][0047]
冰水浴搅拌条件下将上述物料混合均匀,孵育30min后置于2
‑
8℃保存备用。
[0048]
(2)甘胆酸的活化
[0049]
按照下述配方进行溶液配制:
[0050][0051]
冰水浴搅拌条件下将甘胆酸用n
‑
n
‑
二甲基甲酰胺溶解,随后加入羧基活化剂(1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐)进行活化处理40
‑
50min。
[0052]
(3)甘胆酸
‑
酶标记
[0053]
冰水浴搅拌条件下,将活化的甘胆酸溶液逐滴加入葡萄糖六磷酸脱氢酶溶液中,在冰水浴条件下反应4h,得到偶联物稀溶液。
[0054]
(4)标记终止
[0055]
向上述偶联物稀溶液中逐滴加入400ul 3.0mol/l甘氨酸溶液,终止反应。
[0056]
(5)超滤提纯
[0057]
tris
‑
hcl缓冲液作为洗脱液,使用超滤浓缩管7500rpm,8℃条件下离心15min,离心洗脱4
‑
6次,最终得到葡萄糖六磷酸脱氢酶
‑
甘胆酸偶联物浓溶液。
[0058]
本发明中的cg
‑
偶联物制备方法及制备工艺较为简单,标记过程可控且反应后处理简单,仅需要经过超滤浓缩即可得到稳定及较纯的cg
‑
偶联物。
[0059]
实施例2甘胆酸检测试剂盒的制备
[0060]
本发明的甘胆酸(cg)检测试剂盒包括彼此独立的试剂r1和试剂r2双液体组分。
[0061]
(1)试剂r1的制备
[0062]
试剂r1:
[0063]
按照下述配方进行配制,充分搅拌混匀后,置于2
‑
8℃保存。
[0064][0065]
(2)试剂r2的制备
[0066]
试剂r2:
[0067][0068]
实施例3试剂盒的使用方法
[0069]
本实施例中,使用全自动生化分析仪(重庆中元汇吉生物技术有限公司)配合本发明试剂盒进行样本检测。
[0070]
(1)仪器参数设置
[0071]
[0072][0073]
(2)测定方案
[0074][0075]
(3)计算方式
[0076]
使用多点非线性/半对数校准模式,以样条函数为计算模式,根据校准品的值与吸光度变化值作剂量/响应曲线,样品中甘胆酸的含量可根据其吸光度变化值在剂量/响应曲线上计算出。
[0077]
其中,本发明的检测原理为:样本中游离的甘胆酸与葡萄糖六磷酸脱氢酶
‑
甘胆酸偶联物竞争性结合抗甘胆酸特异性抗体位点。样本中游离的甘胆酸越多,竞争结合的抗体位点越多,抗体释放出来的酶标偶联物就越多,游离出来的甘胆酸酶标偶联物催化β
‑
烟酰胺腺嘌呤二核苷酸氧化性(nad+)转化为β
‑
烟酰胺腺嘌呤二核苷酸还原型(nadh)。在340nm波长处测定吸光度的上升与甘胆酸的含量成正比。通过与同样处理的甘胆酸校准品比较,即可计算出样品中的甘胆酸含量。
[0078]
样本中cg(mg/l)=cs
×△
at/
△
as(mg/l)
[0079]
式中:
△
at以空白管吸光度作对照的样品管吸光度值,
△
as以空白管吸光度作对照的校准管吸光度值,cs为校准液中cg的浓度。
[0080]
实施例4试剂盒的性能测试
[0081]
为验证本发明试剂盒的各项性能,共设置3组试剂盒进行性能验证:
[0082]
a组:本发明实施例2制备得到的试剂盒;
[0083]
b组:甘胆酸(cg)检测试剂盒(均相酶免疫法)(武汉生之源);
[0084]
c组:专利cn106405069a实施例1所述方法制备得到的试剂盒。
[0085]
其中c组试剂盒在制备过程中均采用实验室现有的试剂(即a组以及c组试剂盒中涉及到相同的组分,例如抗甘胆酸抗体以及葡萄糖六位磷酸脱氢酶等组分均采用同一厂家同批号产品),a组试剂盒按照实施例3所述的使用方法进行测试,b组按照其说明书进行测试,c组按照其实施例中的使用方法进行测试。
[0086]
(1)准确度验证
[0087]
使用三组试剂盒分别对临床赋值样本进行准确度测试,设2个重复,通过全自动生化分析仪(重庆中元汇吉生物技术有限公司)读取信号,计算测定均值与靶值得相对偏差进行准确度验证。检测结果如下表所示:
[0088]
表1准确度验证
[0089][0090]
由上述实验结果可知,三组试剂盒测试值1与靶值1的相对偏差分别为0.49%、
‑
3.09%以及
‑
0.49%,测试值2与靶值2的相对偏差分别为0.22%、
‑
5.71%以及0.74%。其中本发明实施例1制备得到的试剂盒(a组)检测准确度显著优于b组试剂盒。
[0091]
(2)精密度验证
[0092]
选取临床甘胆酸低值样本、中值样本以及高值样本,使用三组试剂盒分别对样本进行测试,每个样本分别重复测定10次,通过全自动生化分析仪(重庆中元汇吉生物技术有限公司)读取信号,分别计算测定均值和标准差,计算变异系数进行精密度考察。检测结果如下表所示:
[0093]
表2精密度验证
[0094][0095]
由上述实验结果可知,三组试剂盒在低值样本检测时的变异系数分别为1.92%、4.95%以及3.33%,中值样本检测时的变异系数分别为1.59%、4.45%以及3.08%,高值样本检测时的变异系数分别为1.55%、5.14%以及4.52%,实验结果说明,本发明实施例1制备得到的试剂盒(a组)在检测低值样本、中值样本以及高值样本时的精密度优于对照试剂盒
‑
1(b组)以及对照试剂盒
‑
2(c组)。
[0096]
(3)线性范围验证
[0097]
选择临床超高值赋值样本以及低值赋值样本,其中高值样本的理论浓度值为153.03mg/l,低值样本的理论浓度值为0.11mg/l,随后利用高值样本以及低值样本按比例配制各浓度梯度样本,使用三组试剂盒分别对样本进行测试,每个样本分别重复测定2次,通过全自动生化分析仪(重庆中元汇吉生物技术有限公司)读取信号,分别计算测定均值进行线性范围考察。检测结果如下表所示:
[0098]
表3线性范围验证
[0099][0100]
由上述实验结果可知,本发明实施例1制备得到的试剂盒(a组)在样本浓度为0.11
‑
113.03mg/l范围内,检测值与理论值的相对偏差均较小,而对照试剂盒
‑
1(b组)以及对照试剂盒
‑
2(c组)在样本浓度大于84.80mg/l时,其检测值与理论值的相对偏差均大于20%。同时,将三组试剂盒的检测结果与样本浓度理论值进行相关性分析(如附图1
‑
3所示),a组检测值与理论值的相关性显著优于b组以及c组,其中a组检测值与理论值的相关性r2为0.9999,b组r2为0.9207,c组r2为0.9489。实验结果说明本发明实施例1制备得到的试剂盒较对照试剂盒
‑
1以及对照试剂盒
‑
2的线性范围更宽,尤其是针对浓度高于100mg/l的高值样本,两组对照试剂盒均不能进行准确检测。
[0101]
(4)热稳定性验证
[0102]
将三组试剂盒提供的试剂封闭放置在37℃恒温水浴锅中,连续放置16天,每隔一天分别使用三组试剂盒对临床赋值样本进行检测,每个样本重复测定两次,通过全自动生化分析仪(重庆中元汇吉生物技术有限公司)读取信号,分别监控三组试剂盒测定值的变化。检测结果如下表所示:
[0103]
表4热稳定性验证
[0104]
[0105][0106]
注:相对偏差为对应天数的检测结果较相同试剂盒在第“0”天时检测结果的相对偏差。
[0107]
由上述实验结果可知,本发明实施例1制备得到的试剂盒(a组)在37℃热加速16天内,检测结果几乎无变化,稳定性较好。而对比试剂盒(b组及c组)在37℃热加速12天后,检测结果较第“0”天变化明显,相对偏差均较大。实验结果说明,本发明提供的甘胆酸测定试剂盒具有较好的热稳定性。
[0108]
实施例4甘胆酸
‑
酶标记工艺对试剂盒性能的影响
[0109]
(1)为了验证甘胆酸
‑
酶标记时间对试剂盒性能的影响,共设置5组试剂盒:
[0110]
a组:本发明实施例2制备得到的试剂盒;
[0111]
b组:所述试剂盒与实施例2试剂盒的区别仅在于,甘胆酸
‑
酶标记时间为1h;
[0112]
c组:所述试剂盒与实施例2试剂盒的区别仅在于,甘胆酸
‑
酶标记时间为2h;
[0113]
d组:所述试剂盒与实施例2试剂盒的区别仅在于,甘胆酸
‑
酶标记时间为6h;
[0114]
e组:所述试剂盒与实施例2试剂盒的区别仅在于,甘胆酸
‑
酶标记时间为8h。
[0115]
将上述5组试剂盒对应的r1试剂置于37℃热加速8天,分别使用三组试剂盒对临床赋值样本进行检测,每个样本重复测定两次,通过全自动生化分析仪(重庆中元汇吉生物技术有限公司)读取信号,观察3组试剂盒检测结果的变化。检测结果如下表所示:
[0116]
表5标记时间对热稳定的影响
[0117][0118]
注:相对偏差为对应天数的检测结果较相同试剂盒在第“0”天时检测结果的相对偏差。
[0119]
实验结果显示,甘胆酸
‑
葡萄糖六磷酸脱氢酶标记时间为2
‑
4h时,试剂的热稳定最高,推测其原因为随着标记时间的延长,标记效率升高,随着偶联物的增多导致反应体系的稳定性下降,进而使试剂的热稳定性在下降。
[0120]
(2)为了验证甘胆酸
‑
酶标记过程中加入终止液可有效提升标记效率,共设置4组实验:
[0121]
a组:本发明实施例2制备得到的试剂盒;
[0122]
b组:所述试剂盒与实施例2试剂盒的区别仅在于,甘胆酸
‑
酶标记过程中未加入终止液;
[0123]
c组:所述试剂盒与实施例2试剂盒的区别仅在于,甘胆酸
‑
酶标记过程中加入的终止液为酪蛋白;
[0124]
d组:所述试剂盒与实施例2试剂盒的区别仅在于,甘胆酸
‑
酶标记过程中加入的终止液为bsa。
[0125]
将上述4组试剂盒对应的r1试剂置于37℃热加速3天,并在全自动生化分析仪(重庆中元汇吉生物技术有限公司)上进行定标,观察甘胆酸
‑
酶标记过程中加入终止液对试剂反应性能及热稳定性的影响。检测结果如下表所示:
[0126]
表6终止液对热稳定性的影响
[0127][0128]
实验结果显示,在甘胆酸
‑
酶标记过程中,添加终止液将会提升试剂的热稳定性,尤其是当添加甘氨酸终止液时,试剂的热稳定性显著增强。推测其原因为如果未添加终止液,在后续的超滤浓缩过程中,标记反应仍在继续,使标记效率过高,标记效率无法控制,进而导致试剂的稳定性降低。本发明通过在甘胆酸
‑
葡萄糖六磷酸脱氢酶标记过程中的特定时间段里加入特定量的反应终止液(甘氨酸),可以有效控制标记效率,进而控制试剂r1的分析性能和稳定性。
[0129]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变形。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1