一种叶下珠胶囊的质量控制方法与应用与流程
1.本发明属于生物医药技术领域,具体涉及一种叶下珠胶囊的质量控制方法与应用。
背景技术:
2.叶下珠是一个广泛分布种,全世界有600多种,我国有33种,4个变种。三十多年来,国内外进行了广泛深入的研究,已从叶下珠中发现的化学成分有黄酮、鞣质、香豆素、甾体、木脂素、酚酸、有机酸等等70多种。其中以没食子酸含量最高,鉴定了柯里拉京(corilagin)是它的有效成分之一。应用不同的叶下珠样品发现了叶下珠的生理活性颇多:抗病毒、抗肿瘤、抗菌、抗血栓、免疫调节、保肝、抗氧化、抑制α
‑
淀粉酶、利尿等等。广泛应用于医药、食品、农牧业、日化。
3.但目前作为药品,以单方制剂的产品只有“叶下珠片”和“叶下珠胶囊”。这两个制剂的处方不同,制法不同、质量标准也不同、功能与主治也有差异;而与叶下珠胶囊处方相同、制法相似的叶下珠颗粒,是我公司叶下珠胶囊的“剂改”品种,且与现在的叶下珠胶囊质量标准不同、制法也有差异、功能也有不同。因此,本发明是要弥补现有技术不足,解决目前生物技术领域急需解决的问题。
4.叶下珠胶囊是我公司依据傣医药长期应用叶下珠的历史,以及国内外研究的成果,以云南产的叶下珠p.urinaria l.研发出来治疗慢性肝炎的民族药。其功能与主治为:清热解毒、祛湿利胆。用于肝胆湿热所引起的胁痛、腹胀、纳差、恶心、便溏;慢性肝炎见上述证候者。批准文号为:国药准字 z20027597;药品标准为ws
‑
11435(zd
‑
1435)
‑
2002
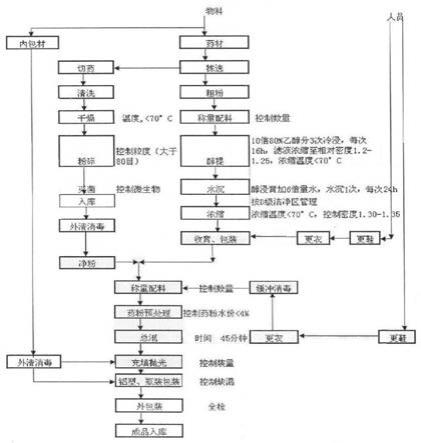
‑
2012。是全国独家品种。
5.随着生产的发展,临床推广(已发表论文十余篇),叶下珠胶囊的安全性、有效性得到了认可,对产品高质量的追求,产品的质量保障尤显得重要。
6.在对叶下珠胶囊的上市再研究中不仅仅是对其功能与主治的再验证,积极发掘其潜力,拓展其新用途也是重要的一方面。
技术实现要素:
7.本发明的目的是为了解决现有技术的不足,提供一种叶下珠胶囊的质量控制方法,全面有效地对叶下珠胶囊生产的全过程进行质量控制与检测,保持药品的安全性、有效性和可控性。
8.本发明的另一目的是公开叶下珠胶囊的一个新应用。是提出了一种解决肝细胞损伤、肝纤维化的技术方案。经药理试验(治疗酒精性肝纤维化、药物性肝损伤、免疫性肝纤维化)证明叶下珠胶囊具有防治肝细胞损伤、肝纤维化的作用,有广泛的应用前景。
9.为实现上述目的,本发明采用的技术方案如下:
10.一种叶下珠胶囊的质量控制方法,包括原料控制、制备方法质量控制和产品质量控制;
11.(1)原料控制:
12.叶下珠药材采用品种为phyllanthus urinaria l.;采用人工栽培的方式栽培;
13.(2)制备方法质量控制:
14.取叶下珠粗粉5000g,用10倍量的80%乙醇分三次冷浸渍,滤过,滤液控制温度<70℃减压浓缩回收乙醇,浓缩成相对密度为1.20~1.25(40℃)的清膏;加入六倍量的水沉淀24小时,取上清液,控制温度<70℃减压浓缩,最终成相对密度为1.30
‑
1.35(40℃)的稠膏;加入叶下珠细粉200g,混匀,于60℃干燥、粉碎、过筛、制粒、填囊,制成1000粒即得叶下珠胶囊;
15.(3)产品质量控制:
16.1)叶下珠的鉴别
17.取叶下珠胶囊内容物2g,加乙醇20ml,振摇2小时,滤过,滤液浓缩至2ml,加硅胶2g,拌匀,挥干溶剂后,装入色谱柱中,以乙醚8ml洗脱,弃乙醚液,加乙醇8ml洗脱,蒸干;加甲醇1ml,使溶解,作为供试品溶液;
18.另取叶下珠对照品药材2g,同法制成对照品药材溶液;
19.照薄层色谱法试验,取得上述两种溶液10μl,分别点于同一硅胶g薄层板上,以体积比为7.5:1 的三氯甲烷
‑
甲醇为展开剂,展开,取出,晾干,喷以质量浓度为10%的硫酸乙醇溶液,在105℃加热至斑点显色清晰;供试品色谱中,在与对照组药材色谱相应的位置上,显相同的颜色斑点;
20.2)含量测定:
21.采用高效液相色谱法:
22.色谱条件与系统适用性试验:以十八烷基硅烷键合硅胶为填充物;以体积比为20:80的甲醇和质量浓度0.5%冰醋酸的混合液作为洗脱液为流动相;检测波长为269nm;理论板数按柯里拉京计数应不低于2000;
23.对照品溶液制备:取柯里拉京对照品适量,精密称定,加甲醇制成每1ml含0.1mg的溶液,即得;
24.供试品溶液的制备:取装量差异项目下的叶下珠内容物,混匀,取约0.5g,精密称定,置于100ml 量瓶中,加入甲醇30ml,密塞,超声处理10分钟,放冷至室温,加流动相稀释至刻度,摇匀,滤过,取续滤液,即得;
25.测定法:分别精密吸取对照品溶液与供试品溶液各20μl,注入液相色谱仪,测定,即得;
26.叶下珠胶囊每粒含叶下珠以柯里拉京计,不得少于3.0mg。
27.进一步,优选的是,叶下珠药材人工栽培的具体方法为:
28.要求周边1km范围内无污染源,土壤疏松透气,ph5.8
‑
7;向阳;向地块施肥,深翻混匀以整地作畦;地块整高畦,面宽1.2m;四月播种,五月出苗,六月初移栽定植,九月末采收全株,晒干,即得。
29.进一步,优选的是,要求土壤为沙壤,肥沃。
30.进一步,优选的是,叶下珠粗粉为过40目筛的筛下物;叶下珠细粉的粒径>80目。
31.进一步,优选的是,用10倍量的80%乙醇分三次冷浸渍的具体方法为:第一次4倍量,第二、三次各3倍量,每次16小时。
32.进一步,优选的是,叶下珠的鉴别中所采用的硅胶粒径为100
‑
200目;含量测定中,超声功率为 250w,频率为50khz。
33.本发明同时提供上述叶下珠胶囊的质量控制方法获得的叶下珠胶囊作为防治肝细胞损伤药物的应用。
34.本发明还提供上述叶下珠胶囊的质量控制方法获得的叶下珠胶囊作为防治肝纤维化药物的应用。
35.本发明并且提供上述叶下珠胶囊的质量控制方法获得的叶下珠胶囊作为抑制肝细胞凋亡、促进 hsc的凋亡药物的应用。
36.本发明另外提供上述叶下珠胶囊的质量控制方法获得的叶下珠胶囊作为抑制肝组织的胶原生成药物的应用。
37.本发明除非另有说明,否则百分号表示质量百分数。
38.叶下珠胶囊阻断肝细胞损伤、肝纤维化的作用:
39.1.方法:
40.采用烈性酒灌胃法复制wistar雄性大鼠酒精性肝纤维化模型、腹腔注射对乙酰氨基酚250mg/kg, 1次/天,连续7天,复制药物性肝损伤模型、腹腔注射无菌猪血清复制免疫性肝纤维化模型。常规检测丙氨酸转移酶(alt)、门冬氨酸转移酶(ast)、白蛋白(alb)、球蛋白(glo)、总蛋自(tp)含量、采用 elisa测定血清iv型胶原(iv
‑
c)、透明质酸(ha)、层黏连蛋白(ln)含量及肝组织mda、gsh、sod、 gsh
‑
px水平;he染色观测肝组织病理学变化、masson染色检测肝纤维化、采用tunel法检测肝组织的肝细胞凋亡、tunel
‑
αsma双标方法检测肝星状细胞(hsc)的凋亡,同时检测肝线粒体膜电位及肿胀。采用rt
‑
qpcr和免疫组化方法分别检测上述各组动物肝组织nf
‑
kb、tgf
‑
β1、mmp
‑
2及timp
‑
1 基因及其蛋白的表达。
41.2.实验结果:
42.叶下珠胶囊对上述3种肝纤维化模型动物能降低血清ast及alt水平,升高alb、glo及tp 的含量;显著降低ha、ln及iv
‑
c的含量。肝组织病理学检测显示,与模型组比较,叶下珠胶囊干预组的肝细胞有轻度脂肪变性、坏死较少,中央静脉及汇管区轻度纤维化,胶原纤维沿窦周散在分布,汇管区及小叶间有少量纤维组织增生。masson染色表明,叶下珠胶囊组较模型组胶原纤维分布明显减少,且显著减少肝组织胶原面积。与药物性肝损伤模型组比较,中、高剂量叶下珠胶囊明显降低 mda水平,升高sod、gsh、gsh
‑
px水平,且明显降低线粒体肿胀度、提高线粒体膜电位水平。在上述3种模型中,叶下珠治疗组,肝细胞凋亡明显减少、hsc的凋亡增多,且a
‑
sma着色减弱,且呈量效关系,随给药剂量增大,hsc凋亡指数增加。叶下珠胶囊抑制纤维化肝组织nf
‑
kb、tgf
‑
β1和timp
‑
1蛋白及其mrna的表达、上调mmp
‑
2蛋白及其mrna的表达。
43.3.结论:
44.1.叶下珠胶囊对酒精性、药物性及免疫肝纤维化的肝细胞功能具有保护作用,可以改善肝纤维化的程度。
45.2.叶下珠胶囊能抑制肝细胞凋亡,促进hsc的凋亡。
46.3.叶下珠胶囊抑制纤维化肝组织nf
‑
kb、tgf
‑
β1和timp
‑
1的表达、上调mmp
‑
2表达,进而抑制肝组织的胶原生成,可能是叶下珠胶囊的抗肝纤维化的重要作用机制之一。
47.本发明叶下珠药材人工栽培施肥时,以农家肥为主,并使用适量过磷酸钙和尿素。
叶下珠人工栽培时视土壤的肥力不同,每亩可施农家肥200~400公斤,过磷酸钙60~120公斤,尿素10~20公斤。本发明对于农家肥、过磷酸钙和尿素的用量不做具体限制,因地块不同而有所不同。
48.叶下珠胶囊含量分析时,严格按“含量测定”项下的要求进行。
49.本发明制备方法质量控制中粉碎到≥80目细粉,过筛目的为控制粒度及防止异物入内。
50.本发明与现有技术相比,其有益效果为:
51.1)本发明将现代药品生产管理融入到质量控制中,坚定药品的质量是生产出来的,建立了从源头抓起,全程质量控制,建立完善的质量标准及较高、合理的有效成分柯里拉京(corilagin)含量检测方法和标准。
52.2)用人工栽培(按gap标准)种植叶下珠,符合云南省中药材标准2005年版云ycbz0010
‑
2005 规定。实现了品种纯正,采收时间可控,质量保证,供需不误。改变了品种混杂,良莠不齐的局面。
53.3)本工艺采用冷浸渍法,减少了提取溶剂用量,将对热敏感活性成分的负面影响降到最低。
54.4)采用醇提水沉的工艺流程,简单易行的让有效成分corilagin溶出,工业化至简易行。
55.第三方叶下珠胶囊的hplc指纹图谱研究也证实:10批样品相似度在0.91
‑
0.97,表明了叶下珠胶囊的生产工艺是可行的,质量是稳定的,药效是得到保障的。
56.经药理试验(治疗酒精性肝纤维化、药物性肝损伤、免疫性肝纤维化)证明叶下珠胶囊具有防治肝细胞损伤、肝纤维化的作用,有广泛的应用前景。
附图说明
57.图1为本发明制备方法质量控制的流程图;
58.图2为叶下珠胶囊对酒精肝损伤大鼠肝组织病理学的影响(he染色,
×
200);
59.图3为叶下珠胶囊对酒精肝损伤大鼠肝组织病理学的影响(masson染色,
×
400);
60.图4为叶下珠胶囊对酒精肝损伤大鼠肝细胞凋亡的影响(tunel染色,
×
400);
61.图5为叶下珠胶囊对酒精肝损伤大鼠肝组织nf
‑
kb蛋白表达的影响(免疫组化法);
62.图6为叶下珠胶囊对酒精肝损伤大鼠肝组织tgf
‑
β1蛋白表达的影响(免疫组化法);
63.图7为叶下珠胶囊对酒精肝损伤大鼠肝组织mmp
‑
2蛋白表达的影响(免疫组化法);
64.图8为叶下珠胶囊对酒精肝损伤大鼠肝组织timp
‑
1蛋白表达的影响(免疫组化法);
65.图9为叶下珠胶囊对对乙酰氨基酚肝损伤大鼠肝组织病理学的影响(he染色,
×
200);
66.图10为叶下珠胶囊对对乙酰氨基酚肝损伤大鼠肝组织病理学的影响(masson染色,
×
400);
67.图11为叶下珠胶囊对对乙酰氨基酚肝损伤大鼠肝细胞凋亡的影响(tunel染色,
×
400);
68.图12为叶下珠胶囊对对乙酰氨基酚肝损伤大鼠肝组织nf
‑
kb蛋白表达的影响(免疫组化法);
69.图13为叶下珠胶囊对对乙酰氨基酚肝损伤大鼠肝组织tgf
‑
β1蛋白表达的影响(免疫组化法);
70.图14为叶下珠胶囊对对乙酰氨基酚肝损伤大鼠肝组织mmp
‑
2蛋白表达的影响(免疫组化法);
71.图15为叶下珠胶囊对对乙酰氨基酚肝损伤大鼠肝组织timp
‑
1蛋白表达的影响(免疫组化法);
72.图16为叶下珠胶囊对免疫性肝损伤大鼠肝组织病理学的影响(he染色,
×
200);
73.图17为叶下珠胶囊对免疫性肝损伤大鼠肝组织病理学的影响(masson染色,
×
400);
74.图18为叶下珠胶囊对免疫性肝损伤大鼠肝细胞凋亡的影响(tunel染色,
×
400);
75.图19为叶下珠胶囊对免疫性肝损伤大鼠肝组织nf
‑
kb蛋白表达的影响(免疫组化法);
76.图20为叶下珠胶囊对免疫性肝损伤大鼠肝组织tgf
‑
β1蛋白表达的影响(免疫组化法);
77.图21为叶下珠胶囊对免疫性肝损伤大鼠肝组织mmp
‑
2蛋白表达的影响(免疫组化法);
78.图22为叶下珠胶囊对免疫性肝损伤大鼠肝组织timp
‑
1蛋白表达的影响(免疫组化法);
79.图2~图8、图16
‑
图22中,a为正常对照组;b为模型组;c为125mg/kg的叶下珠胶囊组;d 为250mg/kg的叶下珠胶囊组;e为500mg/kg的叶下珠胶囊组;f为250mg/kg的益肝灵胶囊组;g为 10mg/kg的易善复胶囊组。
80.图9~图15中,a为正常对照组;b为模型组;c为250mg/kg的叶下珠胶囊组;d为500mg/kg 的叶下珠胶囊组;e为1000mg/kg的叶下珠胶囊组;f为500mg/kg的益肝灵胶囊组。
具体实施方式
81.下面结合实施例对本发明作进一步的详细描述。
82.本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用材料或设备未注明生产厂商者,均为可以通过购买获得的常规产品。
83.实施例1:原料控制
84.使用的叶下珠药材符合云南省中药材标准2005年版:云ycbz0010
‑
2005的规定,经中科院昆明植物所鉴定为p.urinaria l.
85.这个人工栽培品种是用云南地区分布的野生品经驯化选育出来的优良品种。其中corilagin含量≥0.8
‰
;优于野生品种。其产量可达2200kg/亩(药材~440kg/亩)。
86.按gap要求执行,周边(1km范围内)无污染源,土壤疏松透气,较肥沃,沙壤为好,ph5.8
‑
7;向阳;地块施农家肥为主,及适量过磷酸钙和尿素,深翻混匀以整地作畦;地块整
高畦,面宽1.2m,利于排灌;四月播种,五月出苗,六月初移栽定植,九月末采收全株,晒干,即得。比较现有方法与本发明方法药材中corilagin的含量,结果如表1和表2所示。
87.表1叶下珠药材中corilagin含量测定*(c.mg/g)(n=3)
[0088][0089]
*闫小玉著:沈阳药科大学学报2012,29(1):48
[0090]
表2叶下珠人工栽培药材中corilagin的含量测定(c.mg/g)(n=2)
[0091][0092]
实施例2:制备方法质量控制
[0093]
处方:叶下珠5200g
[0094]
制法:取叶下珠粗粉(40目)5000g,用10倍量的80%乙醇分三次冷浸渍。(第一次4倍量,第二、三次各3倍量,每次16小时)滤过,滤液控制温度<70℃减压浓缩回收乙醇,浓缩成相对密度为 1.20~1.25(40℃)的清膏;加入六倍量的水沉淀24小时,取上清液,控制温度<70℃减压浓缩,最终成相对密度为1.30
‑
1.35(40℃)的稠膏。加入在洁净区粉碎、菌检合格的叶下珠细粉(>80目)200g,混匀,于60℃干燥、粉碎、过筛、质检、制粒、填囊,制成1000粒即得。流程图如图1所示。
[0095]
实施例3:产品质量控制
[0096]
1)叶下珠的鉴别
[0097]
取本品内容物2g,加乙醇20ml,振摇2小时,滤过,滤液浓缩至2ml,加硅胶(100
‑
200目)2g,拌匀,挥干溶剂后,装入色谱柱中,以乙醚8ml洗脱,弃乙醚液,加乙醇8ml洗脱,蒸干;加甲醇 1ml,使溶解,作为供试品。另取叶下珠对照品药材2g,同法制成对照品药材溶液。照薄层色谱法(中国药典2005年版一部附录vib)试验,取得上述两种溶液10μl,分别点于同一硅胶g薄层板上,以三氯甲烷
‑
甲醇(7.5:1)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰。供试品色谱中,在与对照组药材色谱相应的位置上,显相同的颜色斑点。
[0098]
2)含量测定
[0099]
照高效液相色谱法(中国药典2005年版一部附录il)
[0100]
色谱条件与系统适用性试验:以十八烷基硅烷键合硅胶为填充物;以甲醇
‑
0.5%冰醋酸为洗脱液 (20:80)为流动相;检测波长为269nm。理论板数按柯里拉京(corilagin)计数应不低于2000。
[0101]
对照品溶液制备:取柯里拉京对照品适量,精密称定,加甲醇制成每1ml含0.1mg的溶液,即得。
[0102]
供试品溶液的制备:取装量差异项目下的本品内容物,混匀,取约0.5g,精密称定,置于100ml 量瓶中,加入甲醇30ml,密塞,超声处理10分钟,(功率250w,频率50khz),放冷,加流动相稀释至刻度,摇匀,滤过,取续滤液,即得。
[0103]
测定法:分别精密吸取对照品溶液与供试品溶液各20μl,注入液相色谱仪,测定,
即得。
[0104]
本品每粒含叶下珠以柯里拉京(c
28
h
24
o
17
)计,不得少于3.0mg。
[0105]
3)上述含量测定方法通过以下试验确立:吸收度、精密度、稳定性、加样回收、重现性及样品测定。
[0106]
色谱条件:以十八烷基硅烷键合硅胶为填充物;以甲醇
‑
0.5%冰醋酸为洗脱液(20:80)为流动相;检测波长为269nm。流速为1.0ml/min。
[0107]
1、测定波长
[0108]
紫外扫描:取柯里拉京对照品溶液1ml,稀释成40μg/ml做紫外扫描光谱,由扫描结果可以看出,柯里拉京对照品溶液的紫外扫描谱图在269nm处有最大吸收,且无干扰。
[0109]
2、标准曲线及回归方程
[0110]
分别用不同浓度的对照品溶液,按高效液相色谱法分别测定其吸收度,其结果如表3。
[0111]
表3
[0112][0113]
结果表明,柯里拉京在对照品溶液40.48~506μg/ml范围内,具有良好的线性关系。
[0114]
取同一供试品溶液,按上述色谱条件重复测定6次,其峰面积如表4所示,结果表明,本发明方法精密度较好。
[0115]
表4
[0116][0117]
取同一供试品溶液,分别在制备后0、3、6、12、24h,按上述色谱条件测定,结果如表5。
[0118]
表5
[0119][0120]
精密称取已知含量的供试品,分别精密加入柯里拉京对照品,按照供试品溶液制备方法制备成待测溶液,按上述色谱条件测定,结果如表6。
[0121]
表6
[0122][0123]
取同一批叶下珠胶囊供试品,按照供试品溶液制备方法制备成供试品溶液,按上述色谱条件测定, rsd=2.13%,说明重现性良好。
[0124]
采用本发明方法制备的叶下珠胶囊,采用本发明含量测定方法测定,结果如表7所示。
[0125]
表7
[0126][0127]
实施例4:叶下珠胶囊作用及其机制
[0128]
1.方法:
[0129]
采用烈性酒灌胃法复制wistar雄性大鼠(180
‑
220g)酒精性肝纤维化模型(给予体积分数为0.56 的酒精7g(kg/d),1次/天,共12周)、腹腔注射昆明种小鼠(18
‑
22g)对乙酰氨基酚250mg/kg,1 次/天,连续7天,复制药物性肝损伤模型、腹腔注射无菌猪血清(每次0.5ml,每周两次,连续14 周)复制免疫性肝纤维化模型。常规检测丙氨酸转移酶(alt)、门冬氨酸转移酶(ast)、白蛋白(alb)、球蛋白(glo)、总蛋自(tp)含量、采用elisa测定血清iv型胶原(iv
‑
c)、透明质酸(ha)、层黏连蛋白 (ln)含量及肝组织mda、gsh、sod、gsh
‑
px水平;he染色观测肝组织病理学变化、masson染色检测肝纤维化、采用tunel法检测肝组织的肝细胞凋亡、tunel
‑
αsma双标方法检测肝星状细胞(hsc) 的凋亡,同时检测肝线粒体膜电位及肿胀。采用rt
‑
qpcr和免疫组化方法分别检测上述各组动物肝组织nf
‑
kb、tgf
‑
β1、mmp
‑
2及
timp
‑
1基因及其蛋白的表达。
[0130]
2.实验结果:
[0131]
叶下珠胶囊对上述3种肝纤维化模型动物能降低血清ast及alt水平,升高alb、glo及tp 的含量;显著降低ha、ln及iv
‑
c的含量。肝组织病理学检测显示,与模型组比较,叶下珠胶囊干预组的肝细胞有轻度脂肪变性、坏死较少,中央静脉及汇管区轻度纤维化,胶原纤维沿窦周散在分布,汇管区及小叶间有少量纤维组织增生,如图2。masson染色表明,叶下珠胶囊组较模型组胶原纤维分布明显减少,且显著减少肝组织胶原面积。与药物性肝损伤模型组比较,中、高剂量叶下珠胶囊明显降低mda水平,升高sod、gsh、gsh
‑
px水平,且明显降低线粒体肿胀度、提高线粒体膜电位水平。在上述3种模型中,叶下珠治疗组,肝细胞凋亡明显减少、hsc的凋亡增多,且a
‑
sma着色减弱,且呈量效关系,随给药剂量增大,hsc凋亡指数增加。叶下珠胶囊抑制纤维化肝组织nf
‑
kb、tgf
‑
β1和timp
‑
1蛋白及其mrna的表达、上调mmp
‑
2蛋白及其mrna的表达。
[0132]
其中:叶下珠胶囊对酒精肝损伤大鼠肝组织的影响如表8~表14、图2~图8所示。用正常大鼠作为正常对照组,酒精性肝纤维化模型大鼠随机分为模型组、125、250、500mg/kg的叶下珠胶囊组、 250mg/kg的益肝灵胶囊组、10mg/kg的易善复胶囊组,每组15只。
[0133]
叶下珠胶囊对对乙酰氨基酚药物损伤小鼠肝组织的影响如表15~表22、图9~图15所示。用正常小鼠作为正常对照组,对乙酰氨基酚药物损伤模型大鼠随机分为模型组、250、500、1000mg/kg的叶下珠胶囊组、500mg/kg的益肝灵胶囊组,每组15只。
[0134]
叶下珠胶囊对免疫性肝损伤大鼠肝组织的影响如表23~表29、图16~图22所示。用正常大鼠作为正常对照组,对乙酰氨基酚药物损伤模型大鼠随机分为模型组、125、250、500mg/kg的叶下珠胶囊组、250mg/kg的益肝灵胶囊组、10mg/kg的易善复胶囊组,每组15只。
[0135]
表8叶下珠胶囊对酒精性肝损伤大鼠肝功能指标的影响
[0136][0137]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型比较;
e
p<0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0138]
表9叶下珠胶囊对酒精性肝损伤大鼠血清iv
‑
c、ha和ln含量的影响
[0139][0140]
n=10,x
±
s,
b
p<0.01,模型组与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0141]
表10叶下珠胶囊对酒精性肝损伤大鼠肝脏组织胶原面积的影响(masson染色)
[0142][0143]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0144]
表11叶下珠胶囊对酒精性肝损伤大鼠肝细胞凋亡影响(tune1染色)
[0145][0146]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
c
p<0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0147]
表12叶下珠胶囊对酒精性肝损伤大鼠肝星状细胞凋亡影响(tune1+α
‑
sma免疫荧
光双标)
[0148][0149]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0150]
表13叶下珠胶囊对酒精性肝损伤大鼠肝组织nf
‑
kb、tgf
‑
β1、mmp
‑
2和timp
‑
1 mrna表达的影响(2
‑
δδct
)
[0151][0152]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0153]
表14叶下珠胶囊对酒精性肝损伤大鼠肝组织nf
‑
kb、tgf
‑
β1、mmp
‑
2和timp
‑
1 mrna表达的影响 (sum
‑
iod值,免疫组化法)
[0154][0155]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
c
p<0.05,与益肝灵胶囊组比较,
f
p<005,与易善复胶囊组比较.
[0156]
表15叶下珠胶囊对对乙酰氨基酚药物损伤小鼠肝功能指标的影响
[0157][0158]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较.
[0159]
表16叶下珠胶囊对对乙酰氨基酚药物损伤小鼠肝组织mda、sod、gsh、gsh
‑
px含量的影响
[0160][0161]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01与模型组比较;
e
p<0.05,与益肝灵胶囊组比较.
[0162]
表17叶下珠胶囊对对乙酰氨基酚药物性肝损伤小鼠肝线粒体膜电位及肿胀的影响
[0163][0164]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较.
[0165]
表18叶下珠胶囊对对乙酰氨基酚药物性肝损伤小鼠肝脏组织胶原面积的影响(masson染色)
[0166][0167]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
d
p<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较.
[0168]
表19叶下珠胶囊对对乙酰氨基酚药物性肝损伤小鼠肝细胞凋亡影响(tune1染色)
[0169][0170]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
e
p <0.05,与益肝灵胶囊组比较.
[0171]
表20叶下珠胶囊对对乙酰氨基酚药物性肝损伤肝星状细胞凋亡影响(tune1+α
‑
sma免疫荧光双标)
[0172][0173]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
d
p<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较.
[0174]
表21叶下珠胶囊对对乙酰氨基酚药物性肝损伤小鼠肝组织nf
‑
kb、tgf
‑
β1、mmp
‑
2和timp
‑
1 mrna 表达的影响(2
‑
δδct
)
[0175][0176]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,dp<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较,
[0177]
表22叶下珠胶囊对对乙酰氨基酚药物性肝损伤小鼠肝组织nf
‑
kb、tgf
‑
β1、mmp
‑
2和timp
‑
1 mrna 表达的影响(sum
‑
iod值,免疫组化法)
[0178][0179]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较:
e
p<0.05,与益肝灵胶囊组比较.
[0180]
表23叶下珠胶囊对免疫性肝损伤大鼠肝功能指标的影响
[0181][0182]
n=10,x
±
s,
b
p<0.01与正常对照组比较:
c
p<0.05,
d
p<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0183]
表24叶下珠胶囊对免疫性肝损伤大鼠血清iv
‑
c、ha和ln含量的影响
[0184][0185]
n=10,x
±
s,
b
p<0.01,模型组与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0186]
表25叶下珠胶囊对免疫性肝损伤大鼠肝脏组织胶原面积的影响(masson染色)
[0187][0188]
n=10,x
±
s,
b
p<001与正常对照组比较;
d
p<001,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0189]
表26叶下珠胶囊对免疫性肝损伤大鼠肝细胞凋亡影响(tune1染色)
[0190][0191]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
e
p <0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0192]
表27叶下珠胶囊对免疫性肝损伤大鼠肝星状细胞凋亡影响(tune1+α
‑
sma免疫荧光双标)
[0193][0194]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
e
p <0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0195]
表28叶下珠胶囊对免疫性肝损伤大鼠肝组织nf
‑
kb、tgf
‑
β1、mmp
‑
2和timp
‑
1mrna表达的影响 (2
‑
δδct
)
[0196][0197]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0198]
表29叶下珠胶囊对免疫性肝损伤大鼠肝组织nf
‑
kb、tgf
‑
β1、mmp
‑
2和timp
‑
1 mrna表达的影响(sum
‑
iod值,免疫组化法)
[0199][0200]
n=10,x
±
s,
b
p<0.01与正常对照组比较;
c
p<0.05,
d
p<0.01,与模型组比较;
e
p<0.05,与益肝灵胶囊组比较,
f
p<0.05,与易善复胶囊组比较.
[0201]
3结论:
[0202]
1叶下珠胶囊对酒精性、药物性及免疫肝纤维化的肝细胞功能具有保护作用,可以改善肝纤维化的程度。
[0203]
2叶下珠胶囊能抑制肝细胞凋亡,促进hsc的凋亡。
[0204]
3叶下珠胶囊抑制纤维化肝组织nf
‑
kb、tgf
‑
β1和timp
‑
1的表达、上调mmp
‑
2表达,进而抑制肝组织的胶原生成,可能是叶下珠胶囊的抗肝纤维化的重要作用机制之一。
[0205]
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1