腐霉利、克百威和多菌灵三联免疫层析检测试剂盒及检测方法与流程
1.本发明涉及农药残留检测技术领域,具体地说,涉及一种腐霉利、克百威和多菌灵三联免疫层析检测试剂盒及检测方法。
背景技术:
2.腐霉利(procymidone),化学名称n
‑
(3,5
‑
二氯苯基)
‑
1,2
‑
二甲基环丙烷
‑
1,2
‑
二甲酰基亚胺,是一种低毒性杀菌剂,可抑制菌体内甘油三酯的合成。克百威(carbofuran),化学名称2,3
‑
二氢
‑
2,2
‑
二甲基
‑7‑
苯并呋喃基甲氨基甲酸酯,是一种氨基甲酸酯类杀虫剂和杀线虫剂。多菌灵(carbendazin),化学名称2
‑
(甲氧基氨基甲酰)苯并咪唑,是一种高效低毒杀菌剂,可用于防治多种植物病害。腐霉利、克百威和多菌灵是植物栽培过程中常用的农药。目前蔬菜中腐霉利、克百威、多菌灵农药残留的检出率高,不合格率也高,且现有检测方法相对繁琐。
3.根据国家标准,腐霉利的检测方法是气相色谱
‑
质谱联用法,克百威的检测方法是液相色谱
‑
柱后衍生法,多菌灵现行有效的检测方法是液相色谱
‑
串联质谱法。上述方法虽然稳定性好、准确率高、重复性强,但是需要昂贵的仪器设备,专业的操作人员以及复杂的前处理过程,对环境不友好、无法满足及时检出、现场办公、现场执法的要求。并且前处理方法和使用的仪器设备均有不同,因此对几种农残同时检测的目标,更是难以实现。
4.在快检方法中,应用较多的有表面增强拉曼光谱法、免疫层析试纸快速检测法。但是很多检测对象没有拉曼信号,而免疫层析试纸检测对象单一,且不同检测对象的前处理方法也不尽相同,不利于几种农残的同时检测。
技术实现要素:
5.本发明的目的是提供一种腐霉利、克百威和多菌灵三联免疫层析检测试剂盒及检测方法。
6.为了实现本发明目的,第一方面,本发明提供一种腐霉利、克百威和多菌灵三联免疫层析检测试纸条,包括样品垫、硝酸纤维素膜、吸水垫和底板,所述硝酸纤维素膜从样品垫到吸水垫的方向上依次设有三条检测线和一条质控线,三条检测线分别包被有腐霉利半抗原
‑
载体蛋白偶联物、克百威半抗原
‑
载体蛋白偶联物和多菌灵半抗原
‑
载体蛋白偶联物,所述质控线包被有羊抗鼠多克隆抗体。
7.所述样品垫、硝酸纤维素膜和吸水垫依次以2
‑
3mm的间距交互层叠黏贴在底板上。
8.检测线上包被的腐霉利半抗原
‑
载体蛋白偶联物的浓度为0.10
‑
0.20mg/ml,优选0.15mg/ml。
9.检测线上包被的克百威半抗原
‑
载体蛋白偶联物的浓度为0.25
‑
0.8mg/ml,优选0.6mg/ml。
10.检测线上包被的多菌灵半抗原
‑
载体蛋白偶联物的浓度为0.25
‑
0.6mg/ml,优选
0.5mg/ml。
11.质控线上包被的羊抗鼠多克隆抗体的浓度为0.25mg/ml。
12.腐霉利半抗原、克百威半抗原、多菌灵半抗原的结构分别如式1)~式3)所示:
13.式1)腐霉利半抗原
14.式2)克百威半抗原
15.式3)多菌灵半抗原
16.优选地,载体蛋白为牛血清蛋白。
17.硝酸纤维素膜上的各检测线之间,以及靠近吸水垫端的检测线与质控线之间的距离均为4
‑
5mm,优选4.3mm。在本发明中,如果相邻的两条检测线距离太近,显色会有干扰;如果距离太远,则层析时间过长,且需要更多的检测液。
18.所述试纸条的宽度为3
‑
5mm,优选3.8mm。试纸条过窄不利于结果的判断,过宽则需要更多的抗原、抗体与检测液,不利于节约成本。
19.所述样品垫的材质可以是硝酸纤维素膜。底板的材质可以是pvc。
20.图1为本发明免疫层析检测试纸条的结构示意图。
21.第二方面,本发明提供腐霉利、克百威和多菌灵三联免疫层析检测试剂盒,包括样品提取净化管(含样品提取净化液)、带反应孔的反应基板和所述三联免疫层析检测试纸条。样品提取净化管、反应基板、免疫层析检测试纸条密封后装入试剂盒中,4℃保存。
22.所述样品提取净化管的制备方法包括:将200mg psa(n
‑
丙基乙二胺固相吸附剂)、200mg c
18
(十八烷基键合硅胶)和30mg gcb(石墨化碳黑)置于5ml离心管中,再加入2ml 0.05mol/l ph7.4的pbs混匀,即为装有样品提取净化液的样品提取净化管。
23.所述反应孔包被有胶体金标记的腐霉利抗体、胶体金标记的克百威抗体和胶体金标记的多菌灵抗体。反应孔的底面积为0.32cm2,容积为365μl,亦可直接使用96孔板作为反应孔,以便大批量的制备试剂盒。
24.所述反应孔的制备方法包括:将胶体金标记的腐霉利抗体溶液2μl、胶体金标记的克百威抗体溶液3μl和胶体金标记的多菌灵抗体溶液2μl加入反应孔中,用冻干保护液稀释至60μl,进行真空冷冻干燥。
25.优选地,所述冻干保护液为:2%bsa、5%海藻糖、1%peg 20000、0.5%吐温20和0.03%proclin 300,以水配制。
26.优选地,胶体金标记的腐霉利抗体溶液的制备方法包括:取1ml胶体金溶液,加入
0.2mol/l k2co3溶液5
‑
10μl(优选7μl),混合均匀后,加入腐霉利抗体6μg,混合均匀,25℃静置10min;然后加入10%bsa封闭液(质量百分数)50μl,混合均匀,25℃静置15min;然后4℃,11000rpm离心15min,弃上清,加入200μl复溶液,即得。
27.优选地,胶体金标记的克百威抗体溶液的制备方法包括:取1ml胶体金溶液,加入0.2mol/l k2co3溶液6
‑
12μl(优选7μl),混合均匀后,加入克百威抗体5μg,混合均匀,25℃静置10min;然后加入10%bsa封闭液(质量百分数)50μl,混合均匀,25℃静置15min;然后4℃,11000rpm离心15min,弃上清,加入200μl复溶液,即得。
28.优选地,胶体金标记的多菌灵抗体溶液的制备方法包括:取1ml胶体金溶液于反应孔,加入0.2mol/l k2co3溶液3
‑
7μl(优选4μl),混合均匀后,加入多菌灵抗体6μg,混合均匀,25℃静置10min;然后加入10%bsa封闭液(质量百分数)50μl,混合均匀,25℃静置15min;然后4℃,11000rpm离心15min,弃上清,加入200μl复溶液,即得。
29.其中,胶体金溶液的制备方法为:先将2g氯金酸(haucl4)粉末溶于100ml超纯水中,获得浓度为2%的氯金酸溶液;再取1l超纯水加热至沸腾后加入质量浓度为1%柠檬酸三钠溶液10ml,沸腾后继续加热8分钟,再加入2%的氯金酸溶液10ml,溶液颜色变为酒红色后,再加热10分钟后停止加热,自然冷却,定容至1l,即为胶体金溶液。
30.所述复溶液可以是含2%海藻糖和1%bsa的0.05mol/l pbs,ph7.4。
31.所述胶体金溶液的平均粒径为40nm。
32.所述胶体金标记的腐霉利抗体,用7μl 0.2mol/l碳酸钾溶液调节1ml胶体金的ph,可用于标记5
‑
10μg(优选6μg)腐霉利抗体。
33.所述胶体金标记的克百威抗体,用7μl 0.2mol/l碳酸钾溶液调节1ml胶体金的ph,可用于标记5
‑
8μg(优选5μg)克百威抗体。
34.所述胶体金标记的多菌灵抗体,用4μl 0.2mol/l碳酸钾溶液调节1ml胶体金的ph,可用于标记5
‑
12μg(优选6μg)多菌灵抗体。
35.所述反应孔的制备方法中,真空冷冻干燥的条件为:
‑
50℃保持4h,
‑
25℃保持4h,
‑
15℃保持4h,5℃保持2h,25℃保持10h。
36.第三方面,本发明提供所述试剂盒在腐霉利、克百威和多菌灵检测中的应用(含非疾病诊断和治疗目的)。本发明的腐霉利、克百威和多菌灵三联胶体金免疫层析试剂盒可以对蔬菜中残留的腐霉利、克百威和多菌灵进行同时地提取、净化和检测。
37.第四方面,本发明提供一种同时提取、净化并检测蔬菜和水果中腐霉利、克百威、多菌灵残留的方法,包括以下步骤:
38.(1)样品的预处理:将蔬菜样品剪碎、匀浆,然后取2g置于提取净化管中混匀,离心,收集上清液,作为待测液;
39.(2)样品的检测:将待测液加入反应孔中,抽吸混匀后,将免疫层析检测试纸条的样品垫端插入反应孔中进行检测;
40.(3)分析检测结果。
41.所述样品提取净化管、反应孔、免疫层析检测试纸条来自所述免疫层析检测试剂盒。
42.具体检测方法如下:
43.(1)样品的预处理:将蔬菜样品剪碎、匀浆,称取2g,加入提取净化管中,涡旋1min
以充分混合均匀,4000rpm离心2min,上清液即为待测液。另取蔬菜样品,加入一定量的腐霉利、克百威、多菌灵标准溶液,使腐霉利含量为0.2ppm,克百威含量为0.02ppm,多菌灵含量为2ppm,之后按预处理方法操作,获得加标待测液。
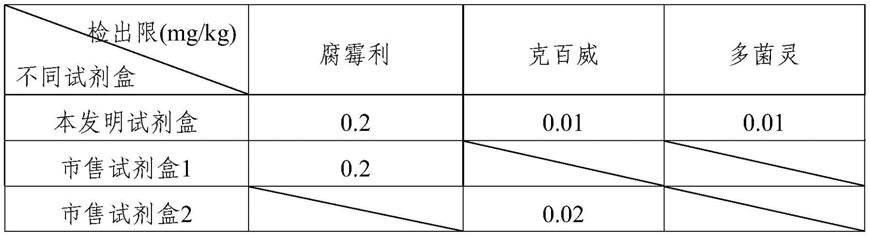
44.(2)样品的检测:用移液枪各取100μl实际样品待测液和加标样品待测液,分别置于反应孔中,并上下抽吸混匀。静置反应2min后,将试纸条的样品垫端插入反应孔中,并计时5min,取出试纸条,轻轻刮去样品垫以终止层析过程,并进行结果判定。
45.(3)结果判定如图2所示:
46.无效:c线不显色,说明试纸条失效或者操作不当,应用新拆封的试纸条重新测试。
47.阴性:c线显色,三条检测线均显色,且颜色深于或等于c线,表明样品中的检测对象浓度低于检出限。
48.阳性:c线显色,检测线不显色或颜色浅于c线,即表明该检测对象的浓度大于等于检出限,此时应再用标准方法进行定量检测。
49.本发明中,腐霉利半抗原
‑
载体蛋白偶联物、克百威半抗原
‑
载体蛋白偶联物、多菌灵半抗原
‑
载体蛋白偶联物以及腐霉利抗体、克百威抗体、多菌灵抗体可以采用本领域公知的方法制备得到,或者也可以通过购买获得。
50.借由上述技术方案,本发明至少具有下列优点及有益效果:
51.(一)本发明的腐霉利、克百威和多菌灵三联胶体金免疫层析试剂盒可以同时提取、净化并检测腐霉利、克百威、多菌灵这三种在蔬菜中使用较多且超标情况较为严重的农药残留,检测对象明确,针对性强。
52.(二)样品提取净化管、试纸条、试剂盒制备方法简单且稳定性好,适合大批量生产。
53.(三)检测方法简便高效,从样品前处理到反应完成并判定结果,总耗时十分钟左右,非常适合于大规模现场筛查。
54.(四)试纸条灵敏度高,检出限低,特异性好且稳定性好,便于基层检验人员的使用。
附图说明
55.图1为本发明免疫层析检测试纸条的结构示意图。其中,1
‑
样品垫,2
‑
t1线,3
‑
t2线,4
‑
t3线,5
‑
c线,6
‑
硝酸纤维素膜,7
‑
吸水垫,8
‑
底板。
56.图2为本发明试纸条的检测结果判定示意图。
具体实施方式
57.本发明提供一种腐霉利、克百威、多菌灵三合一胶体金免疫层析试纸条,所述的试纸条如图1所示:包括底板(8)、样品垫(1)、硝酸纤维素膜(6)和吸水垫(7);所述硝酸纤维素膜(6)上依次包被有腐霉利半抗原
‑
载体蛋白偶联物的第一检测线(2)、克百威半抗原
‑
载体蛋白偶联物的第二检测线(3)、多菌灵半抗原
‑
载体蛋白偶联物的第三检测线(4)以及结合有羊抗鼠多克隆抗体的质控线(5)。
58.本发明提供一种快检试剂盒,由上述试纸条、含有金标抗体的反应孔及样品提取净化管组成。所述反应孔中含有用胶体金标记的腐霉利、克百威、多菌灵抗体。反应孔的底
面积为0.32cm2,容积为365μl,亦可直接使用96孔板作为反应孔,以便大批量地制备试剂盒。
59.本发明中,所用胶体金溶液的平均粒径为40nm左右。腐霉利半抗原
‑
载体蛋白偶联物及其抗体、克百威半抗原
‑
载体蛋白偶联物及其抗体、多菌灵半抗原
‑
载体蛋白偶联物及其抗体可以采用本领域公知的方法制备得到,或者也可以通过购买获得。
60.本发明提供的胶体金免疫层析试纸条及快检试剂盒可以同时实现腐霉利、克百威、多菌灵的快速检测,结果准确,操作简单。具体步骤包括:
61.1、制备胶体金标记的腐霉利抗体、克百威抗体和多菌灵抗体,并冻干于反应孔中。
62.2、制备包被了腐霉利半抗原
‑
载体蛋白偶联物的第一检测线、克百威半抗原
‑
载体蛋白偶联物的第二检测线、多菌灵半抗原
‑
载体蛋白偶联物的第三检测线以及结合有羊抗鼠多克隆抗体的质控线的硝酸纤维素膜。
63.3、将步骤2制备好的硝酸纤维素膜与样品垫、吸水垫和底板组装成试纸条。
64.4、将200mg psa,200mg c18,30mg gcb置于5ml离心管中,再加入2ml0.05mol/l pbs 7.4(即ph7.4的pbs)混匀,即为装有样品提取净化液的样品提取净化管。
65.5、将步骤1中反应孔,步骤3中试纸条与步骤4中的样品提取净化管装于试剂盒中,4
‑
25℃,阴凉干燥处保存待用。
66.6、将待测样品用步骤4中的样品提取净化管进行前处理制备成检测液,移取于反应孔中,并用制备好的试纸条检测。
67.优选地,步骤1中所述胶体金标记腐霉利抗体,用0.2mol/l碳酸钾溶液调节1ml胶体金的ph,用量为5
‑
10μl,优选为7μl。
68.优选地,步骤1中所述胶体金标记腐霉利抗体,1ml胶体金可以标记5
‑
10μg腐霉利抗体,优选为6μg。
69.优选地,步骤1中所述胶体金标记克百威抗体,用0.2mol/l碳酸钾溶液调节1ml胶体金的ph,用量为6
‑
12μl,优选为7μl。
70.优选地,步骤1中所述胶体金标记克百威抗体,1ml胶体金可以标记5
‑
8μg克百威抗体,优选为5μg。
71.优选地,步骤1中所述胶体金标记多菌灵抗体,用0.2mol/l碳酸钾溶液调节1ml胶体金的ph,用量为3
‑
7μl,优选为4μl。
72.优选地,步骤1中所述胶体金标记多菌灵抗体,1ml胶体金可以标记5
‑
12μg多菌灵抗体,优选为6μg。
73.其中,胶体金溶液的制备方法为:先将2g氯金酸(haucl4)粉末溶于100ml超纯水中,获得浓度为2%的氯金酸溶液;再取1l超纯水加热至沸腾后加入质量浓度为1%柠檬酸三钠溶液10ml,沸腾后继续加热8分钟,再加入2%的氯金酸溶液10ml,溶液颜色变为酒红色后,再加热10分钟后停止加热,自然冷却,定容至1l,即为胶体金溶液。
74.优选地,步骤1中所述胶体金标记腐霉利抗体、胶体金标记克百威抗体、胶体金标记多菌灵抗体分别取2μl、3μl、2μl置于反应孔中,并用冻干保护液稀释至60μl,冻干。
75.优选地,步骤2中所述第一检测线上结合的腐霉利半抗原
‑
载体蛋白偶联物的浓度为0.10
‑
0.20mg/ml,优选0.15mg/ml。
76.优选地,步骤2中所述第二检测线上结合的克百威半抗原
‑
载体蛋白偶联物的浓度
为0.25
‑
0.8mg/ml,优选0.6mg/ml。
77.优选地,步骤2中所述第三检测线上结合的多菌灵半抗原
‑
载体蛋白偶联物的浓度为0.25
‑
0.6mg/ml,优选0.5mg/ml。
78.优选地,步骤2中所述质控线上结合的羊抗鼠多克隆抗体浓度为0.25mg/ml。
79.优选地,步骤2中所述第一检测线与第二检测线之间的距离、第二检测线与第三检测线之间的距离、第三检测线与质控线之间的距离均为4
‑
5mm,优选4.3mm。本发明中,如果相邻两条检测线距离太近,显色会有干扰;如果距离太远,则层析时间过长,且需要更多的检测液。
80.优选地,步骤3中所述试纸条宽度为3
‑
5mm,优选3.8mm,过窄不利于结果的判断,过宽则需要更多的抗原、抗体与检测液,不利于节约成本。
81.本发明的腐霉利、克百威和多菌灵三联胶体金免疫层析试剂盒可以同时提取、净化并检测蔬菜中的腐霉利、克百威和多菌灵,试剂盒操作简便,结果准确性高,检出限低,特异性好,性能稳定,能够满足现场快速测定的要求,特别适用于大规模筛选。
82.以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
83.本发明中涉及到的百分号“%”,若未特别说明,是指质量百分比;但溶液的百分比,除另有规定外,是指100ml溶液中含有溶质的克数。
84.以下实施例中使用的腐霉利抗体购自广州优抗多生物技术有限公司。克百威抗体、多菌灵抗体购自江南大学食品安全科学研究所。腐霉利半抗原
‑
载体蛋白偶联物参考文献1(邹强.抗百菌清和腐霉利单克隆抗体制备及其特性分析[d].华中农业大学)的方法合成,克百威半抗原
‑
载体蛋白偶联物参考文献2(孙凤霞,康立超等.克百威人工抗原合成及其免疫应用[j].西北农业学报.2018)的方法合成,多菌灵半抗原
‑
载体蛋白偶联物参考文献3(蒋文慧,吴小胜等.一种多菌灵酶联免疫快速检测方法的建立[j].食品与机械.2021)的方法合成。
[0085]
实施例1腐霉利、克百威和多菌灵三联免疫层析检测试剂盒的构建
[0086]
本实施例提供的腐霉利、克百威和多菌灵三联免疫层析检测试剂盒,制备方法如下:
[0087]
1、胶体金标记腐霉利抗体的制备
[0088]
取1ml胶体金溶液,加入7μl k2co3溶液(0.2mol/l),混合均匀后,加入腐霉利抗体6μg,混合均匀,25℃静置10min。加入50μl bsa封闭液(质量分数为10%),混合均匀,25℃静置15min。4℃,11000rpm离心15min,小心移去上清液,再加入200μl复溶液(0.05mol/l pbs 7.4,含有2%海藻糖和1%bsa)。
[0089]
2、胶体金标记克百威抗体的制备
[0090]
取1ml胶体金溶液,加入7μl k2co3溶液(0.2mol/l),混合均匀后,加入克百威抗体5μg,混合均匀,25℃静置10min。加入50μl bsa封闭液(质量分数为10%),混合均匀,25℃静置15min。4℃,11000rpm离心15min,小心移去上清液,再加入200μl复溶液(0.05mol/l pbs 7.4,含有2%海藻糖和1%bsa)。
[0091]
3、胶体金标记多菌灵抗体的制备
[0092]
取1ml胶体金溶液于反应孔,加入4μl k2co3溶液(0.2mol/l),混合均匀后,加入多
菌灵抗体6μg,混合均匀,25℃静置10min。加入50μl bsa封闭液(质量分数为10%),混合均匀,25℃静置15min。4℃,11000rpm离心15min,小心移去上清液,再加入200μl复溶液(0.05mol/l pbs 7.4,含有2%海藻糖和1%bsa)。
[0093]
4、试剂盒反应孔的制备
[0094]
分别取上述步骤中制备的胶体金标记腐霉利抗体、胶体金标记克百威抗体、胶体金标记多菌灵抗体2μl、3μl、2μl置于反应孔中,并用冻干保护液(含2%bsa,5%海藻糖,1%peg 20000,0.5%吐温20和0.03%proclin 300)稀释至60μl。送入真空冷冻干燥机,按照
‑
50℃保持4h,
‑
25℃保持4h,
‑
15℃保持4h,5℃保持2h,25℃保持10h的程序进行冻干。
[0095]
5、样品提取净化管的制备
[0096]
将200mg psa,200mg c18,30mg gcb置于5ml离心管中,再加入2ml 0.05mol/lpbs 7.4混匀,即为装有样品提取净化液的样品提取净化管。
[0097]
6、试剂盒组装
[0098]
将腐霉利半抗原
‑
载体蛋白偶联物、克百威半抗原
‑
载体蛋白偶联物、多菌灵半抗原
‑
载体蛋白偶联物以及羊抗鼠多克隆抗体包被于硝酸纤维素膜上,分别为第一检测线即t1线(2)、第二检测线即t2线(3)、第三检测线即t3线(4)和质控线即c线(5)。将上述硝酸纤维素膜(6)与样品垫(1)、吸水垫(7)和底板(8)组装并裁成试纸条。底板的材质为pvc。具体方法如下:
[0099]
1)腐霉利半抗原
‑
载体蛋白偶联物、克百威半抗原
‑
载体蛋白偶联物、多菌灵半抗原
‑
载体蛋白偶联物以及羊抗鼠多克隆抗体的包被
[0100]
本方法中,选用赛多利斯cn95膜为包被底膜,用0.02mol/l pbs,ph7.4(含0.625%nacl)将腐霉利半抗原
‑
载体蛋白偶联物稀释至0.15mg/ml,将克百威半抗原
‑
载体蛋白偶联物稀释至0.6mg/ml,将多菌灵半抗原
‑
载体蛋白偶联物稀释至0.5mg/ml,用0.02mol/l pbs,ph7.4(含2%蔗糖)将羊抗鼠多克隆抗体稀释至0.25mg/ml。包被时的划膜条件为0.8μl/cm,每条检测线之间的距离为4.3mm。包被完成后,烘箱60℃干燥2
‑
4h。
[0101]
2)试纸条的制备
[0102]
将干燥过的硝酸纤维素膜(6)粘附于底板(8)的中间位置上,然后将样品垫(1)和吸水纸(7)分别粘附于硝酸纤维素膜两端的底板上,并微微压盖硝酸纤维素膜,以保证检测液和金标抗体的顺利层析。之后用切条机将整块板子裁成3.8mm的试纸条,并密封包装4℃条件下保存,待用时再拆封。
[0103]
本发明提供的快检试剂盒,由上述试纸条、含有金标抗体的反应孔及样品提取净化管组成。所述反应孔中含有用胶体金标记的腐霉利、克百威、多菌灵抗体。反应孔的底面积为0.32cm2,容积为365μl,亦可直接使用96孔板作为反应孔,以便大批量的制备试剂盒。
[0104]
试剂盒于4~25℃,阴凉干燥条件下保存,有效期为12个月。
[0105]
实施例2实际样品的测试
[0106]
利用实施例1制备的试剂盒进行实际样品检测,具体步骤如下:
[0107]
(1)样品的预处理:将蔬菜样品剪碎、匀浆,称取2g加入到样品提取净化管中,涡旋1min以充分混合均匀,4000rpm离心2min,上清液即为待测液。另取蔬菜样品,加入一定量的腐霉利、克百威、多菌灵标准溶液,使腐霉利含量为0.2mg/kg,克百威含量为0.02mg/kg,多菌灵含量为2mg/kg,之后按预处理方法操作,获得加标待测液。
[0108]
(2)样品的检测:用移液枪各取100μl实际样品待测液和加标样品待测液,分别置于反应孔中,并上下抽吸混匀。静置反应2min后,将试纸条的样品垫端插入孔中,并计时5min,取出试纸条,轻轻刮去样品垫以终止层析过程,并进行结果判定。
[0109]
(3)结果判定如图2所示:
[0110]
无效:c线不显色,说明试纸条失效或者操作不当,应用新拆封的试纸条重新测试。
[0111]
阴性:c线显色,3条检测线均显色,且颜色深于或等于c线,表明样品中的检测对象浓度低于检出限。
[0112]
阳性:c线显色,检测线消线或颜色浅于c线,即表明该检测对象的浓度大于等于检出限,此时应再用标准方法进行定量检测。
[0113]
实施例3试剂盒的检出限
[0114]
本实施例旨在对腐霉利、克百威和多菌灵三联免疫层析检测试剂盒的检出限进行测试。
[0115]
1、腐霉利的检出限:将10mg/l不同体积的腐霉利标准溶液加入到韭菜中,使加标浓度为:0.1mg/kg、0.2mg/kg、0.4mg/kg、0.8mg/kg,并按照实施例2中的方法进行检测。结果表明,当加标浓度为0.1mg/kg时,t1线显色与c线颜色相仿,为阴性结果,当浓度为0.2mg/kg时,t1线的颜色明显浅于c线,结果为阳性,因此本试剂盒对腐霉利的检出限为0.2mg/kg。
[0116]
2、克百威的检出限:将10mg/l不同体积的克百威标准溶液加入到韭菜中,使加标浓度为:5μg/kg、0.01mg/kg、0.02mg/kg、0.04mg/kg,并按照实施例2中的方法进行检测。结果表明,当加标浓度为5μg/kg时,t2线显色与c线颜色相仿,为阴性结果,当浓度为0.01mg/kg时,t2线的颜色明显浅于c线,结果为阳性,因此本试剂盒对克百威的检出限为0.01mg/kg。
[0117]
3、多菌灵的检出限:将10mg/l不同体积的多菌灵标准溶液加入到韭菜中,使加标浓度为:5μg/kg、0.01mg/kg、0.02mg/kg、0.04mg/kg,并按照实施例2中的方法进行检测。结果表明,当加标浓度为5μg/kg时,t2线显色与c线颜色相仿,为阴性结果,当浓度为0.01mg/kg时,t2线的颜色明显浅于c线,结果为阳性,因此本试剂盒对克百威的检出限为0.01mg/kg。
[0118]
实施例4试剂盒的特异性考察
[0119]
本实施例对腐霉利、克百威和多菌灵三联免疫层析检测试剂盒的特异性进行试验,方法如下:
[0120]
将氟虫腈、毒死蜱、啶虫脒、甲氰菊酯、吡虫啉等常见农药分别配置成1mg/kg的标准溶液,移取100μl于反应孔中,并上下抽吸混匀。静置反应2min后,将试纸条的样品垫端插入反应孔中,计时5min后,取出试纸条,轻轻刮去样品垫,并进行结果判定。结果显示,c线、t1线、t2线、t3线均显色明显,说明这些农药均不会与抗体发生交叉反应,试纸条的特异性良好。
[0121]
实施例5试剂盒性能比较
[0122]
将本发明试剂盒与市售试剂盒或已公开专利中的试剂盒进行比较,具体如下:
[0123]
1、检出限比较见表1:
[0124]
表1
[0125][0126][0127]
由表1可知,本发明试剂盒的检出限均低于或等于其他市售试剂盒,且本发明试剂盒可以同时提取、净化并检测三种农残,而目前市面上的产品均为单一检测型的试剂盒。以上说明本试剂盒对腐霉利、克百威、多菌灵的检测性能更好,更重要的是实现了三种不同类型农残的同时提取、净化和检测,填补市场空白,有效节约资源,也更加适用于现场的大规模筛查。
[0128]
上述市售试剂盒均购自江苏美正生物科技有限公司,市售试剂盒1的产品编号为mk107a1,市售试剂盒2的产品编号为mk108a1,市售试剂盒3的产品编号为mk106c1。
[0129]
2、前处理试剂比较见表2:
[0130]
表2
[0131][0132]
由表2可知,针对不同的检测对象,前处理试剂略有不同。而本发明试剂盒采用含有200mg psa、200mg c
18
、30mg gcb的2ml 0.05mol/l pbs 7.4作为提取净化液,可同时提取3种不同的农残并净化为待测液,且净化试剂的加入能够有效的吸附色素,为试纸条颜色的判断降低干扰,提高检测方法的灵敏度,降低检出限。本方法一次处理可同时提取3种检测对象并进行净化检测,极大地节省了人力物力,提高检测效率,能够为食品安全基层监管、食品稽查、大型活动保障等提供极为有力的技术支撑。
[0133]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1