利用草履虫生物标志物及IBR检测评价左氧氟沙星环境风险的方法
利用草履虫生物标志物及ibr检测评价左氧氟沙星环境风险的方法
技术领域
1.本发明属于抗生素环境污染生物监测与评价技术领域,具体涉及利用草履虫生物标志物及ibr检测评价左氧氟沙星环境风险的方法。
背景技术:
2.现有技术报道的左氧氟沙星生物检测方法中使用受试物种、检测浓度范围、检测参数及是否使用ibr进行整合分析如下表:
[0003][0004]
例如,cn201110271631.3一种转基因抗虫水稻土壤环境安全的评价方法,利用转基因抗虫水稻秸梗浸泡液培养草履虫,通过对培养草履虫细胞密度的统计来确定转基因水稻是否对草履虫的生长、繁殖等产生影响;再利用彗星电泳技术检测草履虫dna的损伤,统
计分析实验组、阴性对照组和阳性对照组三者的彗星细胞数来确定抗虫转bt基因水稻对草履虫dna的损伤情况;从而来判断转基因抗虫水稻对土壤环境是否安全。
[0005]
cn202110224110.6公开了一种新式联合生物法检测环境毒性物质的方法,包括:采集待检测环境样品标本,分别通过种子发芽试验、细钻螺杀伤试验、水生微小动物群落杀灭试验,根据三项试验结果判断检测标本所处环境的毒性物质种类及含量。把植物界二个科的胡芦巴、鸡毛菜种子,加上动物界三种不同门的动物,即陆生钻头螺科的细钻螺和水生轮虫纲的轮虫、纤毛纲的草履虫和缓步纲的水熊虫联合应用。该方法评价方法复杂并且增加分析难度。
[0006]
现有技术存在的主要缺陷包括:
[0007]
(1)以往开展左氧氟沙星生物检测的物种不够灵敏或者成本较高,周期长,标准化程度不高;
[0008]
(2)以往使用的生物标志物种类少,定性多,定量不足;
[0009]
(3)检测浓度范围与环境实际浓度针对性不强,实用性低;
[0010]
(3)缺乏ibr综合分析评价。
[0011]
ibr指数法在海洋环境质量评价中的应用较为广泛。该方法对筛选生物标志物种类及数量要求低,能够将生物响应同污染物联系起来进行“因果效应”分析,得到了广泛的应用。
[0012]
ibrv2指数法避免了第一代ibr指数法绘制星状图时因标志物排序不同造成计算结果的偏差,同时能够反映多种生物标志物在不同污染条件下的诱导和抑制效应。
[0013]
但是对于特定物质的环境浓度和环境风险评估,需要大量的研究才能建立,如何快速准确评估左氧氟沙星环境浓度和环境风险为本发明需要解决的问题。
技术实现要素:
[0014]
鉴于现有技术存在的问题,本发明提供了利用草履虫生物标志物及ibr检测评价左氧氟沙星环境风险的方法,通过利用敏感指示生物的多种生物标志物和ibr整合分析快速评估左氧氟沙星环境浓度和环境风险。
[0015]
本发明通过以下技术方案来实现:
[0016]
利用草履虫生物标志物及ibr检测评价左氧氟沙星(lev)环境风险的方法,包括:
[0017]
(1)草履虫的培养,挑取单个细胞培养,取对数生长期个体用于左氧氟沙星检测;
[0018]
(2)选取不同浓度左氧氟沙星的溶液,作为检样品;
[0019]
(3)取一定密度的虫液,待检样品处理后,pbs清洗细胞,细胞裂解液裂解细胞,离心,收集上清液,分别用生物标志物检测;
[0020]
(4)整合生物标志物分析(ibr),计算步骤如下:
[0021]
①
标准化:将所有生物标志物数据进行标准化处理为y=log(x/x0)。式中x为每种生物标志物在每个站位上测定结果的平均值;x0为对照站位的生物标志物值;
[0022]
②
均一化:将每种标志物在每个站位的均一化值为z=(y
‑
m)/s,式中y为每种生物标志物标准化值;m为在所有站位上的总平均值;s为每种生物标志物标准化值在所有站位上的标准差;
[0023]
③
赋值:计算各个站位上每种生物标志物的偏离指数a=z
‑
z0,式中z为每种标志
物在每个站位的均一化值;z0为对照站位上该标志物的均一化值;
[0024]
④
计算ibrv2:首先计算各站所有标志物的偏离指数绝对值|a|的加和,再除以生物标志物的种数n。计算公式如下:
[0025][0026]
作为本发明的一种优选技术方案,步骤(1)包括:可于浮游生物丰富的淡水水体采集,挑取单个细胞,小麦粒培养液,20~25℃的恒温恒湿培养箱中建立单克隆培养系,饥饿诱导接合生殖,大量纯培养,取对数生长期个体用于左氧氟沙星检测。
[0027]
作为本发明的一种优选技术方案,步骤(2)包括:左氧氟沙星浓度范围是10ng~700ng/l,在此范围内,根据实际检测需要设置10ng,100ng,300ng,500ng,700ng 5个检测浓度。
[0028]
作为本发明的一种优选技术方案,步骤(3)包括:取密度为1000ind/ml虫液,待检样品处理24小时后,pbs清洗细胞,细胞裂解液(20mmtris,150mm nacl,1%triton x
‑
100,1mm edta)裂解细胞,于4℃,8000rpm离心10min,收集上清液。
[0029]
作为本发明的一种优选技术方案,步骤(3)包括:试剂盒选自sod试剂盒、cat试剂盒、mda试剂盒、gsh
‑
px试剂盒、pgk试剂盒、atpase试剂盒、cyp450试剂盒、rp试剂盒,检测生物标志物。
[0030]
作为本发明的一种优选技术方案,步骤(4)包括:当a大于0时,表示标志物被诱导,反之则为抑制。
[0031]
作为本发明的一种优选技术方案,步骤(4)包括:ibrv2值越高,表明左氧氟沙星污染水平越高,生物受污染压力影响越大。
[0032]
作为本发明的一种优选技术方案,所述评价方法包括:
[0033]
sod+cat+cyp450的共同升高和mda+pgk的共同降低指示10ng/l lev出现;
[0034]
mda+rp的降低表明lev浓度升高到100ng/l;
[0035]
sod+cyp450的升高和其他标志物的降低指示浓度升高到300ng/l;
[0036]
sod的升高和mda+pgk的共同降低指示lev浓度达到了500ng/l;
[0037]
cat+cyp450的升高指示lev的浓度已经达到了700ng/l。
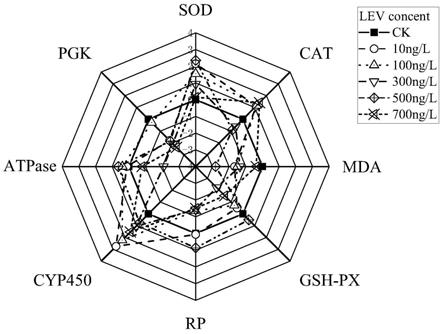
[0038]
作为本发明的一种优选技术方案,具体地,
[0039]
sod+cat+cyp450的共同升高(ai=2.15、1.12、2.75)和mda+pgk的共同降低(ai=
‑
1.67、
‑
1.8)指示10ng/l lev出现;
[0040]
mda+rp的降低(ai=
‑
1.51、
‑
1.35)表明lev浓度升高到100ng/l;
[0041]
sod+cyp450的升高(ai=0.93、1.05)和其他标志物的降低指示浓度升高到300ng/l;
[0042]
sod的升高(ai=2.36)和mda+pgk的共同降低(ai=
‑
2.8、
‑
1.86)指示lev浓度达到了500ng/l;
[0043]
cat+cyp450的升高(ai=1.41、1.53)指示lev的浓度已经达到了700ng/l。
[0044]
本发明相对于现有技术的有益效果包括:
[0045]
1)建立了一种利用单细胞生物多种生物标志物整合分析(ibr)检测和评估左氧氟沙星环境浓度的新方法;
[0046]
2)该方法包括指示生物的标准化培养和8种生物标志物的检测和ibr计算;
[0047]
3)提出了5种浓度左氧氟沙星的生物标志物组合评价参数。
附图说明
[0048]
图1尾草履虫生物标志物对左氧氟沙星的响应
[0049]
图2.生物标志物与左氧氟沙星浓度相关性分析
[0050]
图3.尾草履虫8种生物标志物ibr分析
具体实施方式
[0051]
下面结合附图和实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。
[0052]
实施例1
[0053]
1.材料与方法
[0054]
1.1指示生物
[0055]
尾草履虫(parameciμm caμdatμm),纤毛门,寡膜纲,膜口目,草履科,草履虫属。广泛分布于有机质多的静水水体。对环境污染物刺激比较敏感,因此常被用于环境污染物的评价研究。
[0056]
1.2草履虫的培养
[0057]
可于浮游生物丰富的淡水水体采集,挑取单个细胞,小麦粒培养液,20~25℃的恒温恒湿培养箱中建立单克隆培养系,饥饿诱导接合生殖,大量纯培养,取对数生长期个体用于左氧氟沙星检测。
[0058]
1.3左氧氟沙星检测浓度范围的设定
[0059]
根据各种文献报道和环境监测报告,对水、土环境中和生物可检测的左氧氟沙星实验浓度进行了全面的总结和筛选,确定浓度范围是10ng~700ng/l,在此范围内,根据实际检测需要设置10ng,100ng,300ng,500ng,700ng 5个检测浓度。
[0060]
1.4多种生物标志物测定
[0061]
取密度为1000ind/ml虫液,待检样品处理24小时后,pbs清洗细胞,细胞裂解液(20mmtris,150mm nacl,1%triton x
‑
100,1mm edta)裂解细胞,于4℃,8000rpm离心10min,收集上清液,分别用sod试剂盒、cat试剂盒、mda试剂盒、gsh
‑
px试剂盒、pgk试剂盒、atpase试剂盒、cyp450试剂盒、rp试剂盒,检测生物标志物。
[0062]
1.5整合生物标志物分析(ibr)
[0063]
计算步骤如下:
[0064]
①
标准化:将所有生物标志物数据进行标准化处理为y=log(x/x0)。式中x为每种生物标志物在每个站位上测定结果的平均值;x0为对照站位的生物标志物值。
[0065]
②
均一化:将每种标志物在每个站位的均一化值为z=(y
‑
m)/s。式中y为每种生物标志物标准化值;m为在所有站位上的总平均值;s为每种生物标志物标准化值在所有站位上的标准差。
[0066]
③
赋值:计算各个站位上每种生物标志物的偏离指数a=z
‑
z0。式中z为每种标志物在每个站位的均一化值;z0为对照站位上该标志物的均一化值。当a大于0时,表示标志物
被诱导,反之则为抑制。
[0067]
④
计算ibrv2:首先计算各站所有标志物的偏离指数绝对值|a|的加和,再除以生物标志物的种数n。计算公式如下:
[0068][0069]
ibrv2值越高,表明左氧氟沙星污染水平越高,生物受污染压力影响越大。
[0070]
2.结果
[0071]
2.1单一生物标志物对左氧氟沙星的响应
[0072]
左氧氟沙星处理24小时,引起尾草履虫细胞中多种生物标志物的显著变化(图1)。
[0073]
sod酶活性(图1
‑
a),在10ng,100ng,300ng,500ng处理下显著上升;
[0074]
mda含量(图1
‑
b)在五种浓度处理下,均显著降低;
[0075]
cat酶活性(图1
‑
c),10ng,100ng和700ng时显著升高,当浓度为300ng和500ng时酶活性显著降低;
[0076]
gsh
‑
px酶活性(图1
‑
d)在500ng时显著上升,其他浓度处理时显著减少。
[0077]
pgk的酶活性(图1
‑
e)在五种浓度处理下均显著降低;
[0078]
atp酶活性(图1
‑
f),在100和500ng时显著上升,在300和700ng时显著降低;
[0079]
细胞rp含量(图1
‑
g)在500ng显著升高,在100ng,300ng和700ng处理时显著减少;
[0080]
cyp450活性(图1
‑
h)在五种浓度处理下均显著上升。
[0081]
上述结果表明,任何单一生物标志物对左氧氟沙星暴露的反应都是不够稳定和统一的,需要建立一个多种生物标志物综合评价体系。
[0082]
2.2不同浓度左氧氟沙星胁迫下生物标志物相关性
[0083]
为了构建一个多种生物标志物综合评价系统,对不同浓度生物标志物相关性分析进行了分析(图2)。
[0084]
结果表明:不同浓度左氧氟沙星胁迫下,8种生物标志物之间存在交叉正相关关系,其中与其它标志物相关最多的是sod、gsh
‑
px、atpase这3种。说明氧化应激和三羧酸循环可能是尾草履虫抵抗左氧氟沙星胁迫的主要生物学机制。在24hlev胁迫下,这3种标志物的反应可以作为lev污染存在的的证明,尤其是sod显著升高表现稳定,但是与浓度相关性分析表明均呈负相关。
[0085]
所以,这些标志物的反应只能定性的指示lev污染的存在,而无法定量的指示lev污染的程度。
[0086]
2.3多种生物标志物整合分析(ibr)
[0087]
利用ibr整合分析草履虫8种生物标志物对5种浓度左氧氟沙星24h胁迫的响应,结果如图3。
[0088]
sod+cat+cyp450的共同升高(ai=2.15、1.12、2.75)和mda+pgk的共同降低(ai=
‑
1.67、
‑
1.8)指示10ng/l lev出现;
[0089]
mda+rp的降低(ai=
‑
1.51、
‑
1.35)表明lev浓度升高到100ng/l;
[0090]
sod+cyp450的升高(ai=0.93、1.05)和其他标志物的降低指示浓度升高到300ng/l;
[0091]
sod的升高(ai=2.36)和mda+pgk的共同降低(ai=
‑
2.8、
‑
1.86)指示lev浓度达到
了500ng/l;
[0092]
cat+cyp450的升高(ai=1.41、1.53)指示lev的浓度已经达到了700ng/l。
[0093]
表2:生物标志物组合代表值
[0094][0095]
对比例
[0096]
选择其他物种:大鼠、兔,参照前述方法进行评价,实验结果如下表3,不及使用草履虫的效果。
[0097]
表3:其他物种检测左氧氟沙星标记物及其浓度范围
[0098]
[0099][0100]
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1