一种分析外泌体电荷异质性的方法与流程
1.本发明属于外泌体检测与分析领域,尤其是涉及一种分析外泌体电荷异质性的方法。
背景技术:
2.外泌体是由多泡体(mvb)与质膜融合而分泌的,是被磷脂双层膜包裹的颗粒。这些类型的细胞外囊泡(evs)直径为30 ~ 150 nm,富含与细胞内信号传导相关的物质。外泌体可以从多种体液中分离出来,如血液、尿液、唾液、母乳、羊水、腹水和脑脊液。实验证明外泌体在调节细胞生长中起着至关重要的作用,特别是在肿瘤细胞的生长和转移中。外泌体能够通过细胞间信号传导介导对病原体和肿瘤的适应性免疫应答。外泌体传递的蛋白质、rna和dna分子等物质可以将信号转导到其他细胞,然后在生理和病理状态下调节这些细胞的功能。它们也可能是重要的生物标志物,用于人类疾病的诊断,或预测和监测治疗结果,特别是癌症。外泌体的研究已成为近年来的热门话题,特别是在转化医学领域。
3.外泌体一般呈现微观不均一性,即“异质性”,包括电荷、分子量、形态等相关的异构体。这些异构体可能来自本身,例如外泌体表面的糖基化修饰蛋白、磷脂等分子,也可能来自纯化、制剂等制造过程及贮存过程的任何阶段。其中由于外泌体分子所带电荷差异造成的异质性称为电荷异构体,电荷异质性对外泌体的稳定性及其生物学功能发挥的影响还有待进一步的验证。
技术实现要素:
4.为解决上述技术问题,本发明提供一种分析外泌体电荷异质性的方法。
5.本发明采用的技术方案是:一种分析外泌体电荷异质性的方法,采用离子交换色谱对外泌体溶液进行检测和/或分离,流动相a和流动相b进行梯度洗脱,洗脱过程中包括多于两个的固定值洗脱阶段。
6.优选地,离子交换色谱柱为阴离子色谱柱,优选地,弱阴离子交换色谱柱为bia deae
‑
0.1 analytical column (1.3
ꢀµ
m)色谱柱。
7.优选地,流动相a为缓冲液,流动相b为缓冲液
‑
盐溶液;流动相a和流动相b的ph值为7.0
‑
8.0,优选为7.2
‑
8.0;缓冲液浓度为5
‑
50mm,优选为20mm;盐浓度为0.2
‑
2m,优选为0.25
‑
0.85m。
8.优选地,缓冲液为tris缓冲液,盐溶液为钠盐溶液。
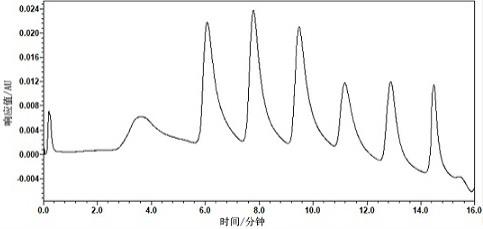
9.优选地,流动相a 和流动相b中还包含保护剂。
10.优选地,保护剂为蔗糖、乳糖和海藻糖中的一种或多种。
11.优选地,保护剂浓度为0.5
‑
5%,优选为2%。
12.优选地,洗脱过程中包括6个固定值洗脱阶段,固定值依次为62%流动相a、54%流动相a、46%流动相a、38%流动相a、28%流动相a和18%流动相a,相邻固定值洗脱阶段调整
时长为0.1
‑
3min。
13.优选地,梯度洗脱条件包括0.0
‑
2.0min,100%流动相a;2.0
‑
5.0min,100
‑
75%流动相a;5.0
‑
5.2min,75
‑
62%流动相a;5.2
‑
7.7min,62%流动相a;7.7
‑
7.9min,62
‑
54%流动相a;7.9
‑
10.4min,54%流动相a;10.4
‑
10.6min,54
‑
46%流动相a;10.6
‑
13.1min,46%流动相a; 13.1
‑
13.3min,46
‑
38%流动相a;13.3
‑
15.8min,38%流动相a;15.8
‑
16.0min,38
‑
28%流动相a;16.0
‑
18.5min,28%流动相a;18.5
‑
18.7min,28
‑
18%流动相a;18.7
‑
21.2min,18%流动相a;21.2
‑
21.4min,18
‑
0%流动相a; 21.4
‑
23.9min,0%流动相a。
14.优选地,流动相流速为0.3
ꢀ‑
1.0ml/min,优选为0.5ml/min;柱温为20℃
‑
60℃,优选为25℃;检测波长为280nm。
15.优选地,根据洗脱时间分别收集不同类型电荷异质性的外泌体。
16.优选地,外泌体为奶源外泌体。
17.本发明具有的优点和积极效果是:通过离子交换色谱对外泌体进行分析和分离,能够充分确认图谱中各组分的相对含量,这样的检测方法重复性好;本方案解决外泌体的离子交换的分离问题,根据不同的外泌体带有不同的电荷性质,而分开出6个不同的亚群,对外泌体进行精准的分离纯化。
附图说明
18.图1是本发明实施例1分离得到的6个不同电荷性质的外泌体亚群;图2 是本发明实施例2分离得到的不同电荷性质的外泌体亚群。
具体实施方式
19.离子交换色谱是根据蛋白组分与色谱介质之间离子作用力大小差异进行分离,由于高分辨性能的离子交换色谱填料技术的发展,固定相与蛋白组分之间其他非特异性作用得到了较好的抑制,使电荷差异极小的电荷不均一性组分能获得较好的分离。本发明提供一种通过离子交换色谱分离/检测外泌体不同电荷异构体的方法,利用离子交换色谱将外泌体根据表面带电差异划分为亚群。它可以有效地将外泌体进行分离,使用馏分收集器对这些不同的亚群进行回收,进而进行外泌体的定性与表面带电情况的研究。
20.采用离子交换色谱对外泌体溶液进行分析检测或分离,通过流动相a和流动相b进行梯度洗脱。其中,离子交换色谱柱为阴离子色谱柱,在本发明某些实施例中,采用弱阴离子色谱柱效果更佳。流动相a为tris缓冲液,流动相b为缓冲液
‑
nacl溶液,ph值为7.0
‑
8.0,优选为7.2
‑
8.0;缓冲液浓度为5
‑
50mm,优选为20mm,nacl溶液浓度为0.2
‑
2m,优选为0.25
‑
0.85m。在本发明某些实施例中,流动相a 和流动相b中还包含保护剂,保护剂为蔗糖和/或乳糖,保护剂浓度为0.5
‑
5%,优选为2%。
21.本发明方案中,采用梯度洗脱,洗脱过程中包括多于两个的固定值洗脱阶段;本发明某些较佳实施例中洗脱过程中包括6个固定值洗脱阶段,固定值依次为62%流动相a、54%流动相a、46%流动相a、38%流动相a、28%流动相a和18%流动相a,相邻固定值洗脱阶段调整时长为0.1
‑
3min。通过这种阶段性的梯度变化分离出不同电荷异质性的外泌体。
22.具体的,梯度洗脱条件包括0.0
‑
2.0min,100%流动相a;2.0
‑
5.0min,100
‑
75%流动相a;5.0
‑
5.2min,75
‑
62%流动相a;5.2
‑
7.7min,62%流动相a;7.7
‑
7.9min,62
‑
54%流动
相a;7.9
‑
10.4min,54%流动相a;10.4
‑
10.6min,54
‑
46%流动相a;10.6
‑
13.1min,46%流动相a; 13.1
‑
13.3min,46
‑
38%流动相a;13.3
‑
15.8min,38%流动相a;15.8
‑
16.0min,38
‑
28%流动相a;16.0
‑
18.5min,28%流动相a;18.5
‑
18.7min,28
‑
18%流动相a;18.7
‑
21.2min,18%流动相a;21.2
‑
21.4min,18
‑
0%流动相a;21.4
‑
23.9min,0%流动相a;冲洗。其中,流动相流速为0.3
‑
1.0ml/min,优选为0.5ml/min;柱温为20℃
‑
60℃,优选为25℃;检测波长为280nm。本发明某些实施例中,可采用单独流动相冲洗,或采用两流动相交替梯度冲洗。
23.本检测/分离方法可用于各种来源的外泌体溶液,尤其适合用于奶源外泌体电荷异质性的检测和分离。外泌体结构比较复杂,体积大小差异较大,内部包含了很多的物质,导致其带点特性复杂,需要设计不同而又复杂的梯度条件洗脱,并且控制条件苛刻才能有效分离不同亚群的外泌体,稍有不合理即不能分离开。
24.下面通过具体实施例对本方案做出进一步说明。
25.实施例1:采用离子交换色谱分析纯化得到牛奶外泌体溶液,离子交换色谱柱为bia deae
‑
0.1 analytical column (1.3
ꢀµ
m)色谱柱,进样量为20 ul,柱温为25℃,检测波长为280nm;流动相a为tris缓冲液,流动相b为tris缓冲液
‑ꢀ
nacl溶液,tris缓冲液浓度为20mm,nacl溶液为0.5m,在流动相a和流动相b中添加质量浓度为2%的蔗糖作为保护剂,流动相流速为0.5ml/min。
26.梯度洗脱条件为:0.0
‑
2.0min,100%流动相a;2.0
‑
5.0min,100
‑
75%流动相a;5.0
‑
5.2min,75
‑
62%流动相a;5.2
‑
7.7min,62%流动相a;7.7
‑
7.9min,62
‑
54%流动相a;7.9
‑
10.4min,54%流动相a;10.4
‑
10.6min,54
‑
46%流动相a;10.6
‑
13.1min,46%流动相a; 13.1
‑
13.3min,46
‑
38%流动相a;13.3
‑
15.8min,38%流动相a;15.8
‑
16.0min,38
‑
28%流动相a;16.0
‑
18.5min,28%流动相a;18.5
‑
18.7min,28
‑
18%流动相a;18.7
‑
21.2min,18%流动相a;21.2
‑
21.4min,18
‑
0%流动相a; 21.4
‑
23.9min,0%流动相a;23.9
‑
24.1min,0
‑
100%流动相a;24.1
‑
25.0min,100
‑
0%流动相a;25.0
‑
25.5min,0
‑
100%流动相a;25.5
‑
26.0min,100
‑
0%流动相a; 26.0
‑
26.5min,0
‑
100%流动相a;26.5
‑
27.0min,100
‑
0%流动相a;27.0
‑
27.5min,0
‑
100%流动相a;27.5
‑
30.0min,100%流动相a。
27.结果如图1所示,根据不同电荷性质,检测得到6个不同亚群,分离的效果很明显,几乎能够做到基线分离,获得一个很好的分离效果,有利于每个亚群的收集。另外,可根据各个亚群洗脱时间,通过馏分收集器对这些不同的亚群进行回收,进一步进行外泌体的各个亚群的进一步表征分析和研究。
28.实施例2:采用离子交换色谱分析如实施例1中的纯化得到牛奶外泌体溶液,离子交换色谱柱为bia deae
‑
0.1 analytical column (1.3
ꢀµ
m)色谱柱,进样量为20 ul,柱温为25℃,检测波长为280nm;流动相a为tris缓冲液,流动相b为tris缓冲液
‑ꢀ
nacl溶液,tris缓冲液浓度为20mm,nacl溶液为0.5m,保护剂蔗糖浓度为2%,流动相流速为0.5ml/min。
29.梯度洗脱条件为:0.0
‑
2.0min,100%流动相a;2.0
‑
5.0min,100
‑
60%流动相a;5.0
‑
5.2min,60
‑
52%流动相a;5.2
‑
6.2min,52%流动相a;6.2
‑
6.4min,52
‑
45%流动相a;6.4
‑
7.4min,45%流动相a;7.4
‑
7.6min,45
‑
39%流动相a;7.6
‑
8.6min,39%流动相a;8.6
‑
9.0min,39
‑
25%流动相a;9.0
‑
10.0min,25%流动相a;10.0
‑
11.5min,25
‑
0%流动相a;11.5
‑
12min,0%流动相a;12.0
‑
13.0min,0
‑
100%流动相a;13.0
‑
15.0min,100%流动相a;。
30.结果如图2所示,检测到4个不同亚群,在一定程度上能够对外泌体进行分离,但是分离检测效果与实施例1比较较弱。能够看出不同的梯度变化对不同电荷异质性外泌体的分离具有较大影响。
31.以上对本发明的实施例进行了详细说明,但所述内容仅为本发明的较佳实施例,不能被认为用于限定本发明的实施范围。凡依本发明申请范围所作的均等变化与改进等,均应仍归属于本发明的专利涵盖范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1