一种测定多联多价结合疫苗中多糖的含量的方法与流程
1.本技术涉及生物技术领域,特别涉及一种测定多联多价结合疫苗中多糖的含量的方法。
背景技术:
2.生物制品(例如,病毒疫苗)在制备完成后,需要根据规定进行成品检定。检定结果符合要求后这些生物制品才可以投放市场。对于多联多价结合疫苗而言,有一项检定是多糖含量的检定。
技术实现要素:
3.本技术的目的在于提供一种测定多联多价结合疫苗中多糖的含量的方法中糖的含量的方法,以准确的测定多联多价结合疫苗中各种存在形式的糖。
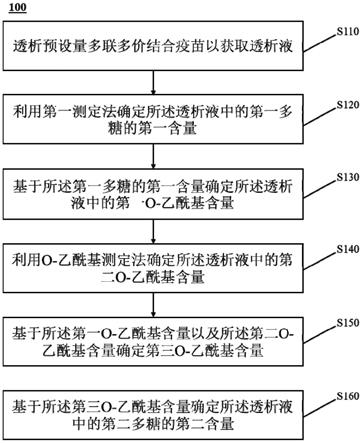
4.本技术一方面提供了一种测定多联多价结合疫苗中多糖的含量的方法。所述方法包括:透析预设量多联多价结合疫苗以获取透析液;利用第一测定法确定所述透析液中的第一多糖的第一含量;基于所述第一多糖的第一含量确定所述透析液中的第一o
‑
乙酰基含量;利用o
‑
乙酰基测定法确定所述透析液中的第二o
‑
乙酰基含量;基于所述第一o
‑
乙酰基含量以及所述第二o
‑
乙酰基含量确定第三o
‑
乙酰基含量;基于所述第三o
‑
乙酰基含量确定所述透析液中的第二多糖的第二含量。
5.在一些实施例中,所述多联多价结合疫苗包括a群c群脑膜炎球菌b型流感嗜血杆菌多糖联合疫苗,所述第二多糖包括a群多糖,所述第二含量包括a群多糖含量;所述确定第二多糖的第二含量包括:获取第一预设比例;基于所述第一预设比例以及所述第三o
‑
乙酰基含量,确定所述a群多糖的a群多糖含量。
6.在一些实施例中,所述第三o
‑
乙酰基含量为所述第一o
‑
乙酰基含量与所述第二o
‑
乙酰基含量之间的差值。
7.在一些实施例中,所述第一多糖包括c群多糖,所述第一含量包括c群多糖含量,所述第一测定法包括唾液酸含量测定法。
8.在一些实施例中,所述基于所述第一多糖的第一含量确定所述预设量多联多价结合疫苗中的第一o
‑
乙酰基含量包括:获取第二预设比例;基于所述第二预设比例以及所述第一多糖含量,确定所述第一o
‑
乙酰基含量。
9.在一些实施例中,所述a群c群脑膜炎球菌b型流感嗜血杆菌多糖联合疫苗进一步包括b型流感嗜血杆菌多糖,所述方法进一步包括:利用第二测定法确定所述透析液中的b型流感嗜血杆菌多糖的多糖含量,所述第二测定法包括核糖法。
10.在一些实施例中,所述多联多价结合疫苗包括a群c群脑膜炎球菌b型流感嗜血杆菌多糖联合疫苗,所述第二多糖包括a群游离多糖,所述第二含量包括a群游离多糖含量;所述确定第二多糖的第二含量包括:获取所述透析液中的第四o
‑
乙酰基含量;获取a群多糖回收率;至少基于所述a群多糖回收率、所述第三o
‑
乙酰基含量以及所述第四o
‑
乙酰基含量,
确定所述a群游离多糖的含量。
11.在一些实施例中,所述第一多糖包括c群游离多糖,所述第一含量包括c群游离多糖含量;所述获取第四o
‑
乙酰基含量包括:取一部分所述透析液进行苯酚制样,获取上清液;获取c群多糖回收率并至少基于所述c群多糖回收率利用第一测定法确定所述上清液中的c群游离多糖含量,所述第一测定法至少包括唾液酸含量测定法;基于所述c群游离多糖含量确定第五o
‑
乙酰基含量;利用o
‑
乙酰基测定法确定所述上清液中的第六o
‑
乙酰基含量;基于所述第五o
‑
乙酰基含量以及所述第六o
‑
乙酰基含量确定所述第四o
‑
乙酰基含量。
12.在一些实施例中,所述第四o
‑
乙酰基含量为所述第五o
‑
乙酰基含量与所述第六o
‑
乙酰基含量之间的差值。
13.在一些实施例中,所述多联多价结合疫苗进一步包括b型流感嗜血杆菌游离多糖,所述方法进一步包括:获取b型流感嗜血杆菌游离多糖回收率;至少基于所述b型流感嗜血杆菌游离多糖回收率利用第二测定法确定所述b型流感嗜血杆菌游离多糖的含量,所述第二测定法至少包括核糖法。
附图说明
14.本技术将以示例性实施例的方式进一步说明,这些示例性实施例将通过附图进行详细描述。这些实施例并非限制性的,在这些实施例中,相同的编号表示相同的结构,其中:
15.图1是根据本技术一些实施例所示的测定多联多价结合疫苗中糖的含量的示例性流程图;
16.图2是根据本技术一些实施例所示的另一种测定多联多价结合疫苗中糖的含量的示例性流程图;
17.图3是根据本技术一些实施例所示的测定o
‑
乙酰基含量的示例性流程图。
具体实施方式
18.为了更清楚地说明本说明书实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本说明书的一些示例或实施例,对于本领域的普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图将本说明书应用于其它类似情景。除非从语言环境中显而易见或另做说明,图中相同标号代表相同结构或操作。
19.如本技术和权利要求书中所示,除非上下文明确提示例外情形,“一”、“一个”、“一种”和/或“该”等词并非特指单数,也可包括复数。一般说来,术语“包括”与“包含”仅提示包括已明确标识的步骤和元素,而这些步骤和元素不构成一个排它性的罗列,方法或者设备也可能包含其它的步骤或元素。用于本技术的数值范围是为了简明扼要表述包括在该范围的每一个数值。
20.图1是根据本技术一些实施例所示的测定多联多价结合疫苗中糖的含量的示例性流程图。如图1所示,用于测定多联多价结合疫苗中糖的含量的流程100可以包括以下步骤。
21.步骤s110,透析预设量多联多价结合疫苗以获取透析液。
22.在一些实施例中,所示预设量可以是以体积表示的预先确定的量。例如,所示预设量可以是1ml、5ml、10ml、15ml、20ml等。本技术中不做具体限定。所述多联多价结合疫苗可
以包含有多种多糖。作为示例,多联多价结合疫苗可以包括a群c群脑膜炎球菌b型流感嗜血杆菌多糖联合疫苗,其可以包含有a群多糖、c群多糖和b型流感嗜血杆菌多糖。在测定所述预设量的多联多价疫苗中的多糖的含量之前,可以对其进行稀释。稀释倍数可以是预设的,例如,3倍、5倍、10倍、20倍等。申请中不做具体限定。稀释完成后,为了测定的准确性,稀释后的多联多价结合疫苗可以被透析以获取透析液。经过透析后,杂质比如单糖、二糖等和/或添加物例如乳糖等将被去除。
23.步骤s120,利用第一测定法确定所述透析液中的第一多糖的第一含量。
24.在一些实施例中,所述多联多价结合疫苗可以包括a群c群脑膜炎球菌b型流感嗜血杆菌多糖联合疫苗,所述第一多糖可以包括c群多糖,所述第一含量可以包括c群多糖含量。作为示例,所述第一测定法可以包括核糖法、蒽酮法、唾液酸含量测定法、磷含量测定法、o
‑
乙酰基测定法等。在一些实施例中,所述第一测定法可以是唾液酸含量测定法。该方法也可以被称为间苯二酚显色法。通过酸水解方法将结合状态的唾液酸变成游离状态,游离状态的唾液酸与间苯二酚反应生成有色化合物,再用有机酸萃取后,测定唾液酸含量。唾液酸含量与c群多糖含量之间存在一个转换比例。作为示例,所述第一多糖的第一含量可以基于以下公式(1)确定:
[0025][0026]
其中,a
group 1
表示第一多糖(c群多糖)的第一含量(c群多糖含量),c
sa
表示唾液酸含量,n表示稀释倍数,0.8表示以上两者之间的转换比例。
[0027]
关于基于唾液酸测定法确定c群多糖含量的描述可以参考本技术实施例部分。
[0028]
步骤s130,基于所述第一多糖的第一含量确定所述透析液中的第一o
‑
乙酰基含量。
[0029]
在一些实施例中,所述第一o
‑
乙酰基含量可以是所述第一多糖中所包含的o
‑
乙酰基的含量。所述第一多糖的第一含量与所包含的o
‑
乙酰基含量之间具有一个比例关系,可以通过数学换算基于所述干扰含量确定所述第一o
‑
乙酰基含量。该比例关系在本技术中可以被称为第二预设比例。所述第二预设比例可以是一个经验值,也可以是根据实际操作情况所确定一个预设值。在一些实施例中,所述第二预设比例可以为1000:1.5。基于所述第二预设比例以及所述第一多糖的第一含量(例如,c群多糖含量),可以确定所述第一o
‑
乙酰基含量。作为示例,所述第一o
‑
乙酰基含量可以基于以下公式(2)确定:
[0030][0031]
归方程,其可表示o
‑
乙酰基含量与吸光度之间的关系。将所述预设量多联多价结合疫苗的透析液测定得到的吸光度带入到回归方程,则可以得到一个o
‑
乙酰基含量的测定值。其与所述预设量多联多价结合疫苗的稀释倍数的乘积可以作为稀释后所述预设量多联多价结合疫苗的透析液的第二o
‑
乙酰基含量。在获取到关于o
‑
乙酰基测定法的实施过程可以参考本技术实施例部分。
[0032]
步骤s150,基于所述第一o
‑
乙酰基含量以及所述第二o
‑
乙酰基含量确定第三o
‑
乙酰基含量。
[0033]
在一些实施例中,所述第三o
‑
乙酰基含量可以与所述预设量多联多价结合疫苗中的第二多糖的第二含量相关。所述多联多价结合疫苗可以包括a群c群脑膜炎球菌b型流感
嗜血杆菌多糖联合疫苗,所述第二多糖可以是a群多糖。所述第三o
‑
乙酰基含量可以是a群多糖中所包含的o
‑
乙酰基含量。
[0034]
由于a群多糖和c群多糖都包含有同一种基团(o
‑
乙酰基),则步骤s140中对所述预设量多联多价结合疫苗的透析液测定的第二o
‑
乙酰基含量包括了a群多糖和c群多糖的所有o
‑
乙酰基的总含量。因此,可以通过所述第一o
‑
乙酰基含量以及所述第二o
‑
乙酰基含量之间的运算,确定所述a群多糖对应的第三o
‑
乙酰基含量。在一些实施例中,所述第三o
‑
乙酰基含量为所述第一o
‑
乙酰基含量与所述第二o
‑
乙酰基含量之间的差值。如以下公式(3)所示:
[0035]
o3=o2‑
o1(3)
[0036]
其中,o3表示第三o
‑
乙酰基含量,o1表示第一o
‑
乙酰基含量,o2表示第二o
‑
乙酰基含量。
[0037]
步骤s160,基于所述第三o
‑
乙酰基含量确定所述透析液中的第二多糖的第二含量。
[0038]
在一些实施例中,所述第二多糖的第二含量可以通过所述第三o
‑
乙酰基含量进行换算后确定。所述第三o
‑
乙酰基含量与所述第二含量之间存在一个比例关系。该比例关系在本技术中可以被称为第一预设比例。所述第一预设比例可以是一个经验值,也可以是根据实际操作情况所确定一个预设值。在一些实施例中,所述第二预设比例可以为1000:2.0。
[0039]
在一些实施例中,基于所述第一预设比例以及所述第三o
‑
乙酰基含量,可以确定所述第二多糖的第二含量。作为示例,所述第二多糖的第二含量可以基于以下公式(4)确定:
[0040]
a
group2
=o3×
pr1(4)
[0041]
其中,o3表示第三o
‑
乙酰基含量,a
group2
表示第二多糖的第二含量(例如,a群多糖含量),pr1表示第一预设比例。
[0042]
在一些实施例中,所述a群c群脑膜炎球菌b型流感嗜血杆菌多糖联合疫苗进一步包括b型流感嗜血杆菌多糖(本说明书中也可以称为hib多糖)。为了测定hib多糖的含量。可以利用第二测定法确定所述透析液中的b型流感嗜血杆菌多糖的含量。作为示例,所述第二测定法可以包括核糖法、蒽酮法、唾液酸含量测定法、磷含量测定法、o
‑
乙酰基测定法等。在一些实施例中,所述第二测定法可以是核糖法。可溶性糖经过无机酸处理后脱水可以产生糖醛(戊糖)或糖醛衍生物。这些生成物能与酚类化合物缩合生成有色物质。对这些有色物质进行吸光度检测,以此测定多糖含量。作为示例,可以以核糖对照品溶液的浓度对其相应的吸光度作直线回归,求得直线回归方程。并将待测溶液(即多联多价结合疫苗稀释后的透析液)的吸光度代入直线回归方程,求出待测溶液的核糖含量。核糖含量与hib多糖含量之间存在一个转换比例。作为示例,hib多糖含量可以基于以下公式(5)确定:
[0043][0044]
其中,a
group3
表示hib多糖的含量,c
r
表示核糖含量,n表示稀释倍数,0.41表示以上两者之间的转换比例。
[0045]
关于基于核糖法测确定hib多糖含量的描述可以参考本技术实施例部分。
[0046]
应当注意的是,上述有关图1中的各个步骤的描述仅仅是为了示例和说明,而不限
定本说明书的适用范围。对于本领域技术人员来说,在本说明书的指导下可以对图1中的各个步骤进行各种修正和改变。然而,这些修正和改变仍在本说明书的范围之内。
[0047]
图2是根据本技术一些实施例所示的另一种测定多联多价结合疫苗中糖的含量的示例性流程图。在一些实施例中,所述多联多价结合疫苗可以包括a群c群脑膜炎球菌b型流感嗜血杆菌多糖联合疫苗。所述第一多糖可以包括c群游离多糖,所述第二多糖可以包括a群游离多糖。流程200可以用于测定a群游离多糖的含量以及c群游离多糖的含量。如图2所示,流程200可以包括以下步骤。
[0048]
s210,获取所述透析液中的第四o
‑
乙酰基含量。
[0049]
在一些实施例中,所述第四o
‑
乙酰基含量可以是a群游离多糖所具有的o
‑
乙酰基的含量。游离多糖可以认为是在结合疫苗中未进行结合的糖。例如,a群c群脑膜炎球菌b型流感嗜血杆菌多糖联合疫苗中,未与蛋白(比如破伤风类毒素蛋白)结合的多糖。而与蛋白结合的多糖可以直接被称为多糖。在一些实施例中,可以通过测定透析液中的游离多糖对应的o
‑
乙酰基的含量,减去c群游离多糖对应的o
‑
乙酰基含量,得到a群游离多糖对应的o
‑
乙酰基含量(即,第四o
‑
乙酰基含量)。例如,通过对透析液进行苯酚制样后得到上清液进行o
‑
乙酰基含量的测定,可以得到所有游离多糖对应的o
‑
乙酰基含量。再减去上清液中c群游离多糖对应的o
‑
乙酰基含量,可以得到a群游离多糖对应的o
‑
乙酰基含量(即,第四o
‑
乙酰基含量)。关于确定所述第四o
‑
乙酰基含量的描述可以参考本技术其他部分,例如,图3。
[0050]
步骤s220,获取a群多糖回收率。
[0051]
在一些实施例中,所述a群多糖回收率可以用于指示通过苯酚制样过程a群多糖的损失率。或者说,经过苯酚制样过程后可以从溶液中回收的a群多糖的量。在一些实施例中,可以利用a群多糖原液中的o
‑
乙酰基含量以及a群多糖原液经过苯酚制样后得到的上清液中的o
‑
乙酰基含量确定所述a群多糖回收率。仅作为示例,a群多糖回收率可以基于以下公式(6)确定:
[0052]
r
pa
=(o
sa
/o
ra
)
×
(v
2a
/v
1a
)
×
100%(6)
[0053]
其中,r
pa
表示a群多糖回收率,o
ra
表示a群多糖原液中的o
‑
乙酰基含量,o
sa
表示a群多糖原液经过苯酚制样后得到的上清液中的o
‑
乙酰基含量,v
1a
表示a群多糖原液的取样量体积,该取样量体积用于苯酚制样,,v
2a
表示经过苯酚制样后得到的上清液的体积。在进行苯酚制样时,可以加入其他溶液,例如,醋酸钠溶液。则v
2a
可以是取样量体积加上加入的醋酸钠体积。
[0054]
关于a群多糖回收率的确定可以参考本技术实施例部分。
[0055]
步骤s230,至少基于所述a群多糖回收率、所述第三o
‑
乙酰基含量以及所述第四o
‑
乙酰基含量,确定所述a群游离多糖的含量。
[0056]
在一些实施例中,所述a群多糖回收率、所述第三o
‑
乙酰基含量以及所述目标o
‑
乙酰基含量可以用于确定所述a群游离多糖的目标含量。作为示例,所述a群游离多糖的含量可以如以下公式(7)确定:
[0057][0058]
其中,t
fa
表示a群游离多糖的含量,o4表示第四o
‑
乙酰基含量,o3表示第三o
‑
乙酰基含量,r
pa
表示多糖回收率。由于苯酚制样后部分苯酚可能残留于上清液中,因此,可以对
经过苯酚制样后得到的上清液进行一次透析以去除这些残留的苯酚。透析前后的体积可以用于计算的补偿。则,v
3a
表示部分透析液经过苯酚制样后得到的上清液透析前的体积,v
4a
表示部分透析液经过苯酚制样后得到的上清液透析后的体积。在一些在对透析液进行苯酚制样时,可以加入其他溶液,例如,醋酸钠溶液。加入的其他溶液的体积也可以用于补偿计算。例如,公式(7)中的(o4/o3)可以替换为(o4×
v
o
/o3×
(v
o
+v
e
))。其中,v
o
可以是所述透析液中所取部分的体积,该部分用于苯酚制样。v
e
可以是加入的其他溶液的体积。
[0059]
应当注意的是,上述有关图2中的各个步骤的描述仅仅是为了示例和说明,而不限定本说明书的适用范围。对于本领域技术人员来说,在本说明书的指导下可以对图2中的各个步骤进行各种修正和改变。然而,这些修正和改变仍在本说明书的范围之内。
[0060]
图3是根据本技术一些实施例所示的测定o
‑
乙酰基含量的示例性流程图。如图3所示,用于测定第四o
‑
乙酰基含量的流程300可以包括以下步骤。
[0061]
s310,取一部分透析液进行苯酚制样,获取上清液。
[0062]
在一些实施例中,所述一部分透析液可以是一个预设量,例如,1ml、1.5ml、2ml、2.5ml、3ml、3.5ml、4ml、4.5ml、5ml等。所述一部分透析液也可以是全部透析液。本技术中不做具体限定。
[0063]
在一些实施例中,经过苯酚制样后,透析液中的多糖(包含a群多糖和c群多糖)可以与苯酚进行反应后将析出(例如,酚羟基与醛基或羰基反应生成沉淀物)。而游离多糖将不与苯酚反应,继续溶解在溶液中。随后,经过离心所述上清液可以被获取。
[0064]
s320,获取c群多糖回收率并至少基于所述c群多糖回收率利用第一测定法确定所述上清液中的c群游离多糖含量。
[0065]
类似于a群多糖回收率,c群多糖回收率可以用于指示通过苯酚制样过程c群多糖的损失率。或者说,经过苯酚制样过程后可以从溶液中回收的c群多糖的量。同样类似地,可以利用c群多糖原液中的o
‑
乙酰基含量以及c群多糖原液经过苯酚制样后得到的上清液中的o
‑
乙酰基含量确定所述c群多糖回收率。仅作为示例,c群多糖回收率可以基于以下公式(8)确定:
[0066]
r
pc
=(o
sc
/o
rc
)
×
(v
2c
/v
1c
)
×
100%(8)
[0067]
其中,r
pc
表示c群多糖回收率,o
rc
表示c群多糖原液中的o
‑
乙酰基含量,o
sa
表示c群多糖原液经过苯酚制样后得到的上清液中的o
‑
乙酰基含量,v
1c
表示c群多糖原液的取样量体积,该取样量体积用于苯酚制样,v
2c
表示经过苯酚制样后得到的上清液后的体积。在进行苯酚制样时,可以加入其他溶液,例如,醋酸钠溶液。则v
2c
可以是取样量体积加上加入的醋酸钠体积。
[0068]
在一些实施例中,c群多糖回收率还可以利用c群多糖原液中的唾液酸含量以及c群多糖原液经过苯酚制样后得到的上清液中的唾液酸含量确定所述c群多糖回收率。仅作为示例,c群多糖回收率可以基于以下公式(9)确定:
[0069]
r
pc
=(sa
sc
/sa
rc
)
×
(v
′
2c
/v
′
1c
)
×
100%(8)
[0070]
其中,r
pc
表示c群多糖回收率,sa
sc
表示c群多糖原液中的唾液酸含量,sa
sa
表示c群多糖原液经过苯酚制样后得到的上清液中的唾液酸含量,v
′
1c
表示c群多糖原液的取样量体积,该取样量体积用于苯酚制样,v
′
2c
表示经过苯酚制样后得到的上清液后的体积。在进行苯酚制样时,可以加入其他溶液,例如,醋酸钠溶液。则v
′
2c
可以是取样量体积加上加入的醋
酸钠体积。
[0071]
关于c群多糖回收率的确定可以参考本技术实施例部分。
[0072]
在一些实施例中,c群多糖回收率、所述透析液中的唾液酸含量以及部分透析液的苯酚制样后的上清液中的唾液含量可以被用于确定c群游离多糖含量。所述透析液中的唾液酸含量以及部分透析液的苯酚制样后的上清液中的唾液含量可以基于第一测定法确定。所述第一测定法可以是唾液酸含量测定法。参考步骤s120中的描述。仅作为示例,c群游离多糖的含量可以基于以下公式(9)确定:
[0073]
其中,t
fc
表示c群游离多糖的含量,c
′
sa
表示部分透析液的苯酚制样后的上清液中的唾液酸含量,c
sa
表示所述透析液中的唾液酸含量,r
pc
表示c群多糖回收率。由于苯酚制样后部分苯酚可能残留于上清液中,因此,可以对经过苯酚制样后得到的上清液进行一次透析以去除这些残留的苯酚。透析前后的体积可以用于计算的补偿。则,v
3c
表示部分透析液经过苯酚制样后得到的上清液透析前的体积,v
4c
表示部分透析液经过苯酚制样后得到的上清液透析后的体积。在一些在对透析液进行苯酚制样时,可以加入其他溶液,例如,醋酸钠溶液。加入的其他溶液的体积也可以用于补偿计算。例如,公式(9)中的(c
′
sa
/c
sa
)可以替换为(c
′
sa
×
v
o
/c
sa
×
(v
o
+v
e
))。其中,v
o
可以是所述透析液中所取部分的体积,该部分用于苯酚制样。v
e
可以是加入的其他溶液的体积。
[0074]
s330,基于所述c群游离多糖含量确定第五o
‑
乙酰基含量。
[0075]
在一些实施例中,所述第五o
‑
乙酰基含量可以是与c群游离多糖的含量具有一个比例关系。通过之前的描述,a群游离多糖和c群游离多糖都含有o
‑
乙酰基。通过确定不同的o
‑
乙酰基含量可以确定不同的多糖/游离多糖的含量。基于此,可以基于c群游离多糖含量确定第五o
‑
乙酰基含量。作为示例,所述第五o
‑
乙酰基含量可以基于以下公式(10)确定:
[0076][0077]
其中,o5表示第五o
‑
乙酰基含量,t
fc
表示c群游离多糖含量,pr
′
表示第五o
‑
乙酰基含量与c群游离多糖含量之间的比例关系。在一些实施例中,该比例关系可以使用所述第二预设比例。
[0078]
s340,利用o
‑
乙酰基测定法确定所述上清液中的第六o
‑
乙酰基含量。
[0079]
在一些实施例中,所述第六o
‑
乙酰基含量可以是所述上清液中的游离多糖所包含的o
‑
乙酰基的总量。例如,所述第六o
‑
乙酰基含量可以包含a群游离多糖和c群游离多糖所含有的o
‑
乙酰基的含量。相同或类似的,利用o
‑
乙酰基测定法确定所述第六o
‑
乙酰基含量的实施过程可以参考本技术实施例部分。
[0080]
s350,基于所述第五o
‑
乙酰基含量以及所述第六o
‑
乙酰基含量确定所述第四o
‑
乙酰基含量。
[0081]
在一些实施例中,所述第四o
‑
乙酰基含量可以是a群游离多糖所包含的o
‑
乙酰基的含量。基于前述的说明,所述第五o
‑
乙酰基含量可以是c群游离多糖所包含的o
‑
乙酰基的含量,所述第六o
‑
乙酰基含量可以是上清液中a群游离多糖和c群游离多糖所包含的o
‑
乙酰基的总量。因此,可以通过所述第五o
‑
乙酰基含量以及所述第六o
‑
乙酰基含量之间的运算,确定所述第四o
‑
乙酰基含量。在一些实施例中,所述四o
‑
乙酰基含量为所述第五o
‑
乙酰基含量与所述第六o
‑
乙酰基含量之间的差值。如以下公式(11)所示:
[0082]
o4=o6‑
o5(11)
[0083]
其中,o4表示第四o
‑
乙酰基含量,o5表示第五o
‑
乙酰基含量,o6表示第六o
‑
乙酰基含量。
[0084]
在一些实施例中,所述多联多价结合疫苗进一步包括b型流感嗜血杆菌游离多糖(本说明书中也可以称为hib游离多糖)。为了确定hib游离多糖,b型流感嗜血杆菌多糖回收率(hib多糖回收率)可以被确定。类似于a群多糖回收率、c群多糖回收率,c群多糖回收率可以用于指示通过苯酚制样过程c群多糖的损失率。或者说,经过苯酚制样过程后可以从溶液中回收的c群多糖的量。同样类似地,可以利用c群多糖原液中的o
‑
乙酰基含量以及c群多糖原液经过苯酚制样后得到的上清液中的o
‑
乙酰基含量确定所述c群多糖回收率。仅作为示例,c群多糖回收率可以基于以下公式(8)确定hib多糖回收率可以用于指示通过苯酚制样过程hib多糖的损失率。或者说,经过苯酚制样过程后可以从溶液中回收的hib多糖的量。在一些实施例中,hib游离多糖回收率可以基于以下公式(12)确定:
[0085]
r
phib
=(c
sc
/c
rc
)
×
(v
hib
‑2/v
hib
‑1)
×
100%(12)
[0086]
其中,其中,r
phib
表示hib多糖回收率,c
sc
表示hib多糖原液中的核糖含量,c
rc
表示hib多糖原液经过苯酚制样后得到的上清液中的核糖含量,v
hib
‑1表示hib多糖原液的取样量体积,该取样量体积用于苯酚制样,v
hib
‑2表示经过苯酚制样后得到的上清液的体积。在进行苯酚制样时,可以加入其他溶液,例如,醋酸钠溶液。则v
hib
‑2可以是取样量体积加上加入的醋酸钠体积在一些实施例中,核糖含量(例如,hib多糖原液中的核糖含量和/或hib多糖原液经过苯酚制样后得到的上清液中的核糖含量)可以基于核糖法确定。参考图1中相关部分描述。
[0087]
在一些实施例中,hib游离多糖含量可以基于以下公式(13)确定:
[0088][0089]
其中,其中,t
fhib
表示hib游离多糖的含量,c
′
r
表示部分透析液的苯酚制样后的上清液中的核糖含量,c
r
表示所述透析液中的唾液酸含量,r
phib
表hib多糖回收率。由于苯酚制样后部分苯酚可能残留于上清液中,因此,可以对经过苯酚制样后得到的上清液进行一次透析以去除这些残留的苯酚。透析前后的体积可以用于计算的补偿。则,v
hib
表示部分透析液经过苯酚制样后得到的上清液透析前的体积,v
′
hib
表示部分透析液经过苯酚制样后得到的上清液透析后的体积。在一些在对透析液进行苯酚制样时,可以加入其他溶液,例如,醋酸钠溶液。加入的其他溶液的体积也可以用于补偿计算。例如,公式(13)中的(c
′
r
/c
r
)可以替换为(c
′
r
×
v
o
/c
r
×
(v
o
+v
e
))。其中,v
o
可以是所述透析液中所取部分的体积,该部分用于苯酚制样。v
e
可以是加入的其他溶液的体积。
[0090]
应当注意的是,上述有关图3中的各个步骤的描述仅仅是为了示例和说明,而不限定本说明书的适用范围。对于本领域技术人员来说,在本说明书的指导下可以对图3中的各个步骤进行各种修正和改变。然而,这些修正和改变仍在本说明书的范围之内。
[0091]
实施例
[0092]
以下通过实施例进一步对本技术进行阐述。但本技术并不受这些实施例的限制。实施例中所使用材料,均为可以通过市售购买获得的常规产品。
[0093]
实施例1
‑
有效量多联多价结合疫苗的透析液与上清液制备
[0094]
取100支a群c群脑膜炎球菌b型流感嗜血杆菌多糖联合疫苗,用纯化水或者配对稀释液0.3ml进行溶解,扎袋透析,换水6次,透析48小时后取出透析液,记录透析液体积。取18ml透析液加2ml饱和醋酸钠溶液再加20ml 70%冷酚溶液进行苯酚制样,a群多糖原液、c群多糖原液、b型多糖原液也同步进行苯酚制样,充分震荡20min,离心取上清,将上清液记录体积后再次扎袋透析,换水6次,透析48小时候取出透析的上清液,记录透析后体积。
[0095]
实施例2
‑
c群多糖含量的测定
[0096]
取0.4g/l唾液酸对照品贮备液精确稀释至80μg/ml为对照品工作液。分别取对照品溶液0.1ml、0.2ml、0.4ml、0.8ml、1.6ml分别置于试管中,补水至2ml。每管加入显色剂2ml,加盖,混匀沸水煮沸15分钟(水浴面高于液面约2cm),取出置冰浴冷却5~10分钟后,每管加入有机相4ml,充分混匀,室温放置10分钟,在波长585nm处测定吸光度。用空白对照调零。
[0097]
取供试品溶液(疫苗透析液)2ml,置于试管中,同法操作,将供试品吸光度代入直线回归方程,计算出供试品溶液的c群多糖含量(μg/ml)
[0098]
实施例3
‑
o
‑
乙酰基含量的测定以及a群多糖含量测定
[0099]
取0.5mmol/l氯化乙酰胆碱对照品工作液。分别取对照品溶液0.3ml、0.6ml、1.2ml、1.8ml、2.4ml、3.0ml分别置于试管中,补水至3.0ml。加新鲜配制的碱性羟胺液(2mol/l盐酸羟胺溶液与3.5mol/l氢氧化钠溶液等体积混合)6.0ml混匀,于室温放置4min,加4mol/l盐酸3.0ml,混匀,加0.37mol/l三氯化铁
‑
盐酸溶液[称取三氯化铁(fecl3·
6h2o)10.0g,加0.1mol/l盐酸溶液溶解并稀释至100ml)]3.0ml,混匀,另精密吸取上述相应的系列对照品溶液,自“补加水至3.0ml”起,除加盐酸与加碱性羟胺的次序颠倒外,同法操作,用作对应的空白对照。在波长540nm处测定吸光度值。以标准管中对照品溶液的含量(mmol)对应其吸光度值作直线回归。
[0100]
吸取供试品溶液(a群c群脑膜炎球菌b型流感嗜血杆菌多糖联合疫苗透析液、苯酚制样上清透析液)3ml置试管中,同法操作;另吸取供试品溶液3ml置20ml试管中,与对照品溶液空白对照同法操作,用作供试品的空白对照。将供试品吸光度代入直线回归方程,计算出供试品溶液的o
‑
乙酰基含量(mmol/l)。
[0101]
实施例4
‑
hib多糖含量的测定
[0102]
取25μg/ml核糖对照品工作液。分别取对照品溶液0.1ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml分别置于试管中,补水至1ml。每管加入0.1%三氯化亚铁盐酸溶液5ml,地衣酚乙醇溶液0.4ml加盖,混匀沸水煮沸5分钟(水浴面高于液面约2cm),取出置冰浴冷却5~10分钟后,在波长670nm处测定吸光度。用空白对照调零。将供试品吸光度代入直线回归方程,计算出供试品溶液的b群多糖含量(μg/ml)
[0103]
取供试品(疫苗透析液)1.0ml置于试管中,同法操作,将供试品吸光度代入直线回归方程,计算出供试品溶液的b型多糖含量。
[0104]
实施例5
‑
多糖回收率的确定
[0105]
1、a群多糖回收率:a群多糖原液取9ml加1ml饱和醋酸钠加10ml70%苯酚制样,吸取的上清液用o
‑
乙酰基含量测定法同步测定a群多糖原液及苯酚制样后的a群多糖上清液,将测得的吸光值代入回归方程中分别计算出a群多糖原液的o
‑
乙酰基含量及苯酚制样后的a群多糖上清液中的o
‑
乙酰基含量。基于以上数值确定a群多糖回收率。a群多糖回收率应
80.0~100.0%为试验有效。
[0106]
a群多糖回收率计算:[苯酚制样后的a群多糖上清液中o
‑
乙酰基含量
×
[0107]
(取样量体积9ml+饱和醋酸钠体积1ml)/(a群多糖原液中o
‑
乙酰基含量
×
取样量体积9m1)]
×
100%
[0108]
2、c群多糖回收率:c群多糖取原液9ml加1ml饱和醋酸钠加10ml70%苯酚制样后吸取的上清液用唾液酸含量测定法同步测定c群多糖原液及苯酚制样后的c群多糖上清液,将测得的吸光值代入回归方程中分别计算出c群多糖原液的o
‑
乙酰基含量中唾液酸含量及苯酚制样后的c群多糖上清液中的唾液酸含量。基于以上数值确定c群多糖回收率。c群多糖回收率应80.0~100.0%为试验有效。
[0109]
c群多糖回收率计算:[苯酚制样后的c群多糖上清液中唾液酸含量
×
(取样量体积9ml+饱和醋酸钠体积1ml)/(c群多糖原液中唾液酸含量
×
取样量体积9ml)]
×
100%
[0110]
3、hib多糖回收率:b型多糖原液取9ml加1ml饱和醋酸钠加10ml70%苯酚制样后吸取的上清液用核糖含量测定法同步测定hib多糖原液及苯酚制样后hib多糖上清液,将测得的吸光值代入回归方程中分别计算出hib多糖中的核糖含量及苯酚制样后的hib多糖上清液中的核糖含量。基于以上数值确定hib多糖回收率。hib多糖回收率应80.0~100.0%为试验有效。
[0111]
hib多糖回收率计算:[多糖原液上清核糖含量
×
(取样量体积9ml+饱和醋酸钠体积1ml)/(多糖原液核糖含量
×
取样量体积9ml)]
×
100%
[0112]
实施例6
‑
游离多糖含量的测定
[0113]
取供试品溶液(a群c群脑膜炎球菌b型流感嗜血杆菌多糖联合疫苗透析液)18ml加饱和醋酸钠2ml,加20ml70%苯酚制样,吸取上清,将上清液进行透析记录透析前后的体积。
[0114]
1、c群游离多糖含量的测定:
[0115]
取供试品溶液及上清液按唾液酸含量测定法分别测定供试品溶液中的唾液酸含量已经上清液中的唾液酸含量。
[0116]
供试品c群游离多糖计算:
[0117]
[供试品溶液酚提后上清液中唾液酸含量
×
(取样量体积+饱和醋酸钠体积)
÷
(供试品溶液中唾液酸含量
×
取样量体积)]
×
(酚提后上清透析后体积v2(ml)
÷
酚提后上清透析前体积v1(ml))
÷
c群多糖回收率
×
100%
[0118]
2、a群游离多糖含量的测定:
[0119]
取供试品溶液及上清液按o
‑
乙酰基含量测定法分别测定两种溶液中的o
‑
乙酰基含量。
[0120]
供试品a群游离多糖含量计算:
[0121]
供试品中c群多糖o
‑
乙酰基含量=供试品溶液中c群多糖唾液酸含量
×
1.5
[0122]
供试品中a群多糖o
‑
乙酰基含量=供试品溶液中o
‑
乙酰基含量
‑
供试品中c群多糖o
‑
乙酰基含量
[0123]
上清液中c群多糖的o
‑
乙酰基含量=上清液中唾液酸含量
×
1.5
[0124]
上清液中a群多糖的o
‑
乙酰基含量=上清液中o
‑
乙酰基含量
‑
上清液中c群多糖的o
‑
乙酰基含量
[0125]
将供试品溶液、a群多糖原液及a群多糖原液酚提后上清液中的o
‑
乙酰基含量转化
为a群多糖=a群多糖(上清)o
‑
乙酰基含量
÷
2.0
[0126]
供试品a群游离多糖=[上清液中a群多糖含量
×
(取样量体积+饱和醋酸钠体积)
÷
(供试品原液中a群多糖含量
×
取样量体积)]
×
(酚提后上清透析后体积v2(ml)
÷
酚提后上清透析前体积v1(ml))
÷
a群多糖回收率
×
100%
[0127]
3、hib游离多糖含量的测定:
[0128]
取供试品溶液及上清液按核糖含量测定法测定核糖含量。
[0129]
供试品b型游离多糖计算:
[0130]
[上清中核糖含量
×
(取样量体积+饱和醋酸钠体积)
÷
(供试品原液中核糖含量
×
取样量体积)]
×
(酚提后上清透析后体积v2(ml)
÷
酚提后上清透析前体积v1(ml))
÷
b型多糖回收率
×
100%
[0131]
上文已对基本概念做了描述,显然,对于本领域技术人员来说,上述详细披露仅仅作为示例,而并不构成对本技术的限定。虽然此处并没有明确说明,本领域技术人员可能会对本技术进行各种修改、改进和修正。该类修改、改进和修正在本技术中被建议,所以该类修改、改进、修正仍属于本技术示范实施例的精神和范围。
[0132]
同时,本技术使用了特定词语来描述本技术的实施例。如“一个实施例”、“一实施例”、和/或“一些实施例”意指与本技术至少一个实施例相关的某一特征、结构或特点。因此,应强调并注意的是,本说明书中在不同位置两次或多次提及的“一个实施例”、“一实施例”或“一个替代性实施例”并不一定是指同一实施例。此外,本技术的一个或多个实施例中的某些特征、结构或特点可以进行适当的组合。
[0133]
同理,应当注意的是,为了简化本技术披露的表述,从而帮助对一个或多个发明实施例的理解,前文对本技术实施例的描述中,有时会将多种特征归并至一个实施例、附图或对其的描述中。但是,这种披露方法并不意味着本技术对象所需要的特征比权利要求中提及的特征多。实际上,实施例的特征要少于上述披露的单个实施例的全部特征。
[0134]
一些实施例中使用了描述成分、属性数量的数字,应当理解的是,此类用于实施例描述的数字,在一些示例中使用了修饰词“大约”、“近似”或“大体上”来修饰。除非另外说明,“大约”、“近似”或“大体上”表明所述数字允许有
±
20%的变化。相应地,在一些实施例中,说明书和权利要求中使用的数值参数均为近似值,该近似值根据个别实施例所需特点可以发生改变。在一些实施例中,数值参数应考虑规定的有效数位并采用一般位数保留的方法。尽管本技术一些实施例中用于确认其范围广度的数值域和参数为近似值,在具体实施例中,此类数值的设定在可行范围内尽可能精确。
[0135]
针对本技术引用的每个专利、专利申请、专利申请公开物和其他材料,如文章、书籍、说明书、出版物、文档等,特此将其全部内容并入本技术作为参考。与本技术内容不一致或产生冲突的申请历史文件除外,对本技术权利要求最广范围有限制的文件(当前或之后附加于本技术中的)也除外。需要说明的是,如果本技术附属材料中的描述、定义、和/或术语的使用与本技术所述内容有不一致或冲突的地方,以本技术的描述、定义和/或术语的使用为准。
[0136]
最后,应当理解的是,本技术中所述实施例仅用以说明本技术实施例的原则。其他的变形也可能属于本技术的范围。因此,作为示例而非限制,本技术实施例的替代配置可视为与本技术的教导一致。相应地,本技术的实施例不仅限于本技术明确介绍和描述的实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1