一种烟草制品气溶胶捕集物的制备方法、所获得的气溶胶捕集物及其应用与流程
1.本发明涉及烟草制品的气溶胶的提取与安全性评价。
背景技术:
2.烟草制品在世界范围内有广泛使用,需要对烟草制品的安全性进行全面和充分评价,因此需要有效捕集来自烟草制品的气溶胶,该气溶胶应尽可能多地包含烟气成分。
3.目前,烟草制品气溶胶的常规捕集方法为使用含缓冲液如pbs的捕集瓶,或使用剑桥滤片捕集、之后通过dmso或乙醇等有机溶剂提取。这些方法具有明显的缺点:捕集物中气溶胶成分浓度很低;或者,所使用的有机溶剂具有明显的溶剂毒性,而且为了实现剑桥滤片中气溶胶成分的有效提取,一张滤片就需要较大量的有机溶剂进行提取,否则提取不完全。而且,有些种类的烟草制品例如电子烟,其气溶胶中的毒物含量比常规卷烟烟气少,有机溶剂的提取效果不佳。
4.因此,需要开发一种新的既能高效捕集烟气成分又能不受到溶剂毒性限制的气溶胶捕集方法;此外,为了对烟草制品进行全面的安全性评价,对于来自烟草制品的气溶胶的捕集物,需要提供针对特定指标的新的毒理学检测方法。
技术实现要素:
5.为了解决上述技术问题,本发明提供一种气溶胶捕集方法。该方法无需溶剂提取操作,而是采用新的气溶胶捕集装置,直接捕集来自烟草制品的气溶胶,并以高速离心的方式,将气溶胶捕集物以物理的方式直接离心下来,使得提取效率更高,最大程度避免了水分及其他挥发及半挥发性成分的损失,样品可检测的剂量更高,并避免了溶剂毒性。
6.因此,本发明的一个目的是提供一种气溶胶捕集物的制备方法。
7.本发明的另一个目的是提供采用该制备方法得到的气溶胶捕集物。
8.本发明的还一个目的是提供对气溶胶捕集物的不同毒理学指标的评价方法。
9.本发明的技术方案如下。
10.一方面,本发明提供一种气溶胶捕集物的制备方法,所述制备方法包括以下步骤:将装有剑桥滤片的气溶胶捕集装置安装在吸烟机上,在烟草制品的抽吸过程中捕集气溶胶,抽吸完成后,取下所述气溶胶捕集装置,两端密封后放入离心机中离心,收集离心下来的液体。
11.在本发明提供的制备方法中,所述气溶胶捕集装置包括密封盖、弹性人工唇、压盖、滤片、放置件、收集件,其中:所述弹性人工唇内开设有贯穿所述弹性人工唇长度方向的导流孔,所述导流孔用于卡接烟支;所述压盖内开设有卡接槽,所述弹性人工唇密封卡接在所述卡接槽内,所述压盖内开设有贯穿所述压盖长度方向的贯穿孔,所述贯穿孔与所述导流孔相连通;所述放置件包括开设有通孔的支撑网,所述放置件内开设有贯穿所述放置件长度方向的中空腔,所述支撑网安装在所述中空腔的内壁上,所述滤片铺设安装在所述支
撑网上,所述中空腔与所述贯穿孔相连通;所述收集件内开设有用于收集气溶胶的收集腔,所述收集腔与所述中空腔相连通;所述密封盖密封安装在所述压盖的外侧壁上;所述压盖密封安装在所述放置件上;所述放置件密封安装在所述收集件上。
12.可选的,所述气溶胶捕集装置还包括导流件,所述放置件通过所述导流件密封安装在所述收集件上,所述导流件上开设有导流腔,所述导流腔为漏斗形状。
13.可选的,所述弹性人工唇为橡胶人工唇。
14.可选的,所述导流件包括安装端,所述安装端位于所述漏斗形状的窄口端的一侧,所述安装端用于可拆卸地安装在吸烟机上。
15.可选的,所述气溶胶捕集装置还包括第一密封圈,所述压盖的外侧壁上开设有第一密封槽,所述第一密封圈安装在所述第一密封槽内,以使所述密封盖密封安装在所述压盖的外侧壁上。
16.可选的,所述气溶胶捕集装置还包括第二密封圈,所述压盖的外侧壁上开设有第二密封槽,所述第二密封圈安装在所述第二密封槽内,以使所述压盖密封安装在所述放置件上。
17.可选的,所述气溶胶捕集装置还包括第三密封圈,所述放置件上开设有第三密封槽,所述第三密封圈安装在所述第三密封槽内,以使所述放置件密封安装在所述收集件上。
18.可选的,所述通孔为多个,多个所述通孔沿所述支撑网的周向排列。
19.可选的,所述气溶胶捕集装置用于安装在离心机内的角转子上。
20.优选地,所述制备方法包括以下步骤:
21.1)气溶胶捕集:将本发明上文所述的气溶胶捕集装置安装在吸烟机上,在抽吸过程中捕集烟草制品的气溶胶;和
22.2)抽吸完成后,取下所述气溶胶捕集装置,两端密封后放入离心机中,以10000-13000rpm离心10-15min后,收集离心下来的液体,除菌,低温保存。
23.优选地,在本发明提供的制备方法中,所述烟草制品为电子烟、加热卷烟或水烟。
24.优选地,在本发明提供的制备方法中,所述烟草制品为电子烟或加热卷烟。优选地,在步骤1)中,所述抽吸采用标准抽吸模式(iso:抽吸容量为35ml,抽吸持续时间为2s,抽吸间隔为30s)或加拿大深度抽吸模式(hci:抽吸容量为55ml,抽吸持续时间为2s,抽吸间隔为30s);更优选地,抽吸5支电子烟或加热卷烟。
25.优选地,在本发明提供的制备方法中,所述烟草制品为水烟。优选地,在步骤1)中,所述抽吸采用抽吸容量为530ml,抽吸持续时间2.6s,抽吸间隔为20s的抽吸模式;更优选地,连续抽吸20口。
26.优选地,在本发明提供的制备方法中,在步骤2)中,以12000rpm离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃下保存待用。
27.另一方面,本发明提供通过上述制备方法得到的气溶胶捕集物。
28.又一方面,本发明提供采用通过上述制备方法得到的气溶胶捕集物来检测来自烟草制品的气溶胶的毒理学指标的方法。或者通过上述制备方法得到的气溶胶捕集物在检测来自烟草制品的气溶胶的毒理学指标中的应用。
29.根据本发明的具体实施方式,所述毒理学指标为选自基于p-cjun的 mapk信号传
导、线粒体膜电势、细胞膜通透性、细胞色素c释放、细胞微核率、线粒体质量、细胞活性、活性氧(ros)含量、细胞毒性(ic50)、gsh 含量、dna双链断裂(γ-h2ax)、细胞周期、细胞生长因子、tk基因突变、 caspase3/7活性、细菌回复突变中的一种或多种。
30.根据本发明的具体实施方式,所述烟草制品为电子烟,所述所述毒理学指标为选自基于p-cjun的mapk信号传导、线粒体膜电势、细胞膜通透性、细胞色素c释放、细胞微核率、线粒体质量中的一种或多种。
31.根据本发明的具体实施方式,所述烟草制品为加热卷烟,所述毒理学指标为选自细胞活性、活性氧(ros)含量、细胞毒性(ic50)、gsh含量、dna 双链断裂(γ-h2ax)中的一种或多种。
32.根据本发明的具体实施方式,所述烟草制品为水烟,所述毒理学指标为选自细胞周期、细胞生长因子、tk基因突变、caspase3/7活性、细菌回复突变中的一种或多种。
33.所述方法包括:
34.1.一种采用高内涵法检测来自烟草制品的气溶胶中基于p-cjun的 mapk信号传导的方法,所述方法包括以下步骤:
35.(1)受试物孵育:通过细胞计数板制备1
×
105个/ml的细胞悬液,将制备好的悬液种植到pe 96孔细胞培养板中,种植量为100μl/孔,将种好的 96孔细胞培养板放置co2细胞培养箱中培养24h后,每孔加入不同浓度的受试物继续培养24h,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物。
36.(2)细胞染色与拍照:phospho-c-jun(ser73)(alexa488conjugate) 抗体按照1∶50的比例用5%的bsa溶液配制,每孔加入100μl染料4℃孵育过夜,使用激发波长488nm进行高内涵检测胞内抗体的荧光检测,最后将检测结果进行分析。
37.(3)结果判定:计算每孔中相对荧光比值,将对应的受试物浓度带入,计算p-cjun的折线图,其中不加受试物组(即control组)的荧光值设定为“1”,将受试物组的相对荧光强度与1进行比较,得出每种受试物的计量效应关系,即认为测试实验结果。
38.优选地,所述烟草制品为电子烟。
39.具体而言,本发明的检测来自烟草制品的气溶胶中基于p-cjun的mapk 信号传导的方法包括以下步骤:
40.(1)受试物孵育:将置于二氧化碳培养箱中培养的nci-h292细胞通过经典的血球计数板计数法和自动化细胞计数仪计数法,任选其一进行细胞悬浮液的细胞浓度计算,计算出每毫升细胞悬浮液中的活细胞数,并用细胞生长培养基稀释细胞悬浮液,使其细胞浓度达到1
×
105个/ml;将制备好的细胞悬浮液种植到pe96孔细胞培养板中,种植量为100μl/孔,将种好的96 孔细胞培养板放置于二氧化碳培养箱中培养24h;轻轻吸弃培养24h后的培养基后,加入100μl用rpm1640加10%fbs培养基配制所述受试物得到的染毒液(不同种类的染毒样本有不同的染毒浓度梯度,所有待测样本参考各自的ic
50
值设置染毒液浓度梯度),继续在二氧化碳培养箱中静置培养24h;
41.(2)细胞染色与拍照:吸弃上清液,慢慢滴加100μl冰冻的1xpbs洗涤三遍,最后一遍弃上清,慢慢滴加100μl冰冻的4%多聚甲醛后,立即轻轻吹散;然后,于室温孵育10min,弃上清,加入100μl 0.25%的triton-x 室温下通透15min,弃上清,加入100μl 3%bsa于37℃下封闭2h或者4℃过夜,清洗三遍最后一遍,按照每孔100μl提前配好染料工作液,同时加
入板中;室温摇床孵育30
±
10min,使用pbs轻轻沿壁洗涤三次后,每孔加入100μl pbs待用,需在20min之内进行hcs拍照;轻轻混悬后,使用pe高内涵进行检测,分别设置版型“plate type
″
,“objective”20x空气镜,非共聚焦模式“non-confocal”等参数设置;通道和激发时长设置,488nm激发波长,参数为100%频率+200ms激发光,进行多层数扫描最终选择最佳观察视野,0-12mm;选择最佳视野,选择细胞核区域找出细胞区域,最终进行读取每孔对应视野中p-cjun抗体激发波长488nm平均荧光值,导出数据excel 表格,后进行数据的分析和作图。
42.(3)结果的计算和表述:将pe高内涵仪器导出excel表格中受试物不同浓度对应平均荧光值进行拷贝和处理,首先减去空白溶剂组的荧光值,得出每种烟草制品不同浓度下对应的p-cjun抗体的平均荧光值即每孔平均“相对荧光值”;将相对荧光值,与空白对照control组进行比较,同除以空白对照组平均相对荧光值,将control组平均值归1,即荧光值比例的数值;使用 graphpad 6.0分析软件,将不同受试物浓度值、荧光比值带入,制作成多组折线图。
43.2.一种采用高内涵法检测来自烟草制品的气溶胶对线粒体膜电势的影响的方法,所述方法包括:
44.(1)细胞培养:人肺癌细胞株nci-h292采用含10%fbs的1640培养基,放置于37℃,5%co2及充分饱和湿度的无菌培养箱中,每日在倒置显微镜下观察细胞生长状况,每隔1-2天或当发现培养基颜色变浅、细胞漂浮、细胞生长缓慢时更换培养基,待细胞贴壁生长融合至80%~90%时进行传代,选取处于对数生长期,生长状态良好的细胞进行试验;
45.(2)种植96孔板:用细胞生长培养基稀释细胞悬浮液,使其细胞浓度达到1
×
105个/ml,将制备好的细胞悬浮液种植到96孔细胞培养板中,种植量为 100μl/孔,将种好的96孔细胞培养板放置于二氧化碳培养箱中培养24h;
46.(3)受试物分组及剂量的设定:96孔细胞培养板上设置四个组别:空白对照组、溶剂对照组、阳性对照组和受试物组,根据ic
50
的值调整适宜的受试物浓度,每个测试样做3个平行检测,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物;
47.(4)加入受试物:移除96孔细胞培养板内的培养基,按要求在相应的孔内加入细胞生长培养基和受试物样品。每孔内加入的受试物和细胞生长培养基的总体积均为100μl;
48.(5)孵育受试物:将加好样的96孔细胞培养板置于二氧化碳培养箱中孵 24h:
49.(6)jc-1母液配制:使用前让jc-1粉末和dmso溶液达到室温,将一小瓶的内容物溶解在所提供的230μl dmso中,制备200μm jc-1储备溶液。
50.(7)细胞标记:对于阳性对照组,96孔板每个孔添加0.1μl 50mm cccp (随jc-1试剂盒提供,50μm最终浓度,使用前确保cccp已平衡到室温),并在37℃下培养细胞20min;
51.(8)孵育:加入2μl 200μm jc-1(2μm最终浓度),并在37℃、5%二氧化碳下培养细胞30min;
52.(9)每孔加入100ul温的1
×
pbs缓冲液,洗涤细胞2次;
53.(10)吸去上清,加入100μl温的1
×
pbs或其他合适的缓冲液;
54.(11)使用pe高内涵检测,488nm处检测细胞平均荧光强度;
55.(12)荧光比例计算:将每孔的平均荧光强度除以空白对照组的平均荧光强度值,即可得到荧光强度变化率。
56.优选地,所述烟草制品为电子烟。
57.3.一种采用高内涵法检测来自烟草制品的气溶胶对细胞膜通透性的效应的方法,所述方法包括以下步骤:
58.(1)受试物孵育:通过细胞计数板制备1
×
105个/ml的细胞悬液,将制备好的悬液种植到pe 96孔细胞培养板中,种植量为100μl/孔,将种好的 96孔细胞培养板放置co2细胞培养箱中培养24h后,每孔加入不同浓度的受试物继续培养24h,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物;
59.(4)细胞膜染色与拍照:制备固定液(4%多聚甲醛)、1
×
封闭液、-1染料按照1∶200的比例配制,每孔加入100μl染料室温孵育2h,使用激发波长491/509nm进行高内涵检测胞内抗体的荧光检测,最后将检测结果进行分析;
60.(5)结果判定:计算每孔中相对荧光比值,将对应的受试物浓度带入,计算细胞膜通透性的折线图,其中不加受试物组(即control组)的荧光值设定为“1”,将受试物组的相对荧光强度与1进行比较,得出每种受试物的计量效应关系,即认为测试实验结果。
61.优选地,所述烟草制品为电子烟。
62.具体而言,本发明的检测来自烟草制品的气溶胶对细胞膜通透性的效应的方法包括以下步骤:
63.(1)受试物孵育:将置于二氧化碳培养箱中培养的nci-h292细胞通过经典的血球计数板计数法和自动化细胞计数仪计数法,任选其一进行细胞悬浮液的细胞浓度计算,计算出每毫升细胞悬浮液中的活细胞数,并用细胞生长培养基稀释细胞悬浮液,使其细胞浓度达到1
×
105个/ml。将制备好的细胞悬浮液种植到pe96孔细胞培养板中,种植量为100μl/孔,将种好的96 孔细胞培养板放置于二氧化碳培养箱中培养24h。轻轻吸弃培养24h后的培养基后,加入100μl用rpm1640加10%fbs培养基配制所述受试物得到的染毒液(不同种类的染毒样本有不同的染毒浓度梯度,所有待测样本参考各自的ic
50
值设置染毒液浓度梯度),继续在二氧化碳培养箱中静置培养24h。
64.(2)细胞膜染色与拍照:吸弃上清液,慢慢滴加100μl冰冻的pbs洗涤三遍,最后一遍弃上清,按照每孔50μl提前配好染料工作液,同时加入板中。室温摇床孵育30
±
10min,使用pbs轻轻沿壁洗涤三次后,每孔加入 100μl pbs待用,需在20min之内进行hcs拍照。轻轻混悬后,使用pe高内涵进行检测,分别设置版型“plate type”,“objective”20x空气镜,非共聚焦模式“non-confocal”等参数设置。通道和激发时长设置,488/pi两种激发波长,参数分别为100%频率+200ms和20%频率+30ms的激发光,进行多层数扫描最终选择最佳观察视野,0-12mm。选择最佳视野,选择细胞核区域找出细胞区域,去除pi阳性细胞,最终进行读取每孔对应视野中染料抗体激发波长488平均荧光值,导出数据excel表格,后进行数据的分析和作图。
65.(5)结果的计算和表述:将pe高内涵仪器导出excel表格中受试物不同浓度对应平均荧光值进行拷贝和处理,首先减去空白溶剂组的荧光值,得出每种电子烟不同浓度下对应的jc-1平均荧光值即每孔平均“相对荧光值”。将相对荧光值,与空白对照control组进行比较,同除以空白对照组平均相对荧光值,将control组平均值归1,即荧光值比例的数值。使用graphpad 6.0 分析软件,将不同受试物浓度值、荧光比值带入,制作成多组折线图。
66.4.一种检测来自烟草制品的气溶胶引起细胞色素c释放的方法,所述方法包括:
67.(1)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的1640 培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板;
68.(2)受试物分组:将受试物分为两组:受试物组和空白对照组。受试物组加入不同浓度的含受试物的培养基,空白对照组加入不含受试物的培养基每个浓度设置三个平行,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物;
69.(3)加入受试物:将步骤(4)中的各个浓度的受试物分别加到96孔板中,每个浓度设置三个复孔,空白对照组更换新鲜培养基,置于37℃、5%co2培养箱中培养24h;
70.(4)加入4%多聚甲醛固定:吸去含受试物的培养基,pbs冲洗两遍,加入4%多聚甲醛室温固定10min;
71.(5)加入免疫荧光通透液:吸去4%多聚甲醛,pbs冲洗两遍,加入免疫荧光通透液室温通透10min;
72.(6)加入封闭液封闭:吸去通透液pbs冲洗两遍,加入封闭液室温封闭 1h:
73.(7)加入细胞色素c抗体:吸去封闭液,加入细胞色素c抗体4℃过夜孵育;
74.(8)标记细胞核:吸去细胞色素c抗体,pbs冲洗两遍,加入hoechst 室温孵育20min;
75.(9)测定细胞色素c荧光强度:吸去hoechst,pbs冲洗两遍。将96孔板放入高内涵仪器中选择alexa643和hoechst荧光通道。设置曝光时间5ms,激发光强度为10%的能量,焦平面选择-4μm。设定完成开始拍摄。
76.(10)结果判定:用高内涵系统软件分析细胞色素c荧光强度,导出荧光强度结果。计算受试物组荧光强度与空白对照组荧光强度的平均值,细胞色素c释放=受试物组平均荧光强度/空白对照组平均荧光强度。受试物组平均荧光强度与空白对照组平均荧光强度的比值大于1说明受试物引起细胞色素 c释放。
77.优选地,所述烟草制品为电子烟。
78.5.一种采用高内涵法检测来自烟草制品的气溶胶对细胞微核率的影响的方法,所述方法包括:
79.(1)单细胞悬浮液的制备:中国仓鼠卵巢细胞(cho)用rpmi1640+10% (v/v)胎牛血清(fbs),在37℃、5%co2培养箱中培养,每天用倒置显微镜观察细胞的形态、生长和汇合状况,确保无污染。当细胞生长达到80%汇合时,移除培养瓶中的培养基,用磷酸缓冲液(pbs)冲洗两次丢弃洗液,加入0.125%(w/v)的胰蛋白酶溶液单层孵育约1min,添加新鲜完全培养基到培养瓶中,充分混合,形成细胞悬浮液;
80.(2)细胞浓度的计算和稀释:采用血球计数板计数法或自动化细胞计数仪计数法,计算出每毫升细胞悬浮液中的活细胞数,并用细胞生长培养基稀释细胞悬浮液,使其细胞浓度达到1
×
105个/ml;
81.(3)96孔板的包被和细胞种植:种植细胞前,高内涵专用96孔板每孔加入50μl多聚赖氨酸(pdl)包被液包被30min至2h,完成后吸出包被液,用pbs清洗后超净台中晾干。将稀释过后浓度为1
×
105个/ml的细胞悬浮液种植到96孔板中,种植量为100μl/孔,每孔的细胞数量是10000个,将种好的96孔板放置于二氧化碳培养箱中培养24h;
82.(4)受试物及对照组设置:试验设置三个组别:空白对照组、阳性对照组和受试物组,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物。空白对照组只加
细胞培养基,阳性对照组采用剂量为50μg/ml的苯并芘,受试物组剂量设置,根据细胞毒性试验得到的ic50为最大剂量,取1/2、1/4、1/8、1/16为中低剂量;
83.(5)细胞染毒:移除96孔板内的培养基,在96孔板的相应孔内加入100 μl配制好的含6μg/ml细胞松弛素b的染毒液,将96孔板放置于二氧化碳培养箱中培养24h;
84.(6)细胞固定和通透:用pbs清洗96孔板,加入4%多聚甲醛溶液固定 10min,固定结束后pbs清洗,用0.1%tritonx-100溶液通透10min,再用 pbs清洗;
85.(7)细胞染色:先使用cell mask red染液避光染色细胞质30min,pbs 清洗后再用hoechst染液避光染色细胞核30min,染色结束后pbs清洗,再用100μl pbs覆盖细胞进行高内涵拍摄;
86.(8)高内涵拍摄:采用20倍空气镜,选取染色良好且细胞密度适宜的 35个视野进行拍摄,最少观察1 000个双核细胞计数微核率。双核细胞应为细胞质保存完好,细胞膜边界清晰,细胞核相互分开,微核易于分辨。微核大小不应超过主核直径的1/3,不应与主核重叠,要完全分开。按照此标准调整高内涵软件筛选参数,分析结果;
87.(9)结果判定:受试物样品与空白对照相比,微核率有显着性增加并有剂量反应关系,即可确认为阳性结果。若统计学上差异有显着性,但无剂量反应关系时,则须进行重复试验,能重复者可确定为阳性。
88.优选地,所述烟草制品为电子烟。
89.6.一种采用高内涵法检测来自烟草制品的气溶胶对线粒体质量的影响的方法,所述方法包括:
90.(1)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的1640 培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、种植96孔板;
91.(2)受试物分组:将受试物分为两组:受试物组和空白对照组,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物。受试物组加入不同浓度的含受试物的培养基,空白对照组加入不含受试物的培养基,每个浓度设置三个平行;
92.(3)加入受试物:将步骤(4)中的各个浓度的受试物分别加到96孔板中,每个浓度设置三个复孔,空白对照组更换新鲜培养基,置于37℃、5%co2培养箱中培养24h;
93.(4)加入mitotracker
tm deep red fm染液:配制浓度为300nm含 mitotracker
tm deep red fm染液的培养基,将含受试物的培养基吸去加入配好的含染液的培养基,置于37℃、5%co2培养箱孵育20min;
94.(5)加入4%多聚甲醛固定:吸去含染液的培养基,pbs冲洗两遍,加入 4%多聚甲醛室温固定10min;
95.(6)加入hoechst标记细胞核:吸去4%多聚甲醛,pbs洗两遍,加入 hoechst室温避光染色20min;
96.(7)测定线粒体荧光强度:吸去hoechst,pbs洗两遍。将96孔板放入高内涵仪器中选择mitotracker
tm deep red和hoechst荧光通道。设置曝光时间5ms,激发光强度为10%的能量,焦平面选择-4μm。设定完成开始拍摄。
97.(8)结果判定:用高内涵系统软件分析线粒体荧光强度,导出荧光强度结果。计算受试物组荧光强度与空白对照组荧光强度的平均值,线粒体质量改变=受试物组平均荧光强度/空白对照组平均荧光强度。受试物组平均荧光强度与空白对照组平均荧光强度的比
值小于1说明受试物引起线粒体质量下降。
98.优选地,所述烟草制品为加热卷烟。
99.7.一种采用实时无标记动态细胞分析技术检测来自烟草制品的气溶胶对细胞活性的影响的方法,所述方法包括:
100.(1)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的1640 培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺e-plate16孔板,培养24h;
101.(2)受试物分组:将受试物分为两组:受试物组和空白对照组,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物。每组设置两个平行;
102.(3)加入受试物:将步骤(4)中配好的受试物分别加到rtca专用e-plate 16孔板中每个浓度设置2个复孔,空白对照组更换新鲜培养基,置于37℃、 5%co2培养箱中培养24h;
103.(4)结果判断:导出细胞指数(cell index与细胞数量和活性成正相关) 随时间变化的结果,判断受试物是否引起cell index降低。
104.优选地,所述烟草制品为加热卷烟。
105.8.一种采用流式细胞术检测来自烟草制品的气溶胶对细胞ros含量影响的方法,所述方法包括:
106.(1)细胞培养:人肺癌细胞株nci-h292采用含10%fbs(胎牛血清),1640 培养基,放置于37℃,5%co2及充分饱和湿度的无菌培养箱中。每日在倒置显微镜下观察细胞生长状况。每隔1-2天或当发现培养基颜色变浅、细胞漂浮、细胞生长缓慢时更换培养基,待细胞贴壁生长融合至80%~90%时进行传代。选取处于对数生长期,生长状态良好的细胞进行试验。
107.(2)种植6孔板:用细胞生长培养基稀释细胞悬浮液,使其细胞浓度达到 1.5
×
105个/ml,将制备好的细胞悬浮液种植到6孔细胞培养板中,种植量为 2ml/孔,将种好的6孔细胞培养板放置于二氧化碳培养箱中培养24h。
108.(3)组别的设置:试验设置四个组别:空白对照组、溶剂对照组、阳性对照组和受试物组,每个剂量设置三个平行副孔,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物。
109.(4)加入受试物:移除6孔细胞培养板内的培养基,按要求在相应的孔内加入细胞生长培养基和受试物样品。每孔内加入的受试物和细胞生长培养基的总体积均为2ml。
110.(5)孵育受试物:将加好样的6孔细胞培养板置于二氧化碳培养箱中孵 24h。
111.(6)染料的配制:按照1∶1000用无血清培养液稀释dcfh-da和rosup,去除细胞培养液,加入适当体积稀释好的dcfh-da,加入的体积以能充分盖住细胞为宜,通常对于6孔板的一个孔加入稀释好的dcfh-da不少于 500μl,37℃细胞培养箱内孵育20min。
112.(7)洗涤:孵育结束后用1
×
pbs洗涤细胞,弃上清,重复两次充分去除未进入细胞内的dcfh-da;
113.(8)流式检测:流式细胞仪上机检测,激发波长为488nm。
114.(9)相对荧光强度计算:将每孔的平均荧光强度除以空白对照组的平均荧光值,即可得到相对荧光强度的变化。
115.优选地,所述烟草制品为加热卷烟。
116.9.一种采用cck-8试剂检测来自烟草制品的气溶胶对细胞的半数抑制率(ic50)的方法,所述方法包括:
117.(1)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的1640培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板,培养24h;
118.(2)受试物分组:将受试物分为两组:受试物组和空白对照组,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物。受试物组的浓度设置应满足最大浓度致死率达到90%最小浓度致死率达到10%,最大浓度和最小浓度之间按梯度设置多个浓度。空白对照组加入不含受试物的培养基;
119.(3)加入受试物:将步骤(4)中的各个浓度的受试物分别加到96孔板中每个浓度设置4个复孔,空白对照组更换新鲜培养基,置于37℃、5%co2培养箱中培养24h;
120.(4)加入含10%cck-8培养基:配制含10%cck-8的培养基,将含受试物的培养基吸去加入配好的含10%cck-8的培养基,置于37℃、5%co2培养箱孵育2.5h;
121.(5)测定不同浓度受试物吸亮度:将孵育完毕的96孔板取出放入酶标仪中450nm测定每孔的吸亮度;
122.(6)结果判定:计算不同浓度受试物及空白对照吸亮度的平均值,细胞抑制率=1-(受试物组平均吸亮度/空白对照组平均吸亮度)*100%。以浓度为x值细胞抑制率为y值用graphdprism5进行非线性拟合计算出受试物对细胞的ic
50
。
123.优选地,所述烟草制品为加热卷烟。
124.10.一种采用高内涵法检测来自烟草制品的气溶胶对细胞内gsh含量的影响的方法,所述方法包括:
125.(1)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的1640培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板;
126.(2)受试物分组:将受试物分为两组:受试物组和空白对照组,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物。受试物组加入不同浓度的含受试物的培养基,空白对照组加入不含受试物的培养基每个浓度设置三个平行;
127.(3)加入受试物:将步骤(4)中的各个浓度的受试物分别加到96孔板中,每个浓度设置三个复孔,空白对照组更换新鲜培养基,置于37℃、5%co2培养箱中培养24h;
128.(4)加入thioltracker
tm
violet染液:配制浓度为20μm含thioltracker
tm
violet染液的培养基,将含受试物的培养基吸去加入配好的含染液的培养基,置于37℃、5%co2培养箱孵育30min;
129.(5)加入4%多聚甲醛固定:吸去含染液的培养基,pbs冲洗两遍,加入4%多聚甲醛室温固定10min;
130.(6)加入hoechst标记细胞核:吸去4%多聚甲醛,pbs洗两遍,加入hoechst室温避光染色20min;
131.(7)测定gsh荧光强度:吸去hoechst,pbs洗两遍。将96孔板放入高内涵仪器中选择alexa405和hoechst荧光通道。设置曝光时间5ms,激发光强度为10%的能量,焦平面选择-4μm。设定完成开始拍摄。
132.(8)结果判定:用高内涵系统软件分析线粒体荧光强度,导出荧光强度结果。计算
受试物组荧光强度与空白对照组荧光强度的平均值,gsh含量变化=受试物组平均荧光强度/空白对照组平均荧光强度。受试物组平均荧光强度与空白对照组平均荧光强度的比值小于1说明受试物引起gsh含量降低。
133.优选地,所述烟草制品为加热卷烟。
134.11.一种采用高内涵法检测来自烟草制品的气溶胶对细胞dna双链断裂的影响的方法,所述方法包括:
135.(1)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的1640 培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板,培养24h.
136.(2)受试物分组与加入受试物:将受试物分为两组:受试物组和空白对照组,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物。受试物组的浓度设置应参考细胞半数抑制率,空白对照组加入不含受试物的培养基,随后置于37℃、5%co2培养箱中继续培养24h。
137.(3)细胞染色与测定吸亮度:制备固定液(4%多聚甲醛)、0.25%的 triton-x、1
×
封闭液、抗γ-h2ax抗体按照1∶200的比例配制,每孔加入100 μl染料室温孵育2h,使用激发波长488nm进行高内涵检测胞内抗体的荧光检测,最后将检测结果进行分析。
138.(4)结果判定:计算每孔中相对荧光比值,将对应的加热卷烟气溶胶数带入,计算γ-h2ax的折线图,其中不加受试物组(即control组)的荧光值设定为“1”,将受试物组的相对荧光强度与1进行比较,得出每种受试物的计量效应关系,即认为测试实验结果。
139.优选地,所述烟草制品为加热卷烟。
140.12.一种采用流式细胞术检测来自烟草制品的气溶胶对细胞周期的影响的方法,所述方法包括:
141.(1)细胞培养:人肺癌细胞株h292采用含10%fbs(胎牛血清),1640培养基,放置于37℃,5%co2及充分饱和湿度的无菌培养箱中。每日在倒置显微镜下观察细胞生长状况。每隔1-2天或当发现培养基颜色变浅、细胞漂浮、细胞生长缓慢时更换培养基,待细胞贴壁生长融合至80%~90%时进行传代。选取处于对数生长期,生长状态良好的细胞进行试验。
142.(2)种植6孔板:用细胞生长培养基稀释细胞悬浮液,使其细胞浓度达到 1.5
×
105个/ml,将制备好的细胞悬浮液种植到6孔细胞培养板中,种植量为 2ml/孔,将种好的6孔细胞培养板放置于二氧化碳培养箱中培养24h。
143.(3)受试物分组:6孔细胞培养板上设三个组别,分别为:空白对照组、溶剂对照组和受试物组,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物,每个测试样做3孔平行检测。
144.(4)加入受试物:移除6孔细胞培养板内的培养基,按要求在相应的孔内加入细胞生长培养基和受试物样品。每孔内加入的受试物和细胞生长培养基的总体积均为2ml。
145.(5)孵育受试物:将加好样的6孔细胞培养板置于二氧化碳培养箱中孵 24h。
146.(6)2
×
edu工作液的配制:由于edu工作液是与培养液等体积加入到孔板中,所以需要配制成2
×
的工作液。推荐的edu终浓度为10μm(1
×
),用细胞培养液1:500稀释edu(10mm)即可得到2
×
的edu工作液(20μm)。
147.(7)标记edu:将37℃预热的2
×
的edu工作液(20μm),等体积加入6孔板中,使6孔板
中的edu终浓度变为1x,继续孵育细胞2小时。
148.(8)固定:edu标记细胞完成后,去除培养液,并加入1ml固定液(可以使用碧云天的免疫染色固定液p0098,或4%的多聚甲醛p0099),室温固定15 分钟。
149.(9)洗涤:去除固定液,每孔用1ml洗涤液洗涤细胞3次,每次3-5分钟。
150.(10)通透:去除洗涤液,每孔用1ml通透液(可以使用碧云天的免疫染色强力通透液p0097,免疫染色洗涤液p0106,或含0.3%triton x-100的pbs),室温孵育10-15分钟。
151.(11)洗涤:去除通透液,每孔用1ml洗涤液洗涤细胞1-2次,每次3-5分钟。
152.(12)配制反应液:严格按顺序配制click反应液,否则点击反应可能无法有效进行;同时,click反应液须在配制后15分钟内使用。
153.(13)孵育染色液:去除上一步骤中的洗涤液,每孔加入0.5ml click反应液,轻轻摇晃培养板以确保反应混合物可以均匀覆盖样品,室温避光孵育30 分钟。
154.(14)洗涤:吸除click反应液,用洗涤液洗涤3次,每次3-5分钟。
155.(15)流式检测:使用流式细胞仪荧光检测,azide 488的最大激发波长是495nm,最大发射波长是519nm。
156.(16)flowjo软件处理原始数据:将流式细胞仪中受试物不同浓度对应图形导出,用flowjo 10软件对原始数据进行处理,拟合出细胞周期峰值图。
157.(17)图例的制作:使用graphpad 5.0分析软件,将不同受试物浓度,细胞周期中不同时期所占比例带入,制作成多组柱状图。
158.优选地,所述烟草制品为水烟。
159.13.一种采用蛋白悬液芯片检测来自烟草制品的气溶胶对细胞生长因子的影响的方法,所述方法包括:
160.(1)受试物孵育:通过细胞计数板制备1
×
105个/ml的细胞悬液,将制备好的悬液种植到100mm细胞培养皿中,种植量为8ml/个,将种好的细胞培养皿放置co2细胞培养箱中培养24h后,每孔加入不同浓度的受试物继续培养24h,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物。
161.(2)提蛋白:吸弃上清液,慢慢滴加1ml冰冻的ripa裂解液,铺均后使用细胞刮板,刮取细胞移至到1.5ml ep管中,冰上裂解30min后,14000 g离心10min,吸取上清液到另一个ep管中,使用碧云天蛋白浓度提取试剂盒bca法进行蛋白总浓度的测定,根据标准曲线图算出蛋白总浓度的数值并进行数据处理。
162.(3)实验前样本处理:按照bio-plex pro assay使用手册进行实验,计划 96孔板布局。按照说明书中要求稀释样本和标准品,至于冰上。
163.(4)磁珠混合:漩涡震荡已稀释的磁珠(1x)数秒,在每孔中加入50μl。加入100μl bio-plex wash buffer,洗板2次。漩涡震荡已准备好的待测样品、标准品、blank数秒,每孔加入相应液体50μl。小心盖上封板膜,并用铝箔完全遮盖,避光于室温下850转摇床,孵育1h。
164.(5)孵育detection antibodies:在孵育结束前10min,漩涡震荡detectionantibodies(20x)5秒,并将其稀释成1x(将300μl 20x detection ab加入 5700μl detection ab diluent中),孵育结束后,小心揭开铝箔及封板膜,每孔加入100μl bio-plex wash buffer,使用磁力架洗板3次,漩涡震荡已稀释的detection antibodies(1x)数
秒,每孔各加入25μl,小心盖上封板膜,并用铝箔完全遮盖,避光于室温下850转摇床,孵育30min。
165.(6)孵育streptavidin-pe:在孵育结束前10min,漩涡震荡 streptavidin-pe(100x)5秒,并将其稀释成1x(将100μl 100x streptavidin-pe加入9900μl assay buffer中),过程中保持避光,孵育结束后,小心揭开铝箔及封板膜,每孔加入100μl bio-plex wash buffer,使用磁力架洗板3次,漩涡震荡已稀释的sa-pe(1x)数秒,每孔各加50μl,小心盖上封板膜,并用铝箔完全遮盖,避光于室温下850转摇床,孵育 10min,孵育结束后,小心揭开铝箔及封板膜,每孔加入100μl bio-plex washbuffer,使用磁力架洗板3次。
166.(7)重悬磁珠:用125μl assay buffer重悬磁珠,小心盖上密封带,于室温下900转摇床30秒后立即放入bio-plex系统中进行检测。
167.(8)结果的计算和表述:将检测指标各个因子s1一s8的荧光值与浓度进行处理,并除以蛋白总浓度,制定15种不同因子对应的标准曲线图。将检测荧光值带入各个标准曲线,计算出每孔中对应生长因子的浓度,并除以蛋白总浓度值,得出同等总浓度下,各个受试物每孔检测因子对应细胞生长因子数值。使用graphpad 6.0分析软件,将不同水烟受试物相对生长因子浓度值,不同受试物浓度值带入,制作成多组折线图。
168.优选地,所述烟草制品为水烟。
169.14.一种检测来自烟草制品的气溶胶致细胞tk基因突变的方法,所述方法包括:
170.(1)细胞培养条件:小鼠淋巴瘤细胞(l5178y tk+/-3.7.2c)用 rpmi1640+10%(v/v)马血清,在37℃、5%co2培养箱中培养,每天用倒置显微镜观察细胞的形态、生长状况,确保无污染。每2~3天传代。
171.(2)细胞自发突变清除:正式试验前,需清除自发突变的tk-/-基因型细胞。使用thmg培养基(3μg/ml胸腺嘧啶核苷+5μg/ml次黄嘌呤+0.1 μg/ml氨甲喋呤+7.5μg/ml甘氨酸)将对数生长的细胞重新悬浮,调整密度至2
×
105个/ml,置于37℃、5%co2条件下培养24h,以约1000rpm的速度离心5min,除去上清液,洗涤后在不含氨甲喋呤的thg培养基中培养2d。
172.(3)受试物及对照组设置:试验设置三个组别:空白对照组、阳性对照组和受试物组,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物。空白对照组只加细胞培养基,阳性对照组采用剂量为3μg/ml的环磷酰胺,根据细胞毒性实验结果设置受试物组水烟样品剂量,在相对存活率为20%~80%范围内设置至少4个非零剂量。
173.(4)10%s9混合液的配制:每10ml混合液,由磷酸缓冲液(pbs)6ml、 0.825mol/l氯化钾-0.2mol/l氯化镁溶液0.4ml、0.05mol/l的葡萄糖-6磷酸钠盐缓冲液1ml和0.025mol/l的辅酶-ii溶液1.6ml混匀,用0.22μm无菌滤膜过滤除菌后,再加入s9液1ml,配制成10%s9混合液冰浴备用。
174.(5)细胞染毒:取生长良好的细胞,密度调整至5
×
105个/ml,按1%体积加入受试物tpm,按10%体积加入10%s9混合液,剩余体积用细胞培养基补充,37℃振摇处理3h。以1000rpm的速度离心5min,除去上清液, pbs洗涤后重悬于含细胞培养基中,并调整细胞密度为2
×
105个/ml。
175.(6)表达培养:染毒后的细胞悬液(2
×
105个/ml),在37℃、5%co2条件下表达培养2d,每天计数细胞密度并保持密度在106个/ml以下,计算相对悬浮生长(rsg)。
[0176][0177]
(7)接种96孔板:
[0178]
7.1第0d平板接种效率(pe0)的测定:取适量步骤(7)染毒后的细胞悬液,用细胞培养基作梯度稀释至8个细胞/ml,接种96孔板,每孔200μl。每个剂量接种2块板,37℃、5%co2条件下培养12d,计数每块平板无集落生长的孔数。
[0179][0180]
(ew-无集落生长的孔数;tw-总孔数;1.6-每孔接种细胞数)
[0181]
7.2第2d平板接种效率(pe2)的测定:取适量步骤(8)表达培养2d后的细胞悬液,用细胞培养基作梯度稀释至8个细胞/ml,接种96孔板,每孔 200μl。每个剂量接种2块板,37℃、5%co2条件下培养12d,计数每块平板无集落生长的孔数。
[0182][0183]
(ew-无集落生长的孔数;tw-总孔数;1.6-每孔接种细胞数)
[0184][0185]
7.3tft抗性突变频率(mf)的测定:取适量步骤(8)表达培养2d后的细胞悬液,用细胞培养基稀释至1
×
104/ml,加入终浓度为3μg/ml的三氟胸苷(tft),接种96孔板,每孔200μl。每个剂量接种2块板,37℃、5%co2条件下培养12d,计数每块平板无集落生长的孔数。
[0186][0187]
(mf-tft抗性突变频率;ew-无集落生长的孔数;tw-总孔数;n
‑ꢀ
每孔接种细胞数2000;pe
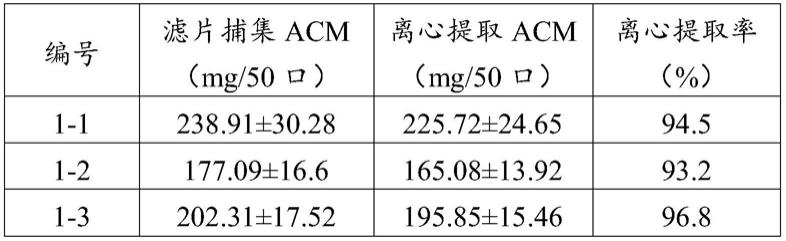
2-表达培养第2天的平板效率。)
[0188]
(8)细胞集落计数:目视或使用显微镜计数各平板无突变集落生长的孔数,排除污染的孔。突变集落按大集落(large colony,lc:直径≥1/4孔径,呈薄层分布,密度低)和小集落(small colony,sc:直径<1/4孔径,呈块状,密度高)分别计数。极小的集落可再继续培养3d后计数。
[0189]
(9)结果判定:
[0190]
9.1实验成立判定:自发突变频率应在50~200
×
10-6
之间,阴性/溶剂对照的pe0在60%~140%,pe2在70%~130%。阳性对照mf与阴性/溶剂对照有显着差异,或是阴性/溶剂对照的3倍以上。
[0191]
9.2阳性结果判定:受试物至少一个剂量组mf显着高于阴性/溶剂对照,或是阴性/溶剂对照的3倍以上,并有剂量-反应趋势,则可判定为阳性。但如果仅在rs低于20%的高剂量情况下出现阳性,结果则判为“可疑”。
[0192]
9.3阴性结果判定:在rs低于20%的情况下未见mf的增加,可判断受试物为阴性。
[0193]
优选地,所述烟草制品为水烟。
[0194]
15.一种采用高内涵法检测来自烟草制品的气溶胶对细胞内caspase3/7 活性的影响的方法,所述方法包括:
[0195]
(1)细胞培养:人肺癌细胞株nci-h292采用含10%fbs(胎牛血清),1640 培养基,放置于37℃,5%co2及充分饱和湿度的无菌培养箱中。每日在倒置显微镜下观察细胞生长状况。每隔1-2天或当发现培养基颜色变浅、细胞漂浮、细胞生长缓慢时更换培养基,待细胞贴壁生长融合至80%~90%时进行传代。选取处于对数生长期,生长状态良好的细胞进行试验。
[0196]
(2)种植96孔板:用细胞生长培养基稀释细胞悬浮液,使其细胞浓度达到1
×
105个/ml,将制备好的细胞悬浮液种植到96孔细胞培养板中,种植量为 100μl/孔,将种好的96孔细胞培养板放置于二氧化碳培养箱中培养24h。
[0197]
(3)受试物分组:96孔细胞培养板上设三个组别,分别为:空白对照组、溶剂对照组和受试物组,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物,每个测试样做3孔平行检测。
[0198]
(4)加入受试物:移除96孔细胞培养板内的培养基,按要求在相应的孔内加入细胞生长培养基和受试物样品。每孔内加入的受试物和细胞生长培养基的总体积均为100μl。
[0199]
(5)孵育受试物:将加好样的96孔细胞培养板置于二氧化碳培养箱中孵 24h。
[0200]
(6)稀释检测试剂:用含5%胎牛血清的pbs溶液进行稀释,将绿色检测试剂稀释到2-8μm最终浓度。为了获得最佳结果,建议用5%胎牛血清的pbs 溶液来稀释试剂盒中绿色检测试剂。但也可以用完全的培养基进行稀释,然而,这可能导致高荧光背景,建议进行条件优化。预试验应该设定2-10μm 浓度范围的绿色检测试剂,以确定该试剂的最佳浓度。
[0201]
(7)孵育染色液:将培养液从细胞培养板中除去,然后将稀释后的绿色检测试剂加入细胞中,在96孔板中,每孔添加100μl试剂溶液。在37℃的温度下培养细胞至少30min。
[0202]
(8)洗涤:每孔加入100μl温的1
×
pbs缓冲液,洗涤细胞2次。
[0203]
(9)检测:pe高内涵检测,绿色检测试剂的激发/发射最大值为 502/530nm。
[0204]
(10)相对荧光强度计算:将每孔的平均荧光强度除以空白对照组的平均荧光值,即可得到相对荧光强度的变化。
[0205]
优选地,所述烟草制品为水烟。
[0206]
16.一种检测来自烟草制品的气溶胶致细菌回复突变的方法,所述方法包括:
[0207]
(1)增菌培养:将菌株ta98、ta100、ta102、ta1535、ta1537分别接种于含有适量营养肉汤培养基的无菌三角瓶中,于37℃条件下振荡(130 次/min)培养10h或静置培养16h,使每毫升培养液的活菌数不少于1
×
109个。
[0208]
(2)配制底层培养基:三角瓶中配制1.8%(w/v)琼脂培养基,高压灭菌后,依次加入10ml磷酸盐贮备液,25ml 40%葡萄糖溶液,于培养皿 (φ90mm)中加入混匀后的底层培养基(约25ml/皿),凝固后,将培养皿倒置于培养箱中,于37℃条件下培养过夜。
[0209]
(3)配制顶层培养基:0.6%(w/v)琼脂培养基中加入50ml 0.5mmol/l 组氨酸-生物素溶液,混匀后分装在小试管中,每管约2ml,高压灭菌后水浴保温。
[0210]
(4)10%s9混合液的配制:每10ml混合液,由磷酸缓冲液(pbs)6ml、 0.825mol/l氯化钾-0.2mol/l氯化镁溶液0.4ml、0.05mol/l的葡萄糖-6磷酸钠盐缓冲液1ml和0.025mol/l的辅酶-ii溶液1.6ml混匀,用0.22μm无菌滤膜过滤除菌后,再加入s9液1ml,配制成10%s9
混合液冰浴备用。
[0211]
(5)受试物及对照组设置:试验设置四个组别:自发回复组、溶剂对照组、阳性对照组和受试物组,其中所述受试物为通过本发明提供的制备方法得到的气溶胶捕集物,每个剂量设置三个平行。所有组别组剂量设置如参见实施例25。
[0212]
(6)平板掺入:于约2ml保温的顶层培养基中加入受试物/阳性对照/溶剂对照100μl、10%s9混合液500μl(不加s9代谢活化体系的条件则加入pbs 500μl)、测试菌株新鲜菌液100μl,旋转3s混匀并迅速倒入底层培养基上,转动平皿使顶层培养基均匀分布在底层培养基上,平放固化,在培养箱中于37℃条件下倒置培养48-72h。
[0213]
(7)结果判定:计数培养基上长出的回复突变菌落数,如在背景生长良好的条件下,受试物的回复突变菌落数等于或大于自发回变的2倍,并有剂量反应关系或至少某一tpm测试浓度有可重复的并有统计学意义的阳性反应,即可认为该受试物诱变试验阳性。应做两次测试,才能对受试物的诱变性作出判定。
[0214]
优选地,所述烟草制品为水烟。
[0215]
与传统溶剂提取方法相比,本发明的方法无需溶剂提取,而是利用一种气溶胶捕集装置(气溶胶原位离心萃取装置),直接将气溶胶捕集物以物理的方式离心下来进行烟草制品气溶胶的毒理学指标的检测,最大程度避免了水分等成分挥发,提取效率更高,样品可检测剂量得到提高,并据此确定了样品的检测剂量,是一种能更准确地检测毒理学指标的方法,并能横向比较不同烟草制品气溶胶的毒理学效应差异。
附图说明
[0216]
以下,结合附图来详细说明本发明的实施方案,图中的nic代表烟碱 (nicotine)。其中:
[0217]
图1为本发明的方法中采用的气溶胶捕集装置的爆炸示意图;
[0218]
图2为本发明的方法中采用的气溶胶捕集装置的结构示意图;
[0219]
图3为本发明的方法中采用的气溶胶捕集装置中的导流件的结构示意图;
[0220]
图4为本发明的方法中采用的气溶胶捕集装置安装在离心机内的角转子上的结构示意图。
[0221][0222][0223][0224][0225][0226][0227]
图5为电子烟的离心转速优化结果。
[0228]
图6为电子烟的离心时间优化结果。
[0229]
图7为三种电子烟对nci-h292的p-cjun的mapk信号通路的影响。
[0230]
图8为三种电子烟对nci-h292细胞的线粒体膜电势。
[0231]
图9为三种电子烟对nci-h292细胞膜通透性的影响。
[0232]
图10为三种电子烟对nci-h292细胞色素c释放的影响。
[0233]
图11为三种电子烟对cho细胞的微核率的影响。
[0234]
图12为加热卷烟的离心转速优化结果。
[0235]
图13为加热卷烟的离心时间优化结果。
[0236]
图14为三种加热卷烟对nci-h292细胞线粒体质量的影响。
[0237]
图15为三种加热卷烟对nci-h292细胞活性的影响。
[0238]
图16为三种加热卷烟对nci-h292细胞ros含量的影响。
[0239]
图17为三种加热卷烟对nci-h292细胞的ic50。
[0240]
图18为三种加热卷烟对nci-h292的gsh含量的影响。
[0241]
图19为三种加热卷烟对nci-h292的dna双链断裂的影响。
[0242]
图20为水烟的离心转速优化结果。
[0243]
图21为水烟的离心时间优化结果。
[0244]
图22为水烟#1对nci-h292的细胞周期的影响。
[0245]
图23为水烟#1对nci-h292的炎性因子il-6的影响。
[0246]
图24为水烟#1对l5178y细胞引起的tk基因突变频率。
[0247]
图25为三种水烟对nci-h292细胞的caspase3/7活性的影响。附图标记说明:1:密封盖;2:弹性人工唇;3:压盖;4:滤片;5:放置件;6:收集件;7:导流件;8:角转子;9:电机转轴;10:气溶胶捕集装置;31:卡接槽;51:支撑网;52:中空腔;61:收集腔;71:安装端;72:导流腔。
具体实施方式
[0248]
以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。
[0249]
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的原料、试剂材料等,如无特殊说明,均为市售购买产品。
[0250]
(一)气溶胶捕集装置
[0251]
如图1和图3所示,本发明的方法中采用的气溶胶捕集装置10,包括密封盖1、弹性人工唇2、压盖3、滤片4、放置件5、收集件6,其中:弹性人工唇2内开设有贯穿弹性人工唇2长度方向的导流孔,导流孔用于卡接烟支;压盖3内开设有卡接槽31,弹性人工唇2密封卡接在卡接槽31内,压盖3内开设有贯穿压盖3长度方向的贯穿孔,贯穿孔与导流孔相连通;放置件5包括开设有通孔的支撑网51,放置件5内开设有贯穿放置件5长度方向的中空腔52,支撑网51安装在中空腔52的内壁上,滤片4铺设安装在支撑网51上,中空腔52与贯穿孔相连通;收集件6内开设有用于收集气溶胶的收集腔61,收集腔61与中空腔52相连通;密封盖1密封安装在压盖3的外侧壁上;压盖3密封安装在放置件5上;放置件5密封安装在收集件6上。
[0252]
导流孔、贯穿孔、中空腔52、通孔、收集腔61均为相连通的,从而使从烟支上提取的气溶胶能顺利地进入到收集腔61内进行收集;收集腔61的一端开口设置,另一端是密封封闭的;当不安装气溶胶捕集装置10中的密封盖1和收集件6时,将烟支卡接在人工唇上的导流孔内,并将气溶胶捕集装置10中余下的组件依次进行组装,并将组装后的组件安装在吸烟机中,从而将烟支中的气溶胶提取到滤片4上;再将密封盖1密封安装在压盖3上,将收集件6密封安装在放置件5上后,将气溶胶装置安装在离心机上,从而使气溶胶液态离心到收
集腔61内。
[0253]
本发明的方法中采用的气溶胶捕集装置10,与吸烟机、离心机配合使用,包括密封盖1、弹性人工唇2、压盖3、滤片4、放置件5、收集件6,通过将滤片4安装在放置件5内的支撑网51上,将烟支安装在人工唇的导流孔内,从而使从烟支中提取的气溶胶依次经导流孔、贯穿孔、中空腔52、通孔进入收集腔61,避免了使用有机溶剂提取气溶胶,提高了气溶胶的捕集纯度及捕集后气溶胶的检测结果。
[0254]
如图1所示,气溶胶捕集装置10还包括导流件7,放置件5通过导流件7密封安装在收集件6上,导流件7上开设有导流腔72,导流腔72为漏斗形状。本实施例中,漏斗形状的导流腔72,能够使气溶胶较顺畅的进入到收集腔61内,提高了气溶胶捕集装置10的使用方便性。
[0255]
滤片4为剑桥滤片,剑桥滤片能够较完整地收集气溶胶,且较容易地采购到,提高了气溶胶捕集装置10的捕集效果,降低了气溶胶捕集装置10的生产成本。
[0256]
弹性人工唇2为橡胶人工唇。材质为橡胶的人工唇,具有较好地弹性和耐磨性,提高了气溶胶捕集装置10的使用寿命。
[0257]
如图1和图3所示,导流件7包括安装端71,安装端71位于漏斗形状的窄口端的一侧,安装端71用于可拆卸地安装在吸烟机上。导流件7可拆卸地安装在吸烟机上,便于导流件7的安装或更换,提高了气溶胶捕集装置 10的安装或更换的方便性。
[0258]
气溶胶捕集装置10还包括第一密封圈,压盖3的外侧壁上开设有第一密封槽,第一密封圈安装在第一密封槽内,以使密封盖1密封安装在压盖3 的外侧壁上。第一密封圈的材质为抗腐蚀的氟橡胶。第一密封圈价格便宜且容易采购到,降低了气溶胶捕集装置10的生产成本。
[0259]
气溶胶捕集装置10还包括第二密封圈,压盖3的外侧壁上开设有第二密封槽,第二密封圈安装在第二密封槽内,以使压盖3密封安装在放置件5 上。第二密封圈的材质为抗腐蚀的氟橡胶。第二密封圈价格便宜且容易采购到,降低了气溶胶捕集装置10的生产成本。
[0260]
气溶胶捕集装置10还包括第三密封圈,放置件5上开设有第三密封槽,第三密封圈安装在第三密封槽内,以使放置件5密封安装在收集件6上。第三密封圈的材质为抗腐蚀的氟橡胶。第三密封圈价格便宜且容易采购到,降低了气溶胶捕集装置10的生产成本。
[0261]
如图1所示,通孔为多个,多个通孔沿支撑网51的周向排列。多个通孔能够较快地使气溶胶从通孔中通过,提高了气溶胶的收集效率,进而提高了气溶胶捕集装置10的使用效率。
[0262]
如图4所示,气溶胶捕集装置10用于安装在离心机内的角转子8上。气溶胶捕集装置10安装在离心机内的角转子8上,通过离心机内的电机转轴9的转动带动气溶胶捕集装置10转动,从而使气溶胶成液态的进入到收集腔61内,进而实现对气溶胶的收集,提高了气溶胶捕集装置10的使用方便性。
[0263]
气溶胶捕集装置10的使用过程如下:首先,将干净的剑桥滤片4铺设地放入支撑网51上,依次安装好弹性人工唇2、压盖3、和放置件5,并将烟支卡接在弹性人工唇2上,随即将上述安装好的组件放入吸烟机进行抽吸;然后,抽吸完成后快速取下上述组装件,将密封盖1和收集件6依次安装好,以对上述弹性人工唇2、压盖3、和放置件5组件的两端进行密封;最后,将密封好的气溶胶捕集装置10放入离心机内的角转子8内,开始高速离心,剑桥滤片4在
角转子8的高速旋转下产生离心力,剑桥滤片4内的气溶胶成分在离心力的作用下成液态逐渐流出,并最终汇集在收集腔61内,完成了气溶胶的捕集。
[0264]
本发明的方法中采用的气溶胶捕集装置10,与吸烟机、离心机配合使用,包括密封盖1、弹性人工唇2、压盖3、滤片4、放置件5、收集件6,通过将滤片4安装在放置件5内的支撑网51上,将烟支安装在人工唇的导流孔内,从而使从烟支中提取的气溶胶依次经导流孔、贯穿孔、中空腔52、通孔进入收集腔61,避免了使用有机溶剂提取气溶胶,提高了气溶胶的捕集纯度及捕集后气溶胶的检测结果。
[0265]
(二)使用气溶胶捕集装置,电子烟的气溶胶捕集物的制备与检测
[0266]
实施例1:离心提取条件优化
[0267]
采用直线型吸烟机,一定抽吸模式下(抽吸容量为55ml,抽吸持续时间2s,抽吸间隔为30s)连续抽吸10口,使用剑桥滤片捕集5支电子烟的总粒相物。抽吸完成后,从吸烟机上快速取下捕集装置,将捕集装置两端密封,保持剑桥滤片原位状态,放入离心机中。
[0268]
离心转速优化:在离心机离心时间一定的情况下(10min),考察离心机不同转速下(3000rpm、5000rpm、7000rpm、9000rpm、12000、14000rpm) 所离心下来总粒相物的重量差异。优化结果表明,离心机转速在12000rpm 时所离心下来总粒相物的重量不再增加,故选择离心机转速为12000rpm(图 5)。
[0269]
离心时间优化:在离心机转速一定的情况下(12000rpm),考察不同离心时间下(5min、10min、15min、20min)所离心下来总粒相物的重量差异。优化结果表明,离心时间在10min时所离心下来总粒相物的重量不再增加,故选择离心时间为10min(图6)。
[0270]
实施例2:电子显微镜观察确认
[0271]
使用g-prox台式扫描电子显微镜(荷兰phenom公司)对空白滤片及气溶胶捕集物离心提取前后的滤片进行观察。结果表明,离心提取后,捕集有气溶胶的剑桥滤片与空白滤片一致,未发现捕集物,这说明离心法对剑桥滤片捕集物具有良好的提取效果。
[0272]
实施例3气溶胶捕集物离心效率分析
[0273]
1.气溶胶捕集物离心提取率:
[0274]
一定抽吸模式下(抽吸容量为55ml,抽吸持续时间2s,抽吸间隔为 30s)连续抽吸10口,使用剑桥滤片捕集5支电子烟的总粒相物,平行测试三次,通过比较离心前后滤片质量变化及总粒相物质量来计算离心效率,研究可知,离心法对总粒相物的提取效率达90%以上(表1)。
[0275]
表1.电子烟气溶胶捕集物离心提取率
[0276][0277]
2.气溶胶捕集物主成分离心提取率分析:
[0278]
一定抽吸模式下(抽吸容量为55ml,抽吸持续时间2s,抽吸间隔为 30s)连续抽吸
10口,使用剑桥滤片捕集5支电子烟的总粒相物,平行测试三次。参考coresta recommended method no.84,对离心提取法(12000 rpm,10min)的提取液中的烟碱、甘油、丙二醇和水分含量进行气相色谱分析,并与溶液提取法(异丙醇)进行比较。结果显示,两种提取方法效率差异不大,其中离心提取法为溶液提取法提取效率的90.50%以上 (90.50%~99.64%)(表2)。
[0279][0280]
3.气溶胶捕集物主要有害成分离心效率分析:
[0281]
一定抽吸模式下(抽吸容量为55ml,抽吸持续时间2s,抽吸间隔为 30s)连续抽吸
10口,使用剑桥滤片捕集5支电子烟的总粒相物,平行测试三次。参考coresta recommended method no.72和no.74,对离心提取法(12000rpm,10min)的提取液中的代表性有害成分含量进行分析,如羰基化合物(甲醛、乙醛),并与溶液提取法(标准方法)进行比较。结果显示,与溶液提取法相比,离心提取法对羰基化合物的提取效率在 88.52%~93.76%,取得较好效果(表3)。
[0282]
表3.电子烟气溶胶捕集物典型羰基化合物离心提取率
[0283][0284]
实施例4:实际样品测试(p-cjun)
[0285]
根据以上方法,选择三种不同电子烟#1,#2,#3为样品,使用本发明方法制备电子烟气溶胶,并检测其对人肺癌细胞nci-h292细胞的p-cjun,结果如图7所示。
[0286]
检测步骤:
[0287]
(1)气溶胶捕集及提取:利用一种基于角转子的电子烟气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集电子烟气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm的速度离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0288]
(2)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的 1640培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板,培养24h。
[0289]
(3)受试物孵育:将置于二氧化碳培养箱中培养的nci-h292细胞通过经典的血球计数板计数法和自动化细胞计数仪计数法,任选其一进行细胞悬浮液的细胞浓度计算,计算出每毫升细胞悬浮液中的活细胞数,并用细胞生长培养基稀释细胞悬浮液,使其细胞浓度达到1
×
105个/ml。将制备好的细胞悬浮液种植到pe96孔细胞培养板中,种植量为100μl/孔,将种好的96 孔细胞培养板放置于二氧化碳培养箱中培养24h。轻轻吸弃培养24h后的培养基后,加入100μl用rpm1640加10%fbs培养基配制的染毒液,继续在二氧化碳培养箱中静置培养24h。
[0290]
表4.基于p-cjun的mapk信号通路试验不同组别剂量设置下细胞状态
[0291][0292]
注:“+”表示细胞状态良好,
“‑”
表示细胞部分死亡,“——”表示细胞大量死亡。
[0293]
(4)细胞染色与拍照:吸弃96孔板的上清液,慢慢滴加100μl冰冻的 1xpbs洗涤三遍,最后一遍弃上清,按照每孔100μl提前配好染料工作液 (1∶50v/v),同时加入板中。室温摇床孵育30
±
10min,使用1x pbs轻轻沿壁洗涤三次后,每孔加入100μlpbs待用,需在20min之内进行hcs拍照。轻轻混悬后,使用pe高内涵进行检测,分别设置版型“plate type”,“objective”20x空气镜,非共聚焦“non-confocal”等参数设置。通道和激发时长设置,488激发波长,参数为100%频率+200ms激发光,进行多层数扫描最终选择最佳观察视野,0-12mm。选择最佳视野,选择细胞核区域找出细胞区域,最终进行读取每孔对应视野中phospho-c-jun(ser73)(alexa 488conjugate)抗体激发波长488平均荧光值,导出数据excel表格,后进行数据的分析和作图。
[0294]
(5)结果的计算和表述:将pe高内涵仪器导出excel表格中受试物不同浓度对应平均荧光值进行拷贝和处理,首先减去空白溶剂组的荧光值,得出每种电子烟不同浓度下对应的p-cjun平均荧光值即每孔平均“相对荧光值”。将相对荧光值,减去同型对照荧光值后与空白对照control组进行比较,同除以空白对照组平均相对荧光值,将control组平均值归1,即荧光值比例的数值。使用graphpad 6.0分析软件,将不同电子烟受试物代码,不同受试物 nic浓度值,荧光比值带入,制作成多组折线图(图7)。
[0295]
结果显示,本方法能准确定量电子烟气溶胶对细胞的基于p-cjun的 mapk信号传导效应,是一种能更准确地检测电子烟气溶胶细胞损伤的方法,并能横向比较不同电子烟气溶胶的基于p-cjun的mapk信号传导效应差异。
[0296]
实施例5:实际样品测试(线粒体膜电势)
[0297]
根据以上方法,选择三种不同电子烟#1,#2,#3为样品,使用本发明方法制备烟气气溶胶提取物并检测其对细胞的损伤,结果如图8所示。
[0298]
检测步骤:
[0299]
(1)气溶胶捕集及提取:利用一种基于角转子的电子烟气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集电子烟气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm的速度离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0300]
(2)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的1640 培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板,培养24h。
[0301]
(3)细胞培养:人肺癌细胞株nci-h292采用含10%fbs(胎牛血清), 1640培养基,放置于37℃,5%co2及充分饱和湿度的无菌培养箱中。每日在倒置显微镜下观察细胞生长状况。每隔1-2天或当发现培养基颜色变浅、细胞漂浮、细胞生长缓慢时更换培养基,待细胞贴壁生长融合至 80%~90%时进行传代。选取处于对数生长期,生长状态良好的细胞进行试验。
[0302]
(4)种植96孔细胞培养板:计算出每毫升细胞悬浮液中的活细胞数,并用细胞生长培养基稀释细胞悬浮液,使其细胞浓度达到1
×
105个/ml,将制备好的细胞悬浮液种植到96孔细胞培养板中,种植量为100μl/孔,将种好的96孔细胞培养板放置于二氧化碳培养箱中培养24h。
[0303]
(5)受试物分组:将受试物分为两组:受试物组和空白对照组。受试物组的浓度设置应满足最大浓度致死率达到90%最小浓度致死率达到10%,最大浓度和最小浓度之间按梯度设置多个浓度。空白对照组加入不含受试物的培养基。每个剂量设置四个平行。按烟碱当量计算#1配制550μg/ml的工作液,#2配制425μg/ml的工作液,#3配制600μg/ml的工作液,所有剂量设置如表5所示;
[0304]
表5.三种电子烟的剂量设置
[0305][0306]
(6)加入受试物:移除96孔细胞培养板内的培养基,按要求在相应的孔内加入细胞生长培养基和受试物样品。每孔内加入的受试物和细胞生长培养基的总体积均为100μl。
[0307]
(7)孵育受试物:将加好样的96孔细胞培养板置于二氧化碳培养箱中孵 24h。
[0308]
(8)jc-1母液配制:使用前让jc-1粉末和dmso溶液达到室温,将一小瓶的内容物溶解在所提供的230μl dmso中,制备200μm jc-1储备溶液。
[0309]
(9)细胞染色:对于阳性对照组,96孔板每个孔添加0.1μl 50mm cccp (随试剂盒提供,50μm最终浓度,使用前确保cccp已平衡到室温),并在 37℃下培养细胞20min。
[0310]
(10)孵育:加入2μl 200μm jc-1(2μm最终浓度),并在37℃、5%二氧化碳下培养细胞30min。
[0311]
(11)每孔加入100ul温的1
×
pbs缓冲液,洗涤细胞2次。
[0312]
(12)吸去上清,加入100μl温的1
×
pbs或其他合适的缓冲液。
[0313]
(13)使用pe高内涵检测,488nm处检测细胞平均荧光强度。
[0314]
(14)荧光比例计算:受试物组的平均荧光值除以空白对照组平均荧光值,得到每组相对荧光强度的数值。
[0315]
(15)结果判定:受试物组的ratio of control值小于0.7,并有剂量反应关系,即可判定引起阳性反应。应重复两次以上试验,才能对结果做出准确判定。
[0316]
结果表明,电子烟样品使nci-h292细胞线粒体膜电势减小,且效应呈剂量依赖性,但均未引起阳性反应,因此电子烟没有造成细胞损伤。本方法能准确定量电子烟气溶胶对细胞线粒体膜电势的影响,是一种能更准确地检测电子烟气溶胶细胞损伤的方法,并能横向比较不同电子烟气溶胶的细胞损伤差异。
[0317]
实施例6:实际样品测试(细胞膜通透性)
[0318]
根据以上方法,选择三种不同电子烟#1,#2,#3为样品,使用本发明方法制备电子烟气溶胶,并检测其对人肺癌细胞nci-h292细胞的细胞膜通透性,结果如图9所示。
[0319]
检测步骤:
[0320]
(1)气溶胶捕集及提取:利用一种基于角转子的电子烟气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集电子烟气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm的速度离心离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0321]
(2)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的 1640培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板,培养24h。
[0322]
(3)受试物分组与加入受试物:将受试物分为两组:受试物组和空白对照组。受试物组的浓度设置应参考细胞半数抑制率,所有剂量设置如表6 所示;空白对照组加入不含受试物的培养基,随后置于37℃、5%co2培养箱中继续培养24h。
[0323]
表6:细胞膜通透性试验不同组别剂量设置下细胞状态
[0324][0325]
注:“+”表示细胞状态良好,
“‑”
表示细胞部分死亡,“——”表示细胞大量死亡。
[0326]
(4)细胞膜染色与拍照:吸弃上清液,慢慢滴加100μl冰冻的pbs洗涤三遍,最后一遍弃上清,按照每孔50μl提前配好染料工作液,同时加入板中。室温摇床孵育30
±
10min,使用pbs轻轻沿壁洗涤三次后,每孔加入 100μl pbs待用,需在20min之内进行hcs拍照。轻轻混悬后,使用pe高内涵进行检测,分别设置版型“plate type”,“objective”20x空气镜,非共聚焦“non-confocal”等参数设置。通道和激发时长设置,488/pi两种激发波长,参数分别为100%频率+200ms和20%频率+30ms的激发光,进行多层数扫描最终选择最佳观察视野,0-12mm。选择最佳视野,选择细胞核区域找出细胞区域,去除pi阳性细胞,最终进行读取每孔对应视野中染料抗体激发波长488平均荧光值,导出数据excel表格,后进
行数据的分析和作图。
[0327]
(5)结果的计算和表述:将pe高内涵仪器导出excel表格中受试物不同浓度对应平均荧光值进行拷贝和处理,首先减去空白溶剂组的荧光值,得出每种电子烟不同浓度下对应的jc-1平均荧光值即每孔平均“相对荧光值”。将相对荧光值,与空白对照control组进行比较,同除以空白对照组平均相对荧光值,将control组平均值归1,即荧光值比例的数值。使用graphpad 6.0 分析软件,将不同电子烟受试物代码,不同受试物nic浓度值,荧光比值带入,制作成多组折线图。
[0328]
结果显示,本方法能准确定量电子烟气溶胶对细胞的细胞膜通透性效应,是一种能更准确地检测电子烟气溶胶细胞毒性的方法,并能横向比较不同电子烟气溶胶的细胞膜通透性差异。
[0329]
实施例7:实际样品测试(细胞色素c释放)
[0330]
根据以上方法,选择三种不同电子烟#1,#2,#3为样品,使用本发明方法制备电子烟气溶胶,并检测其对人肺癌细胞nci-h292引起细胞色素c的释放,结果如图10所示。
[0331]
检测步骤:
[0332]
(1)气溶胶捕集及提取:利用一种基于角转子的电子烟气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集电子烟气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm的速度离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0333]
(2)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的1640 培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板;
[0334]
(3)受试物分组:将受试物分为两组:受试物组和空白对照组,每个剂量设置三个平行。按烟碱当量计算#1配制450μg/ml的工作液,#2配制 290μg/ml的工作液,#3配制570μg/ml的工作液所有剂量设置如表7所示;
[0335]
表7.三种电子烟的剂量设置
[0336][0337]
(4)加入受试物:将步骤(4)中的各个浓度的受试物分别加到96孔板中,每个浓度设置三个复孔,空白对照组更换新鲜培养基,置于37℃、5%co2培养箱中培养24h;
[0338]
(5)加入4%多聚甲醛固定:吸去含受试物的培养基,pbs冲洗两遍,加入4%多聚甲
醛室温固定10min;
[0339]
(6)加入免疫荧光通透液:吸去4%多聚甲醛,pbs冲洗两遍,加入免疫荧光通透液室温通透10min;
[0340]
(7)加入封闭液封闭:吸去通透液pbs冲洗两遍,加入封闭液室温封闭 1h;
[0341]
(8)加入细胞色素c抗体:吸去封闭液,加入细胞色素c抗体4℃过夜孵育;
[0342]
(9)标记细胞核:吸去细胞色素c抗体,pbs冲洗两遍,加入hoechst 室温孵育20min;
[0343]
(10)测定细胞色素c荧光强度:吸去hoechst,pbs冲洗两遍。将96 孔板放入高内涵仪器中选择alexa643和hoechst荧光通道。设置曝光时间 5ms,激发光强度为10%的能量,焦平面选择-4μm。设定完成开始拍摄。
[0344]
(11)结果判定:用高内涵系统软件分析细胞色素c荧光强度,导出荧光强度结果。计算受试物组荧光强度与空白对照组荧光强度的平均值,细胞色素c释放=受试物组平均荧光强度/空白对照组平均荧光强度。受试物组平均荧光强度与空白对照组平均荧光强度的比值大于1说明受试物引起细胞色素 c释放。
[0345]
结果显示,本方法能准确定量电子烟气溶胶对引起细胞色素c的释放,是一种能更准确地检测加电子烟气溶胶引起细胞色素c释放的方法,并能横向比较不同电子烟气溶胶引起细胞色素释放的差异。
[0346]
实施例8:实际样品测试(微核率)
[0347]
根据以上方法,选择三种不同电子烟#1,#2,#3为样品,使用本发明方法制备电子烟气溶胶,并检测其对中国仓鼠卵巢细胞(cho)的微核率的影响,检测其致突变性,结果如图11所示。
[0348]
检测步骤:
[0349]
(1)气溶胶捕集及提取:利用一种基于角转子的电子烟气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集电子烟气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm的速度离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0350]
(2)单细胞悬浮液的制备:中国仓鼠卵巢细胞(cho)用rpmi1640+10% (v/v)胎牛血清(fbs),在37℃、5%co2培养箱中培养,每天用倒置显微镜观察细胞的形态、生长和汇合状况,确保无污染。当细胞生长达到80%汇合时,移除培养瓶中的培养基,用磷酸缓冲液(pbs)冲洗两次丢弃洗液,加入0.125%(w/v)的胰蛋白酶溶液单层孵育约1min,添加新鲜完全培养基到培养瓶中,充分混合,形成细胞悬浮液。
[0351]
(3)细胞浓度的计算和稀释:采用血球计数板计数法或自动化细胞计数仪计数法,计算出每毫升细胞悬浮液中的活细胞数,并用细胞生长培养基稀释细胞悬浮液,使其细胞浓度达到1
×
105个/ml。
[0352]
(4)96孔板的包被和细胞种植:种植细胞前,高内涵专用96孔板每孔加入50μl多聚赖氨酸(pdl)包被液包被30min至2h,完成后吸出包被液,用pbs清洗后超净台中晾干。将稀释过后浓度为1
×
105个/ml的细胞悬浮液种植到96孔板中,种植量为100μl/孔,每孔的细胞数量是10000个,将种好的96孔板放置于二氧化碳培养箱中培养24h。
[0353]
(5)受试物及对照组设置:试验设置三个组别:空白对照组、阳性对照组和受试物组。空白对照组只加细胞培养基,阳性对照组采用剂量为50 μg/ml的苯并芘,电子烟样品按烟碱当量计算配制100mg/ml的工作液,剂量设置和稀释方法如表8所示:
[0354]
表8.电子烟样品1#的剂量设置及配制方法
[0355][0356]
(6)细胞染毒:移除96孔板内的培养基,在96孔板的相应孔内加入100 μl配制好的含6μg/ml细胞松弛素b的染毒液,将96孔板放置于二氧化碳培养箱中培养24h。
[0357]
(7)细胞固定和通透:用pbs清洗96孔板,加入4%多聚甲醛溶液固定10min,固定结束后pbs清洗,用0.1%tritonx-100溶液通透10min,再用 pbs清洗。
[0358]
(8)细胞染色:先使用cell mask red染液避光染色细胞质30min,pbs 清洗后再用hoechst染液避光染色细胞核30min,染色结束后pbs清洗,再用100μl pbs覆盖细胞进行高内涵拍摄。
[0359]
(9)高内涵拍摄:采用20倍空气镜,选取染色良好且细胞密度适宜的 35个视野进行拍摄,最少观察1000个双核细胞计数微核率。双核细胞应为细胞质保存完好,细胞膜边界清晰,细胞核相互分开,微核易于分辨。微核大小不应超过主核直径的1/3,不应与主核重叠,要完全分开。按照此标准调整高内涵软件筛选参数,分析结果。
[0360]
(10)结果判定:受试物样品与空白对照相比,微核率有显着性增加并有剂量反应关系,即可确认为阳性结果。若统计学上差异有显着性,但无剂量反应关系时,则须进行重复试验,能重复者可确定为阳性。
[0361]
结果表明,电子烟样品#1、#2、#3在各剂量下均未引起微核率的显着增加,表明在此实验条件下电子烟气溶胶提取物不具有遗传毒性。
[0362]
(三)使用气溶胶捕集装置,加热卷烟的气溶胶捕集物的制备与检测
[0363]
实施例9:离心提取条件优化
[0364]
采用直线型吸烟机,一定抽吸模式下(抽吸容量为55ml,抽吸持续时间2s,抽吸间隔为30s)连续抽吸10口,使用剑桥滤片捕集5支加热卷烟的总粒相物。抽吸完成后,从吸烟机上快速取下捕集装置,将捕集装置两端密封,保持剑桥滤片原位状态,放入离心机中。
[0365]
离心转速优化:在离心机离心时间一定的情况下(10min),考察离心机不同转速下(3000rpm、5000rpm、7000rpm、9000rpm、12000、14000rpm) 所离心下来总粒相物的重量差异。优化结果表明,离心机转速在12000rpm 时所离心下来总粒相物的重量不再增加,故选择离心机转速为12000rpm(图 12)。
[0366]
离心时间优化:在离心机转速一定的情况下(12000rpm),考察不同离心时间下(5min、10min、15min、20min)所离心下来总粒相物的重量差异。优化结果表明,离心时间在10min时所离心下来总粒相物的重量不再增加,故选择离心时间为10min(图13)。
[0367]
实施例10:电子显微镜观察确认
[0368]
使用g-prox台式扫描电子显微镜(荷兰phenom公司)对空白滤片及气溶胶捕集物离心提取前后的滤片进行观察。结果表明,离心提取后,捕集有气溶胶的剑桥滤片与空白滤片一致,未发现捕集物,这说明离心法对剑桥滤片捕集物具有良好的提取效果。
[0369]
实施例11:气溶胶捕集物离心效率分析
[0370]
1.气溶胶总粒相物总离心效率分析:
[0371]
一定抽吸模式下(抽吸容量为55ml,抽吸持续时间2s,抽吸间隔为 30s)连续抽吸10口,使用剑桥滤片捕集5支加热卷烟的总粒相物,平行测试三次,通过比较离心前后滤片质量变化及总粒相物质量来计算离心效率,研究可知,离心法对总粒相物的提取效率达90%以上(表9)。
[0372]
表9.气溶胶总粒相物总离心效率
[0373][0374]
2.气溶胶总粒相物主要关注成分离心效率分析:
[0375]
一定抽吸模式下(抽吸容量为55ml,抽吸持续时间2s,抽吸间隔为 30s)连续抽吸10口,使用剑桥滤片捕集5支加热卷烟的总粒相物,平行测试三次。参考coresta recommended method no.84,对离心提取法(12000 rpm,10min)的提取液中的烟碱、甘油、丙二醇和水分含量进行气相色谱分析,并与溶液提取法(异丙醇)进行比较。结果显示,两种提取方法效率差异不大,其中离心提取法为溶液提取法提取效率的90.50%以上 (90.50%
~99.64%)(表10)。
[0376]
表10.气溶胶总粒相物主要关注成分离心效率
[0377][0378][0379]
3.气溶胶总粒相物主要有害成分离心效率分析:
[0380]
一定抽吸模式下(抽吸容量为55ml,抽吸持续时间2s,抽吸间隔为30s)连续抽吸10口,使用剑桥滤片捕集5支加热卷烟的总粒相物,平行测试三次。参考coresta recommended method no.72和no.74,对离心提取法(12000rpm,10min)的提取液中的代表性有害成分含量进行分析,如烟草特有亚硝胺(nnn、nnk、nat、nab)和羰基化合物(甲醛、乙醛),并与溶液提取法(标准方法)进行比较。结果显示,与溶液提取法相比,离心提取法对烟草特有亚硝胺及羰基化合物的提取效率分别在 68.24%~86.05%、82.82%~97.97%,取得较好效果(表11、表12)。
[0381]
表11.气溶胶总粒相物主要有害成分离心效率(烟草特有亚硝胺)
[0382][0383]
表12.气溶胶总粒相物主要关注成分离心效率(羰基化合物)
[0384][0385]
实施例12:实际样品测试(线粒体质量)
[0386]
根据以上方法,选择三种不同加热卷烟#1,#2,#3为样品,使用本发明方法制备加
热卷气溶胶,并检测其对人肺癌细胞nci-h292线粒体质量的影响,结果如图14所示。
[0387]
(1)气溶胶捕集及提取:利用一种基于角转子的加热卷气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集加热卷气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm的速度离心离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0388]
(2)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的1640 培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板;
[0389]
(3)受试物分组:将受试物分为两组:受试物组和空白对照组,每个剂量设置三个平行。按烟碱当量计算#1配制450μg/ml的工作液,#2配制 290μg/ml的工作液,#3配制570μg/ml的工作液所有剂量设置如表13所示;
[0390]
表13.三种加热卷烟的剂量设置
[0391][0392]
(4)加入受试物:将步骤(3)中的各个浓度的受试物分别加到96孔板中,每个浓度设置三个复孔,空白对照组更换新鲜培养基,置于37℃、5%co2培养箱中培养24h;
[0393]
(5)加入mitotracker
tm deep red fm染液:配制浓度为300nm含 mitotracker
tm deep red fm染液的培养基,将含受试物的培养基吸去加入配好的含染液的培养基,置于37℃、5%co2培养箱孵育20min;
[0394]
(6)加入4%多聚甲醛固定:吸去含染液的培养基,pbs冲洗两遍,加入 4%多聚甲醛室温固定10min;
[0395]
(7)加入hoechst标记细胞核:吸去4%多聚甲醛,pbs洗两遍,加入 hoechst室温避光染色20min;
[0396]
(8)测定线粒体荧光强度:吸去hoechst,pbs洗两遍。将96孔板放入高内涵仪器中选择mitotracker
tm deep red和hoechst荧光通道。设置曝光时间5ms,激发光强度为10%的能量,焦平面选择-4μm。设定完成开始拍摄。
[0397]
(9)结果判定:用高内涵系统软件分析线粒体荧光强度,导出荧光强度结果。计算受试物组荧光强度与空白对照组荧光强度的平均值。
[0398]
线粒体质量改变=受试物组平均荧光强度/空白对照组平均荧光强度。受试物组平均荧光强度与空白对照组平均荧光强度的比值小于1说明受试物引起线粒体质量下降。
[0399]
结果显示,本方法能准确定量加热卷气溶胶对线粒体质量的影响,是一种能更准确地检测加热卷气溶胶溶胶影响线粒体质量的方法,并能横向比较不同加热卷烟气溶胶对线粒体质量影响的差异。
[0400]
实施例13:实际样品测试(细胞活性)
[0401]
根据以上方法,选择三种不同加热卷烟#1,#2,#3为样品,使用本发明方法制备加热卷气溶胶,并检测其对人肺癌细胞nci-h292细胞活性的影响,结果如图15所示。
[0402]
检测步骤:
[0403]
(1)气溶胶捕集及提取:利用一种基于角转子的加热卷气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集加热卷气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm的速度离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0404]
(2)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的 1640培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板,培养24h.
[0405]
(4)受试物分组:将受试物分为两组:受试物组和空白对照组,每个剂量设置2个平行。按烟碱当量计算#1配制450μg/ml的工作液,#2配制 290μg/ml的工作液,#3配制570μg/ml的工作液;
[0406]
(5)加入受试物:将步骤(4)中的各个浓度的受试物分别加到96孔板中每个浓度设置2个复孔,空白对照组更换新鲜培养基,置于37℃、5%co2培养箱中培养24h;
[0407]
(6)结果判断:导出细胞指数(cell index与细胞数量和活性成正相关) 随时间变化的结果,判断受试物是否引起cell index降低。
[0408]
结果显示,本方法能准确定量加热卷气溶胶对细胞活性的影响,是一种能更准确地检测加热卷气溶胶对细胞活性影响的方法,并能横向比较不同加热卷烟气溶胶对细胞活性影响差异。
[0409]
实施例14:实际样品测试(活性氧含量)
[0410]
根据以上方法,选择三种不同加热卷烟#1,#2,#3为样品,使用本发明方法制备烟气气溶胶提取物并检测其对细胞的损伤,结果如图16。
[0411]
检测步骤:
[0412]
(1)气溶胶捕集及提取:利用一种基于角转子的加热卷烟气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集加热卷烟气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm 的速度离心离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0413]
(2)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的1640 培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板,培养24h。
[0414]
(3)细胞培养:人肺癌细胞株nci-h292采用含10%fbs(胎牛血清), 1640培养基,放置于37℃,5%co2及充分饱和湿度的无菌培养箱中。每日在倒置显微镜下观察细胞生长
状况。每隔1-2天或当发现培养基颜色变浅、细胞漂浮、细胞生长缓慢时更换培养基,待细胞贴壁生长融合至 80%~90%时进行传代。选取处于对数生长期,生长状态良好的细胞进行试验。
[0415]
(4)种植6孔板:用细胞生长培养基稀释细胞悬浮液,使其细胞浓度达到1.5
×
105个/ml,将制备好的细胞悬浮液种植到6孔细胞培养板中,种植量为2ml/孔,将种好的6孔细胞培养板放置于二氧化碳培养箱中培养24h。
[0416]
(5)受试物分组:将受试物分为两组:受试物组和空白对照组。受试物组的浓度设置应满足最大浓度致死率达到90%最小浓度致死率达到10%,最大浓度和最小浓度之间按梯度设置多个浓度。空白对照组加入不含受试物的培养基。每个剂量设置四个平行。按烟碱当量计算#1配制550μg/ml的工作液,#2配制425μg/ml的工作液,#3配制600μg/ml的工作液,所有剂量设置如表14所示;
[0417]
表14.三种加热卷烟的剂量设置
[0418][0419]
(6)加入受试物:移除6孔细胞培养板内的培养基,按要求在相应的孔内加入细胞生长培养基和受试物样品。每孔内加入的受试物和细胞生长培养基的总体积均为2ml。
[0420]
(7)孵育受试物:将加好样的6孔细胞培养板置于二氧化碳培养箱中孵 24h。
[0421]
(8)染料的配制:按照1∶1000用无血清培养液稀释dcfh-da和rosup,去除细胞培养液,加入适当体积稀释好的dcfh-da,加入的体积以能充分盖住细胞为宜,通常对于6孔板的一个孔加入稀释好的dcfh-da不少于 500μl,37℃细胞培养箱内孵育20min。
[0422]
(9)洗涤:孵育结束后用1
×
pbs洗涤细胞,弃上清,重复两次充分去除未进入细胞内的dcfh-da;
[0423]
(10)流式检测:流式细胞仪上机检测,激发波长为488nm。
[0424]
(11)相对荧光强度计算:将每孔的平均荧光强度除以空白对照组的平均荧光值,即可得到相对荧光强度的变化。
[0425]
(12)结果判定:受试物组的ratio of control值大于1.5,并有剂量反应关系,即可判定引起阳性反应。应重复两次以上试验,才能对结果做出准确判定。
[0426]
结果表明,加热卷烟样品#1,#2未使nci-h292细胞的活性氧含量升高至对照组的1.5倍,没有出现阳性反应,表明#1,#2加热卷烟样品未引起细胞损伤。加热卷烟样品#3在高浓度时引起阳性反应。结果显示,本方法能准确定量加热卷烟气溶胶造成的细胞损伤,是一种能更准确地检测加热卷烟气溶胶细胞损伤的方法,并能横向比较不同加热卷烟气溶胶的
细胞损伤差异。
[0427]
实施例15:实际样品测试(ic50)
[0428]
根据以上方法,选择三种不同加热卷烟#1,#2,#3为样品,使用本发明方法制备加热卷气溶胶,并检测其对人肺癌细胞nci-h292细胞的ic
50
,结果如图17所示。
[0429]
检测步骤:
[0430]
(1)气溶胶捕集及提取:利用一种基于角转子的加热卷气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集加热卷气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm的速度离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0431]
(2)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的 1640培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板,培养24h.
[0432]
(3)受试物分组:将受试物分为两组:受试物组和空白对照组。受试物组的浓度设置应满足最大浓度致死率达到90%最小浓度致死率达到10%,最大浓度和最小浓度之间按梯度设置多个浓度。空白对照组加入不含受试物的培养基。每个剂量设置四个平行。按烟碱当量计算#1配制550μg/ml的工作液,#2配制425μg/ml的工作液,#3配制600μg/ml的工作液,所有剂量设置如表15所示;
[0433]
表15.三种加热卷烟的剂量设置
[0434][0435]
(4)加入受试物:将步骤(3)中的各个浓度的受试物分别加到96孔板中每个浓度设置4个复孔,空白对照组更换新鲜培养基,置于37℃、5%co2培养箱中培养24h;
[0436]
(5)加入含10%cck-8培养基:配制含10%cck-8的培养基,将含受试物的培养基吸去加入配好的含10%cck-8的培养基,置于37℃、5%co2培养箱孵育2.5h;
[0437]
(6)测定不同浓度受试物吸亮度:将孵育完毕的96孔板取出放入酶标仪中450nm测定每孔的吸亮度;
[0438]
(7)结果判定:计算不同浓度受试物及空白对照吸亮度的平均值,细胞抑制率=1-(受试物组平均吸亮度/空白对照组平均吸亮度)*100%。以浓度为 x值细胞抑制率为y值用graphd prism5进行非线性拟合计算出受试物对细胞的ic
50
。
[0439]
结果显示,本方法能准确定量加热卷气溶胶对细胞的ic
50
,是一种能更准确地检测加热卷气溶胶溶胶细胞毒性的方法,并能横向比较不同加热卷烟气溶胶的细胞毒性差异。
[0440]
实施例16:实际样品测试(gsh含量)
[0441]
根据以上方法,选择三种不同加热卷烟#1,#2,#3为样品,使用本发明方法制备加热卷气溶胶,并检测其对人肺癌细胞nci-h292细胞内gsh含量的影响,结果如图18所示。
[0442]
检测步骤:
[0443]
(1)气溶胶捕集及提取:利用一种基于角转子的加热卷气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集加热卷气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm的速度离心离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0444]
(2)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的1640培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板;
[0445]
(3)受试物分组:将受试物分为两组:受试物组和空白对照组,每个剂量设置三个平行。按烟碱当量计算#1配制460μg/ml的工作液,#2配制290μg/ml的工作液,#3配制570μg/ml的工作液所有剂量设置如表16所示;
[0446]
表16.三种加热卷烟的剂量设置
[0447][0448]
(4)加入受试物:将步骤(4)中的各个浓度的受试物分别加到96孔板中,每个浓度设置三个复孔,空白对照组更换新鲜培养基,置于37℃、5%co2培养箱中培养24h;
[0449]
(5)加入thioltracker
tm
viole染液:配制浓度为20μmthioltracker
tm
viole染液的培养基,将含受试物的培养基吸去加入配好的含染液的培养基,置于37℃、5%co2培养箱孵育20min;
[0450]
(6)加入4%多聚甲醛固定:吸去含染液的培养基,pbs冲洗两遍,加入4%多聚甲醛室温固定10min;
[0451]
(7)加入hoechst标记细胞核:吸去4%多聚甲醛,pbs洗两遍,加入hoechst室温避光染色20min;
[0452]
(8)测定线粒体荧光强度:吸去hoechst,pbs洗两遍。将96孔板放入高内涵仪器中选择mitotracker
tm
deepred和hoechst荧光通道。设置曝光时间5ms,激发光强度10%的能量,焦平面选择-4μm。设定完成开始拍摄。
[0453]
(9)结果判定:用高内涵系统软件分析线粒体荧光强度导出荧光强度结果。计算受
h2ax差异。
[0468]
(四)使用气溶胶捕集装置,水烟的气溶胶捕集物的制备与检测
[0469]
实施例18:离心提取条件优化
[0470]
采用直线型吸烟机,一定抽吸模式下(抽吸容量为530ml,抽吸持续时间2.6s,抽吸间隔为20s)连续抽吸20口,使用剑桥滤片捕集20口水烟气溶胶的总粒相物。抽吸完成后,从吸烟机上快速取下捕集装置,将捕集装置两端密封,保持剑桥滤片原位状态,放入离心机中。
[0471]
离心转速优化:在离心机离心时间一定的情况下(10min),考察离心机不同转速下(3000rpm、5000rpm、7000rpm、9000rpm、12000、14000rpm) 所离心下来总粒相物的重量差异。优化结果表明,离心机转速在12000rpm 时所离心下来总粒相物的重量不再增加,故选择离心机转速为12000rpm(图 20)。
[0472]
离心时间优化:在离心机转速一定的情况下(12000rpm),考察不同离心时间下(5min、10min、15min、20min)所离心下来总粒相物的重量差异。优化结果表明,离心时间在10min时所离心下来总粒相物的重量不再增加,故选择离心时间为10min(图21)。
[0473]
实施例19:电子显微镜观察确认
[0474]
使用g-prox台式扫描电子显微镜(荷兰phenom公司)对空白滤片及气溶胶捕集物离心提取前后的滤片进行观察。结果表明,离心提取后,捕集有气溶胶的剑桥滤片与空白滤片一致,未发现捕集物,这说明离心法对剑桥滤片捕集物具有良好的提取效果。
[0475]
实施例20气溶胶捕集物离心效率分析
[0476]
(1)气溶胶总粒相物总离心效率分析:
[0477]
一定抽吸模式下(抽吸容量为530ml,抽吸持续时间2.6s,抽吸间隔为20s)连续抽吸20口,使用剑桥滤片捕集20口水烟气溶胶的总粒相物,平行测试三次,通过比较离心前后滤片质量变化及总粒相物质量来计算离心效率,研究可知,离心法对总粒相物的提取效率达90%以上(表18)。
[0478]
表18.水烟气溶胶捕集物总离心效率
[0479][0480]
(2)气溶胶总粒相物主要关注成分离心效率分析:
[0481]
一定抽吸模式下(抽吸容量为530ml,抽吸持续时间2.6s,抽吸间隔为20s)连续抽吸20口,使用剑桥滤片捕集20口水烟气溶胶,平行测试三次。参考coresta recommended method no.84,对离心提取法(12000rpm, 10min)的提取液中的烟碱、甘油、丙二醇和水分含量进行气相色谱分析,并与溶液提取法(异丙醇)进行比较。结果显示,两种提取方法效率差异不大,其中离心提取法为溶液提取法提取效率的90%以上(表19)。
[0482]
表19.气溶胶总粒相物主要关注成分离心效率
[0483][0484]
(3)气溶胶总粒相物主要有害成分离心效率分析:
[0485]
一定抽吸模式下(抽吸容量为530ml,抽吸持续时间2.6s,抽吸间隔为20s)连续抽吸20口,使用剑桥滤片捕集20口水烟气溶胶的总粒相物,平行测试三次。参考coresta recommended method no.74,对离心提取法 (12000rpm,10min)的提取液中的代表性有害成分含量进行分析(甲醛),并与溶液提取法(标准方法)进行比较。结果显示,与溶液提取法相比,离心提取法对甲醛的提取效率为89.12-91.95%,取得较好效果(表20)。
[0486]
表20.气溶胶总粒相物关注有害成分离心效率(甲醛)
[0487][0488][0489]
实施例21:实际样品测试(细胞周期)
[0490]
根据以上方法,选择三种不同水烟#1为样品,使用本发明方法制备烟气气溶胶提取物并检测其细胞损伤,结果如图22所示。
[0491]
检测步骤:
[0492]
(1)气溶胶捕集及提取:利用一种基于角转子的水烟气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集水烟气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm的速度离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0493]
(2)受试细胞培养:人肺癌细胞nci-h292培养在含10%胎牛血清的1640 培养基中,置于37℃、5%co2培养箱,待细胞融合率到达70%-80%进行消化、传代、铺96孔板,培养24h。
[0494]
(3)细胞培养:人肺癌细胞株nci-h292采用含10%fbs(胎牛血清), 1640培养基,放置于37℃,5%co2及充分饱和湿度的无菌培养箱中。每日在倒置显微镜下观察细胞生长状况。每隔1-2天或当发现培养基颜色变浅、细胞漂浮、细胞生长缓慢时更换培养基,待细胞贴壁生长融合至 80%~90%时进行传代。选取处于对数生长期,生长状态良好的细胞进行试验。
[0495]
(4)种植6孔板:用细胞生长培养基稀释细胞悬浮液,使其细胞浓度达到1.5
×
105个/ml,将制备好的细胞悬浮液种植到6孔细胞培养板中,种植量为2ml/孔,将种好的6孔细
胞培养板放置于二氧化碳培养箱中培养24h。
[0496]
(5)受试物分组:将受试物分为两组:受试物组和空白对照组。受试物组的浓度设置应满足最大浓度致死率达到90%最小浓度致死率达到10%,最大浓度和最小浓度之间按梯度设置多个浓度。空白对照组加入不含受试物的培养基。每个剂量设置四个平行。按烟碱当量计算#1配制550μg/ml的工作液,#2配制425μg/ml的工作液,#3配制600μg/ml的工作液,所有剂量设置如表21所示;
[0497]
表21.水烟样品1#的剂量设置及配制方法
[0498]
受试物剂量(μg/ml tpm)10020030040050060010mg/ml tpm工作液体积(ml)0.20.40.60.811.210%s9体积(ml)222222培养基体积(ml)17.817.617.417.21716.8
[0499]
(6)加入受试物:移除6孔细胞培养板内的培养基,按要求在相应的孔内加入细胞生长培养基和受试物样品。每孔内加入的受试物和细胞生长培养基的总体积均为2ml。
[0500]
(7)孵育受试物:将加好样的6孔细胞培养板置于二氧化碳培养箱中孵 24h。
[0501]
(8)2
×
edu工作液的配制:由于edu工作液是与培养液等体积加入到孔板中,所以需要配制成2
×
的工作液。推荐的edu终浓度为10μm(1
×
),用细胞培养液1:500稀释edu(10mm)即可得到2
×
的edu工作液(20μm)。
[0502]
(9)标记edu:将37℃预热的2
×
的edu工作液(20μm),等体积加入6孔板中,使6孔板中的edu终浓度变为1x,继续孵育细胞2小时。
[0503]
(10)固定:edu标记细胞完成后,去除培养液,并加入1ml固定液(可以使用碧云天的免疫染色固定液p0098,或4%的多聚甲醛p0099),室温固定15 分钟。
[0504]
(11)洗涤:去除固定液,每孔用1ml洗涤液洗涤细胞3次,每次3-5分钟。
[0505]
(12)通透:去除洗涤液,每孔用1ml通透液(可以使用碧云天的免疫染色强力通透液p0097,免疫染色洗涤液p0106,或含0.3%triton x-100的pbs),室温孵育10-15分钟。
[0506]
(13)洗涤:去除通透液,每孔用1ml洗涤液洗涤细胞1-2次,每次3-5分钟。
[0507]
(14)配制反应液:严格按顺序配制click反应液,否则点击反应可能无法有效进行;同时,click反应液须在配制后15分钟内使用。
[0508]
(15)孵育染色液:去除上一步骤中的洗涤液,每孔加入0.5ml click反应液,轻轻摇晃培养板以确保反应混合物可以均匀覆盖样品,室温避光孵育30 分钟。
[0509]
(16)洗涤:吸除click反应液,用洗涤液洗涤3次,每次3-5分钟。
[0510]
(17)流式检测:使用流式细胞仪荧光检测,azide 488的最大激发波长是495nm,最大发射波长是519nm。
[0511]
(18)flowjo软件处理原始数据:将流式细胞仪中受试物不同浓度对应图形导出,用flowjo 10软件对原始数据进行处理,拟合出细胞周期峰值图。
[0512]
(19)图例的制作:使用graphpad 5.0分析软件,将不同水烟受试物代码,不同受试物nic浓度值,细胞周期中不同时期所占比例带入,制作成多组柱状图。
[0513]
结果表明,水烟样品#1在高浓度下,使s期所占比例有所降低,凋亡比例略微增加,变化幅度较小。结果显示,本方法能准确定量水烟气溶胶对细胞的损伤,是一种能更准确地检测水烟气溶胶细胞损伤的方法。
bio-plex wash buffer,洗板2次。漩涡震荡已准备好的待测样品、标准品、blank数秒,每孔加入相应液体50μl。小心盖上封板膜,并用铝箔完全遮盖,避光于室温下850转摇床,孵育1h。
[0525]
(7)孵育detection antibodies:在孵育结束前10min,漩涡震荡detectionantibodies(20x)5秒,并将其稀释成1x(将300μl 20x detection ab加入 5700μl detection ab diluent中),孵育结束后,小心揭开铝箔及封板膜,每孔加入100μl bio-plex wash buffer,使用磁力架洗板3次,漩涡震荡已稀释的detection antibodies(1x)数秒,每孔各加入25μl,小心盖上封板膜,并用铝箔完全遮盖,避光于室温下850转摇床,孵育30min。
[0526]
(8)孵育streptavidin-pe:在孵育结束前10min,漩涡震荡 streptavidin-pe(100x)5秒,并将其稀释成1x(将100μl 100x streptavidin-pe加入9900μl assay buffer中),过程中保持避光,孵育结束后,小心揭开铝箔及封板膜,每孔加入100μl bio-plex wash buffer,使用磁力架洗板3次,漩涡震荡已稀释的sa-pe(1x)数秒,每孔各加50μl,小心盖上封板膜,并用铝箔完全遮盖,避光于室温下850转摇床,孵育10 min,孵育结束后,小心揭开铝箔及封板膜,每孔加入100μl bio-plexwash buffer,使用磁力架洗板3次。
[0527]
(9)重悬磁珠:用125μl assay buffer重悬磁珠,小心盖上密封带,于室温下900转摇床30秒后立即放入bio-plex系统中进行检测。
[0528]
(10)结果的计算和表述:将检测指标各个因子s1-s8的荧光值与浓度进行处理,并除以蛋白总浓度,制定15种不同因子对应的标准曲线图。将检测荧光值带入各个标准曲线,计算出每孔中对应生长因子的浓度,并除以蛋白总浓度值,得出同等总浓度下,各个受试物每孔检测因子对应细胞生长因子数值。使用graphpad 6.0分析软件,将不同水烟受试物相对生长因子浓度值,不同受试物nic浓度值带入,制作成多组折线图。
[0529]
结果显示,本方法能准确定量水烟气溶胶对细胞炎症因子il-6表达,是一种能更准确地检测水烟气溶胶细胞损伤的方法,并能横向比较不同水烟气溶胶的细胞损伤差异。
[0530]
实施例23:实际样品测试(tk基因突变)
[0531]
根据以上方法,选择水烟#1为样品,使用本发明方法制备水烟气溶胶提取物并检测其致突变性,结果如图24所示。
[0532]
检测步骤:
[0533]
(1)气溶胶捕集及提取:利用一种基于角转子的水烟气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集水烟气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm的速度离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0534]
(2)细胞培养条件:小鼠淋巴瘤细胞(l5178y tk+/-_3.7.2c)用 rpmi1640+10%(v/v)马血清,在37℃、5%co2培养箱中培养,每天用倒置显微镜观察细胞的形态、生长状况,确保无污染。每2~3天传代。
[0535]
(3)细胞自发突变清除:正式试验前,需清除自发突变的tk-/-基因型细胞。使用thmg培养基(3μg/ml胸腺嘧啶核苷+5μg/ml次黄嘌呤+0.1 μg/ml氨甲喋呤+7.5μg/ml甘氨酸)将对数生长的细胞重新悬浮,调整密度至2
×
105个/ml,置于37℃、5%co2条件下培养
24h,以约1000rpm的速度离心5min,除去上清液,洗涤后在不含氨甲喋呤的thg培养基中培养2d。
[0536]
(4)受试物及对照组设置:试验设置三个组别:空白对照组、阳性对照组和受试物组。空白对照组只加细胞培养基,阳性对照组采用剂量为3μg/ml 的环磷酰胺。按总粒相物(tpm)计算水烟样品#1配制10mg/ml的工作液,剂量设置和配制如表23所示:
[0537]
表23.水烟样品1#的剂量设置及配制方法
[0538]
受试物剂量(μg/ml tpm)10020030040050060010mg/ml tpm工作液体积(ml)0.20.40.60.811.210%s9体积(ml)222222培养基体积(ml)17.817.617.417.21716.8
[0539]
(5)10%s9混合液的配制:每10ml混合液,由磷酸缓冲液(pbs)6ml、 0.825mol/l氯化钾-0.2mol/l氯化镁溶液0.4ml、0.05mol/l的葡萄糖-6磷酸钠盐缓冲液1ml和0.025mol/l的辅酶-ii溶液1.6ml混匀,用0.22μm无菌滤膜过滤除菌后,再加入s9液1ml,配制成10%s9混合液冰浴备用。
[0540]
(6)细胞染毒:取生长良好的细胞,密度调整至5
×
105个/ml,按1%体积加入受试物tpm,按10%体积加入10%s9混合液,剩余体积用细胞培养基补充,37℃振摇处理3h。以1000rpm的速度离心5min,除去上清液, pbs洗涤后重悬于含细胞培养基中,并调整细胞密度为2
×
105个/ml。
[0541]
(7)表达培养:染毒后的细胞悬液(2
×
105个/ml),在37℃、5%co2条件下表达培养2d,每天计数细胞密度并保持密度在106个/ml以下,计算相对悬浮生长(rsg)。
[0542][0543]
(8)接种96孔板:
[0544]
9.1第0d平板接种效率(pe0)的测定:取适量步骤(7)染毒后的细胞悬液,用细胞培养基作梯度稀释至8个细胞/ml,接种96孔板,每孔200μl。每个剂量接种2块板,37℃、5%co2条件下培养12d,计数每块平板无集落生长的孔数。
[0545][0546]
(ew-无集落生长的孔数;tw-总孔数;1.6-每孔接种细胞数)
[0547]
9.2第2d平板接种效率(pe2)的测定:取适量步骤(8)表达培养2d后的细胞悬液,用细胞培养基作梯度稀释至8个细胞/ml,接种96孔板,每孔 200μl。每个剂量接种2块板,37℃、5%co2条件下培养12d,计数每块平板无集落生长的孔数。
[0548][0549]
(ew-无集落生长的孔数;tw-总孔数;1.6-每孔接种细胞数)
[0550]
个/ml,将制备好的细胞悬浮液种植到96孔细胞培养板中,种植量为100μl/孔,将种好的96孔细胞培养板放置于二氧化碳培养箱中培养24h。
[0567]
(5)受试物分组:将受试物分为两组:受试物组和空白对照组。受试物组的浓度设置应满足最大浓度致死率达到90%最小浓度致死率达到10%,最大浓度和最小浓度之间按梯度设置多个浓度。空白对照组加入不含受试物的培养基。每个剂量设置四个平行。按烟碱当量计算#1配制550μg/ml的工作液,#2配制425μg/ml的工作液,#3配制600μg/ml的工作液,所有剂量设置如表24所示;
[0568]
表24.三种水烟的剂量设置
[0569][0570]
(6)加入受试物:移除96孔细胞培养板内的培养基,按要求在相应的孔内加入细胞生长培养基和受试物样品。每孔内加入的受试物和细胞生长培养基的总体积均为100μl。
[0571]
(7)孵育受试物:将加好样的96孔细胞培养板置于二氧化碳培养箱中孵 24h。
[0572]
(8)稀释检测试剂:用含5%胎牛血清的pbs溶液进行稀释,将试剂盒中绿色检测试剂稀释到2-8μm最终浓度。为了获得最佳结果,建议用5%胎牛血清的pbs溶液来稀释绿色检测试剂。但也可以用完全的培养基进行稀释,然而,这可能导致高荧光背景,建议进行条件优化。预试验应该设定2
‑ꢀ
10μm浓度范围的绿色检测试剂,以确定该试剂的最佳浓度。
[0573]
(9)孵育染色液:将培养液从细胞培养板中除去,然后将稀释后的绿色检测试剂加入细胞中,在96孔板中,每孔添加100μl试剂溶液。在37℃的温度下培养细胞至少30min。
[0574]
(10)洗涤:每孔加入100μl温的1
×
pbs缓冲液,洗涤细胞2次。
[0575]
(11)检测:pe高内涵检测,绿色检测试剂的激发/发射最大值为 502/530nm。
[0576]
(12)相对荧光值计算:将pe高内涵仪器中受试物不同浓度对应平均荧光值进行拷贝和处理,受试物组的平均荧光强度除以空白对照组的平均荧光强度值,得到荧光值的相对变化量,用graph pad 5.0软件做图。
[0577]
(13)结果判定:受试物组的ratio of control值大于1.5,并有剂量反应关系,即可判定引起阳性反应。应重复两次以上试验,才能对结果做出准确判定。
[0578]
结果显示,水烟样品未使nci-h292细胞的caspase3/7活性升高至对照组的1.5倍,未引起阳性反应。说明本方法是一种能更准确地检测水烟气溶胶caspase3/7活性的方法。
[0579]
实施例25:实际样品测试(细菌回复突变)
[0580]
根据以上方法,选择水烟#1为样品,使用本发明方法制备水烟气溶胶提取物并检测其致突变性,结果如表26所示。
[0581]
检测步骤:
[0582]
(1)气溶胶捕集及提取:利用一种基于角转子的水烟气溶胶原位离心萃取装置,采用直线型吸烟机,在一定抽吸模式下,捕集水烟气溶胶成分,抽吸完成后,从吸烟机上快速取下捕集器,将捕集器两端密封,保持剑桥滤片原位状态,放入离心机的角转子中,使用高速离心机以12000rpm的速度离心10min后,收集离心下来的液体,并用0.22μm的无菌滤膜过滤除菌,分装至1ml冻存管中,在-80℃超低温冰箱中保存待用。
[0583]
(2)增菌培养:将主平板或冷冻保存的菌株ta98、ta100、ta102、 ta1535、ta1537分别接种于含有适量营养肉汤培养基的无菌三角瓶中,于 37℃条件下振荡(130次/min)培养10h或静置培养16h,使每毫升培养液的活菌数不少于1
×
109个。
[0584]
(3)配制底层培养基:三角瓶中配制1.8%(w/v)琼脂培养基,高压灭菌后,依次加入10ml磷酸盐贮备液,25ml 40%葡萄糖溶液,于培养皿 (φ90mm)中加入混匀后的底层培养基(约25ml/皿),凝固后,将培养皿倒置于培养箱中,于37℃条件下培养过夜。
[0585]
(4)配制顶层培养基:0.6%(w/v)琼脂培养基中加入50ml 0.5mmol/l 组氨酸-生物素溶液,混匀后分装在小试管中,每管约2ml,高压灭菌后水浴保温。
[0586]
(5)10%s9混合液的配制:每10ml混合液,由磷酸缓冲液(pbs)6ml、 0.825mol/l氯化钾-0.2mol/l氯化镁溶液0.4ml、0.05mol/l的葡萄糖-6磷酸钠盐缓冲液1ml和0.025mol/l的辅酶-ii溶液1.6ml混匀,用0.22μm 无菌滤膜过滤除菌后,再加入s9液1ml,配制成10%s9混合液冰浴备用。
[0587]
(6)受试物及对照组设置:试验设置四个组别:自发回复组、溶剂对照组、阳性对照组和受试物组,每个剂量设置三个平行。所有组别组计量设置如表25所示:
[0588]
表25.细菌回复突变试验不同组别剂量设置
[0589][0590]
(7)平板掺入:于约2ml保温的顶层培养基中加入受试物/阳性对照/溶剂对照100μl、10%s9混合液500μl(不加s9代谢活化体系的条件则加入pbs 500μl)、测试菌株新鲜菌液
100μl,旋转3s混匀并迅速倒入底层培养基上,转动平皿使顶层培养基均匀分布在底层培养基上,平放固化,在培养箱中于37℃条件下倒置培养48-72h。
[0591]
(8)结果判定:计数培养基上长出的回复突变菌落数,如在背景生长良好的条件下,受试物的回复突变菌落数等于或大于自发回变的2倍,并有剂量反应关系或至少某一tpm测试浓度有可重复的并有统计学意义的阳性反应,即可认为该受试物诱变试验阳性。应做两次测试,才能对受试物的诱变性作出判定。
[0592]
结果表明:自发对照和阳性对照回复菌落数在正常范围内,证明试验体系正常,水烟样品1#在最高4mg tpm/皿的剂量下,对ta102、ta1535未引起突变菌落数显着增加,而在低剂量下即对ta98、ta100、ta1537三种测试菌的致突变倍数达到2倍以上,表明水烟具有致突变性。
[0593][0594]
以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1