一种荧光抗体封存液、制备方法和用途与流程
1.本发明属于荧光免疫检验技术领域,特别是一种荧光抗体封存液、制备方法和用途。
背景技术:
2.心肌三项是心血管专科临床上非常常用的三个指标,分别是肌钙蛋白、肌红蛋白和肌酸激酶同工酶,这三类指标对于心肌损伤都有不同的特异性和敏感性,并且表现在心肌损伤之后的不同阶段,所以,对心肌损害的严重程度和时间判断有很重要的意义,有利于早期发现心肌损伤,及时进行治疗干预,对后期的治疗、恢复判断有很好的指导意义。肌红蛋白是心肌损伤之后最早出现变化的一个指标,有助于早期发现心肌损害。肌钙蛋白对于心肌梗死的诊断和治疗,有很大的临床指导意义。肌酸激酶同工酶在临床中应用最为广泛,可以作为心脏疾病的常规检查。
3.目前有胶体金和荧光层析两种方法的产品,均是采用双抗体夹心法检测血液样本种的待检物质,然后通过仪器检测,定量分析检测物。现有的产品基本上时采用nc膜作为载体,该载体受环境影响因素较大,若温度和湿度不符合要求,会导致nc膜对样本的检测结果造成非常显著的影响,所以在生产和储存过程中有较高的环境控制要求,同时nc膜批次间差大固定抗体的量不均一,其次,用nc膜制备的心肌三联检测试剂会因为nc膜、样品垫、结合垫这3个因素导致荧光抗体随样本流动释放的问题,进而也会对检测结果造成影响,所以会导致产品重复性cv较大。另外,由于心肌三联检是将心肌三项ckmb、ctni和myo 的3个检测项目联合在同一个检测试剂卡上,存在项目间的相互干扰,检测灵敏度不高,重复性cv较差等问题。为此,本技术人发明了一种自驱动微流控芯片,并于2020年01月17日向国家知识产权局提交了专利申请,该申请已于2020 年4月28日公布,其请公布号为cn111068801a。该自驱动微流控芯片将待检物质所对应的抗体预存在自驱动微流控芯片上,样本能分别通过识别反应和免疫反应形成双抗体夹心。其凭借单一纯净材质形成的微流道优势,通过精准微流体控制,能够保障样品检测结果的可靠性和可控性,有望代替目前临床常用的多种膜材料的免疫层析(lifcs)技术,从而为解决目前poct检测技术所面临的挑战提供新的技术思路。之后,本技术人又于2020年5月22日,向国家知识产权局提交了一种基于自驱动微流控芯片的快速免疫荧光检测方法的专利申请,该申请已于2020年8月21日公布,其请公布号为cn111562380a;该方法公开了使用该自驱动微流控芯片进行快速免疫荧光检测的全过程。
4.该自驱动微流控芯片在制作过程中,需要将标记有荧光物质的一株抗体封存在混合区内,将另一株抗体固定在芯片检测区的微柱上,以在被检样本在芯片内流动过程中,在与混合区内荧光抗体发生识别反应后,携带有荧光标志物的抗体再与检测区微柱上的抗体发生免疫反应,从而形成滞留在微柱上的双抗体夹心标识物,荧光检测仪通过对双抗体夹心标识物的荧光标记检测获得检测结果。因此,将标记有荧光物质的抗体封存在混合区,以在发生识别反应后,荧光抗体能够完全挣脱混合区的束缚,并且抗体能在设定期限内保持
活性是获得准确检测结果基础。目前,现有技术中,尚无文献披露能够达到前述目的相关技术。
技术实现要素:
5.本发明的第一目的就是针对现有自驱动微流控芯片的制备过程中缺少抗体封存技术的不足,提供一种荧光抗体封存液,以将荧光抗体封存在自驱动微流控芯片的混合区,并在被检样本在芯片内流动过程中,在与混合区内荧光抗体发生识别反应后,携带有荧光标志物的抗体完全挣脱混合区后,再与微柱上的抗体发生免疫反应后,形成双抗体夹心标识物,从而由荧光检测仪通过对双抗体夹心标识物的荧光标记检测获得检测结果。本发明的第二目的是提供一种基于前述封存液的制备方法,以获得满足前述要求的荧光抗体封存液。本发明的第三目的是提供一种前述抗体封存液用于自驱动微流控芯片的用途。
6.为实现第一目的,本发明采用如下技术方案。
7.一种荧光抗体封存液,主要由海藻糖、bsa、聚乙烯吡咯烷酮和山梨醇通过 hepes缓冲液配制而成;其中,按质量百分比计,海藻糖:5%~20%,bsa:0.1%~ 1.0%,聚乙烯吡咯烷酮:0.1%~1.0%,山梨醇:0.1%~5.0%,其余为hepes缓冲液。
8.采用前述技术方案的本发明,利用前述组合物中的胶质成分可将荧光微球抗体封存在自驱动微流控芯片的混合区,并在晾干后利用营养成分使抗体在设定期限内保持活性,以在被检样本在芯片内流动过程中,在与混合区内荧光抗体发生识别反应后,携带有荧光微球的抗体能够挣脱混合区的束缚,再自动流入检测区与微柱上的抗体发生免疫反应后,形成双抗体夹心标识物,从而由荧光检测仪通过对双抗体夹心标识物的荧光标记检测获得检测结果。其中,荧光微球抗体封存后的晾干是在满足10万级洁净区的环境要求条件下自然晾干;其环境温度为25℃,湿度为50~60%的恒湿恒温条件。
9.优选的,还包括透明质酸钠,按质量百分比计,透明质酸钠:0.05%~0.1%。具有透明质酸钠的封存液,用于将通过化学反应标记有荧光染料的抗体封存自驱动微流控芯片的混合区。并在晾干后利用营养成分使抗体在设定期限内保持活性,以在被检样本在芯片内流动过程中,在与混合区内荧光抗体发生识别反应后,携带有荧光染料抗体能够挣脱混合区的束缚,再自动流入检测区与微柱上的抗体发生免疫反应后,形成双抗体夹心标识物,从而由荧光检测仪通过对双抗体夹心标识物的荧光标记检测获得检测结果。其中,荧光染料抗体封存后的晾干是在满足10万级洁净区的环境要求条件下自然晾干;其环境温度为25℃,湿度为50~60%的恒湿恒温条件。
10.为获得更好的封存效果,用于荧光染料抗体封存的封存液,按质量百分比计,海藻糖:5%~10%,bsa:0.5%~1.0%,聚乙烯吡咯烷酮:0.5%~1.0%,山梨醇: 0.5%~1.0%,透明质酸钠:0.05%~0.1%,其余为hepes缓冲液。
11.为获得更好的封存效果,用于荧光微球抗体封存的封存液,按质量百分比计,海藻糖:5%~10%,bsa:0.5%~1.0%,聚乙烯吡咯烷酮:0.5%~1.0%,山梨醇: 0.5%~1.0%,其余为hepes缓冲液。
12.为实现第二目的,本发明采用如下技术方案。
13.一种荧光抗体封存液的制备方法,包括以下步骤:
14.第一步,配制20mmol/l的hepes缓冲液;
15.第二步,用1mol/l的氢氧化钠调ph7.4~7.6;
16.第三步,顺序加入实现第一目的荧光抗体封存液的其余组分,充分溶解后即可。
17.采用前述技术方案的荧光抗体封存液的制备方法,在按相应的质量百分比顺序加入海藻糖、bsa、聚乙烯吡咯烷酮和山梨醇,并充分溶解后获得用于封存荧光微球抗体的封存液;在按相应的质量百分比顺序加入海藻糖、bsa、聚乙烯吡咯烷酮、山梨醇和透明质酸钠,并充分溶解后获得用于封存荧光染料抗体的封存液。其操作方法简单,通过该方法获得的两种封存液,可用于不同荧光标记方式的抗体封存,封存效果好。
18.为实现第三目的,本发明采用如下技术方案。
19.方案一,一种荧光抗体封存液的用途,按实现第二目的的制备方法获得的由海藻糖、bsa、聚乙烯吡咯烷酮和山梨醇通过hepes缓冲液配制的荧光抗体封存液,用于将活化后的荧光微球抗体稀释后封存在心肌检测的自驱动微流控芯片的混合区内。并在晾干后利用营养成分使抗体在设定期限内保持活性,以在被检样本在芯片内流动过程中,在与混合区内荧光抗体发生识别反应后,携带有荧光微球的抗体能够挣脱混合区的束缚,再自动流入检测区与微柱上的抗体发生免疫反应后,形成双抗体夹心标识物,从而由荧光检测仪通过对双抗体夹心标识物的荧光标记检测获得检测结果。其中,荧光微球抗体封存后的晾干是在满足10万级洁净区的环境要求条件下自然晾干;其环境温度为25℃,湿度为 50~60%的恒湿恒温条件。
20.为获得更好的封存效果,还包括以下步骤,
21.第一步,将荧光微球用交联剂edc/nhs在37℃条件下活化20min~40min,荧光微球与edc/nhs的质量比为100∶1~1∶1;
22.第二步,将活化后的荧光微球加入到抗体溶液中,并在37℃条件下反应2h~ 3h,荧光微球与抗体的质量比为20∶1~5∶1;
23.第三步,用冷冻离心机对抗体荧光微球反应后的溶液离心分离,并在去除未标记的抗体后,加入hepes缓冲液重悬抗体微球结合物;
24.第四步,重复执行第三步至少一次;
25.第五步,再用冷冻离心机对抗体微球反应后的溶液进行离心分离,并在去除未标记的抗体微球后,加入前述的荧光抗体封存液重悬抗体微球结合物。
26.为进一步获得更好的封存效果,在加入所述hepes缓冲液的重悬过程中,以重悬后的质量百分比计,按混合液中荧光抗体微球结合物的固含量为0.5%的比例加入所述hepes缓冲液;在加入所述荧光抗体封存液的重悬过程中,以重悬后的质量百分比计,按混合液中荧光抗体微球结合物的固含量为0.2%的比例加入所述荧光抗体封存液。重悬采用超声赋能手段进行,即将超声清洗头的伸入混合液体中使抗体微球形成再次悬浮状态。
27.方案二,一种荧光抗体封存液的用途,按实现第二目的的制备方法获得的由海藻糖、bsa、聚乙烯吡咯烷酮、山梨醇和透明质酸钠通过hepes缓冲液配制的荧光抗体封存液,用于将活化后的荧光染料抗体封存在心肌检测的自驱动微流控芯片的混合区内。并在晾干后利用营养成分使抗体在设定期限内保持活性,以在被检样本在芯片内流动过程中,在与混合区内荧光抗体发生识别反应后,携带有荧光染料的抗体能够挣脱混合区的束缚,再自动流入检测区与微柱上的抗体发生免疫反应后,形成双抗体夹心标识物,从而由荧光检测仪通过对双抗体夹心标识物的荧光标记检测获得检测结果。其中,荧光染料抗体封存后的
晾干是在满足10万级洁净区的环境要求条件下自然晾干;其环境温度为25℃,湿度为50~60%的恒湿恒温条件。
28.为获得更好的封存效果,还包括,
29.第一步,将荧光染料与抗体按质量比1∶1~1∶10混合后,在37℃条件下反应20min~40min;
30.第二步,通过透析或纯化的方式去除多余的荧光染料;
31.第三步,用前述荧光抗体封存液稀释到0.2mg/ml的抗体浓度。
32.本发明的有益效果是,两种荧光抗体封存液能够分别将荧光微球抗体和荧光染料抗体封存在芯片上,并使抗体具有长时间的活性,其封存的荧光抗体在发生标识反应后,能够挣脱束缚随样本流动;封存液制备方法简单,经过检测验证,其发生标识反应后挣脱能力强,抗体活性保持时间长,相应的封存效果好。用于心脏疾病常规检查的自驱动微流控芯片时,检测效率高,检测精度高。
附图说明
[0033][0034]
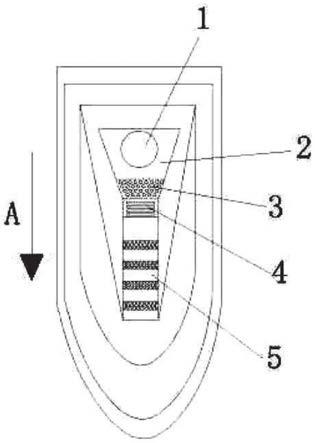
图1是应用本发明荧光抗体封存液的自驱动微流控芯片的结构示意图。
具体实施方式
[0035]
下面结合附图对本发明作进一步说明,但并不因此将本发明限制在所述的实施例范围之中。
[0036]
实施例1,参见图1,一种荧光抗体封存液,用于心脏疾病常规检查的自驱动微流控芯片中,将荧光微球抗体封存在混合区3内,由海藻糖、bsa、聚乙烯吡咯烷酮和山梨醇通过hepes缓冲液配制而成;其中,按质量百分比计,海藻糖:5%~20%,bsa:0.1%~1.0%,聚乙烯吡咯烷酮:0.1%~1.0%,山梨醇:0.1%~ 5.0%,其余为hepes缓冲液。
[0037]
作为优选的方案,前述组分按质量百分比计,海藻糖:5%~10%,bsa:0.5%~ 1.0%,聚乙烯吡咯烷酮:0.5%~1.0%,山梨醇:0.5%~1.0%,其余为hepes缓冲液。
[0038]
实施例2,参见图1,一种荧光抗体封存液,用于心脏疾病常规检查的自驱动微流控芯片中,将荧光染料抗体封存在混合区3内,由海藻糖、bsa、聚乙烯吡咯烷酮、山梨醇和透明质酸钠通过hepes缓冲液配制而成;其中,按质量百分比计,海藻糖:5%~20%,bsa:0.1%~1.0%,聚乙烯吡咯烷酮:0.1%~1.0%,山梨醇:0.1%~5.0%,透明质酸钠:0.05%~0.1%,其余为hepes缓冲液。
[0039]
作为优选的方案,前述组分按质量百分比计,按质量百分比计,海藻糖: 5%~10%,bsa:0.5%~1.0%,聚乙烯吡咯烷酮:0.5%~1.0%,山梨醇:0.5%~ 1.0%,透明质酸钠:0.05%~0.1%,其余为hepes缓冲液。
[0040]
实施例3,一种荧光抗体封存液的制备方法,包括以下步骤:
[0041]
第一步,配制20mmol/l的hepes缓冲液;
[0042]
第二步,用1mol/l的氢氧化钠调ph7.4~7.6;
[0043]
第三步,顺序加入构成实施例1或实施例2的荧光抗体封存液的其余组分,充分溶解后即可。
[0044]
实施例4,一种荧光抗体封存液的用途,按实施例3的制备方法获得的由海藻糖、bsa、聚乙烯吡咯烷酮和山梨醇通过hepes缓冲液配制的如实施例1的荧光抗体封存液,用于将活化后的荧光微球抗体稀释后封存在心肌检测的自驱动微流控芯片的混合区3内。并在晾干后利用营养成分使抗体在设定期限内保持活性,以在被检样本在芯片内流动过程中,在与混合区3内荧光抗体发生识别反应后,携带有荧光微球的抗体能够挣脱混合区的束缚,再自动流入检测区5 与微柱上的抗体发生免疫反应后,形成双抗体夹心标识物,从而由荧光检测仪通过对双抗体夹心标识物的荧光标记检测获得检测结果。其中,荧光微球抗体封存后的晾干是在满足10万级洁净区的环境要求条件下自然晾干;其环境温度为25℃,湿度为50~60%的恒湿恒温条件。
[0045]
为获得更好的效果,还包括,
[0046]
第一步,将荧光微球用交联剂edc/nhs在37℃条件下活化20min~40min,荧光微球与edc/nhs的质量比为100∶1~1∶1;
[0047]
第二步,将活化后的荧光微球加入到抗体溶液中,并在37℃条件下反应2 h~3h,荧光微球与抗体的质量比为20∶1~5∶1;
[0048]
第三步,用冷冻离心机对抗体荧光微球反应后的溶液离心分离,并在去除未标记的抗体后,加入hepes缓冲液重悬抗体微球结合物;
[0049]
第四步,重复执行第三步至少一次;
[0050]
第五步,再用冷冻离心机对抗体微球反应后的溶液进行离心分离,并在去除未标记的抗体微球后,加入前述的荧光抗体封存液重悬抗体微球结合物。
[0051]
其中,在加入所述hepes缓冲液的重悬过程中,以重悬后的质量百分比计,按混合液中荧光抗体微球结合物的固含量为0.5%的比例加入所述hepes缓冲液;在加入所述荧光抗体封存液的重悬过程中,以重悬后的质量百分比计,按混合液中荧光抗体微球结合物的固含量为0.2%的比例加入所述荧光抗体封存液。重悬采用超声赋能手段进行,即将超声清洗头的伸入混合液体中使抗体微球形成再次悬浮状态。
[0052]
实施例5,一种荧光抗体封存液的用途,按实施例3的制备方法获得的由海藻糖、bsa、聚乙烯吡咯烷酮、山梨醇和透明质酸钠通过hepes缓冲液配制的荧光抗体封存液,用于将活化后的荧光染料抗体封存在心肌检测的自驱动微流控芯片的混合区3内。并在晾干后利用营养成分使抗体在设定期限内保持活性,以在被检样本在芯片内流动过程中,在与混合区3内荧光抗体发生识别反应后,携带有荧光染料的抗体能够挣脱混合区3的束缚,再自动流入检测区5与微柱上的抗体发生免疫反应后,形成双抗体夹心标识物,从而由荧光检测仪通过对双抗体夹心标识物的荧光标记检测获得检测结果。其中,荧光染料抗体封存后的晾干是在满足10万级洁净区的环境要求条件下自然晾干;其环境温度为25℃,湿度为50~60%的恒湿恒温条件。
[0053]
为获得更好的封存效果,还包括,
[0054]
第一步,将荧光染料与抗体按质量比1∶1~1∶10混合后,在37℃条件下反应20min~40min;
[0055]
第二步,通过透析或纯化的方式去除多余的荧光染料;
[0056]
第三步,用前述荧光抗体封存液稀释到0.2mg/ml的抗体浓度。
[0057]
根据荧光抗体封存的如下要求,即封存的荧光抗体不残留地完全随检测样本流
走,同时还要保证抗体的活性不受影响。申请人通过以下试验对两种封存液进行了验证,并通过荧光分析仪测试后获得了实验数据,表1为不同配比条件下用于荧光染料抗体封存的第一封存液的试验数据记录,表中,荧光抗体残留检验的是荧光抗体与样本发生识别反应后的挣脱能力,挣脱能力与残留值反相关,即挣脱能越强,残留越少,反之亦然;其中,“+”表示有残留,“++”表示有明显残留,“+++++”表示严重残留,
“‑”
表示无残留;抗体活性是通过在 37℃环境经历30天的荧光信号强度测试结果,通过信号衰减指标表征,其中“+”表示有衰减,“++”有明显衰减,“+++”有严重衰减
“‑”
表示无衰减。表2为不同配比条件下用于荧光微球抗体封存的第二封存液的试验数据记录,表中,荧光抗体残留检验的是荧光抗体与样本发生识别反应后的挣脱能力,挣脱能力与残留值反相关,即挣脱能越强,残留越少,反之亦然;其中,“+”表示有残留,“++”表示有明显残留,“++++”表示有严重残留,
“‑”
表示无残留;抗体活性是通过在37℃环境加速老化1个月后的信号衰减程度,其中“+”表示有衰减,“++”有明显衰减,“+++”有严重衰减。其中,荧光信号强度单位为cps。
[0058]
表1,不同配比固含量条件下第一封存液的试验数据记录
[0059][0060]
表1中所列百分比均为固含量的质量百分比,其余为hepes缓冲液。
[0061]
表2,不同配比固含量条件下第二封存液的试验数据记录
[0062][0063]
表2中所列百分比均为固含量的质量百分比,其余为hepes缓冲液。
[0064]
在对第一封存液和第二封存液的封存的抗体活性评价过程中,在经历的30 天过程中进行每隔一段时间进行了相关荧光信号强度的测试;具体测试数据分别见表3和表4,表3为第一封存液对应组别的间断时间测试结果;表4为第二封存液对应组别的间断时间测试结果。
[0065]
表3,第一封存液对应组别的间断时间测试结果记录
[0066][0067]
表4,第二封存液对应组别的间断时间测试结果记录
[0068][0069]
在表3和表4中,信号强度的变化率为间隔30天时的信号检测值与封存当天检测之差相对于当天信号检测值的百分比,负数为衰减,正数为增强,理论上不会出现增强,但考虑检测误差,信号值有微小增强是可以接受的。评定标准为,信号变化率绝对值小于等于10%定义为无衰减,记为
“‑”
;大于10%,并小于等于20%为有衰减,记为“+”;大于20%,并小于等于50%为明显衰减,记为“++”;大于50%为严重衰减,记为“+++”。
[0070]
实施例6,一种自驱动微流控芯片,包括混合区3和检测区5,混合区3内封存有荧光抗体,检测区5通过芯片底板微流道上的微柱固定有固定抗体;其中,荧光抗体的封存采用实施例3所述的方法制备的实施例1或2荧光抗体封存液。其中,混合区3内封存的抗体为荧光微球抗体时,采用实施1的荧光抗体封存液;混合区3内封存的抗体为荧光染料抗体时,采用实施2的荧光抗体封存液。
[0071]
该芯片用于心肌三项联检时,包括如图1所示的芯片底板,芯片底板上依次设有加样区1、滤血区2、混合区3、限速区4和检测区5,限速区4设有时控阀门,以减缓待测样本在限速区4内的流动速度缓慢,延长待测样本在混合区3内的滞留时间,增加待测样本与混合区3
内试剂的反应时间;混合区3内封存有三株荧光抗体,三株荧光抗体分别为一株ckmb抗体、一株ctni抗体和一株myo抗体,检测区5内通过芯片底板微流道上的微柱依次固定有三株抗体,该固定的三株抗体分别为一株ckmb抗体、一株ctni抗体和一株myo抗体。
[0072]
使用时,被检全血、血清或血浆的血样通过吸管加注在加样区1后,依靠毛细原理试样按箭头a所指方向自动进入滤血区2过滤,之后进入混合区3与荧光抗体进行识别反应,荧光抗体与血样结合后挣脱混合区3的束缚随血样流动,随后进入检测区5,在通过与固定的抗体结合后形成双抗体夹心检测标识物。最后通过荧光仪检测标识物的信号强度获得检测结果。其中,检测区中设有零值区和质控区,质控作为检测卡失效和检测时间的判断依据,零值点作为背景扣除。
[0073]
以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1