源自人参属植物或其不同部位的中药的鉴别方法及其应用
1.本发明关于中药鉴定技术领域,尤其涉及一种源自人参属植物或其不同部位的化学组成相似的中药的鉴别方法及其应用。
背景技术:
2.近年来,人参属中药在医疗和大健康产业发展中优势凸显,被广为研究和开发利用。不同的人参属中药具有不同的药性,在实际应用过程中应合理使用才能保证安全有效。另一方面,由于人参属中药具有广阔的市场前景以及较高的市场价值,除了《中国药典》(2020版一部)收录的人参、红参、人参叶、西洋参、三七、竹节参、珠子参外,还有不法商贩以药典未收录的其他人参属药材或收录植物品种的不同部位(比如茎叶、花)替代投料,严重影响了中药使用的安全性和有效性。因此,对于人参属中药以及含有人参属中药的产品而言,药材的精准鉴别至关重要。当中药饮片被粉碎、加工、提取后,通过常规的性状鉴定、显微鉴定难以将其区分。中国药典标准对于已收录的人参属来源中药的薄层法鉴别多以人参皂苷为指标,但人参皂苷为人参属来源中药中的共有、主要活性成分,在多种人参属植物的根、茎叶、花中均含量丰富。故以单一某种或少数几种人参皂苷为指标进行鉴别难以精准区分不同的人参属中药。因此,深入研究出能够表征、鉴别人参属中药中皂苷成分的方法对于人参属中药及其产品的准确鉴别具有重要意义。
技术实现要素:
3.针对以上技术问题,本发明提供一种源自人参属植物或其不同部位的化学组成相似的中药的鉴别方法及其应用,该鉴别方法以特定的人参皂苷标志物作为标志性成分对待测中药进行鉴定,能够准确区分待测的植物或使用的植物部位,并且该鉴别方法还能用于鉴别中成药等成方制剂中的人参属中药种类。
4.为达到上述发明目的,本发明实施例采用了如下的技术方案:
5.一种源自人参属植物或其不同部位的中药的鉴别方法,以三七皂苷r1、人参皂苷rg1、人参皂苷re、丙二酰人参花蕾皂苷re1、24(r)-拟人参皂苷f11、人参皂苷rf、人参皂苷f3、人参皂苷rg2、人参皂苷ra2、人参皂苷rb1、人参皂苷ra1、人参皂苷rc、人参皂苷rb2、丙二酰基人参皂苷rc、人参皂苷ro、人参皂苷rb3、丙二酰基人参皂苷rb2、竹节参皂苷iv、人参皂苷rd、竹节参皂苷iva、丙二酰基人参皂苷rd、三七皂苷k、人参皂苷rg3作为标志性成分对待测样品进行检测,通过检测结果鉴别所述待测成分的来源。
6.以上标志性成分在不同人参属植物以及同一人参属植物的不同部位中均含量不同,根据以上标志性成分是否被检出、含量,以及成分含量之间的比值即可鉴别出待测样品的具体品种和所属部位,适用范围较广,既能用于人参属中药或其部位的鉴别,也能应用于中成药处方中人参属成分的真伪鉴别和来源鉴别。
7.优选地,用高效液相色谱/质谱联用分析方法检测所述待测样品中的所述标志性成分;
8.所述高效液相色谱的色谱条件为:
9.色谱柱:极性修饰十八烷基硅烷键合硅胶色谱柱;
10.流动相a为乙腈,流动相b为0.1%v/v甲酸水溶液,进行线性梯度洗脱,所述线性梯度洗脱的程序如下:
[0011][0012][0013]
流速:0.28~0.32ml/min;
[0014]
柱温:30~40℃。
[0015]
本发明所采用的流动相以及线性洗脱程序能够提高不同人参皂苷的分离度并减少拖尾现象,且部分成分在该流动相下的峰面积较大,有利于各标志性成分的有效检出。
[0016]
优选地,所述色谱柱为beh shield rp18。在本发明的色谱条件下,采用该色谱柱可达到更好的分离度、峰型以及色谱峰出峰个数。
[0017]
优选地,所述柱温为40℃。在本发明的色谱条件下,柱温40℃时可达到更多的出峰个数以及更好分离度。
[0018]
优选地,所述流速为0.3ml/min。
[0019]
优选地,所述质谱为q-trap 4500三重四极杆-线型离子阱质谱仪。
[0020]
优选地,所述质谱的离子源为电喷雾离子源,在负离子模式下采集数据;所述离子源的参数为:喷雾电压(spray voltage)为-4500v,毛细管温度(capillary temperature,tem)为550.0℃,鞘气(curtain gas,cur)为35.0psi,雾化电压(gas 1)为55.0psi,去溶剂电压(gas 2)为55.0psi,碰撞气压(collision gas,cad)为high,碰撞室出口电压(collision cell exit potential,cxp)为-13.0v。
[0021]
优选地,所述鉴别方法还包括利用mrm采集模式对所述待测样品的质谱检测结果进行分析。具体方法如下:
[0022]
人参具有人参皂苷rg1(以下简称rg1)、人参皂苷re(以下简称re)、丙二酰人参花蕾皂苷re1(以下简称m-re1)、人参皂苷rb1(以下简称rb1)、人参皂苷rc(以下简称rc)、丙二酰基人参皂苷rc(以下简称m-rc)、人参皂苷ro(以下简称ro)、人参皂苷rb3(以下简称rb3)、丙二酰基人参皂苷rb2(以下简称m-rb2)、人参皂苷rd(以下简称rd)、丙二酰基人参皂苷rd(以下简称m-rd)、人参皂苷rf(以下简称rf)和人参皂苷rb2(以下简称rb2)峰,不含24(r)-拟人参皂苷f11(以下简称p-f11)峰,且rf/竹节参皂苷iv(以下简称chiku-iv)》50(指两种
皂苷mrm峰峰面积的比值),三七皂苷r1(以下简称noto-r1)/ro《1,rd/re《0.5;
[0023]
人参叶具有rg1、re、m-re1、rb1、rc、rb2、rb3、rd和m-rd峰,几乎不含p-f11,且rg1/rb1》1,多数人参叶还表现为rc/rg1《2,rb1/rg1《0.5,rc/rb3》5;
[0024]
人参花具有rg1、re、m-re1、rb1、rc、rb2、rd和m-rd峰,rf含量低或几乎不含,且rc/rg1》2,rb1/rg1》1,rg1/noto-r1》1,rb3/noto-r1《1,m-re1/noto-r1》5,m-rd/noto-r1》10;
[0025]
红参具有rg1、re、rf、rb1、rc、ro、rd、rf和rb2峰,且rd/re》0.5;
[0026]
西洋参具有re、rb1、m-rb1、rc、ro、rd、m-rd和p-f11峰,rg1、rf和rb2含量很低,且rf/chiku-iv《0.5,p-f11/chiku-iv》15,noto-r1/ro《0.5,p-f11/rb1《1,rb1/rb2》1,rb1/rc》1,rb1/rb3》1;
[0027]
西洋参叶具有noto-r1、re、rb1、rc、rb2、rb3、m-rb2、rd、m-rd和p-f11峰,且p-f11/rb1》10,rb1/rb2《1,rb1/rc《1,rb1/rb3《1,rb2/rg1《12,rc/rb3《1,多数西洋参还表现为rc/rg1《4,rb3/rg1《30,0.6《rg1/rb1《1;
[0028]
西洋参花具有noto-r1、re、rb1、rc、rb2、rb3、m-rb2、rd、m-rd,p-f11峰,且p-f11/rb1》10,rb1/rb2《1,rb1/rc《1,rb1/rb3《1,rc/rg1》5,rb2/rg1》14,rb3/rg1》30,rg1/noto-r1《1,10《rb3/noto-r1《15,多数西洋参花还表现为rb3/rc《50;
[0029]
三七具有rg1、re、f3、rb1、rd、noto-k和noto-r1色谱峰,几乎不含ro、rc、rb2,且noto-r1/ro》1000,多数三七还表现为1《rf/chiku-iv《10;
[0030]
三七叶具有ra2、rb1、ra1、rc、rb2、m-rc、m-rb2、rd和rb3峰,几乎不含p-f11,且rc/rb3《1,rg1/rb1《0.1,多数三七叶还表现为rb1/re《160,rc/re《600,rb3/re《900;
[0031]
三七花具有ra2、rb1、ra1、rc、rb2、rb3和rd峰,且rg1/noto-r1《1,rb3/rc》100,m-re1/noto-r1《0.1,m-rd/noto-r1《2,多数三七花还表现为rb1/re》450,rc/re》800,rb3/re》1000,rb3/noto-r1》190;
[0032]
竹节参含oa型皂苷ro,chiku-iv和竹节参皂苷iva(以下简称chiku-iva),且ro/chiku-iv《2,多数竹节参还表现为chiku-iva/ro《1,re/rb1》1;
[0033]
珠子参含oa型皂苷ro,chiku-iv和chiku-iva,多数珠子参还表现为chiku-iva/ro》1,ro/chiku-iv》2,re/rb1《1。
[0034]
以及,本发明还提供上述源自人参属植物或其不同部位的中药的鉴别方法在鉴别成方制剂中人参属中药来源中的应用。以上检测方法可鉴别出待测样品的具体人参属植物和所属部位,即使在中成药的复杂体系中,也可鉴别所含人参属成分的真伪和来源。
[0035]
本发明的有益效果在于:本发明提供的方法将线性范围良好的mrm采集模式与差异分析技术相结合,利用上述特定的23种标志性成分可实现种间差异的比较与区分,为人参类中药品种和部位的鉴别以及中成药中人参类中药品种的真伪鉴别提供了有效的基础。
附图说明
[0036]
下面将结合附图及实施例对本发明作进一步说明,附图中:
[0037]
图1是本发明实施例1中oa型分子预测流程图;
[0038]
图2是本发明实施例1中基于95批次人参属样品的full ms数据的pca得分图;
[0039]
图3是本发明实施例1中基于95批次人参属样品的full ms数据的opls-da得分图;
[0040]
图4是本发明实施例1中基于95批次人参属样品的full ms数据的置换检验图;
[0041]
图5是本发明实施例1中基于95批次人参属样品的full ms数据的vip图;
[0042]
图6是本发明实施例1中人参的多通道mrm图;
[0043]
图7是本发明实施例1中红参的多通道mrm图;
[0044]
图8是本发明实施例1中西洋参的多通道mrm图;
[0045]
图9是本发明实施例1中三七的多通道mrm图;
[0046]
图10是本发明实施例1中人参叶的多通道mrm图;
[0047]
图11是本发明实施例1中人参花的多通道mrm图;
[0048]
图12是本发明实施例1中西洋参叶的多通道mrm图;
[0049]
图13是本发明实施例1中西洋参花的多通道mrm图;
[0050]
图14是本发明实施例1中三七叶的多通道mrm图;
[0051]
图15是本发明实施例1中三七花的多通道mrm图;
[0052]
图16是本发明实施例1中竹节参的多通道mrm图;
[0053]
图17是本发明实施例1中珠子参的多通道mrm图;
[0054]
图18是本发明实施例2中基于mrm方法8种中成药中特征性标志物色谱图;
[0055]
图19是本发明对比例1中qtrap 4500质谱仪采用拟靶向代谢组学方法分析得到的pca图;
[0056]
图20是本发明对比例1中q-orbitrap质谱仪采用非靶向代谢组学方法分析得到的pca图;
[0057]
图21是本发明对比例1中基于95批次人参属样品的mrm数据的pca得分图;
[0058]
图22是本发明实施例1中基于95批次人参属样品的mrm数据的opls-da得分图;
[0059]
图23是本发明实施例1中基于95批次人参属样品的mrm数据的置换检验图;
[0060]
图24是本发明实施例1中基于95批次人参属样品的mrm数据的vip图。
具体实施方式
[0061]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0062]
人参属中药品种多、化学组成相似,难以准确鉴别与区分,针对该问题,本实验通过对多种人参类中药(人参、红参、西洋参、三七、竹节参、珠子参、人参叶、人参花、西洋参叶、西洋参花、三七叶、三七花)进行了研究,通过基于超高效液相色谱/三重四极杆-线型离子阱质谱仪构建拟靶向代谢组学技术的方法,将线性范围良好的mrm采集模式与差异分析技术相结合构成拟靶向代谢组学策略,直接观测到每个离子对通道下的峰面积,直观真实反映种内以及种间皂苷成分含量差异,首次对人参属中药典收录与未收录但在因化学成分相似、不容易区分、极易被替代的五种不同部位的药材进行差异成分分析,发现了药典收录的七种人参属来源中药以及药典未收录但极易被替代使用的五种药材之间不同的化学标志物,可实现种间差异的比较与区分。
[0063]
以下实施例中所采用的试剂和药品:
[0064]
乙腈(fisher,fair lawn,nj,usa),甲醇(fisher,fair lawn,nj,usa),甲酸fisher,fair lawn,nj,usa)均为lc-ms级。去离子水经milli-q系统(millipore,bedford,
ma,usa)纯化。
[0065]
60个对照品主要分为:
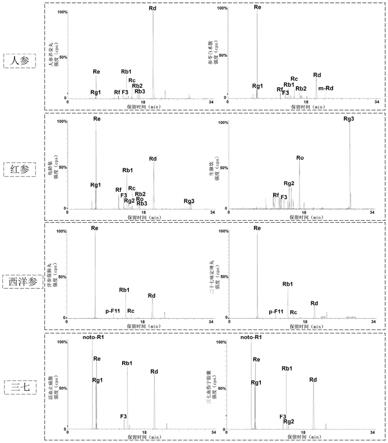
[0066]
18个原人参三醇型人参皂苷(ppt):人参皂苷f1(以下简称f1),20(s)-人参皂苷rh1(以下简称rh1),20(r)-人参皂苷rh1(以下简称20(r)-rh1),人参皂苷f3(以下简称f3),20(s)-三七皂苷a3(以下简称a3),人参皂苷f5(以下简称f5),三七皂苷r2(以下简称r2),20(r)-三七皂苷r2(以下简称20(r)-r2),人参皂苷rg2(以下简称rg2),人参皂苷rf(以下简称rf),人参皂苷rg1(以下简称rg1),三七皂苷r1(以下简称noto-r1),三七皂苷fp1(以下简称fp1),人参皂苷re(以下简称re),20-o-葡萄糖基-人参皂苷rf(以下简称20-o-glu-rf),人参皂苷re2(以下简称re2),人参皂苷re3(以下简称re3),丙二酰人参花蕾皂苷re1(以下简称m-re1),人参皂苷rb1(以下简称rb1);
[0067]
22个原人参二醇型人参皂苷(ppd):人参皂苷rh2(以下简称rh2),20(r)-人参皂苷rh2(以下简称20(r)-rh2),人参皂苷k(以下简称k),人参皂苷f2(以下简称f2),人参皂苷rg3(以下简称rg3),20(r)-人参皂苷rg3(以下简称20(r)-rg3),三七皂苷fe(以下简称fe),人参皂苷rd2(以下简称rd2),三七皂苷k(以下简称noto-k),人参皂苷rd(以下简称rd),绞股蓝皂苷xvii(以下简称xvii),丙二酰基人参皂苷rd(以下简称m-rd),人参皂苷rb2(以下简称rb2),人参皂苷rb3(以下简称rb3),人参皂苷rc(以下简称rc),丙二酰基人参皂苷rc(以下简称m-rc),丙二酰基人参皂苷rb2(以下简称m-rb2),丙二酰基人参皂苷rb1(以下简称m-rb1),人参皂苷ra1(以下简称ra1),人参皂苷ra2(以下简称ra2),三七皂苷r4(以下简称r4),三七皂苷t(以下简称t);
[0068]
4个齐墩果酸型人参皂苷(oa):竹节参皂苷iva(以下简称chiku-iva),竹节参皂苷iv(以下简称chiku-iv),拟人参皂苷rt1(以下简称rt1),人参皂苷ro(以下简称ro);
[0069]
两种奥克梯隆型人参皂苷:24(r)-拟人参皂苷rt5(以下简称24(r)-rt5),24(r)-拟人参皂苷f11(以下简称p-f11);
[0070]
其他类型皂苷:人参皂苷rk3(以下简称rk3),人参皂苷rh4(以下简称rh4),三七皂苷t5(以下简称t5),人参皂苷rg5(以下简称rg5),人参皂苷rg6(以下简称rg6),人参皂苷f4(以下简称f4),人参皂苷rk1(以下简称rk1),5,6-脱氢人参皂苷rd,越南参皂苷r8(以下简称r8),5,6-脱氢人参皂苷rb1;
[0071]
四个人参皂苷元:20(s)-原人参三醇,20(s)-原人参二醇,齐墩果酸,20(s),24(r)-奥克梯隆醇苷元。
[0072]
上述对照品全部来自于上海诗丹德生物技术有限公司及成都德斯特生物技术有限公司。
[0073]
人参根、人参叶、人参花、西洋参根、西洋参叶、西洋参花、三七根、三七叶、三七花、红参、竹节参、珠子参共95批次样品信息见表1。
[0074]
表1 95批不同品种药材信息表
[0075]
[0076][0077]
以下实施例中所采用的分析仪器:
[0078]
qtrap 4500三重四极杆-线性离子阱质谱仪(applied biosystems-sciex scientific,concord,canada)。
[0079]
实施例1
[0080]
本发明实施例提供了差异鉴别标志物的获得过程。
[0081]
1、数据采集
[0082]
1.1样品溶液的制备
[0083]
分别取药典收载的7种人参属中药的不同批次样品(人参、红参、西洋参、三七、竹节参、珠子参、人参叶)粉末各25mg,加70%的甲醇-水溶液(v/v)5ml溶解,并涡旋震荡2min,超声提取1h,提取液冷却后用70%甲醇-水溶液(v/v)补足失重,并14000rpm(11481g)离心10min,取上清液,过0.22μm微孔滤膜过滤,制得浓度为5mg/ml的人参属中药样品溶液,取100μl滤液用于lc-ms分析。
[0084]
1.2液相与质谱条件
[0085]
高效液相色谱分析在i-class超高效液相系统下完成,色谱条件具体如下:
[0086]
色谱柱:beh shield rp18(2.1
×
100mm,1.7μm);
[0087]
流动相:乙腈(a),0.1%v/v甲酸水溶液(b);
[0088]
柱温:40℃;
[0089]
流速:0.3ml/min;
[0090]
进样量:3μl;
[0091]
进行线性梯度洗脱,所述线性梯度洗脱的程序如下:
[0092][0093]
质谱条件为:
[0094]
离子源为电喷雾离子源,喷雾电压(spray voltage)为-4500v,毛细管温度(capillary temperature,tem)为550.0℃,鞘气(curtain gas,cur)为35.0psi,雾化电压(gas 1)为55.0psi,去溶剂电压(gas 2)为55.0psi,碰撞气压(collision gas,cad)为high,碰撞室出口电压(collision cell exit potential,cxp)为-13.0v。
[0095]
采用以上参数,设定进样量为3μl,对七个人参属中药样品进行三种母离子列表两种采集方法的靶向采集,数据分析采用analyst(1.6.3)软件。
[0096]
1.3采用信息依赖采集-增强产物离子扫描(ida-epi)的技术对人参皂苷进行表征与鉴定,用mrm-ida-epi模式检测中性皂苷和丙二酸酰化皂苷,用mim-ida-epi模式检测齐墩果酸型人参皂苷。mim-ida-epi模式中的ce值为70ev~100ev,mrm-ida-epi模式中的ce值70ev~120ev;信息依赖采集响应强度为1~2。
[0097]
2、离子对的构建
[0098]
2.1mrm离子对构建
[0099]
对q1传输的母离子,经过ida模式进行条件选择后,送入q3得到子离子,通过母离子与子离子匹配的方式确认该成分再送入离子阱中进行裂解。对中性皂苷、丙二酸酰化皂苷离子对进行确认,统一标准为考察nl(46/44)-ida-epi模式下采集的七种人参属来源中药样品的数据,找到列表中的质量数为[m-h]-峰,作为mrm模式的母离子,而每个成分对应响应最强的二级碎片作为子离子,构建用于mrm-ida-epi模式采集的离子对。最终中性皂苷得到106个离子对,丙二酸酰化共23个离子对,mim-ida-epi模式中分子预测能够捕捉到二级碎片的成分质量数共有150个。
[0100]
2.2mim离子对构建
[0101]
先根据oa型皂苷已知结构特征预测可能存在的结构(苷元+糖基+取代基),构建“oa型皂苷数据库”。根据已知报道的oa型苷元结构,共统计出此类皂苷特点如下;已报道的oa型皂苷共有44种,如表2所示,糖基质量数为5种,取代基4种(-ch2/-c2h4/-c3h6/-c4h8)。
[0102]
表2已报道齐墩果酸型皂苷信息表
[0103][0104]
[0105]
根据以上规律,本发明通过对44种皂苷结构中含有的糖基数和取代基个数进行总结,在已知齐墩果酸型皂苷原来的结构基础上进行糖基和取代基的预测:设定分子设计规则为在预测过程中连接在每种齐墩果酸型苷元上5种糖基数目最少为1个,最多不超过6个,非糖取代基数目最多不超过2个、最少为1个,最终预测的糖基数与取代基个数均包含已知皂苷结构中已有的个数,均满足规则的情况即可。
[0106]
依据此规则对oa型皂苷数据库进行扩展预测,共构建了8905个分子式,其中包括了已知的齐墩果酸型皂苷,对预测的所有质量数进行去重复,最终得到338个不同的质量数,作为oa型人参皂苷预测母离子输入mim方法的列表。oa型分子预测流程图如图1所示。
[0107]
将以上mrm和mim采集到的质量数作为母离子,二级响应最高的碎片离子作为子离子,将所得结果进行合并和去重复,最后得到了252个离子对。将离子对输入mrm方法中,构建拟靶向代谢组学技术用于分析人参属多来源多品种多部位药材的差异分析方法。
[0108]
3、样品分析
[0109]
3.1供试品溶液的制备
[0110]
分别取表1中12个品种不同批次样品粉末各25mg,加70%的甲醇-水溶液(v/v)5ml溶解,并涡旋震荡2min,超声提取1h,提取液冷却后用70%甲醇-水溶液(v/v)补足失重,并14000rpm(11481g)离心10min,取上清液,过0.22μm微孔滤膜过滤,制得浓度为5mg/ml的供试品溶液,取100μl滤液用于lc-ms分析。液相和质谱条件同1.1,不需要触发epi模式,只需使用探测扫描模式即可。
[0111]
3.2 12味人参属中药“皂苷鉴别标志物”的构建
[0112]
通过拟靶向代谢组学的方法,本实施例建立了mrm方法用于人参属来源中药差异成分鉴定的方法,将所开发的流程用于分析12种人参属来源中药的差异成分分析,继而找到12种人参属来源中药各自的鉴别点,构建每种药材的差异鉴别标志物。
[0113]
3.2.1基于模式识别化学计量学分析的差异皂苷化合物的发现与结构鉴定
[0114]
借助于simca-p 14.1软件采用多元统计分析的方法分析人参根、人参叶、人参花、西洋参根、西洋参叶、西洋参花、三七根、三七叶、三七花、红参、竹节参、珠子参12味药材pca得分图(如图2所示)、opls-da得分图(如图3所示)、置换检验图(如图4所示)和vip图(如图5所示),使用opls-da分析数据,并利用vip图来探索潜在的人参皂苷标志物。其中pca得分图中供试样品数据聚类良好,表明其数据稳定可靠。图3中结果为人参、红参、西洋参聚为一簇,三七根、三七叶、三七花聚为一簇,人参叶、西洋参叶、人参花、西洋参花聚为一簇,依旧是竹节参和珠子参聚为一簇。从结果来看,不同源品种之间差异较为明显,且同源不同部位之间距离较近,化学成分差异较小。因此该方法应用于多品种多来源药材代谢组学分析效果良好。本实施例设定vip》1共鉴定出38个差异成分。本实施例根据标准品对照(保留时间与质谱信息)、二级裂解碎片解析,以及结合文献中报道的化合物的出峰顺序,对这些差异成分进行了鉴定,鉴定结果如表3。
[0115]
表3基于负离子模式mrm数据确定的38个潜在标记成分的信息表
[0116]
[0117]
[0118][0119]
注:a表示经过对照品鉴定。未标注a表示未经对照品鉴定,是推测出的鉴定结果。
[0120]
3.2.2人参属中药皂苷“鉴别标志物”的构建
[0121]
根据鉴定出的差异成分,在原始mrm谱图中进行峰标记,更直观表现出12种药材之间的差异,如图6~17。对所有药材进行分组比较,且从标记的差异成分中,选取每组中的内标物,方便直观表示不同品种之间的含量差异。通过差异成分与内标峰面积比值进行分析,总结出人参属来源中药的差异鉴别点,并找到每种药材的差异鉴别标志物。
[0122]
(1)人参与红参:
[0123]
人参的共有峰:rg1、re、m-re1、rb1、rc、rb2、m-rc、ro、rb3、m-rb2、rd、m-rd等,特征峰为rf和rb2,如图6所示。红参的共有峰:rg1、re、rf、rb1、rc、ro、rd,特征峰为rf和rb2,如图7所示。
[0124]
人参与红参所含的rg1,re,rf,rb2,ro的丰度高,二者的主要区别在于丙二酸酰化人参皂苷和一些小极性皂苷(如rg3和rg2);除此之外,红参中rd含量较高,人参中rd/re《0.5(7批满足,0.29-0.47),红参中rd/re》0.5(10批满足,0.53-1.34)。
[0125]
(2)根类:人参/西洋参/三七
[0126]
人参的共有峰:rg1、re、m-re1、rb1、rc、rb2、m-rc、ro、rb3、m-rb2、rd、m-rd等,特征峰为rf和rb2。西洋参的共有峰:re、rb1、m-rb1、rc、ro、rd、m-rd等,特征峰为p-f11,如图8所示。三七的共有峰:rg1、re、f3、rb1、rd、noto-k等,特征峰为noto-r1,且几乎不含ro、rc、rb2,如图9所示。
[0127]
人参含有丰富的rg1、re、rf、rb2、ro,不含p-f11,其中人参中rf/chiku-iv》50(10批全部满足,比值范围70-1000),西洋参中rf/chiku-iv《0.5(10批全部满足,比值范围0.01-0.3),三七中1《rf/chiku-iv《10(10批中有8批满足,比值范围5-9.2);西洋参中rg1,rf和rb2含量很低,特征性成分是p-f11,p-f11/chiku-iv》15(10批全部满足,17.1-106.3);三七中含有丰富的noto-r1,其中noto-r1/ro》1000(10批全部满足,比值范围1490-2900),人参中noto-r1/ro《1(10批中9批满足,0.2-0.9),西洋参中noto-r1/ro《0.5(10批全部满足,0.06-0.23)并且三七中ro、rc、rb2含量很低。
[0128]
(3)人参:根/叶/花
[0129]
人参共有峰:rg1、re、m-re1、rb1、rc、rb2、m-rc、ro、rb3、m-rb2、rd、m-rd等;特征峰为rf;人参叶共有峰:rg1、re、m-re1、rb1、rc、rb2、rb3、rd、m-rd等,rf含量低,如图10所示;人参花共有峰:rg1、re、m-re1、rb1、rc、rb2、rd、m-rd等,rf含量低,如图11所示。
[0130]
人参根中含有丰富的rf、rb1、ro、rc和rb2,且m-rb1、m-rc、和m-rb2含量中等;叶和花含有丰富的rg1、re、rc、rb1和丙二酸酰化人参皂苷m-re1和m-rd,但含量很低或者几乎不含ro、rf和rb3。结合峰面积来看,人参花中m-re1、rc、rb1含量较高,其中rc/rg1》2(5批全部
满足,2.8-3.3),rb1/rg1》1(5批全部满足,1.7-2.3);人参叶中rc/rg1《2(10批有9批满足,0.7-1.7),rb1/rg1《0.5(10批有9批满足,0.34-0.47)。
[0131]
(4)西洋参:根/叶/花
[0132]
西洋参的共有峰:re、rb1、m-rb1、rc、ro、rd、m-rd等,特征峰为p-f11;西洋参叶的共有峰:noto-r1、re、rb1、rc、rb2、rb3、m-rb2、rd、m-rd等,p-f11含量丰富,如图12所示;西洋参花的共有峰:noto-r1、re、rb1、rc、rb2、rb3、m-rb2、rd、m-rd,p-f11,如图13所示。
[0133]
西洋参的特征性成分为p-f11,rb1含量丰富,且含有中等的rd和m-rd,但含量很低或者不含rg1,rf,rb2;西洋参叶和花,与根相比,含有更丰富的p-f11,根中p-f11/rb1《1(10批全部满足,0.07-0.23),而叶和花中p-f11/rb1》10(叶和花共10批全部满足,12.6-44.7);西洋参根中含有丰富的rb1,而叶和花中rc、rb2、rb3三种ppd型皂苷含量更高,西洋参根中色谱峰高rb1/rb2、rb1/rc、rb1/rb3均》1,茎叶和花中色谱峰高rb1/rb2、rb1/rc、rb1/rb3均《1;西洋参叶与花相比,花中rc、rb2、rb3含量更为丰富,西洋参花中rc/rg1》5(5批全部满足,5.3-15.7),rb2/rg1》14(5批全部满足,14.8-22.1),rb3/rg1》30(5批全部满足,32.6-53.4),而叶中rc/rg1《4(5批中有4批满足,比值范围0.7-3.4),rb2/rg1《12(5批全部满足,2.6-11.8),rb3/rg1《30(5批中有4批满足,10.9-24.2)。
[0134]
(5)三七:根/叶/花
[0135]
三七根的共有峰:rg1、re、f3、rb1、rd、noto-k等,特征峰为noto-r1含量高,但ro和rc含量低或基本不含;三七叶的共有峰:ra2、rb1、ra1、rc、rb2、m-rc、m-rb2、rd等,rb3含量高,但noto-r1、rg1、re含量低,如图14所示;三七花的共有峰:ra2、rb1、ra1、rc、rb2、rb3、rd,其中rc含量丰富,但noto-r1、rg1、re含量低,如图15所示。
[0136]
三七根富含noto-r1与rg1,但ro、chiku-iv和rb2含量低;三七叶和三七花富含rc和rb3,rd含量中等,还含有ra1和ra2,但noto-r1含量很低。与三七叶相比,三七花中rb1、rc、rb3含量更高,rb1/re》450(5批中4批满足,467.3-1001.8),rc/re》800(5批中4批满足,825.7-1611.9),rb3/re》1000(5批中有4批满足,1205.3-2559.4);叶中rb1/re《160(5批有4批满足,54.7-157.7),rc/re《600(5批中有4批满足,187.6-595.8),rb3/re《900(5批中有4批满足,350.1-885.6)。
[0137]
(6)竹节参和珠子参
[0138]
相对于其它人参属中药,竹节参与珠子参均富含oa型皂苷ro,chiku-iv和chiku—iva,为其特征成分。珠子参中chiku-iva含量更丰富,chiku-iva/ro》1(10批中有7批满足,1.03-3.2),而竹节参中chiku-iva/ro《1(10批中有8批满足,0.4-0.7);竹节参中chiku-iv和re含量更高,ro/chiku-iv《2(10批全部满足,0.1-1.7),珠子参中ro/chiku-iv》2(10批中有7批满足,2.0-4.2);竹节参中re/rb1》1(10批中有9批满足,2.3-24.1),而珠子参中re/rb1《1(10批中有7批满足,0.05-0.9)。如图16、图17所示。
[0139]
(7)叶类:人参叶/西洋参叶/三七叶
[0140]
人参叶共有峰:rg1、re、m-re1、rb1、rc、rb2、rb3、rd、m-rd等,rg1和m-re1含量高,但p-f11含量低;西洋参叶共有峰:noto-r1、re、rb1、rc、rb2,rb3,m-rb2,rd,m-rd等;含丰富的p-f11;三七叶共有峰:ra2、rb1、ra1、rc、rb2、m-rc、m-rb2、rd等;但rg1和p-f11含量低。
[0141]
人参叶中含有rg1和m-re1,西洋参叶中含有丰富的p-f11和m-rd;rb3和rc在人参叶中rc/rb3》5(10批中有7批满足,5.75-8.16),而西洋参茎叶与三七叶中rc/rb3《1(10批全
部满足,0.08-0.68);人参叶和三七叶几乎不含p-f11,西洋参叶中p-f11/rb1》10(5批全部满足,15.0-44.7);西洋参叶和三七叶中rg1含量很低,西洋参叶0.6《rg1/rb1《1(5批有4批满足,0.65-0.93),三七叶rg1/rb1《0.1(5批全部满足,0.01-0.02),而人参叶rg1/rb1》1(10批全部满足,1.7-3.2);另外,三七叶中含有ra1和ra2,其在人参叶与西洋参叶中含量很低。
[0142]
(8)花类:人参花/西洋参花/三七花
[0143]
人参花共有峰:rg1、re、m-re1、rb1、rc、rb2、rd、m-rd等,m-re1含量高,但p-f11含量低;西洋参花共有峰:noto-r1、re、rb1、rc、rb2、rb3、m-rb2、rd、m-rd等p-f11与m-rb2含量高;三七花共有峰:ra2、rb1,ra1、rc、rb2、rb3、rd等,但p-f11含量低。
[0144]
人参花富有rg1、re和m-re1,rg1/noto-r1》1(5批全部满足,1.23-2.0);但西洋参花和三七花中rg1/noto-r1《1(10批全部满足,0.2-0.5);rb3在三七花中含量丰富,但在人参花含量很低,人参花rb3/noto-r1《1(5批全部满足,0.6-0.9);西洋参花中10《rb3/noto-r1《15(5批全部满足,10.7-14.9);而三七花中rb3/noto-r1》190(5批全部满足,192.8-353.0);西洋参花中p-f11含量较高为其特征成分,同时含有rb3和m-rb2;且西洋参花rb3/rc《50(5批中有4批满足,比值范围28.3-46.7),而三七花中rb3/rc》100(5批全部满足,比值范围103.3-364.3);三七花中几乎不含rg1和re,丙二酸酰化皂苷含量相对较低,m-re1/noto-r1《0.1(5批全部满足,0.01-0.02)和m-rd/noto-r1《2(5批全部满足,1.1-1.9);而人参花中分别m-re1/noto-r1》5(5批全部满足,5.01-8.0)和m-rd/noto-r1》10(5批全部满足,10.9-17.0);人参花中同时含有丰富的ra1、ra2和rb3。
[0145]
以上所有差异成分比较中共提到23种成分,分别为:noto-r1(977.4-931.3)、rg1(845.4-475.3)、re(991.4-799.4)、m-re1(1031.6-945.5)、p-f11(845.7-799.3)、rf(845.7-799.3)、f3(815.3-475.3)、rg2(829.5-637.3)、ra2(1255.4-1209.6)、rb1(1153.6-1107.5)、ra1(1255.4-1209.6)、rc(1123.3-1077.6)、rb2(1123.3-1077.6)、m-rc(1163.3-1077.7)、ro(955.5-793.4)、rb3(1123.3-1077.6)、m-rb2(1163.3-1077.7)、chiku-iv(925.5-613.3)、rd(991.1-945.5)、chiku-iva(793.4-569.4)、m-rd(1031.6-945.5)、noto-k(991.1-945.5)、rg3(829.5-459.4),以上23种成分可作为12种药材的差异鉴别标志物。
[0146]
实施例2
[0147]
本实施例选取了29种包含人参属来源中药的不同剂型的中成药,如表4所示。
[0148]
表4 29批中成药信息表
[0149]
[0150][0151]
选取以下14个离子通道检测人参皂苷标志物:noto-r1(977.4-931.3)、rg1(845.4-475.3)、re(991.4-799.4)、p-f11(845.7-799.3)、rf(845.7-799.3)、f3(815.3-475.3)、rg2(829.5-637.3)、rb1(1153.6-1107.5)、rc(1123.3-1077.6)、rb2(1123.3-1077.6)、ro(955.5-793.4)、rb3(1123.3-1077.6)、rd(991.1-945.5)、rg3(829.5-459.4),通过以上离子对标志性成分来鉴别中成药中的人参属来源中药种类。通过在mrm模式中设置以上离子对信息,在不同种类的中成药中捕获其差异成分,以验证差异鉴别标志物在中成药真伪鉴别中的能力。如图18所示(各缩写对应的中成药同表4),例如,从图中可见,包含人参和红参的中成药中成分较为丰富,而包含西洋参和三七药材的中成药中成分相对较少些。rf、rc、rb2、rb3含量相对较高,可能表明人参养荣丸、参苓白术散、龟龄集和生脉饮中可能含有人参,且在龟龄集和生脉饮中含有相对丰富的小极性皂苷rg2和rg3,而人参中不含有,证明这两种中成药中含有红参;稀有的rg1、rf和rb2,以及含量丰富的p-f11能够证明洋参保肺丸和二十七味定坤丸中含有西洋参;noto-r1和rg1含量丰富,且罕见rf、rc和rb2,证明活血止痛散和三七血伤宁胶囊中含有三七。可用该方法鉴别其它21种中成药中的人参属中药品种,如表5所示。
[0152]
表5 29批中成药特征性成分信息表
[0153]
[0154][0155]
其中需要说明的是在定坤丹中能同时发现含有丰富的noto-r1、rg1、re、rg2和rg3,同时含有红参和三七的特征成分红参和三七,从而证明其中同时含有药材红参和三七。
[0156]
通过以上结果,不仅从中成药样品中验证了人参属来源中药得到的差异成分定位的结果,并且证明了采用mrm方法能够直观地描述药材和中成药中人参皂苷的种类以及分布情况,并且能够同时区分人参属来源中药,适用范围较广,能够应用于对中成药处方的真伪鉴别。
[0157]
对比例1
[0158]
本对比例是基于qtrap-ms拟靶向代谢组学与基于q-orbitrap-ms非靶向代谢组学技术在人参属中药差异分析中的对比研究。
[0159]
由于mrm采集模式没有full ms的数据信息,无法借助qi软件进行解析。因此本实施例采用手动记录的方式,对每个通道中不同保留时间下的色谱峰进行标记,并将保留时间和离子对信息输入multi quat软件,共标记了483个色谱峰,并对所有批次样品进行统一积分处理,导出离子对-峰面积数据的列表。将数据结果进行“80%规则”和“30%变异”处理后导入simca-p 14.1软件进行多元统计分析。两组数据如图19、20所示,图19为qtrap 4500质谱仪采用拟靶向代谢组学方法分析得到的pca图,图20为q-orbitrap质谱仪采用非靶向代谢组学方法分析得到的pca图。从图中可看出,两台仪器的两种方法对于不同品种药材的聚类情况有所不同。二者的qc数据聚类良好,表明所采集的数据稳定性良好,左图中分成了
五个群落,其中人参和红参、竹节参和珠子参分别聚在一起,西洋参、三七、人参叶分成了三个单独的群落,表明人参与其炮制品红参之间,竹节参和珠子参之间化学成分差异相对较小。虽然人参叶和人参是同一品种,但由于是不同部位,二者却有一定距离存在显著差异,且三七与人参等在pca图的距离也相对较远,证明同样存在显著的差异。根据右图的数据,共分成了三个群落,其中人参、人参叶、西洋参、红参聚在一起,竹节参和珠子参聚在一起,而三七单独聚成一簇。虽然不同品种之间差别较大,但相近的品种如人参和人参叶差异却很小。因此,从数据的聚类程度来分析,采用拟靶向代谢组学技术对于同属不同品种之间的差异分析有更大的优势。
[0160]
接着,本实施例对两套代谢组学方法进行了解析,分别做opls-da进一步分析,vip图找到其主要的差异成分,以及置换检验图可证明两组模型没有过度拟合,如图2~5和图21~24。其中非靶向代谢组学方法下vip值》1.5共有41个成分,根据标准品和二级碎片共鉴定(或推导)出29个,在拟靶向代谢组学方法下vip值》1共有50个成分,根据标准品和二级碎片共鉴定(或推导)出38个。对两套代谢组学技术得到的差异成分结果进行分析,选择统计了两组数据10个共有成分的峰面积线性范围,如下表6所示。
[0161]
表6拟靶向代谢组学与非靶向代谢组学线性范围比较表
[0162][0163][0164]
通过对两组数据的比较结果来看,mrm方法下能够捕获的线性范围更宽,覆盖度更广,最大值和最小值最多覆盖了4个数量级,而full ms的方法主要覆盖了2个数量级和3个数量级。因此表明mrm方法能够覆盖的差异成分线性范围更广,更能够真实反映不同批次药材成分的含量差异。
[0165]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1