一种胶乳增强免疫比浊法试剂和用于提高胶乳增强免疫比浊法试剂检测准确度的方法与流程
1.本发明属于体外诊断试剂盒开发技术领域,更具体地说,是关于一种胶乳增强免疫比浊法试剂和用于提高胶乳增强免疫比浊法试剂检测准确度的方法。
背景技术:
2.在体外诊断领域,胶乳增强免疫比浊法试剂是一种用于定量检测的产品,按照体外诊断试剂分析性能评估指导原则要求,准确度评估资料是评价拟上市产品有效性的重要依据,也是产品注册所需重要申报资料之一。我们通常采用方法学比对实验来评价胶乳增强免疫比浊法试剂盒的准确度,具体内容就是与参考方法或临床上公认质量较好的已上市产品(以下简称参比试剂)进行比对。
3.胶乳增强免疫比浊法试剂有时也被称为胶乳增强免疫比浊试剂,原理是,选择一种大小合适,均匀一致的胶乳微球吸附或者交联抗体(或抗原),当遇到相应抗原(或抗体)时,则发生聚集,出现浊度变化,单个胶乳微球在入射光波长之内,光线可透过,当两个或多个胶乳颗粒凝聚时,则使透射光减少,这种减少的程度在一定范围内与胶乳凝集成正比,故而与被测样本中的目标抗原(或抗体)浓度成正比,所以通过测定特定波长的反应体系吸光度,参照校准曲线即可计算出样本中待检测抗原(或抗体)的含量。
4.与其他检测方法相比,胶乳免疫比浊法通量大,耗时短,可实现自动化,减少人为因素对检测结果的影响,同时具备良好的灵敏度及准确度。因此,胶乳免疫比浊法具有较好的应用前景。
5.胶乳增强免疫比浊法试剂准确度高低,直接表现在,与参比试剂比对结果上,两款产品同时测定临床样本时,利用两份样本测定值进行相关系数计算,如果r≥0.975(或者r2≥0.95),则认为选择的数据范围合适,数据满足要求。这也就是本技术提及的临床相关性,好与不好的判断标准。
6.目前,提高胶乳增强免疫比浊法试剂准确度的方法包括但不限于,改变致敏微球厂家或提高胶乳粒径,或者直接提高试剂盒缓冲体系中促聚剂的品种与量,例如,相应的减少或者增加peg的量,或者添加表面活性剂,阻断剂等成分,但是这样方法也会带来一些负面影响,比如,peg浓度过高时,会引起比较强的非特异性反应,会直接影响灵敏度测试。还有一些方法,更换缓冲液种类,改变ph值,调节抗体种类,加入一些裂解液,有的时候也会有效果;有的时候收效甚微,可能就会被困扰住,所以找到一种普适的方法,提高试剂的准确度就显得尤为重要。
技术实现要素:
7.鉴于上述情况,本发明提供了一种普适的用于提高胶乳增强免疫比浊法试剂准确度的方法,在胶乳增强免疫比浊法试剂开发的过程中,当改变r1的缓冲对种类、peg浓度、盐浓度、r2的偶联工艺、微球的投料量等均无较明显改善实际临床相关性的效果时,可考虑成
倍数增加或减少核心抗原、抗体的投料量。
8.经过实验验证,在胶乳免疫比浊r2试剂的偶联过程中,包被抗原时,在临床相关性不佳的时候,可适当成倍减少抗原的包被量,能非常明显提高试剂检测结果的临床相关性;包被抗体时,在临床相关性不佳的时候,可适当成倍增加抗体的包被量,能非常明显提高试剂检测结果的临床相关性,提高检测的准确度,与抗原抗体反应动力学有一定的关系。因此,本发明的目的是提供一种用于提高胶乳增强免疫比浊法试剂与参比试剂临床相关性的方法。
9.为实现上述目的,本发明采用如下技术方案:
10.作为本发明的第一个方面,一种用于提高胶乳增强免疫比浊法试剂检测准确度的方法,当胶乳增强免疫比浊法试剂为包被抗体检测抗原的胶乳增强免疫比浊法试剂,制备r2试剂时,成倍增加胶乳增强免疫比浊法试剂中的目的抗体的投料量;当胶乳增强免疫比浊法试剂为包被抗原检测抗体的胶乳增强免疫比浊法试剂,制备r2试剂时,成倍减少胶乳增强免疫比浊法试剂中的目的抗原的投料量。
11.优选的,当胶乳增强免疫比浊法试剂为包被抗体检测抗原的胶乳增强免疫比浊法试剂,制备r2试剂时,目的抗体的投料量增加至胶乳增强免疫比浊法试剂中的初始抗体投料量的两倍。
12.优选的;当胶乳增强免疫比浊法试剂为包被抗原检测抗体的胶乳增强免疫比浊法试剂,制备r2试剂时,目的抗原的投料量减少至胶乳增强免疫比浊法试剂中的初始抗原投料量的1/2倍。
13.根据本发明,r2试剂的制备方法,包括如下步骤:
14.(1)微球活化,获得胶乳;
15.(2)活化后的微球的清洗:将上述活化后的胶乳离心,去上清,加入偶联缓冲液,复溶,获得乳胶液,备用;
16.(3)蛋白偶联:按照不同粒径微球的单层包被量投入目的蛋白,取目的蛋白加入到pbs偶联缓冲液中,混合均匀后,逐滴加入到胶乳液中,37℃持续搅拌5h;
17.(4)封闭:在胶乳液中加入封闭液封闭,封闭结束后离心去上清,加入贮存液,在细胞破碎仪上进行超声分散,直到胶管出现透亮,分散均匀;
18.(5)老化,52℃,放置16h后,获得r2试剂。
19.根据本发明,所述活化后的微球的清洗的步骤为将活化后的胶乳12000rpm离心30min,去上清,加入1ml偶联缓冲液,复溶,获得乳胶液,备用。
20.根据本发明,微球的活化步骤为:将0.1ml微球加入0.9ml活化缓冲液,均匀混合,称取5mg nhs(n-羟基琥珀酰亚胺),3mg edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),取上述1ml的活化缓冲液溶解后,取100μl,加入微球稀释液中,室温下持续搅拌20min。
21.根据本发明,所述pbs偶联缓冲液为50mm ph 9.0,含0.1%v/v tw-20的pbs缓冲液。
22.根据本发明,所述封闭的步骤为:在胶乳液中加入500μl封闭液,37℃,持续搅拌3h,封闭结束,将封闭后的胶乳液12000rpm离心20min,去上清,加入5ml贮存液,在细胞破碎仪上进行超声分散,直到胶管出现透亮,分散均匀
23.根据本发明,所述封闭液为50mm ph 9.0,含5g/l脱脂牛奶,0.1%v/v tw-20,
0.05%v/v p300的pbs缓冲液。
24.作为本发明的第二个方面,上述所述的方法在制备胶乳增强免疫比浊法试剂中的应用。
25.作为本发明的第三个方面,一种胶乳增强免疫比浊法试剂,包括r1试剂、r2试剂、目标蛋白校准品。
26.根据本发明,目标蛋白校准品为50mm ph 7.5tris缓冲液,是由0.9%氯化钠,0.1%edta-2na,0.4%bsa,0.1%p300,0.01%tx-100配置而成。
27.根据本发明,所述r1试剂为50mm ph 7.5pbs缓冲液,是由0.9%氯化钠,2.5%peg,0.1%bsa,0.1%p300,0.01%tx-100配置而成。
28.根据本发明,所述的胶乳增强免疫比浊法试剂的r2试剂包括目的抗原和微球,当微球粒径为100nm时,0.5wt%1ml的微球对应的目的抗原的投料量为0.7mg*1/2n;当微球粒径为200nm时,0.5wt%1ml的微球对应的目的抗原的投料量为0.4mg*1/2n;当微球粒径为300nm时,0.5wt%1ml的微球对应的目的抗原的投料量为0.3mg*1/2n;当微球粒径为400nm时,0.5wt%1ml的微球对应的目的抗原的投料量为0.2mg*1/2n,其中,n为正整数。
29.根据本发明,所述的胶乳增强免疫比浊法试剂的r2试剂包括目的抗体和微球,当微球粒径为100nm时,0.5wt%1ml的微球对应的目的抗体的投料量为0.7mg*2n;当微球粒径为200nm时,0.5wt%1ml的微球对应的目的抗体的投料量为0.4mg*2n;当微球粒径为300nm时,0.5wt%1ml的微球对应的目的抗体的投料量为0.3mg*2n;当微球粒径为400nm时,0.5wt%1ml的微球对应的目的抗体的投料量为0.4mg*2n,其中,n为正整数。
30.根据本发明,所述r2试剂包括目的抗原和微球,当微球粒径为100nm时,0.5wt%1ml的微球对应的目的抗原的投料量为0.35mg;当微球粒径为200nm时,0.5wt%1ml的微球对应的目的抗原的投料量为0.2mg;当微球粒径为300nm时,0.5wt%1ml的微球对应的目的抗原的投料量为0.15mg;当微球粒径为400nm时,0.5wt%1ml的微球对应的目的抗原的投料量为0.1mg。
31.或者,所述r2试剂包括目的抗体和微球,当微球粒径为100nm时,0.5wt%1ml的微球对应的目的抗体的投料量为1.4mg;当微球粒径为200nm时,0.5wt%1ml的微球对应的目的抗体的投料量为0.8mg;当微球粒径为300nm时,0.5wt%1ml的微球对应的目的抗体的投料量为0.6mg;当微球粒径为400nm时,0.5wt%1ml的微球对应的目的抗体的投料量为0.4mg。
32.进一步的,所述目的抗原为抗链球菌溶血素o蛋白(aso)。
33.进一步的,所述目的抗体为抗人saa兔多抗、抗人白蛋白兔多抗或兔抗人dd抗体。
34.根据本发明,所述胶乳增强免疫比浊法试剂包括包被抗原检测抗体的胶乳增强免疫比浊法试剂和包被抗体检测抗原的胶乳增强免疫比浊法试剂。
35.进一步的,包被抗原检测抗体的胶乳增强免疫比浊法试剂为抗链球菌溶血素o(aso)试剂盒。
36.进一步的,所述包被抗体检测抗原的胶乳增强免疫比浊法试剂为脂蛋白相关磷脂酶a2(lp-pla2)试剂盒或c反应蛋白(crp)试剂盒或saa试剂盒或malb试剂盒、dd试剂盒。
37.本发明的用于提高胶乳增强免疫比浊法试剂检测准确度的方法和胶乳增强免疫比浊法试剂,其有益效果是:可以改善检测的临床相关性,提高胶乳增强免疫比浊法试剂的
准确性,可以广泛应用于各项胶乳免疫比浊检测项目中,为优化临床相关性提供两种优化方向(1、如果是包被抗体类项目,需成倍增加抗体的投料量;2、如果是包被抗原类项目,需成倍减少抗原的投料量)。
附图说明
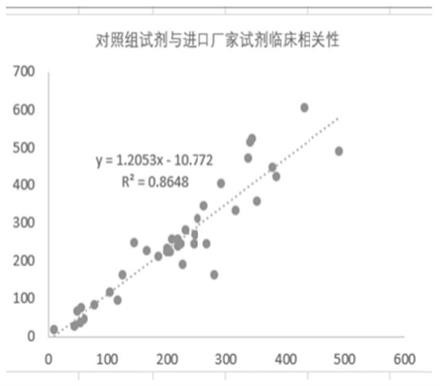
38.图1为对照组试剂与进口厂家试剂临床相关性。
39.图2为改变r1的缓冲体系与进口厂家临床比对。
40.图3为改变r1的盐浓度与进口厂家临床比对。
41.图4为改变r1的peg浓度与进口厂家临床比对。
42.图5为优化抗原聚合度与进口厂家试剂临床比对。
43.图6为微调加入量试剂与进口厂家临床比对。
44.图7为2倍抗原包被量与进口厂家临床相关性。
45.图8为3倍抗原包被量与进口厂家临床相关性。
46.图9为1/2倍抗原包被量与进口厂家临床相关性。
47.图10为1/3倍抗原包被量与进口厂家临床相关性。
48.图11为1/4倍抗原包被量与进口厂家临床相关性。
49.图12为1/5倍抗原包被量与进口厂家临床相关性。
50.图13为更换偶联工艺试剂与进口厂家试剂临床比对。
51.图14为对照组数据与进口厂家临床比对。
52.图15为改变r1的缓冲体系与进口厂家临床比对。
53.图16为微调r2中抗体的加入量与进口厂家临床比对。
54.图17为调整r2的偶联工艺与进口厂家试剂临床比对。
55.图18为2倍抗体试剂与进口厂家临床比对。
56.图19为4倍抗体试剂与进口厂家临床比对。
57.图20为1/2倍抗体试剂与进口厂家临床比对。
58.图21为1/4倍抗体试剂与进口厂家临床比对。
59.图22为对照组与参比试剂临床比对。
60.图23为改变r1的peg浓度与参比试剂临床比对。
61.图24为改变盐离子浓度与参比试剂临床比对。
62.图25为改变抗原聚合度与参比试剂临床比对。
63.图26为4倍抗体包被量与参比试剂临床比对。
64.图27为3倍抗体包被量与参比试剂临床比对。
65.图28为3倍抗体包被量与参比试剂临床比对。
66.图29为实施例4的对照组与参比试剂临床比对。
67.图30为改变r1的阻断剂与参比试剂临床比对。
68.图31为改变r1的盐离子浓度与参比试剂临床比对。
69.图32为1/2倍抗体包被量与参比试剂临床比对。
70.图33为2倍抗体包被量与参比试剂临床比对。
71.图34为4倍抗体包被量与参比试剂临床比对。
72.图35为8倍抗体包被量与参比试剂临床比对。
73.图36为实施例5的对照组与参比试剂临床比对。
74.图37为改变r1的缓冲液与参比试剂临床比对。
75.图38为加入01%tw-20试剂与参比试剂临床比对。
76.图39为1/2倍抗体包被量与参比试剂临床比对。
77.图40为2倍抗体包被量与参比试剂临床比对。
78.图41为3倍抗体包被量与参比试剂临床比对。
79.图42为4倍抗体包被量与参比试剂临床比对。
80.图43为6倍抗体包被量与参比试剂临床比对。
81.图44为实施例5的对照组与参比试剂临床比对。
82.图45为1/6倍抗体包被量与参比试剂临床比对。
83.图46为1/4倍抗体包被量与参比试剂临床比对。
84.图47为1/2倍抗体包被量与参比试剂临床比对。
85.图48为2倍抗体包被量与参比试剂临床比对。
86.图49为3倍抗体包被量与参比试剂临床比对。
87.图50为4倍抗体包被量与参比试剂临床比对。
88.图51为6倍抗体包被量与参比试剂临床比对。
具体实施方式
89.下面将对本发明实施例中的技术方案进行清楚、完整地描述,现所描述的实施例只是本发明部分实施例,并不是全部的实施例,以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或厂商提供的条件进行。
90.现有的r2试剂的制备过程中的蛋白偶联过程中,按照不同粒径微球的单层包被量投入蛋白,见表1。
91.表1不同粒径微球的单层包被量投入蛋白
92.微球粒径100nm200nm300nm400nm0.5wt%1ml0.7mg0.4mg0.3mg0.2mg
93.实施例1aso项目
94.本实施例采用抗链球菌溶血素o(aso)试剂盒,aso为包被抗原检测抗体的项目。
95.1、抗链球菌溶血素o(aso)试剂盒:r1试剂、r2试剂、目标蛋白校准品。其中,
96.r1试剂:50mm ph 7.5pbs缓冲液,含0.9%氯化钠,2.5%peg,0.1%bsa,0.1%p300,0.01%tx-100,室温备用。
97.目标蛋白标准品(蛋白稀释液):50mm ph 7.5tris缓冲液,0.9%氯化钠,0.1%edta-2na,0.4%bsa,0.1%p300,0.01%tx-100,室温备用。
98.目标蛋白:抗链球菌溶血素o蛋白,2mg/ml。
99.r2试剂的制备过程如下:
100.(1)活化缓冲液、偶联缓冲液、封闭液的配置
101.a、配制活化缓冲液:50mm ph 7.0,含0.1%v/v tw-20的pbs缓冲液,室温备用。
102.b、配制pbs偶联缓冲液:50mm ph 9.0,含0.1%v/v tw-20的pbs缓冲液,室温备用。
103.c、配制封闭液:50mm ph 9.0,含5g/l脱脂牛奶,0.1%v/v tw-20,0.05%v/v p300的pbs缓冲液,室温备用。
104.(2)微球活化,本实验使用日本jsr公司胶乳,故而免去清洗步骤,0.1ml微球加入0.9ml活化缓冲液,均匀混合,称取5mg nhs(n-羟基琥珀酰亚胺),3mg edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),取上述1ml的活化缓冲液溶解后,取100μl,加入微球稀释液中,室温下持续搅拌20min。
105.(3)活化后的清洗,将上述活化后的胶乳12000rpm离心30min,去上清,加入1ml偶联缓冲液,复溶,获得乳胶液,备用。
106.(4)蛋白偶联,按照不同粒径微球的单层包被量投入蛋白。取抗链球菌溶血素o蛋白(aso)60μl(12mg/ml),加入到上述pbs偶联缓冲液中,混合均匀后,逐滴加入到磁力搅拌的胶乳液中。37℃持续搅拌5h。
107.(5)封闭,在上述胶乳液中加入500μl上述封闭液,37℃,持续搅拌3h。封闭结束,将封闭后的胶乳液12000rpm离心20min,去上清,加入5ml贮存液,在细胞破碎仪上进行超声分散,直到胶管出现透亮,分散均匀。
108.(6)老化,52℃,放置16h后,r2试剂制备完成。
109.2、上机测试
110.仪器:日立7180,参数设置,样本量3μl,240μl前述的r1试剂,60μl r2,570/800nm,双波长,两点终点法,多点非线性spline,18-34读点计算
△
abs(吸光度变化值)
111.3、参比体系,贝克曼image 800特种
112.蛋白分析仪;贝克曼原装试剂aso(m701161)
113.4、同济医院提供100例住院患者血清,其中男性50例,女性50例,平均年龄30岁。100例样本中有40例有病,30例健康,30例重症。
114.5、单一变量实验
115.本实施例的条件均为单一变量,本实施例通过对单一变量进行一系列的验证重复实验。
116.单一变量验证过程:
117.(1)对照组(参比试剂盒),结果如图1所示。
118.(2)改变r1的缓冲体系,我们选择了市面上比较通用的缓冲液,以下几例,50mm hepes缓冲液ph7.5,50mm gly(甘氨酸缓冲液)ph 7.5,50mm mopso缓冲液ph 7.5,50mm tris缓冲液ph,50mm mes缓冲液ph 7.5,五组缓冲液(图2列举的只是hepes缓冲液的代表性结果),结果如图2所示。结果显示,通过r1的缓冲体系,试剂与参比试剂的临床相关性从0.87分别降低到0.72、0.76、0.77、0.68、0.58。
119.(3)改变r1的盐浓度,分别为0.45%,0.9%,1.35%,1.8%,2.7%,五组(r1中盐浓度拉梯度。结果显示,通过改变r1的盐浓度,试剂与参比试剂的临床相关性从0.87分别降低到0.77、0.78、0.87、0.89、0.81。图3列举的只是0.45%的代表性结果。
120.(4)改变r1的peg浓度,r1中peg浓度拉梯度分别为1%,1.5%,2.0%,2.5%,四组。结果显示,通过改变r1的peg浓度,试剂与参比试剂的临床相关性从0.87降低到0.84,0.78、0.67、0.79。图4列举的只是2.5%的代表性结果。
121.(5)抗原聚合度优化组,分别设置不同浓度抗原,48mg/ml,24mg/ml,6mg/ml,4mg/ml,3mg/ml,2.4mg/ml。结果显示,通过改变抗原聚合度,试剂与参比试剂的临床相关性从0.87降低到0.82,0.68,0.89,0.78,0.77,0.79。图4列举的只是2.4mg/ml的代表性结果。
122.(6)微调抗原加入量:抗原投料量为正常投料量的
±
20%幅度内调整,分别加入9.6mg/ml,10.8mg/ml,13.2mg/ml,三组。结果显示,试剂与参比试剂的临床相关性从0.87分别降低到0.82,0.78,0.76。图6列举的只是13.2mg/ml的代表性结果。
123.(7)2倍抗原投料量组,结果如图7所示。结果显示,试剂与参比试剂的临床相关性从0.87降低到0.79。
124.(8)3倍抗原投料量组,结果如图8所示。结果显示,试剂与参比试剂的临床相关性从0.87降低到0.53。
125.(9)抗原投料量减至1/2,结果如图9所示。结果显示,通过对半减少抗原的包被量,试剂与参比试剂的临床相关性从0.87优化到0.95。
126.(10)抗原投料量减至1/3,结果如图10所示。结果显示,试剂与参比试剂的临床相关性为0.87。
127.(11)抗原投料量减至1/4,结果如图11所示。结果显示,试剂与参比试剂的临床相关性为0.86。
128.(12)抗原投料量减至1/5,结果如图12所示。结果显示,试剂与参比试剂的临床相关性为0.83。
129.(13)改变r2的偶联工艺,将活化剂的用量,将edc的用量由原来的3mg提升到6mg,结果如图13所示。结果显示,试剂与参比试剂的临床相关性为0.85。
130.结果显示:aso项目在与参比试剂临床相关性不好的情况下,进行了r1的相关关键物料的调整,进行r2中抗原投料量的微调,进行了抗原聚合度的调整,以及进行了r2偶联工艺的调整,发现均无较为明显的效果。
131.在进行r2中抗原投料量的大幅度调整时,发现减少抗原投料量至1/2时,试剂与进口厂家试剂盒的临床相关性有了非常明显的提高,r2从0.8648提高至0.9511,减少至1/3,1/4时相关性r2没有变得更好,反而有变差的趋势。
132.实施例2血清淀粉样蛋白a(saa)项目
133.saa项目为包被抗体检测抗原的项目。
134.1.配制蛋白稀释液(目标蛋白校准品):50mm ph 7.5tris缓冲液,含0.9%氯化钠,0.1%edta-2na,0.4%bsa,0.1%p300,0.01%tx-100,室温备用。
135.2.配制活化缓冲液:50mm ph 7.0,含0.1%v/v tw-20的pbs缓冲液,室温备用。
136.3.配制偶联缓冲液:50mm ph 9.0,含0.1%v/v tw-20的pbs缓冲液,室温备用。
137.4.配制封闭液:50mm ph 9.0,含5g/l脱脂牛奶,0.1%v/v tw-20,0.05%v/v p300的pbs缓冲液,室温备用。
138.5.反应缓冲液(r1试剂):50mm ph 7.5pbs缓冲液,含0.9%氯化钠,2.5%peg,0.1%bsa,0.1%p300,0.01%tx-100,室温备用。
139.校准品母液:重组人源血清淀粉样蛋白a(saa),3mg/ml。
140.6、r2试剂的制备
141.(1)微球活化,本实验使用日本jsr公司胶乳,故而免去清洗步骤,0.1ml微球加入
0.9ml活化缓冲液,均匀混合,称取5mg nhs(n-羟基琥珀酰亚胺),3mg edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),取上述1ml的活化缓冲液溶解后,取100μl,加入微球稀释液中,室温下持续搅拌20min。
142.(2)活化后的清洗,将上述活化后的胶乳12000rpm离心30min,去上清,加入1ml偶联缓冲液,复溶,获得胶乳液,备用。
143.(3)蛋白偶联,按照不同粒径微球的单层包被量投入蛋白。取抗人saa兔多抗120μl(6mg/ml),加入到上述pbs偶联缓冲液中,混合均匀后,逐滴加入到磁力搅拌的胶乳液中。37℃持续搅拌5h。
144.(4)封闭,在上述胶乳液中加入500μl上述封闭液,37℃,持续搅拌3h。封闭结束,将封闭后的胶乳液12000rpm离心20min,去上清,加入5ml贮存液,在细胞破碎仪上进行超声分散,直到胶管出现透亮,分散均匀。
145.(5)老化,52℃,放置16h后,r2试剂制备完成。
146.7、上机测试
147.仪器:日立7180,参数设置,样本量3μl,240μl前述反应缓冲液,60μlr2,570/800nm,双波长,两点终点法,多点非线性spline,18-34读点计算
△
abs(吸光度变化值)。
148.8、选择西门子赋值样本100例,50例男性,50例女性,平均年纪30岁,其中50例健康人,30例轻症,20例重症。
149.9、本实施例的条件均为单一变量。本实施例通过对单一变量进行一系列的验证重复实验。
150.单一变量验证过程:
151.(1)参比体系,选择西门子赋值样本直接测试实验组试剂。结果如图14所示。
152.(2)改变r1的缓冲体系:分别更换成50mmgly 7.0、50mmmopso 7.0和50mmhepes 7.0,相关系数从0.88分别降低到0.76,0.75,0.77。图15列举的只是50mm gly ph7.0缓冲液的代表性结果。
153.(3)微调抗体的加入量,减少20%与增加20%(抗体投料量为正常投料量的
±
20%幅度内调整,相关系数从0.88降低0.76、0.79。结果如图16所示。
154.(4)改变r2的活化剂edc的量,由原来的3mg提升至4mg。结果如图17所示。
155.(5)2倍抗体投料量组,结果显示,通过成倍增加抗体的包被量,试剂与竞品试剂的临床相关性从0.88优化到0.98。结果如图18所示。
156.(6)4倍抗体投料量组,结果如图19所示。
157.(7)1/2抗体投料量组,结果如图20所示。
158.(8)1/4抗体投料量组,结果如图21所示。
159.结论:saa项目为包被抗体检测抗原类项目,当与参比试剂盒临床相关性不好的时候,改变r1的配方,微调r2关键组分的加入量,改变r2的偶联工艺均无较明显的效果。当成倍增加抗体的投料量,试剂与进口试剂的相关性有明显的提升,r2从0.87提升至0.98左右,继续成倍增加抗体投料量时无较明显的优化效果,甚至临床相关性有变差的趋势。
160.实施例3尿微量白蛋白(malb)项目(免疫比浊法)
161.malb项目为包被抗体检测抗原的项目。
162.1.配制蛋白稀释液(目标蛋白标准品):50mm ph 7.5tris缓冲液,含0.9%氯化钠,
0.1%edta-2na,0.4%bsa,0.1%p300,0.01%tx-100,室温备用。
163.2.配制活化缓冲液:50mm ph 7.0,含0.1%v/v tw-20的pbs缓冲液,室温备用。
164.3.配制偶联缓冲液:50mm ph 9.0,含0.1%v/v tw-20的pbs缓冲液,室温备用。
165.4.配制封闭液:50mm ph 9.0,含5g/l脱脂牛奶,0.1%v/v tw-20,0.05%v/v p300的pbs缓冲液,室温备用。
166.5.反应缓冲液(r1试剂):50mm ph 7.5pbs缓冲液,含0.9%氯化钠,2.5%peg,0.1%bsa,0.1%p300,0.01%tx-100,室温备用。
167.目标蛋白标准品:人血清白蛋白(has)高值,20g/l
168.6、r2试剂的制备
169.(1)微球活化,本实验使用日本jsr公司胶乳,故而免去清洗步骤,0.1ml微球加入0.9ml活化缓冲液,均匀混合,称取5mg nhs(n-羟基琥珀酰亚胺),3mg edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),取上述1ml的活化缓冲液溶解后,取100μl,加入微球稀释液中,室温下持续搅拌20min。
170.(2)活化后的清洗,将上述活化后的胶乳12000rpm离心30min,去上清,加入1ml偶联缓冲液,复溶,获得胶乳液,备用。
171.(3)蛋白偶联,按照不同粒径微球的单层包被量投入蛋白,投入一定量的抗人白蛋白兔多抗120μl(6mg/ml),加入到上述pbs偶联缓冲液中,混合均匀后,逐滴加入到磁力搅拌的胶乳液中。37℃持续搅拌5h。
172.(4)封闭,在上述胶乳液中加入500μl上述封闭液,37℃,持续搅拌3h。封闭结束,将封闭后的胶乳液12000rpm离心20min,去上清,加入5ml贮存液,在细胞破碎仪上进行超声分散,直到胶管出现透亮,分散均匀。
173.(5)老化,52℃,放置16h后,r2试剂制备完成。
174.7、上机测试
175.仪器:日立7180,参数设置,样本量3μl,240μl前述反应缓冲液,60μlr2,570/800nm,双波长,两点终点法,多点非线性spline,18-34读点计算
△
abs(吸光度变化值)
176.8、市场上购买100例奥瑞雅赋值尿样本
177.100例住院患者尿液,其中男性50例,女性50例,平均年龄30岁。100例样本中有40例有病,30例健康,30例肾病重症。
178.9、本实施例的条件均为单一变量。本实施例通过对单一变量进行一系列的验证重复实验。
179.单一变量验证过程:
180.(1)参比体系,选择奥瑞雅赋值尿样本直接测试实验组试剂。结果如图22所示。
181.(2)更改r1中促聚剂浓度,分别设置为0.5%、1%、2%、3%、5%。结果显示,通过改变r1的peg浓度,试剂与参比试剂的临床相关性从0.81分别降低到0.71、0.72、0.76。图23列举的只是0.5%peg的代表性结果。
182.(3)改变r1中盐离子浓度:将r1的氯化钠浓度由1mol/l分别换成1.5mol/l、0.8mol/l、0.2mol/l。结果显示,通过改变r1的盐离子浓度,试剂与参比试剂的临床相关性从0.81分别降低到0.67、0.68、0.65。图24列举的只是其中0.8mol/l的结果。
183.(4)分别设置不同浓度抗原,分别设置为12mg/ml,6mg/ml,3mg/ml,1mg/ml。结果显
示,通过改变抗原聚合度,试剂与参比试剂的临床相关性从0.81分别降低到0.82,0.68,0.89,0.78。图25列举的只是2.4mg/ml的代表性结果。
184.(5)2倍抗体投料量组,结果如图26所示。结果显示,通过成倍增加抗体的包被量,试剂与竞品试剂的临床相关性从0.81优化到0.9953左右。
185.(6)3倍抗体投料量组,结果如图27所示。结果显示,通过成倍增加抗体的包被量,试剂与竞品试剂的临床相关性从0.81优化到0.9929左右。
186.(7)4倍抗体投料量组,结果如图28所示。结果显示,通过成倍增加抗体的包被量,试剂与竞品试剂的临床相关性从0.81优化到0.9879左右。
187.结果显示,两种试剂盒检测结果的相关系数r=0.9002,线性回归方程,根据美国临床实验室标准化协会(clsi)文件要求(r>0.975),本发明测定试剂盒不满足预期要求。但在加入多倍抗体后,相关系数得到明显提升,尤其是2倍与3倍的抗体投料量,均满足该文件要求,由此可见,运用本发明制备的试剂盒的准确性良好。
188.实施例4d-二聚体(dd)试剂盒(胶乳增强免疫比浊法)
189.dd项目为包被抗体检测抗原的项目。
190.1.配制蛋白稀释液(目标蛋白标准品):50mm ph 7.5tris缓冲液,含0.9%氯化钠,0.1%edta-2na,0.4%bsa,0.1%p300,0.01%tx-100,室温备用。
191.2.配制活化缓冲液:50mm ph 7.0,含0.1%v/v tw-20的pbs缓冲液,室温备用。
192.3.配制偶联缓冲液:50mm ph 9.0,含0.1%v/v tw-20的pbs缓冲液,室温备用。
193.4.配制封闭液:50mm ph 9.0,含5g/l脱脂牛奶,0.1%v/v tw-20,0.05%v/v p300的pbs缓冲液,室温备用。
194.5.反应缓冲液(r1试剂):50mm ph 7.5pbs缓冲液,含0.9%氯化钠,2.5%peg,0.1%bsa,0.1%p300,0.01%tx-100,室温备用。
195.目标蛋白校准品:d二聚体高值血浆提纯,56mg/l
196.6、r2试剂的制备
197.(1)微球活化,本实验使用日本jsr公司胶乳,故而免去清洗步骤,0.1ml微球加入0.9ml活化缓冲液,均匀混合,称取5mg nhs(n-羟基琥珀酰亚胺),3mg edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),取上述1ml的活化缓冲液溶解后,取100μl,加入微球稀释液中,室温下持续搅拌20min。
198.(2)活化后的清洗,将上述活化后的胶乳12000rpm离心30min,去上清,加入1ml偶联缓冲液,复溶,获得乳胶液,备用。
199.(3)蛋白偶联,按照不同粒径微球的单层包被量投入蛋白,取兔抗人dd抗体30μl(24mg/ml),加入到上述pbs偶联缓冲液中,混合均匀后,逐滴加入到磁力搅拌的胶乳液,37℃持续搅拌5h。
200.(4)封闭,在上述胶乳液中加入500μl上述封闭液,37℃,持续搅拌3h。封闭结束,将封闭后的胶乳液12000rpm离心20min,去上清,加入5ml贮存液,在细胞破碎仪上进行超声分散,直到胶管出现透亮,分散均匀。
201.(5)老化,52℃,放置8h后,制备完成。
202.7、上机测试
203.仪器:日立7180,参数设置,样本量12μl,180μl前述反应缓冲液,60μl r2,570/
800nm,双波长,两点终点法,多点非线性spline,18-34读点计算
△
abs(吸光度变化值)
204.8、参比体系dd积水赋值样品
205.dd项目为包被抗体检测抗原的项目,与参比试剂盒临床相关性较差,r2只有0.815左右,通过调试r1阻断剂、盐离子浓度等等均无明显的效果。
206.9、本实施例的条件均为单一变量。本实施例通过对单一变量进行一系列的验证重复实验。
207.单一变量验证过程:
208.(1)参比体系,选择积水赋值样本直接测试实验组试剂。结果如图29所示。
209.(2)更改r1中阻断剂浓度,分别设置浓度为0.1%、0.2%、0.3%、0.4%,试剂与参比试剂的临床相关性从0.815分别升高到0.99、0.98、0.97、0.98。图30列举的只是其中0.1%的代表性结果。
210.(3)改变r1中盐离子浓度:将氯化钠浓度由1mol/l换成0.8mol/l、0.5mol/l和0.2mol/l,试剂与参比试剂的临床相关性从0.815分别降低到0.67、0.68、0.78。图31列举的只是其中0.5mol/l的结果。
211.(4)1/2抗体投料量组,结果如图32所示。结果显示,试剂与参比试剂的临床相关性从0.815降低到0.2944。
212.(5)2倍抗体投料量组,结果如图33所示。结果显示,通过成倍增加抗体的包被量,试剂与参比试剂的临床相关性从0.815优化到0.9983。
213.(6)4倍抗体投料量组,结果如图34所示。结果显示,试剂与参比试剂的临床相关性从0.815优化到0.9982。
214.(7)8倍抗体投料量组,结果如图35所示。结果显示,试剂与参比试剂的临床相关性从0.815优化到0.9471。
215.结果显示,通过成倍投入抗体量能使检测结果的相关系数r提升至0.9999,同时加入0.1%的阻断剂也可以达到目的。线性回归方程,根据美国临床实验室标准化协会(clsi)文件要求(r>0.975),此dd测定试剂盒和市售进口试剂盒临床一致性良好。由此可见,此试剂盒的准确性得到优化。
216.实施例5c反应蛋白(crp)试剂盒(胶乳增强免疫比浊法)
217.1、按照胶乳试剂制备工艺制备出一款适用于临床诊断的crp试剂盒,并对此试剂盒的基本性能进行了评价。
218.2、上机测试
219.仪器:日立7180,参数设置,样本量3μl,250μl反应缓冲液(50mm ph 7.5pbs缓冲液,含0.9%氯化钠,2.5%peg,0.1%bsa,0.1%p300,0.01%tx-100),50μlr2,540,单波长,两点终点法,多点非线性spline,18-34读点计算
△
abs(吸光度变化值)
220.3、参比体系,日本生研原装crp试剂盒,生研crp校准品及质控品。
221.协和医院提供100例住院患者血清,其中男性50例,女性50例,平均年龄28岁。100例样本中有40例轻微炎症,30例健康,30例重症。用本发明的试剂盒和市售的日本生研试剂盒分别对样本重复测定2次,分别计算平均值,对100例样本检测结果进行线性回归分析,计算两种试剂盒检测结果的相关系数,如图36。
222.结果显示,两种试剂盒检测结果的相关系数r=0.8734,线性回归方程,根据美国
临床实验室标准化协会(clsi)文件要求(r>0.975),此crp测定试剂盒和市售进口试剂盒临床一致性不好。由此可见,此试剂盒的准确性不佳。
223.4、本实施例的条件均为单一变量。本实施例通过对单一变量进行一系列的验证重复实验。
224.单一变量验证过程:
225.(1)改变r1的缓冲体系,分别更改为50mm hepes 7.5、50mm gly 7.5、50mm mopso 7.5、50mm pbs 7.5。试剂与参比试剂的临床相关性从0.7627分别调整到0.7345、0.8635、0.7643、0.8426。图37列举的只是50mm pbs 7.5的代表性结果。
226.(2)改变r1的分散剂组分:更换不同的分散剂种类,将原来的1%tw-20换成0.1%tx-100、0.2%tx-100、0.4%tx-100,试剂与参比试剂的临床相关性从0.7627分别升高到0.9153、0.8983、0.8721。图38列举的只是其中0.1%tx-100的代表性结果。
227.(3)1/2倍抗体投料量组,结果如图39所示。结果显示,试剂与参比试剂的临床相关性从0.7627优化到0.8516。
228.(4)2倍抗体投料量组,结果如图40所示。结果显示,试剂与参比试剂的临床相关性从0.7627优化到0.9966。
229.(5)3倍抗体投料量组,结果如图41所示。结果显示,试剂与参比试剂的临床相关性从0.7627优化到0.982。
230.(6)4倍抗体投料量组,结果如图42所示。结果显示,试剂与参比试剂的临床相关性从0.7627优化到0.9273。
231.(7)6倍抗体投料量组,结果如图43所示。结果显示,试剂与参比试剂的临床相关性从0.7627优化到0.8686。
232.结果显示,通过调试r1缓冲体系、r1分散剂组分等等均无明显的效果,当成倍增加抗体的包被量时,试剂与参比试剂的临床相关性有明显提升,尤其是2倍投料时,从0.7627优化到了0.99左右。
233.实施例6脂蛋白相关磷脂酶a2(lp-pla2)项目(胶乳增强免疫比浊法)
234.1、按照胶乳试剂制备工艺制备出一款适用于临床诊断的lp-pla2试剂盒,并对此试剂盒的基本性能进行了评价。
235.2、上机测试
236.3、参比体系,雅培(abbott)生化分析仪型号:architect c16000;德赛脂蛋白相关磷脂酶a2测定试剂盒(连续监测法),与之成套的校准品及质控。
237.中南医院提供50例住院患者血清,其中男性20例,女性30例,平均年龄30岁。50例样本中有15例轻微炎症,20例健康,15例重症。用本发明的试剂盒和市售的德赛试剂盒分别对样本重复测定2次,分别计算平均值,对50例样本检测结果进行线性回归分析,计算两种试剂盒检测结果的相关系数,如图44所示。
238.结果显示,两种试剂盒检测结果的相关系数r=0.8734,线性回归方程,根据美国临床实验室标准化协会(clsi)文件要求(r>0.975),此lp-pla2测定试剂盒和市售进口试剂盒临床一致性不好。由此可见,此试剂盒的准确性不佳。
239.4、本实施例的条件均为单一变量。本实施例通过对单一变量进行一系列的验证重复实验。
240.单一变量验证过程:
241.(1)1/6倍抗体投料量组,结果如图45所示。结果显示,试剂与参比试剂的临床相关性从0.7727下降到0.5074。
242.(2)1/4倍抗体投料量组,结果如图46所示。结果显示,试剂与参比试剂的临床相关性从0.7727下降到0.7052。
243.(3)1/2倍抗体投料量组,结果如图46所示。结果显示,试剂与参比试剂的临床相关性从0.7727上升到0.8461。
244.(4)2倍抗体投料量组,结果如图48所示。结果显示,试剂与参比试剂的临床相关性从0.7727上升到0.9963。
245.(5)3倍抗体投料量组,结果如图49所示。结果显示,试剂与参比试剂的临床相关性从0.7727上升到0.9943。
246.(6)4倍抗体投料量组,结果如图50所示。结果显示,试剂与参比试剂的临床相关性从0.7727上升到0.9955。
247.(7)6倍抗体投料量组,结果如图51所示。结果显示,试剂与参比试剂的临床相关性从0.7727上升到0.9542。
248.结果显示,通过调试抗体量,当成倍减少抗体量时,试剂与参比试剂的临床相关性明显变差,当成倍增加抗体的包被量时,试剂与参比试剂的临床相关性有明显提升,尤其是2倍投料时,从0.7727优化到了0.99左右。
249.以上所述仅是本发明的实施方式的举例,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1