一种检测乳腺癌组织间隙液中标志物的微针及其制备方法
1.本发明涉及生物检测领域,尤其涉及一种检测乳腺癌组织间隙液中标志物的微针及其制备方法。
背景技术:
2.即时检测(poct)技术非常适合公共筛查和个性化医疗保健纵向监测,开发微创、低成本和高度自动化的体液采样方法对于poct检测至关重要。目前,血液因其丰富的生物学信息成为诊断和跟踪疾病进展的常规手段,但是静脉采血会导致组织损伤、感染以及引起患者不适,因此,寻找可以提供与个人健康状况息息相关的血液采样替代方法正越来越引起人们的关注。
3.皮肤间隙液(isf)由血液经过毛细血管过滤而得到,其中的小分子、电解质和蛋白质的数量与血浆中的成分相似,同时isf充当细胞/癌细胞和循环系统之间的中间体,所以isf中的一些生物标志物是独一无二的。利用微针进行isf采样的优点是穿透深度大大减小,同时避免激活疼痛感知神经元,是一种无创监测健康相关重要参数的新兴方法。皮肤以及皮肤组织间隙液所携带的与健康相关的信息较多,微针(mns)具有以非侵入方式获取这些信息的重要特征。乳腺癌是全世界女性死亡率最高的恶性肿瘤,对于乳腺癌检查,乳房周围的组织液可以实时反映癌细胞的状态。流行病学和实验室研究证明mirna在乳腺癌中出现异常表达。金属离子是健康所必需的,在癌症形成和转移的过程往往伴随着血管生成,而cu
2+
在血管的形成中起着重要的作用。所以,开发能够在isf中同步检测mirna和cu
2+
的方法对于乳腺癌监测具有重要的临床价值。
4.目前制备的水凝胶微针主要用于给药,通过微针可以克服皮肤角质层层的屏障作用,极大地提高药物递送效率,但是用于提取生物标志物的微针却为数不多。文献1(al sulaiman,d.hydrogel-coated microneedle arrays for minimally invasive sampling and sensing of specific circulating nucleic acids from skin interstitial fluid.acs nano 2019,13,9620-9628.)报道,利用水凝胶涂层微针,可以从皮肤isf中采取和分离特定的mirna生物标志物,同时能够原位检测捕获的mirna,但是捕获的生物标志物后续依然需要特定的分离步骤和检测仪器。文献2(philip r,miller.extraction and biomolecular analysis of dermal interstitial fluid collected with hollow microneedles.commun biol 2018,1,173.)报道,首次利用中空微针实现了isf中外泌体的分离和表征,但是微针的材料是不锈钢,制作过程繁琐且需要昂贵的仪器,并且会造成生物材料医用垃圾。文献3(chang,h.a swellable microneedle patch to rapidly extract skin interstitial fluid for timely metabolic analysis.adv.mater.2017,29(37):1702243.)报道,利用多聚物水凝胶微针可以提取isf中的葡萄糖,以实现个人医疗保健监测,但是存在采样量少,力学性能不足等缺点。上述制备的微针,存在力学性能不足,采样量较少,需要的设备昂贵且复杂,会造成格外的医疗垃圾等问题,除了给药之外,即使进行isf采样,也需要后续的分离监测步骤,不适合poct的应用,并且并未对乳腺癌的生物标志物实
现同步检测。
5.因此,现有技术还有待于改进和发展。
技术实现要素:
6.鉴于上述现有技术的不足,本发明的目的在于提供一种检测乳腺癌组织间隙液中标志物的微针及其制备方法,旨在解决现有微针机械强度不足、吸水膨胀率较低以及无法实时检测乳腺癌标志物的问题。
7.本发明的技术方案如下:
8.一种检测乳腺癌组织间隙液中标志物的微针的制备方法,其中,包括步骤:
9.将甲基丙烯酸化透明质酸溶液和甲基丙烯酸化明胶溶液按照预定体积比混合,制得预聚体溶液;
10.提供氨基化碳量子点以及与乳腺癌中目标mirna发生cha反应的h1,h2溶液;
11.将所述氨基化碳量子点和h1,h2溶液以及光固化剂加入到所述预聚体溶液中并混合,得到复合溶液;
12.将所述复合溶液加入到预制的聚二甲基硅氧烷微针阴模中,经过光照固化处理后,制得检测乳腺癌组织间隙液中标志物的微针。
13.所述检测乳腺癌组织间隙液中标志物的微针的制备方法,其中,所述甲基丙烯酸化透明质酸溶液的制备包括步骤:
14.向透明质酸水溶液中加入甲基丙烯酸酐,调节ph为8-10,室温反应12-24h后,制得所述甲基丙烯酸化透明质酸溶液。
15.所述检测乳腺癌组织间隙液中标志物的微针的制备方法,其中,所述甲基丙烯酸化明胶溶液的制备包括步骤:
16.向明胶水溶液中加入甲基丙烯酸酐中,反应2-4h后加入pbs终止反应,制得所述甲基丙烯酸化明胶溶液。
17.所述检测乳腺癌组织间隙液中标志物的微针的制备方法,其中,所述甲基丙烯酸化透明质酸溶液和甲基丙烯酸化明胶溶液的体积比为1:1-10:3。
18.所述检测乳腺癌组织间隙液中标志物的微针的制备方法,其中,所述氨基化碳量子点的制备包括步骤:
19.将柠檬酸和聚乙烯亚胺溶解在去离子水中,并经过超声处理后形成均匀的混合溶液;
20.将所述混合溶液置于水热反应釜中,在180-250℃条件下加热2-4h,然自然冷却至室温,得到氨基化碳量子点。
21.所述检测乳腺癌组织间隙液中标志物的微针的制备方法,其中,所述聚二甲基硅氧烷微针阴模的制备包括步骤:
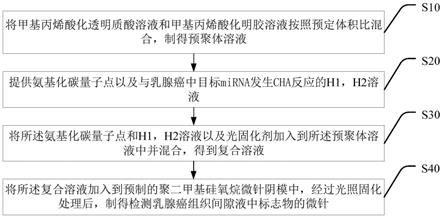
22.将聚二甲基硅氧烷和固化剂混合,将混合液浇筑在金属商业微针模板表面,抽真空去除气体中的气泡;
23.将浇筑了混合液的金属商业微针模板放入烘箱中进行加热固化,冷却后将固化的聚二甲基硅氧烷与金属商业微针模板分离,得到聚二甲基硅氧烷微针阴模。
24.所述检测乳腺癌组织间隙液中标志物的微针的制备方法,其中,所述光固化剂为
苯基-2,4,6-三甲基苯甲酰基亚膦酸锂。
25.所述检测乳腺癌组织间隙液中标志物的微针的制备方法,其中,将所述复合溶液加入到预制的聚二甲基硅氧烷微针阴模中,经过光照固化处理的步骤中,所述光固化处理为蓝光照射,时间为5-15s。
26.所述检测乳腺癌组织间隙液中标志物的微针的制备方法,其中,所述乳腺癌标志物为目标mirna和cu
2+
。
27.一种检测乳腺癌组织间隙液中标志物的微针,其中,采用本发明所述制备方法制得。
28.有益效果:本发明提供了一种检测乳腺癌组织间隙液中标志物的微针的制备方法,通过将甲基丙烯酸化透明质酸溶液和甲基丙烯酸化明胶溶液以不同的体积比混合在一起制备微针,与现有单一水凝胶微针相比,既克服了现有微针机械强度不足的问题,穿透深度可达到350um,也解决了现有微针吸水膨胀率较低的问题,吸水膨胀率可达到700%;本发明还将与乳腺癌中目标mirna发生cha反应的h1,h2溶液以及响应cu
2+
的氨基化碳量子点加载到所述微针中,实现了对乳腺癌组织液中mirna和cu
2+
的原位同步检测。
附图说明
29.图1为本发明一种检测乳腺癌组织间隙液中标志物的微针的制备方法较佳实施例的流程图。
30.图2为按照不同体积比混合两种水凝胶制成复合微针的吸水膨胀率对比图。
31.图3为按照不同体积比混合两种水凝胶制成复合微针的机械性能对比图。
32.图4为体积比是meha;gelma=7:3(v/v)时的皮肤插入深度图。
33.图5为利用皮肤模型进行微针采样之后的荧光变化图。
具体实施方式
34.本发明提供一种检测乳腺癌组织间隙液中标志物的微针及其制备方法,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
35.请参阅图1,图1为本发明提供的一种检测乳腺癌组织间隙液中标志物的微针的制备方法较佳实施例的流程图,如图所示,其包括步骤:
36.s10、将甲基丙烯酸化透明质酸溶液和甲基丙烯酸化明胶溶液按照预定体积比混合,制得预聚体溶液;
37.s20、提供氨基化碳量子点以及与乳腺癌中目标mirna发生cha反应的h1,h2溶液;
38.s30、将所述氨基化碳量子点和h1,h2溶液以及光固化剂加入到所述预聚体溶液中并混合,得到复合溶液;
39.s40、将所述复合溶液加入到预制的聚二甲基硅氧烷微针阴模中,经过光照固化处理后,制得检测乳腺癌组织间隙液中标志物的微针。
40.具体来讲,由单一的甲基丙烯酸化明胶(gelma)制备的水凝胶微针机械性能较强,但是质脆,容易断裂,而且吸水膨胀率较低,这样对于采样的体积就少,不容易检测到isf中肿瘤的生物标志物;由单一的甲基丙烯酸化透明质酸(meha)制备的水凝胶微针吸水膨胀率
较大,可吸收超过自身体积10倍的溶液,但是质软,机械性能较低。
41.基于此,本发明通过将甲基丙烯酸化透明质酸溶液和甲基丙烯酸化明胶溶液以不同的体积比混合在一起制备微针,两者混合在一起经过固化处理后会形成具有双网络结构的复合水凝胶。与现有单一水凝胶微针相比,本发明制备的微针既克服了现有微针机械强度不足的问题,穿透深度可达到350um,也解决了现有微针吸水膨胀率较低的问题,吸水膨胀率可达到700%;本发明还将与乳腺癌中目标mirna发生cha反应的h1,h2溶液以及响应cu
2+
的氨基化碳量子点加载到所述微针中,实现了对乳腺癌组织液中mirna和cu
2+
的原位同步检测。也就是说,本发明可减少微针采样后的离心,检测等后续步骤,利用掩模法在微针上加载对mirna和cu
2+
的检测体系,实现原位同步检测,节省时间,提高诊断和预后的精度,适合poct。
42.在一些实施方式中,所述甲基丙烯酸化透明质酸溶液的制备包括步骤:向透明质酸水溶液中加入甲基丙烯酸酐,调节ph为8-10,室温反应12-24h后,制得所述甲基丙烯酸化透明质酸溶液。
43.在一些实施方式中,所述甲基丙烯酸化明胶溶液的制备包括步骤:向明胶水溶液中加入甲基丙烯酸酐中,反应2-4h后加入pbs终止反应,制得所述甲基丙烯酸化明胶溶液。
44.在一些实施方式中,所述甲基丙烯酸化透明质酸溶液和甲基丙烯酸化明胶溶液的体积比为1:1-10:3。在该比例范围内,制得的微针同时具有较佳的机械强度和较高的吸水膨胀率。优选地,所述甲基丙烯酸化透明质酸溶液和甲基丙烯酸化明胶溶液的体积比为7:3。
45.在一些实施方式中,所述氨基化碳量子点的制备包括步骤:将柠檬酸和聚乙烯亚胺溶解在去离子水中,并经过超声处理后形成均匀的混合溶液;将所述混合溶液置于水热反应釜中,在180-250℃条件下加热2-4h,然自然冷却至室温,得到氨基化碳量子点。
46.在一些实施方式中,所述聚二甲基硅氧烷微针阴模的制备包括步骤:将聚二甲基硅氧烷和固化剂混合,将混合液浇筑在金属商业微针模板表面,抽真空去除气体中的气泡;将浇筑了混合液的金属商业微针模板放入烘箱中进行加热固化,冷却后将固化的聚二甲基硅氧烷与金属商业微针模板分离,得到聚二甲基硅氧烷微针阴模。
47.在一些实施方式中,当所述光固化剂为苯基-2,4,6-三甲基苯甲酰基亚膦酸锂时,将所述复合溶液加入到预制的聚二甲基硅氧烷微针阴模中,经过蓝光照射5-15s后,复合溶液发生固化,最后制得的微针在室温下干燥,并在使用前储存在4℃。
48.在一些实施方式中,本发明制备的微针主要用于检测乳腺癌中的两种生物标志物,即目标mirna和cu
2+
。本发明利用与乳腺癌中目标mirna发生cha反应的h1,h2溶液,以及响应cu
2+
的氨基化碳量子点对其进行检测。mirna种类繁多,在一种癌症患者体内会出现多种mirna浓度的变化,利用cha反应进行荧光检测时只需更换cha反应中的h1,h2序列即可,h1,h2序列均为根据现有技术可以制得的序列。
49.在一些实施方式中,还提供一种检测乳腺癌组织间隙液中标志物的微针,其采用本发明所述制备方法制得。
50.下面通过具体实施例对本发明做进一步的解释说明:
51.实施例1
52.步骤1.meha溶液的制备:将1g透明质酸溶于水中,缓慢滴加甲基丙烯酸酐,用5m氢
氧化钠调节ph=8-10,室温反应24h。溶液在4℃下用水透析3天以去除未反应的试剂(截留量12-14kda透析袋),冷冻干燥得到固体产物并在4℃下储存。
53.步骤2.gelma溶液的制备:将10克明胶溶解在50℃的100ml水中,搅拌至完全溶解。缓慢加入8ml甲基丙烯酸酐至明胶溶液中反应3h,接着加入300mlpbs终止反应。将溶液在4℃下用去离子水透析一周以去除未反应的试剂(截留量12-14kda透析袋)。
54.步骤3.将步骤1和步骤2所得溶液按照体积比分别为1:0、7:3、5:5和3:7不同比例混合均匀,添加0.1%(w/v)苯基-2,4,6-三甲基苯甲酰基亚膦酸锂(lap),在50℃反应1h。取1ml混合均匀的预聚体溶液加入模具中,离心(4000rmp,5min)确保溶液进入模腔,蓝光照射10s固化。最后,mns在室温下干燥,并在使用前储存在4℃。
55.步骤4.将步骤3所得微针进行吸水膨胀率测试:首先,记录干燥状态下mns的重量,记为m0,然后将mns贴剂在磷酸盐缓冲盐水(pbs,ph=7.4)中浸泡2小时。去除mns表面的所有多余水分,并记录mns贴片的重量(m
t
)。同样,记录不同浸泡时间(1、5、7、10和20分钟)后mns贴片的重量。此外,还测试了不同体积比微针的溶胀性能。结果如图2所示,单一的meha微针的吸水膨胀率最高,随着gelma的加入,吸水膨胀率呈现不同程度的下降。这是因为,gelma与meha中的羟基结合,使得meha的亲水性有所下降。
56.步骤5.将步骤3所得微针进行机械性能测试:将不同体积比例的mns贴片放置在压力传感器上,尖端朝上,以便传感器的初始位置刚好在mns的尖端上方。控制传感器的移动速度为0.05mm/s,并记录了施加的力与mns压缩之间的相关性。结果如图3所示,单一的meha微针机械性能最小,任何比例的混合微针机械性能都高于单一微针。
57.步骤6.分析步骤4和步骤5的测试结果,最终选取meha:gelma=7:3的微针作为用于组织间隙液中生物标志物微创监测乳腺癌的微针;
58.实施例2
59.步骤1.meha溶液的制备:将1g透明质酸溶于水中,缓慢滴加甲基丙烯酸酐,用5m氢氧化钠调节ph=8-10,室温反应24h。溶液在4℃下用水透析3天以去除未反应的试剂(截留量12-14kda透析袋),冷冻干燥得到固体产物并在4℃下储存。
60.步骤2.gelma溶液的制备:将10克明胶溶解在50℃的100ml水中,搅拌至完全溶解。缓慢加入8ml甲基丙烯酸酐至明胶溶液中反应3h,接着加入300mlpbs终止反应。将溶液在4℃下用去离子水透析一周以去除未反应的试剂(截留量12-14kda透析袋)。
61.步骤3.将步骤1和步骤2所得溶液按照体积比为7:3的比例混合均匀,添加0.1%(w/v)lap,在50℃反应1h。取1ml混合均匀的预聚体溶液加入模具中,离心(4000rmp,5min)确保溶液进入模腔,蓝光照射10s固化。最后,mns在室温下干燥,并在使用前储存在4℃。
62.步骤4.选取8周龄大小的balb/c雌性小鼠,使用脱毛膏将小鼠腹部毛发除去,将步骤3的微针贴片在处理过的小鼠腹部按压约5分钟,然后取出相应的皮肤区域,用4%多聚甲醛固定,最后使用苏木精&伊红(h&e)染色。结果如图4所示,微针插入皮肤深度大约为350μm,这个深度比一般微针穿透深度要大,足以穿透角质层,到达真皮层进行isf采样。
63.实施例3
64.步骤1.meha溶液的制备:将1g透明质酸溶于水中,缓慢滴加甲基丙烯酸酐,用5m氢氧化钠调节ph=8-10,室温反应24h。溶液在4℃下用水透析3天以去除未反应的试剂(截留量12-14kda透析袋),冷冻干燥得到固体产物并在4℃下储存。
65.步骤2.gelma溶液的制备:将10克明胶溶解在50℃的100ml水中,搅拌至完全溶解。缓慢加入8ml甲基丙烯酸酐至明胶溶液中反应3h,接着加入300mlpbs终止反应。将溶液在4℃下用去离子水透析一周以去除未反应的试剂(截留量12-14kda透析袋)。
66.步骤3.将步骤1和步骤2所得溶液按照体积比为7:3的比例混合均匀,得到预聚物前体溶液,将参与cha反应的h1和h2溶液添加到预聚物前体溶液中,使最终浓度为200nm;同样,将cqds溶液(w/v=1:1)也加入到预聚物前体溶液中并搅拌10分钟。将混合物分不同区域加入,离心确保装入模腔,蓝光照射10s固化。最后,mns在室温下干燥,并在使用前储存在4℃避光保存。
67.步骤4.皮肤模型制备:将新鲜猪皮用水洗涤(3次)并转移到培养皿中,分别加入100μlpbs(对照)、500nm mirna和100μm cu
2+
溶液(实验)。将皮肤样品孵育过夜。将步骤3制备mn贴片压在皮肤上取样约20分钟,并在37℃下放置2小时。结果如图5所示,与对照组相比,实验组都显示出了不同的荧光变化,说明所制备的微针可实现乳腺癌中mirna和cu
2+
的定性以及半定量检测。
68.应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1