一种组织中的药物分析方法与流程
1.本发明属于医药领域,特别涉及一种组织中的药物分析方法。
背景技术:
2.皮肤给药经皮吸收,是指药物从特殊设计的装置中释放,通过完整的皮肤吸收,进入全身血液系统的一种给药剂型,通常称为经皮给药系统或经皮治疗系统。主要特点为:
3.①
避免药物在胃肠道的灭活及肝的首关效应;
4.②
使血药浓度平稳并能较长时间保持在有效浓度范围之内;
5.③
减少药物对胃肠道的刺激性;
6.④
提高安全性,可随时停止用药。
7.皮肤的结构:皮肤由表皮、真皮和皮下脂肪组织构成。真皮及皮下组织对药物穿透的阻力很小,且微血管发达,药物由此吸收进入体循环。
8.常规皮肤涂抹给药后各层皮肤组织难以分离,需对所有皮肤组织进行纵向切片后再横向切片选取需要的部分(比如特定的选真皮层),耗费时间,取样无法精准定位到需要的皮层。皮肤涂抹给药后,纵向切片时药物易污染纵切面上的皮肤组织,此时再使用横向切片选取需要部分匀浆进行药物检测,无法判断其检测结果是否有污染部分及污染的程度,从而导致数据结果不准确。
9.除皮肤给药后分析药物分布情况外,在其他分层的组织中也需要分析药物分布情况,尤其是患有肿瘤的分层的组织。
技术实现要素:
10.为了节省实验时间,精准定位、直观观察到药物在组织中的分布情况,本发明提供一种组织中的药物分析方法。该方法采用定量全身放射性自显影技术(qwba)和组织包埋切片对离体组织中的药物分布情况进行定量分析检测。
11.在一些实施方式中,包括以下步骤:
12.s1、取用放射性标记的药物作用后的目标组织,冷冻定型;
13.s2、目标组织样品包埋;
14.s3、标准曲线用样品的制备:将
14
c-葡萄糖用血浆配置至设定浓度后,加入羧甲基纤维素钠包埋块包裹的孔中,冷冻,包埋,得到所述标准曲线用样品;
15.s4、质控样品的制备:将
14
c-葡萄糖用血浆配置至设定浓度后,加入目标组织样品所在的羧甲基纤维素钠包埋块包裹的空白孔中,冷冻,包埋,得到所述质控样品;
16.s5、切片与脱水;
17.s6、曝光与显影:曝光后,用激光扫描成像仪扫描得到放射性自显影图像;
18.s7、数据分析:使用图像分析软件对所述步骤s6得到的放射性自显影图像中的放射性浓度定量。
19.进一步地,羧甲基纤维素钠包埋块中的羧甲基纤维素钠为2.2%-3%羧甲基纤维
素钠(w/v)。优选地,为2.5%羧甲基纤维素钠(w/v)。
20.在一些实施方式中,所述步骤s7包括以下步骤:
21.s7.1、用液体闪烁计数仪测定所述标准曲线用样品的放射性浓度,得到所述标准曲线用样品的理论值;用所述图像分析软件圈选所述标准曲线用样品的单位面积灰度值与所述标准曲线用样品的理论值进行配对定量,得到标准曲线和线性回归方程式:y=a
×
x;y表示单位面积灰度值,x表示校正浓度,a表示系数;
22.s7.2、用液体闪烁计数仪测定所述质控样品的放射性浓度,得到所述质控样品的理论值;用所述图像分析软件圈选所述质控样品的单位面积灰度值,根据所述步骤s7.1得到的线性回归方程式计算,得到所述质控样品的校正浓度;
23.s7.3、标准曲线及质控样品的接受标准包括1)-3)条:1)单个所述质控样品的校正浓度与所述质控样品的理论值的偏差在可接受范围以内,则该质控样品合格;2)至少2/3的所述质控样品合格;3)标准曲线的决定系数≥0.9;所述可接受的范围为
±
15%;只有满足所述接受标准的1)-3)条时,才对所述目标组织样品用所述图像分析软件进行定量分析。在一些实施方式中,所述步骤s7还包括步骤s7.4、用所述图像分析软件圈选分析区域时,排除切片外圈非目标组织外表面的区域的放射性残留物。
24.在一些实施方式中,a为1.35030。
25.在一些实施方式中,所述目标组织为皮肤;所述步骤s1为取用所述放射性标记的药物以皮肤给药的方式作用后的所述皮肤,冷冻定型。进一步地,所述步骤s7还包括步骤s7.4、用所述图像分析软件圈选分析区域时,排除切片外圈非角质层的区域的放射性残留物。进一步地,所述步骤s1取得的皮肤样品放入干冰中冷冻定型。
26.在一些实施方式中,所述步骤s2目标组织样品包埋中将所述步骤s1中得到的冷冻定型的目标组织的纵切面朝上置于包埋容器中。进一步地,所述步骤s2目标组织样品包埋中将所述步骤s1中得到的冷冻定型的目标组织垂直置于包埋容器中,且纵切面朝上。
27.在一些实施方式中,所述步骤s3中的标准曲线的定量范围为0.5-8000nci/g。进一步地,所述步骤s3中的标准曲线的定量范围为1-8000nci/g。
28.在一些实施方式中,所述步骤s4中的质控样品的浓度包含3个梯度,分别是:所述步骤3中的标准曲线用样品的最低浓度的2-4倍(优选3倍)、所述步骤3中的标准曲线用样品的最高浓度的10%
±
2%和所述步骤3中的标准曲线用样品的最高浓度的75%
±
5%。
29.优选地,所述步骤s4中的质控样品的浓度包含3个梯度,分别是:所述步骤3中的标准曲线用样品的最低浓度的3倍、所述步骤3中的标准曲线用样品的最高浓度的10%和所述步骤3中的标准曲线用样品的最高浓度的75%。
30.在一些实施方式中,所述步骤s5中对目标组织样品所在的羧甲基纤维素钠包埋块的切片为平行于所述目标组织的纵切面进行的切片。
31.在一些实施方式中,所述步骤s7中的图像分析软件为aida图像分析软件。
32.本发明的有益效果有:
33.1、qwba的应用,避免了纵向切片后的横向切片,节省实验时间,精准定位皮肤各层结构,直观观察到药物在皮肤角质层、表皮层、真皮层、皮下组织的分布情况。对于其他组织也有类似效果。
34.2、可以直观观察到药物的分布情况,避免采集时药物污染样品而导致的样品药物
浓度虚高,避免数据失真。即可以在步骤s7.4、用图像分析软件圈选分析区域时,排除切片外圈非角质层的区域的放射性残留物,从而有效避免了采集时药物污染样品而导致的样品药物浓度虚高,避免数据失真。
35.以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
36.图1是实施例1的标准曲线。
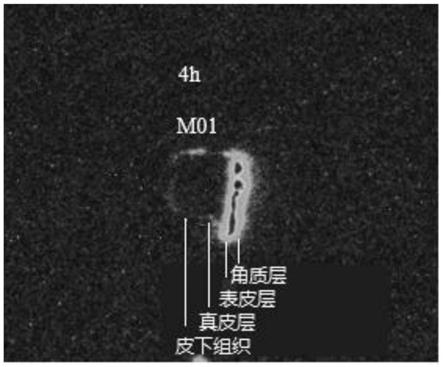
37.图2是药物在皮肤纵向切片中的放射性自显影图像。其中,m01是动物编号,这里为小型猪(minipig)01号。
具体实施方式
38.为了使发明实现的技术手段、创造特征、达成目的和功效易于明白了解,下结合具体图示,进一步阐述本发明。但本发明不仅限于以下实施的案例。
39.须知,本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。
40.下述实施例以皮肤给药检测皮肤中的药物分布为例进行进一步的说明介绍,其他组织可参照皮肤类似处理,这里不再赘述。质控样品与待测样品需位于同一个包埋块中,且需要采用与待测样品相同种类的血浆为溶剂(比如待测样品是猪的皮肤,则质控样品的溶剂需要为猪血浆),以便监控处理过程是否准确以及仪器分析的稳定性情况。
41.实施例1
42.1给药、采样:使用放射性标记的化合物(
14
c-化合物)对猪进行皮肤涂抹给药,按指定时间点用7mm直径的取皮器切除干燥的皮肤组织,深度为7-8mm。取出皮肤后放入培养皿内,立即放入干冰中冷冻定型。
43.2样品包埋:将2.5%羧甲基纤维素钠(w/v)倒入一个长方形型框架中,只覆盖底板,放入液氮中预冷冻至半凝固状态。用镊子取皮肤使其纵切面朝上,垂直放入半凝固的2.5%羧甲基纤维素钠(w/v)中,加入足够的2.5%羧甲基纤维素钠(w/v)覆盖皮肤填充满框架,再放入液氮中冷冻至完全冻结后转移至-20℃冰箱冷冻过夜。
44.3标准曲线制备:用大鼠血浆将
14
c-葡萄糖储备液(购自perkin elmar)稀释至指定浓度得到标准曲线用样品并加入到预先打孔的2.5%羧甲基纤维素钠(w/v)冷冻包埋块中。标准曲线的定量范围约为1~8000nci/g。将标准曲线用样品采用液体闪烁计数仪测定放射浓度,得到理论值。在本实施例中,设定了10个浓度的标准曲线用样品,其理论值分别为:0.940、4.18、40.8、82.4、423、839、1711、3877、5922、7994nci/g。
45.4质控(qc)样品制备:使用巴马小型猪血浆稀释
14
c-葡萄糖至指定浓度制作qc样品,(qc样品浓度分为低、中、高三种,分别是:标准曲线最低浓度的3倍、标准曲线最高浓度的10%、标准曲线最高浓度的75%)用作制作qc的标准样品采用液体闪烁计数仪测定放射
浓度。使用电钻在样品包埋块的空白处平行钻三个直径10mm的孔,然后分别填入低、中、高三个浓度的质控样品。
46.5标准曲线和样品包埋块切片:应用leica cm3600冷冻切片机(leica biosystems,德国)对样品包埋块进行切片,片厚约30μm。用切片采集胶带将切片转移至胶带上,在冷冻切片机中(-20℃)下脱水至少24小时。
47.6曝光与显影:由于显像板(磷屏)是反复利用的,故在曝光、显影前,需要将显像板置于清屏仪中均匀照射至少30分钟,以去除残留的潜像或本底。将脱水后的干燥的样品胶带(包括质控样品)及标准曲线样品采集胶带固定在显像板上,并将显像板紧压在曝光盒内曝光约4天。在暗室内,应用amersham typhoon rgb成像仪扫描得到放射性自显影图像。
48.7使用aida图像分析软件(raytest gmbh,germany)对放射性自显影图像组织中的放射性浓度定量。
49.7.1液体闪烁计数仪测定标准曲线数据为:0.940、4.18、40.8、82.4、423、839、1711、3877、5922、7994nci/g,作为放射性浓度的理论值,在本发明中简称理论值。利用aida软件圈选标准曲线用样品的单位面积灰度值与液体闪烁计数仪测定的理论值进行匹配定量,做出标准曲线。从该标准曲线(图1)上可以得到标准曲线用样品的校正浓度为0.980、3.59、38.9、77.3、472、845、1851、3823、5927、7983nci/g。该标准曲线的线性回归方程式为y=1.35030
×
x,y表示单位面积灰度值,单位为psl/mm2;x表示校正浓度,单位为nci/g;决定系数(r2)为0.9998,符合标准曲线范围。
50.7.2液体闪烁计数仪(简称液闪仪)测定质控样品数据为:6007、883、3.19nci/g,作为理论值。利用aida软件圈选质控样品的单位面积灰度值,根据标准曲线计算质控样品的校正浓度分别为6152、1004、3.04nci/g。
51.7.3标准曲线及qc样品的接受标准
52.对切片扫描所得的放射性自显影图像中质控样品进行分析。当质控样品的切片的校正浓度达到以下标准时,可判定标准曲线和质控样品合格:1)单个质控样品的校正浓度与理论值(液闪仪测定值)的偏差在可接受范围(
±
15%)之内,则该质控样品合格;2)至少2/3的质控样品合格;3)标准曲线的决定系数(r2)≥0.9。只有完全符合上述三条标准,标准曲线和质控样品才是合格的,可用于对待测组织样品进行定量分析。若未达到上述标准,须再取与目标组织样品平行操作的切片,然后重新分析。
53.7.4使用aida软件对角质层、表皮、真皮、皮下组织进行圈选定量并报告放射性浓度。给药后4h猪皮的角质层、表皮、真皮、皮下组织浓度分别为2311、1008、1.64、0.35nci/g。从放射性图像(图2)可直观观察到相关的放射性在角质层和表皮层分布。图像观察外圈有少量放射性残留,为取皮器向下取皮时沾染了药液。在图像框选时没有框选这部分区域,有效地避免了样品污染。
54.以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1