一种动物源基质吡噻菌胺及其代谢物的检测方法
1.本发明涉及农药残留检测技术领域,特别是涉及一种动物源基质吡噻菌胺及其代谢物的检测方法。
背景技术:
2.吡噻菌胺(penthiopyrad)为日本三井化学公司研发的新颖酰胺类杀菌剂,其与现有的羧酰胺类杀菌剂有不同的杀菌谱。除了与现有羧酰胺类杀菌剂一样对担子菌有效外,其对子囊菌、不完全菌亦有效,现被推荐用于防治对其他杀菌剂具抗性的灰霉病和白粉病。
3.该药剂通常使用的有效成分剂量为100-200g/hm2,其被广泛应用于果树、蔬菜、草坪等众多作物,防治锈病、菌核病、灰霉病、霜霉病、苹果黑星病和白粉病。penthiopyrad于2008年在日本获得首次批准,用于果树、蔬菜和观赏植物,后又于2011年11月在加拿大获准登记。商标名为vertisan和fontelis(均以penthiopyrad 200g/l为其活性成分)和treoris(penthiopyrad100g/l+chlorothalonil(百菌清)250g/l)的3个产品主要用在果树、蔬菜和田间作物上,在实际应用发现吡噻菌胺具有很广阔的应用前景。
4.随着吡噻菌胺的登记、推广和使用,作为我国主要出口市场的欧盟、加拿大和澳大利亚等国家制定了其在蔬菜、水果、粮谷和畜产品等食品农产品中的最大允许残留量(mrl),加拿大规定吡噻菌胺在果蔬、坚果、粮谷及畜产品等动物源性食品中的mrl为0.01-30mg/kg;澳大利亚规定吡噻菌胺在果蔬、坚果、粮谷及畜产品等动物源性食品中的mrl为0.01-5mg/kg;欧盟规定吡噻菌胺在果蔬、坚果、粮谷及畜产品等动物源性食品中的mrl为0.01-30mg/kg;欧盟、日本等国家规定若田间使用农药没有在该国家登记,没有制定相应的残留限量标准时,出口至其国家的食品农产品包括畜禽肉等动物源性食品中残留限量均实行0.01mg/l的“一律标准”。
5.现阶段,对吡噻菌胺残留量测定方法的研究较少,无同时检测吡噻菌胺及其代谢物的方法,报道的检测方法主要为蔬菜和水果中吡噻菌胺残留检测方法,这些检测方法均采用液相色谱串联质谱(lc-ms/ms)测定蔬菜和水果中吡噻菌胺残留量的检测方法,使用lc-ms/ms测定食品农产品中农药残留具有快速、简便、灵敏度高等优点,但由于其价格较昂贵,很多检测机构、企业或科研院所未配置该仪器或配置台数较少,由于不同的化合物采用lc-ms/ms检测时,需使用不同的流动相或色谱柱,这样需要不断更换色谱柱、流动相并耗费比较长的时间对系统进行平衡,这一定程度上制约了lc-ms/ms的应用。配备电子轰击电离源的气相色谱质谱(gc-ei-ms)分析食品农产品中农药残留具有很大优势,由于电子轰击电离源质谱为通用性检测器,可实现几百种农药的多残留分析,可同时定性和定量,价格适中,因此现各种检测机构和企业均配备气相色谱-电子轰击离子源-质谱仪(gc-ei-ms)对食品农产品中的农药残留进行检测,但迄今为止未见食品农产品中吡噻菌胺残留量的gc-ei-ms检测方法的报道。吡噻菌胺属电负性化合物,由于动物源性食品等食品农产品基质比较复杂,须建立净化效果良好的样品前处理方法和仪器分析条件才能满足检测要求。
6.因此,提供一种能够定性和定量分析动物源基质吡噻菌胺及其代谢物的检测方法
具有重要意义。
技术实现要素:
7.本发明的目的在于提供一种动物源基质吡噻菌胺及其代谢物的检测方法,通过分散固相萃取净化,提取动物源基质中的吡噻菌胺及其代谢物,采用uplc-ms/ms检测提取得到的靶标农药。
8.为实现上述目的,本发明提供了如下方案:
9.本发明提供一种动物源基质吡噻菌胺及其代谢物的检测方法,以羟基修饰多壁碳纳米管为分散固相萃取净化材料。
10.进一步地,所述动物源基质吡噻菌胺及其代谢物的检测方法,包括如下步骤:取动物源样品,加入乙腈,提取,加入氯化钠,盐析,离心,上清液利用所述分散固相萃取净化材料进行净化,离心,利用uplc-ms/ms测定上清液中吡噻菌胺及其代谢物的含量。
11.进一步地,所述动物源样品包括猪肉样品、鸡蛋样品或牛奶样品中的一种。
12.进一步地,所述动物源样品与乙腈的料液比为(4.95~5.05)g:10ml。
13.进一步地,所述动物源样品与氯化钠的质量比为(4.95~5.05):2。
14.进一步地,所述动物源样品与羟基修饰多壁碳纳米管的质量比为(4.95~5.05):0.01。
15.目前,本领域检测农药残留通常采用传统分散萃取净化材料,例如psa、c18、gcb等。由于动物源样品油脂含量较高,对于其分离净化难度较高,本领域目前没有特定有效的净化材料组合,本发明针对动物源样品油脂含量较高的特性,选择羟基修饰多壁碳纳米管为分散固相萃取净化材料增强吸附动物源样品中的脂质,改善目标分析物的分配方式,提高检测方法的准确性。
16.本发明公开了以下技术效果:
17.本发明通过分散固相萃取净化,提取动物源基质中的吡噻菌胺及其代谢物,通过uplc-ms/ms检测。
18.本发明针对日常膳食必须的动物源样品,选择新型纳米净化材料—羟基修饰多壁碳纳米管为分散固相萃取净化材料,提高了检测方法的准确性和稳定性。
19.本发明以羟基修饰多壁碳纳米管为分散固相萃取净化材料,提取/净化动物源基质中的吡噻菌胺及其主要代谢物((1-甲基-3-三氟甲基-1h-吡唑-4-基)甲酰胺,简称pam),再利用超高效液相色谱串联三重四级杆质谱仪(uplc-ms/ms)对提取得到的物质进行测定,达到准确定性定量动物源基质中吡噻菌胺及其代谢物的目的。
20.本发明检测方法的平均回收率为88%~106%,相对标准偏差(rsd)为1.0%~4.9%,定量限为0.001mg/kg,检出限为0.38~0.57μg/kg。
21.国际惯例要求同时检测吡噻菌胺及其代谢物的方法,本发明提供的检测方法具有操作简便,灵敏度高,准确性好、快速、高效的优点,弥补了方法领域的空白。
附图说明
22.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施
例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
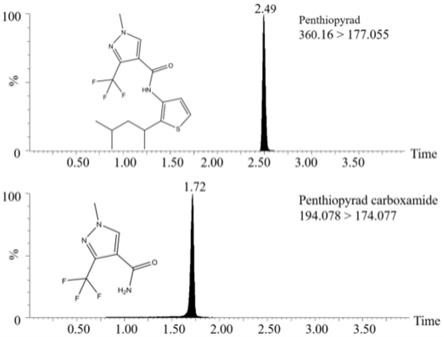
23.图1为实施例1的色谱条件下测定的吡噻菌胺及其代谢物pam的典型色谱图和分子结构;
24.图2为吡噻菌胺乙腈提取液标准曲线;
25.图3为吡噻菌胺代谢物pam乙腈提取液标准曲线;
26.图4为吡噻菌胺鸡蛋基质标准曲线;
27.图5为吡噻菌胺代谢物pam鸡蛋基质标准曲线;
28.图6为吡噻菌胺牛奶基质标准曲线;
29.图7为吡噻菌胺代谢物pam牛奶基质标准曲线;
30.图8为吡噻菌胺猪肉基质标准曲线;
31.图9为吡噻菌胺代谢物pam猪肉基质标准曲线;
32.图10为鸡蛋空白对照色谱图;
33.图11为牛奶空白对照色谱图;
34.图12为猪肉空白对照色谱图;
35.图13为吡噻菌胺及其代谢物pam在鸡蛋基质中最低添加水平(0.001mg/kg)典型色谱图;
36.图14为吡噻菌胺及其代谢物pam在牛奶基质中最低添加水平(0.001mg/kg)典型色谱图;
37.图15为吡噻菌胺及其代谢物pam在猪肉基质中最低添加水平(0.001mg/kg)典型色谱图。
具体实施方式
38.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
39.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
40.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
41.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
42.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即
意指包含但不限于。
43.本发明所用检测试剂及标准品如下:
44.乙腈:色谱纯,批号ja080730,由fisher chemical提供。
45.氯化钠:分析纯,批号20180904,由北京市通广精细化工公司提供。
46.甲酸:色谱纯,批号s2510100,由上海安谱科学仪器有限公司提供。
47.吡噻菌胺:纯度≥98%,由北京谨明科技有限公司提供。
48.吡噻菌胺代谢物pam:纯度98.8%,由北京谨明科技有限公司提供。
49.羟基修饰多壁碳纳米管,由天津博纳艾杰尔科技有限公司提供。
50.本发明所用仪器设备如下:
51.超高效液相色谱-三重四级秆质谱联用仪:waters acquity uplc h-class/xevo tqd,沃特世公司;
52.台式离心机:fc-5706型低速离心机,奥豪斯国际贸易有限公司;
53.分析天平:mettler toledo me204e万分之一分析天平,精度i级,梅特勒-托利多公司;
54.电子天平:scout pro sps202fzh百分之一电子天平,精度iii级,奥豪斯公司;
55.移液枪:5ml、1000μl、200μl、100μl、20μl移液枪,eppendorf公司;
56.瓶口分配器:5~50ml,brand公司;
57.实验室纯水系统:s30uv型,上海和泰仪器有限公司;
58.多管涡旋混合仪:mtv-100型,杭州奥盛仪器有限公司;
59.高速离心机:pico 17型,thermos scientific公司。
60.本发明所用流动相溶液和提取液配制方法如下:
61.0.05%甲酸水(v/v):量取1000ml纯净水于溶剂瓶中,加入500μl色谱纯甲酸,摇匀后静置,备用。
62.本发明所用标准母液和工作液配制方法如下:
63.标准溶液配制:
64.吡噻菌胺标准母液:称取0.0051g吡噻菌胺原药,用乙腈溶解并定容到50ml,浓度为500.00mg/l;
65.吡噻菌胺代谢物标准溶液:准确量取0.0093g吡噻菌胺代谢物((1-甲基-3-三氟甲基-1h-吡唑-4-基)甲酰胺)粉末,用乙腈定容到10ml,浓度为918.84mg/l。
66.实施例1
67.动物源样品制备
68.将市场采集的适量新鲜的鸡蛋,去壳,将蛋清和蛋黄搅拌均匀,密封标记,-20℃冷冻保存。猪肉样品去骨,包含脂肪含量小于10%的脂肪组织,用绞肉机绞碎,充分混匀,用四分法缩分至不少于500g,作为试样,装入清洁容器内,密封标记,-20℃冷冻保存。牛奶(生乳)取不少于500g代表性的牛奶(生乳)样品,充分混匀,置于样品瓶中,密封标记,4℃冰柜中避光保存。
69.动物源基质中吡噻菌胺及其代谢物的检测方法:
70.(1)待测液的制备:
71.分别将5.00(
±
0.05g)的鸡蛋、猪肉及牛奶样品称重至50ml ptfe离心管中。添加
10ml乙腈,振荡提取5min,加2g nacl。重复震荡5min,然后在1110
×
g相对离心力下离心5min,取1.5ml上清液转移到含10mg羟基修饰多壁碳纳米管的离心管中,涡旋震荡5min,9.6
×
g相对离心力下离心3min,取上清液经0.22um滤膜过滤后通过uplc-ms/ms进行测定。
72.(2)标准溶液准备:
73.将10mg/l的吡噻菌胺标准溶液和吡噻菌胺代谢物标准溶液用空白动物源基质提取液分别稀释至浓度为0.001、0.01、0.1、0.25、0.5、0.75和1mg/l,制得标准溶液。
74.(3)uplc-ms/ms检测:
75.利用uplc-ms/ms对步骤(1)制备的待测液及步骤(2)制备的标准溶液进行测定,仪器参数设定如下:
76.色谱柱:waters acquitybeh c18(2.1mm
×
100mm,1.7μm);
77.柱温:40℃;
78.流速:0.35ml/min;
79.进样量:5μl;
80.梯度洗脱条件见表1。
81.表1流动相及梯度脱洗条件
82.时间(t/min)流速(ml/min)乙腈(%)0.05%甲酸水(%)00.3510900.50.3590103.50.3590104.00.3510905.00.351090
83.离子源:电喷雾离子源esi;
84.扫描方式:正离子源;
85.毛细管电压:3.0kv;
86.离子源温度:150℃;
87.脱溶剂温度:500℃;
88.脱溶剂气流量:1000l/h;
89.锥孔气流量:50l/h;
90.检测方式:多重反应监测(mrm)见表2。
91.表2吡噻菌胺和吡噻菌胺代谢物的主要参考质谱系数
[0092][0093]
实施例1的色谱条件下测定的吡噻菌胺及其代谢物pam的典型色谱图和分子结构见图1。
[0094]
(4)分析结果计算:
[0095]
根据标准溶液(表3~表10)的测定结果,绘制标准曲线,利用绘制的曲线计算待测液中吡噻菌胺的含量。
[0096]
表3吡噻菌胺乙腈提取液标准曲线的确定
[0097][0098][0099]
根据表3绘制的标准曲线(图2)可以看出,所得线性回归方程的相关系数>0.99,表示吡噻菌胺在0.001~1mg/l的范围内测得峰面积与浓度的呈线性相关。
[0100]
表4吡噻菌胺代谢物pam乙腈提取液标准曲线的确定
[0101]
序号浓度mg/l峰面积10.001674.420.016703.230.161655.240.25143350.150.5293709.560.75460937.571575442.4
[0102]
根据表4绘制的标准曲线(图3)可以看出,所得线性回归方程的相关系数>0.99,表示吡噻菌胺代谢物pam在0.001~1mg/l的范围内测得峰面积与浓度的呈线性相关。
[0103]
表5吡噻菌胺鸡蛋基质标准曲线的确定
[0104]
序号浓度mg/l峰面积10.001425.620.013260.730.131214.840.2575479.750.5142954.960.75203061.171258025.2
[0105]
根据表5绘制的标准曲线(图4)可以看出,所得线性回归方程的相关系数>0.99,表示吡噻菌胺在0.001~1mg/l的范围内测得峰面积与浓度呈线性相关。
[0106]
表6吡噻菌胺代谢物pam鸡蛋基质标准曲线的确定
[0107][0108][0109]
根据表6绘制的标准曲线(图5)可以看出,所得线性回归方程的相关系数>0.99,表示吡噻菌胺在0.001~1mg/l的范围内测得峰面积与浓度呈线性相关。
[0110]
表7吡噻菌胺牛奶基质标准曲线的确定
[0111]
序号浓度mg/l峰面积10.001455.420.014366.630.143664.640.2598320.450.5169490.360.75226931.771289022.0
[0112]
根据表7绘制的标准曲线(图6)可以看出,所得线性回归方程的相关系数>0.99,表示吡噻菌胺在0.001~1mg/l的范围内测得峰面积与浓度呈线性相关。
[0113]
表8吡噻菌胺代谢物pam牛奶基质标准曲线的确定
[0114]
序号浓度mg/l峰面积10.001557.020.014722.830.151805.140.25128105.950.525429260.75362644.271452904.6
[0115]
根据表8绘制的标准曲线(图7)可以看出,所得线性回归方程的相关系数>0.99,表示吡噻菌胺在0.001~1mg/l的范围内测得峰面积与浓度呈线性相关。
[0116]
表9吡噻菌胺猪肉基质标准曲线的确定
[0117]
序号浓度mg/l峰面积10.001361.320.012867.1
30.129178.040.2555613.050.5104735.460.75142384.571207848.9
[0118]
根据表9绘制的标准曲线(图8)可以看出,所得线性回归方程的相关系数>0.99,表示吡噻菌胺在0.001-1mg/l的范围内测得峰面积与浓度呈线性相关。
[0119]
表10吡噻菌胺代谢物pam猪肉基质标准曲线的确定
[0120]
序号浓度mg/l峰面积10.001729.220.015980.230.155504.940.25142532.950.5262906.860.75386120.371493309.1
[0121]
根据表10绘制的标准曲线(图9)可以看出,所得线性回归方程的相关系数>0.99,表示吡噻菌胺在0.001~1mg/l的范围内测得峰面积与浓度呈线性相关。
[0122]
实施例2
[0123]
考察实施例1检测方法的特异性、准确度和精密度:
[0124]
根据实施例1的检测方法,选择空白动物源基质(鸡蛋、牛奶和猪肉的空白对照色谱图见图10-12)分别按照0.001mg/kg、0.01mg/kg、0.1mg/kg、1mg/kg的添加量加入混合标准溶液,每组设置6个平行样品,根据测定结果,计算回收率和相对标准偏差rsd,结果见表11-16。不同添加水平对回收率和相对标准偏差的要求见表17。
[0125]
表11吡噻菌胺在鸡蛋中添加回收结果
[0126][0127]
表12吡噻菌胺代谢物pam在鸡蛋中添加回收结果
[0128][0129]
表13吡噻菌胺在牛奶中添加回收结果
[0130][0131]
表14吡噻菌胺代谢物pam在牛奶中添加回收结果
[0132][0133]
表15吡噻菌胺在猪肉中添加回收结果
[0134][0135]
表16吡噻菌胺代谢物pam在猪肉中添加回收结果
[0136][0137]
表17不同添加水平对回收率和相对标准偏差的要求
[0138]
添加水平(c)mg/kg回收率(r)%相对标准偏差(rsd)%c>170-110≤100.1<c≤170-110≤150.01<c≤0.170-120≤200.001<c≤0.0160-120≤30c≤0.00150-120≤35
[0139]
从表11~17中的数据可以看出,本发明的动物源基质中的吡噻菌胺及其代谢物的检测方法回收率及相对标准偏差均符合欧盟农药残留参考实验室《食品和饲料中农药残留分析质量控制和方法验证程序》,说明本发明提供的检测方法准确度和精密度均符合要求。
[0140]
实施例1的检测方法的定量限:
[0141]
利用实施例1中uplc-ms/ms的检测条件,测定在空白提取溶液中添加不同浓度的吡噻菌胺及其代谢物后的回收率和相对标准偏差,以表17所述标准的最低浓度为定量限,测定结果为动物源基质中吡噻菌胺及其代谢物的定量限为0.001mg/kg。吡噻菌胺及其代谢物pam在鸡蛋、猪肉和牛奶基质中最低添加水平(0.001mg/kg)典型色谱图见图13~15。
[0142]
实施例1的检测方法的检出限:
[0143]
利用实施例1中uplc-ms/ms的检测条件,观察样品信号在基线噪音浓度3倍时的浓
度,分析结果为动物源基质中吡噻菌胺及其代谢物的检出限为0.38~0.57μg/kg。
[0144]
对比例1
[0145]
与实施例1相比,区别在于将前处理过程中装有10mg羟基修饰多壁碳纳米管的离心管替换为装有50mg psa的离心管,省略绘制标准曲线的过程。
[0146]
对比例2
[0147]
与实施例1相比,区别在于将前处理过程中装有10mg羟基修饰多壁碳纳米管的离心管替换为装有50mg c18的离心管,省略绘制标准曲线的过程。
[0148]
对比例3
[0149]
与实施例1相比,区别在于将前处理过程中装有10mg羟基修饰多壁碳纳米管的离心管替换为装有50mg gcb的离心管,省略绘制标准曲线的过程。
[0150]
根据实施例1的检测方法,在处理样品的同时,分别按照0.001、0.01、0.1和1mg/kg的添加量加入混合标准溶液,每组设置5个平行样品,根据测定结果,计算回收率和相对标准偏差rsd。对比例1~3的检测方法,在处理猪肉样品时设定0.01和1mg/kg两个添加量加入混合标准溶液,每组设置5个平行样品,根据测定结果,计算回收率和相对标准偏差rsd。
[0151]
结果见表18~表23。不同添加水平对回收率和相对标准偏差的要求见表17。
[0152]
表18吡噻菌胺在鸡蛋中添加回收结果(对比例1检测方法)
[0153][0154]
表19吡噻菌胺代谢物pam在鸡蛋中添加回收结果(对比例1检测方法)
[0155][0156]
表20吡噻菌胺在鸡蛋中添加回收结果(对比例2检测方法)
[0157][0158]
表21吡噻菌胺代谢物pam在鸡蛋中添加回收结果(对比例2检测方法)
[0159][0160]
表22吡噻菌胺在鸡蛋中添加回收结果(对比例3检测方法)
[0161][0162]
表23吡噻菌胺代谢物pam在鸡蛋中添加回收结果(对比例3检测方法)
[0163][0164]
从表18~23中的数据可以看出,本发明的动物源基质中的吡噻菌胺及其代谢物pam的检测方法回收率及相对标准偏差均符合欧盟农药残留参考实验室《食品和饲料中农药残留分析质量控制和方法验证程序》,说明本发明提供的检测方法准确度和精密度均符合要求。
[0165]
从表11~12及表18~23中的数据可以看出,实施例1的检测方法的准确度和精密度高于对比例1~3的检测方法,说明不同的提取剂和净化材料对于动物源样品的农药残留检测结果存在较大影响,经过对提取剂和净化材料进行改进后,明显提高了检测方法的准确度和精密度。新型纳米材净化料优于传统净化剂,这可能是由于较大的比表面积和高吸附容量,在减少用量的同时能够从油脂含量较高的动物源样品中选择性萃取脂质,使分析结果更加准确。
[0166]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1