低位阻胶乳增强免疫竞争法定量测定全血中他克莫司的试剂盒的制作方法
1.本发明属于生化检测领域,具体涉及一种低位阻胶乳增强免疫竞争法定量测定全血中他克莫司的试剂盒。
背景技术:
2.他克莫司(tacrolimus,fk506,又名:普乐可复、大环哌南)是从土壤真菌中提取的一种大环内酯类抗生素,具有较强的免疫抑制特性,其药物强度是环胞霉素a的10-100倍,预防各种器官移植所出现的排斥反应的效果优于环孢菌素。
3.1984年,日本藤泽公司(fujisawa)在日本大阪筑波地区分离出筑波链霉菌,通过酦酵、纯化及分离出tacrolimus成分。1989年,美国匹兹堡大学starzl器官移植中心将普乐可复首次在临床试用。1993年,在日本以普乐可复(prograf)上市。1995年经fda获准后在多个国家正式使用。目前,普乐可复已广泛的应用于肝脏、胰腺、肾脏、心脏、肺等实体器官的移植中。根据美国匹兹堡大学报告,在使用环孢素无效的援救疗法中,肝移植患者应用fk506有87%的成功率,而肾移植患者有74%成功率。1999年在中国上市以来,到目前为止,使用过该产品的移植患者累积已超过5000例人数,基本上每个移植中心和单位都应用普乐可复产品。2002年该品的全国医院用药金额为3.4亿元,占整个免疫抑制剂的5.44%;2003年为5.4亿元,占整个免疫抑制剂的8.17%。该品种在全国畅销药品徘名中名列第70位,居免疫抑制剂的第4位。但由于其价格昂贵,大多数患者经济上无法承受,使其应用受限。值得关注的是,该类产品中由安徽金蟾药业独家生产的华蟾素。它是一种治乙肝、抗肿瘤纯中药制剂,现已在北京、上海、广州等地大医院得到普遍应用。
4.他克莫司的疗效、不良反应与其血药浓度密切相关,血药浓度太高会增加不良反应发生率,血药浓度太低又增加排斥风险,因此须将其血药浓度控制在疗效最优,不良反应最低的范围,通过血药浓度检测(tdm)来指导个体化用药,所用的剂量须因人而异,针对不同患者的具体情况制定出最佳给药剂量,尽可能获得最佳效果、减少不良反应。
5.目前,检测fk506血药浓度的方法国内主要有高效液相-质谱联用(hplc-ms)、酶放大免疫测定(emia)、化学发光微粒子免疫测定(cmia)、电化学发光免疫测定(eclia)等。其中hplc-ms法测定血药浓度准确、灵敏,但其操作繁琐,检测时间长,检测成本高,需要昂贵设备,主要用于科研领域或作为一种参考方法。国内市场基本被西门子emia、雅培cmia、罗氏eclia三家瓜分,其3种都是检测自动化程度高,检测结果准确的方法学,但试剂价格昂贵,需要使用配套专用的仪器。
6.nta-ni-his标签
7.在1987年,hochuli等人发明了改进的金属螯合配体次氮基三乙酸(n ta),伴随着现代分子生物学和重组蛋白技术的高速发展,基于nta配体在纯化组氨酸标签(his-tagged)蛋白方面得到了很重要的应用。
8.众所周知,广泛使用的金属离子为ni
2+
,其周围共有六个配位点供配体结合。ida是
三齿配体,即可以结合ni
2+
周围的三个配位点,剩余的三个配位点中两个用于结合组氨酸标签蛋白中的组氨酸残基,另一个用于和h2o配位结合,因此,ida对ni
2+
的结合能力相对较弱,造成结合到介质上的ni
2+
容易脱落,致使介质的性能不稳定。而nta是四齿配体,即nta可以结合ni
2+
周围的四个配位点,剩余两个配位点用于结合组氨酸标签蛋白中的组氨酸残基。
9.fc受体蛋白
10.fc受体指一系类细胞膜表面能与igfc片段结合的受体。在免疫学中,具有fc受体细胞一般有b细胞、杀伤细胞、巨噬细胞。抗体是由免疫细胞产生的特殊蛋白质,可以与抗原如微生物、毒素或过敏物质结合。当免疫细胞上的fc受体与抗体及其附着的抗原结合时,可以引发吞噬作用,这样会消耗被抗体包被的抗原。
11.基于不同类型的抗体,会存在不同的特异性抗原。这也意味着也存在不同的fc受体,每个fc受体能够在其fc区结合抗体。抗体也称为免疫球蛋白,简称ig,并且最常见于血液中的igg类型。fc受体主要分为三类,包括fc-γ受体,fc-α受体和fc-ε受体。每种类型的fc受体包含基于遗传同源性的几种亚型,比如fc-γ受体可结合igg的fc片段,fc-α受体可结合iga的fc片段,fc-ε受体可结合ige的fc片段。近年来研究发现一种小鼠fc受体(fcα/μr,又称fcamr,cd351),既可以结合igm,又可以结合iga。
12.胶乳增强免疫比浊法具有操作简单、快速、灵敏度高、可应用于自动生化分析仪,易于国产化等优点,但胶乳增强免疫比浊法大多用于大分子蛋白的测定,且相比较cmia和eclia的方法学有灵敏度不足的缺点。因此,开发出一种可以更高灵敏度检测他克莫司小分子药物的新型胶乳增强免疫方法将为临床他克莫司作为免疫抑制剂的使用提供强有力的支持。
13.胶乳增强免疫竞争法是目前用于检测样本中药物小分子浓度的常用方法,该方法的原理是在高分子胶乳微球的表面交联单克隆抗体,药物小分子(样本中的半抗原)和药物-蛋白复合物(人工构建的抗原)两者同时竞争结合胶乳微球表面的抗体位点,反应体系的浊度大小与样本中的药物小分子浓度呈负相关,通过测定反应液的吸光度,计算样本中药物小分子的浓度。然而,传统的胶乳微球包被法,抗体位阻大,如图1所示。
技术实现要素:
14.本发明所要解决的技术问题是针对现有技术中检测药物小分子他克莫司的方法较为复杂、灵敏度低、抗体位阻大等缺陷,从而提供了一种利用胶乳增强免疫竞争法低位阻高灵敏度定量测定全血中免疫抑制剂他克莫司的试剂盒。其具体原理如下:
15.在测定他克莫司浓度之前,对全血样本进行预处理,将全血中细胞内与蛋白结合的他克莫司提取出来。检测过程中,从样本中提取的他克莫司药物与药物蛋白复合物试剂(试剂r1)中的他克莫司药物-蛋白复合物竞争结合致敏胶乳试剂(试剂r2)中胶乳微球表面的抗他克莫司抗体,样本中的他克莫司小分子药物竞争结合了抗体的位点,会抑制凝集反应。所以,当样本中他克莫司药物浓度较低时,产生凝集反应较强;当样本中他克莫司药物浓度较高时,产生的凝集反应较弱;反应体系产生的浊度大小与样本中的他克莫司浓度呈负相关,通过测定546nm附近的吸光度,计算全血样本他克莫司的浓度。
16.本发明的另一项创新点为,本发明使用的结合抗他克莫司单克隆抗体的纳米胶乳微球,能够定向结合抗体fc片段,有效减小抗体位阻,使得抗体活性位点充分暴露,提高灵
敏度,其示意图如图1所示。
17.本发明所用的抗他克莫司单克隆抗体可以通过利用实施例2中所述的方法进行制备,并从中筛选出效果最好的抗体应用在本发明中。但本发明可用的抗他克莫司单克隆抗体不限于此,任何通过商业途径购买得到的抗他克莫司单克隆抗体只要其类型能对应上特异性的fc受体蛋白,就都能够达到与本发明相当的技术效果。
18.为解决上述技术问题,本发明提供的技术方案之一为:一种定量测定他克莫司的试剂盒,包括致敏胶乳试剂,所述致敏胶乳试剂包含胶乳微球-nta-ni-fc受体-抗他克莫司单克隆抗体。
19.如技术方案之一所述的试剂盒,所述胶乳微球-nta-ni-fc受体-抗他克莫司单克隆抗体的制备方法包含以下步骤,反应的示意图如图2和图3所示:
20.i)胶乳微球共价结合n-(5-氨基-1-羧基戊基)亚氨基二乙酸(末端有nta结构),制成胶乳微球-nta。
21.ii)所述胶乳微球-nta结合ni离子,制成胶乳微球-nta-ni。
22.iii)所述胶乳微球-nta-ni结合带his标签的fc受体(也叫fcbp,fc结合蛋白,其结构有多种,目前市面上商用的有很多种,获取方便,不同种类对应不同抗体型,例如fcγr1和fcamr),制成胶乳微球-nta-ni-fc受体。
23.iv)所述胶乳微球-nta-ni-fc受体结合抗他克莫司单克隆抗体的fc端,制成所述胶乳微球-nta-ni-fc受体-抗他克莫司单克隆抗体。
24.根据本领域常规,本发明所用的胶乳微球可选的表面基团有羧基和氨基两种,只要选择使用合适的比例和偶联剂,理论上可以达到相同的效果,即两种微球都可以应用于本发明中。
25.如技术方案之一所述的试剂盒,当所述胶乳微球为羧基胶乳微球时,使用nhs(n-羟基丁二酰亚胺)和edc(1-乙基-(3-二甲基氨基丙基)碳酰二亚胺)作为偶联剂,i)中所述胶乳微球-nta的制备具体包含以下步骤:
26.(1)将粒径50nm~350nm的所述羧基胶乳微球分散在ph 5.8~6.5的mes(吗啉乙磺酸)中,使得微球质量体积百分比为1%,加入n-羟基丁二酰亚胺和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺,使其包被浓度为0.1~3mg/10mg微球,于室温反应0.5-3h;所述ph优选6.1;所述室温反应的时间优选1h,n-羟基丁二酰亚胺和1-乙基-(3-二甲基氨基丙基)碳酰二亚胺的包被浓度优选1~1.5mg/10mg微球。
27.(2)离心弃去上清,用ph 5.8~6.5的mes重悬浮超声;该ph值优选6.1。
28.(3)加入0.5~3mg/ml,例如1.2mg/ml,的n-(5-氨基-1-羧基戊基)亚氨基二乙酸,搅拌反应1-3h。
29.(4)加入过量30~50mmol伯胺(如羟胺、乙醇胺、甘氨酸),封闭反应1-3h。
30.(5)离心弃去上清,用ph 6.8~8.5的pbs重悬浮超声,制成所述胶乳微球-nta;所述pbs优选ph7.4,100mm。
31.如技术方案之一所述的试剂盒,ii)中所述胶乳微球-nta-ni的制备具体包含以下步骤:
32.(1)加入过量ni(ch3coo)2,搅拌反应0.5-3h;优选2h。
33.(2)离心弃去上清,用ph 6.8~8.5的pbs重悬浮超声,置于2~8℃备用;所述pbs优
选ph7.4,100mm。短期可不加防腐剂,长期需要加入防腐剂,防腐剂可选叠氮化钠、硫柳汞。
34.如技术方案之一所述的试剂盒,iii)中所述胶乳微球-nta-ni-fc受体的制备具体包含以下步骤:
35.(1)将所述带his标签的fc受体加入所述胶乳微球-nta-ni中,反应0.5~3h;优选2h。
36.(2)离心弃上清,用pbs悬浮超声、反复洗涤2次后,溶于pbs中。
37.根据本领域常规,所述带his标签的fc受体可为6xhis-fc受体。
38.如技术方案之一所述的试剂盒,iv)中所述胶乳微球-nta-ni-fc受体-抗他克莫司单克隆抗体的制备具体包含以下步骤:
39.(1)在所述胶乳微球-nta-ni-fc受体中加入抗他克莫司单克隆抗体,使得所述胶乳微球的抗体包被量为0.05~10mg抗他克莫司单克隆抗体/10mg胶乳微球,反应1h;所述胶乳微球的抗体包被量优选0.1~0.4mg抗他克莫司单克隆抗体/10mg胶乳微球。
40.(2)离心弃上清,用pbs悬浮超声,反复洗涤2次后,溶于微球储存液中。
41.如技术方案之一所述的试剂盒,所述微球储存液包含浓度为50~500mm、ph为6.5~7.8的缓冲液,质量百分比为0.5~5%的离子稳定剂,质量百分比为0.05~0.5%的微球稳定剂,以及防腐剂。
42.按照本领域常规,所述缓冲液可为tris、hepes、pbs,所述粒子稳定剂可为nacl、kcl、mgcl2,所述防腐剂可为叠氮钠、硫柳汞、proclin300。
43.所述缓冲液为浓度为100mm、ph优选7.4的pbs;所述离子稳定剂的质量百分比优选2%的nacl;所述微球稳定剂的质量百分比优选0.1%~0.2%的甘氨酸;所述防腐剂优选叠氮钠。
44.本发明所述离心的转速和时间可为本领域常规,例如,转速12000rpm离心30min。
45.如技术方案之一所述的试剂盒,所述试剂盒还包括药物蛋白复合物试剂,所述药物蛋白复合物试剂包含他克莫司药物-蛋白复合物、稳定剂、促凝剂、表面活性剂、防腐剂和缓冲液。
46.所述他克莫司药物-蛋白复合物的浓度为0.1μg/ml~3μg/ml,优选1μg/ml。
47.所述缓冲液可为本领域常规,如tris、hepes、pbs,优选hepes;浓度为50~500mm,ph 6.5~7.8,优选50mm,ph 6.8。
48.所述稳定剂可为本领域常规,如甘油、海藻糖、甘露醇、葡聚糖中的一种或几种的组合,其质量百分比为1%~10%。
49.所述表面活性剂可为本领域常规,如tx100、tween20、tween80、span20、span60、span80中的一种或两种的组合,其质量百分比为0.01%~0.5%。
50.所述促凝剂可为peg6000、peg8000、peg20000、peg35000中的一种或几种的组合。
51.所述防腐剂可为叠氮钠、硫柳汞、proclin300。
52.如技术方案之一所述的试剂盒,所述试剂盒还包括校准品,所述校准品包含防腐剂、他克莫司纯品和牛全血基质,所述校准品的他克莫司浓度选自0~50ng/ml之间的5~7个点。
53.在本发明的优选实施方案中,所述校准品的他克莫司浓度分别为0ng/ml、3ng/ml、6ng/ml、10ng/ml、20ng/ml、30ng/ml,共6个点。
54.所述防腐剂可选叠氮钠、硫柳汞、proclin300、庆大霉素中的一种或几种的组合。
55.如技术方案之一所述的试剂盒,所述试剂盒还包括样本前处理剂,所述样本前处理剂包含蛋白变性剂、蛋白水解酶、表面活性剂和缓冲液。
56.所述缓冲液为ph为6.5-8.5的tris-hcl缓冲液。
57.所述蛋白变性剂为3mol/l-8mol/l的尿酸,和/或2mol/l-6mol/l的盐酸胍。
58.所述蛋白水解酶为2.5u/ml-10u/ml的枯草杆菌蛋白酶。
59.所述表面活性剂可为sds、tx100、tween20中的一种或多种组合。
60.为解决上述技术问题,本发明提供的技术方案之二为:一种定量测定样本中他克莫司浓度的方法,使用如技术方案之一所述的试剂盒,所述方法的步骤如下:
61.(1)将所述样本或所述校准品与所述样本前处理剂按照1:1体积混合、孵育后,离心,获得上清液(原理:将全血样本或校准品中细胞内的结合有小分子他克莫司分子的蛋白通过变性剂变性后将他克莫司释放出来,转化成游离状态);所述水浴孵育优选42℃水浴孵育10min。
62.(2)将(1)中所述上清液与所述药物蛋白复合物试剂混合,孵育,获得混合液;所述孵育优选37℃孵育3~6min。
63.(3)在(2)中所述混合液中加入所述致敏胶乳试剂,读取吸光度a1,孵育后,再读取吸光度a2;所述孵育优选37℃孵育3~6min。
64.(4)计算所述样本或所述校准品的吸光度增值δa,δa=a2-a1。
65.(5)以所述校准品的吸光度增值δa对其所含他克莫司的浓度建立校准曲线,通过比对所述样本的吸光度增值δa,实现对所述样本中他克莫司浓度的定量检测。
66.该检测方法的特点是样本中的待测药物小分子与药物-蛋白复合物竞争结合致敏胶乳微球表面的抗体位点,样本中待测药物小分子越多,这种抑制凝集反应的效果就越是明显;从而实现药物浓度的测定。
67.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
68.本发明所用试剂和原料均市售可得。
69.本发明的积极进步效果在于:本发明提供的利用胶乳增强免疫竞争法测定全血中免疫抑制剂他克莫司的试剂盒,具有检测方法简便、抗体位阻小、灵敏度高等优点。
附图说明
70.图1为新微球比传统胶乳微球抗体位阻更小示意图。
71.图2为胶乳微球-nta-ni制备示意图。
72.图3为胶乳微球-nta-ni-fc受体结合抗他克莫司单克隆抗体fc端示意图。
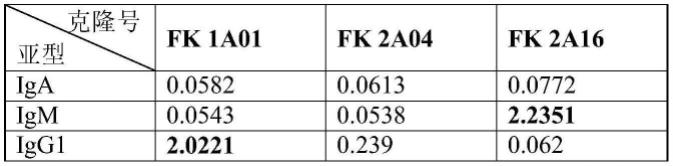
73.图4为实验组1~7不同条件下的灵敏度和线性性能测试结果。
74.图5为不同n-nta浓度包被后的校准曲线比对。
75.图6为试剂盒功能灵敏度的测试结果。
76.图7为与lc-ms/ms对比,passing and bablok回归曲线。
77.图8为与lc-ms/ms对比,bland-altman绝对偏差图。
78.图9为与lc-ms/ms对比,bland-altman相对偏差图。
79.图10为与雅培cmia对比,passing and bablok回归曲线。
80.图11为与雅培cmia对比,bland-altman绝对偏差图。
81.图12为与雅培cmia对比,bland-altman相对偏差图。
具体实施方式
82.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
83.实施例1他克莫司bsa复合物的制备
84.将20mg他克莫司纯品(福建科瑞提供)和8mg琥珀酸酐溶解在0.7ml甲苯和1ml ch2cl2的混合物中,放入小瓶中。依次加入5mg二甲基氨基吡啶和5μl三乙胺。混合溶液在室温下氩气搅拌24小时。以ch2cl2/meoh(1:12v/v)为显影溶剂,在sio2板上对产物进行薄层色谱(tlc)分析,结果表明他克莫司至少95%羧基化。然后用0.1n hcl洗涤粗品两次。分离底部ch2cl2层,用饱和nacl溶液洗涤。收集浅黄色的上层有机层,在mg2so4上干燥,用氩气流蒸发干燥,得到18.3mg的浅黄色固体,用于蛋白质偶联,无需进一步纯化。将4.5mg 1-乙基-3-(3-二甲胺丙基)-盐酸卡二亚胺(edc)和15mg n-羟基丁二酰亚胺(nhs)加入0.5ml含5mg羧基化他克莫司的无水二甲酰胺中。反应30min后,将混合物滴加到含20mg bsa的4ml nahco3溶液(0.1m,ph 8.5)中,孵化120min。制备的他克莫司-bsa复合物经sepharose cl-6b柱(2.5x55 cm)凝胶过滤纯化,用akta-prime plus进行洗脱监测(洗脱缓冲液为50mm tris-hcl,ph 8.0,含0.9%nacl和0.05%nan3)。
85.实施例2他克莫司单克隆抗体的制备
86.以下自制抗体是为了成本考虑;市售抗体只要类型能对应上特异性的fc受体蛋白就可以实现以下效果,并非必须用本发明的自制抗体。
87.为了开发抗他克莫司单克隆抗体,通过上述类似的程序制备了他克莫司-klh复合物(根据上述方法把bsa替换成klh,钥孔血蓝蛋白,来自thermo)作为免疫原使用。
88.实例中使用的单抗是在balb/c小鼠上以他克莫司-klh复合物为免疫原开发的。使用弗氏完全佐剂制备的100μl乳剂中他克莫司-klh复合物(作为免疫原)进行首次皮内免疫,25d后使用弗氏不完全佐剂制备的100μl乳剂中30μg免疫原进行增强免疫。再用30μg免疫原进行2次皮内免疫,间隔4周,再用30μg免疫原在100μl hanks平衡盐溶液(中国碧时生物科技有限公司)中静脉和腹腔内进行预融合促进(实例中igm抗体株为首次免疫就进行融合得到)。采用标准的融合技术产生分泌他克莫司特异性抗体的杂交瘤细胞系。经过广泛筛选,我们选择几种特异性较好的抗他克莫司抗体克隆用于开发他克莫司测定试剂盒。
89.抗体亚型的测试:使用市售的抗体亚型鉴定试剂盒(elisa)对筛选出的几种他克莫司特异性较好的抗体进行亚型鉴定,鉴定结果如表1:
90.表1
[0091][0092][0093]
克隆号为fk1a01的抗体为igg1型,克隆号为fk2a04的抗体为igg2a型,克隆号为fk2a16的抗体为igm型。
[0094]
实施例3包被微球的抗体与微球储存液ph的筛选
[0095]
本发明发现如果使用fc-γr受体无法结合抗体,使用fcamr则可以使用有较好的效果,故使用两种不同型的fc受体蛋白(fcγr1和fcamr)对这3种抗体型进行包被,表2中的试剂r2(致敏胶乳试剂)的制备步骤如下:
[0096]
(1)将70mg羧基胶乳微球(309nm,来自北京博尔迈)分散在7ml mes(ph6.1)中(微球浓度1%),加入70mgnhs(n-羟基丁二酰亚胺)和7mgedc(1-乙基-(3-二甲基氨基丙基)碳酰二亚胺),于室温反应1h。
[0097]
(2)12000rmp离心30mins弃去上清,用mes(ph6.1)重悬浮超声。
[0098]
(3)加入1.0mg/ml n-(5-氨基-1-羧基戊基)亚氨基二乙酸,室温搅拌反应(1h)。
[0099]
(4)加入50mmol乙醇胺,室温封闭反应(1h)。
[0100]
(5)12000rmp离心30mins弃去上清,加入100mm pbs(ph7.4)7ml重悬浮超声,制成胶乳微球(ps)-nta。
[0101]
(6)加入过量ni(ch3coo)2,搅拌反应(2h)。
[0102]
(7)12000rmp离心30mins弃去上清,加入100mm pbs(ph7.4)7ml重悬浮超声;分成两组,#1:3ml,#2:4ml。
[0103]
(8)#1加入0.3mgfcγr1(鼠源,his标签),#2加入0.4mgfcamr(鼠源,his标签)于ps-nta-ni溶液中,室温震荡反应(2h)。
[0104]
(9)12000rmp离心30mins弃上清,用pbs悬浮超声,反复洗涤2次后各溶于2ml 100mm pbs(ph7.4)中,备用。
[0105]
将上述ps-nta-ni-his-fcγr1溶液平均分成3组,记实验组1、实验组2、实验组3,ps-nta-ni-his-fcamr溶液平均分成4组,记实验组4、实验组5、实验组6、实验组7。
[0106]
(10)在上述实验组1、4加入fk1a01(igg1型)、实验组2、5加入fk2a04(igg2a型)、实验组3、6、7加入fk2a16(igm型),每组各0.2mg的抗体量,室温搅拌反应1h。
[0107]
(11)12000rmp离心30mins弃上清,用pbs悬浮超声,反复洗涤2次后溶于10ml微球储存液(实验组1~6均储存于100mm tris ph7.4,2%nacl,0.2%甘氨酸,0.1%procline300中;实验组7储存于100mm mes ph6.1,2%nacl,0.2%甘氨酸,0.1%procline300中)。
[0108]
再配制表2中配方的试剂r1(药物蛋白复合物试剂),生理盐水作为样本进行r1中
蛋白复合物浓度的测试实验:
[0109]
表2
[0110][0111]
在日立7180上机检测,具体参数设置如表3:
[0112]
表3
[0113]
波长546nm/无(主/副)标本15μl反应方法两点终点法比色杯光径1cmr1100μl校准类型spline/logit-log(4p)反应温度37℃r2100μl反应方向向上
[0114]
按表4数据设置设备参数:
[0115]
表4
[0116][0117]
测试结果如表5:
[0118]
表5
[0119][0120]
从表5和图4来看,实验组1、2、3的数据表明fcγr1作为受体时,可以特异性结合fk1a01(igg1型)和fk2a04(igg2a型)单抗,且与fk2a04(igg2a型)所产生灵敏度和线性更好;实验组4、5、6的数据表明fcamr作为受体时,与fk 2a16(igm型)有较高的灵敏度与线性反应,与fk1a01(igg1型)和fk2a04(igg2a型)均无反应。
[0121]
实验组6和实验组7除了最后储存ph不同,其余的条件都相同,数据上可以看出ph在6.1的条件下反应极速下降,ni在酸性条件下极易脱落,故储存液选用ph7.4。
[0122]
实施例4包被过程中n-nta用量的筛选实验
[0123]
图5展示了包被n-(5-氨基-1-羧基戊基)亚氨基二乙酸(n-nta)的最适用量实验数据,其余包被参数与实施例3中的实验组6一致,n-nta包被浓度为1.2mg/10mg微球时得到的校准曲线的反应吸光度值和表现出的抑制率最优。
[0124]
实施例5他克莫司测定试剂盒的配制
[0125]
经优化的试剂:
[0126]
药物蛋白复合物试剂(试剂r1)含有2%海藻糖、2.5%peg8000、0.02%tween20、0.1%nan3的hepes缓冲液(50mm,ph 6.8)和1000ng/ml他克莫司蛋白复合物;
[0127]
致敏胶乳试剂(试剂r2)含有2%氯化钠、0.1%nan3的pbs缓冲液(100mm,ph7.4)和0.1%抗他克莫司抗体致敏的胶乳微球(羧基胶乳微球-nta-ni-fcamr-fk 2a16);
[0128]
校准品包含0.05%庆大霉素、0.1%nan3的edta抗凝牛全血基质和对应浓度的他克莫司纯品;校准品浓度分为a(0ng/ml)、b(3ng/ml)、c(6ng/ml)、d(10ng/ml)、e(20ng/ml)、f(30ng/ml)共6点;
[0129]
样本前处理剂包含有5mol尿酸、3mol/l盐酸胍、5u/ml枯草杆菌蛋白酶、0.1%sds、0.2%tx100的tris-hcl缓冲液(50mm,ph7.4);
[0130]
将上述制备的药物蛋白复合物试剂(试剂r1)和致敏胶乳试剂(试剂r2)按体积比r1:r2=1:1分装入瓶,与校准品及样本前处理剂组成试剂盒。
[0131]
上机检测:
[0132]
在测定标本之前,先使用样本前处理剂从edta全血中提他克莫司:将200μl全血标本或校准品转移到含200μl样本前处理剂的1.5ml ep管中,强力涡旋10秒钟,42℃水浴10分钟;然后13000rpm离心5分钟,将上清倒入标本杯,转移到生化分析仪测定他克莫司。
[0133]
检测前,按表6数据设置设备参数:
[0134]
表6
[0135]
波长546nm/无(主/副)标本15μl反应方法两点终点法比色杯光径1cmr1100μl校准类型spline/logit-log(4p)反应温度37℃r2100μl反应方向向上
[0136]
按表7数据设置设备参数:
[0137]
表7
[0138][0139]
功能灵敏度和精密度:
[0140]
制备临床样本盘,将相同血型的临床样本互相混合成19个低浓度的样本盘,混匀后分装。对每个浓度的样本进行重复检测5次,每天两次,连续测定10天,计算每个浓度的平均浓度和%cv,根据所得数据以average multiple curves fitting拟合,他克莫司的功能灵敏度定义为变异系数(cv,%)为20%时所对应的他克莫司浓度,在浓度为1.0ng/ml之后的样本的cv均小于20%,即该试剂的功能灵敏度为1.0ng/ml;其中,2.1ng/ml、3.0ng/ml的混合样本对应的实验间精密度分布是11.4%、9.5%,如图6所示。
[0141]
稀释线性:
[0142]
稀释线性研究中,使用他克莫司校准品a对高浓度他克莫司全血样本进行稀释。然后测定每份稀释样本的他克莫司浓度,计算平均百分比回收率(%)。研究数据见下表8:
[0143]
表8
[0144][0145]
平均回收率:101%
[0146]
计算值=检测值浓度
×
稀释浓度
[0147]
回收率%=(计算浓度/稀释前浓度)
×
100
[0148]
实施例6本发明的他克莫司试剂盒、雅培cmia和lc-ms/ms的临床标本测定值比较
[0149]
用于对比研究的46例全血edta标本,分别以基于本发明的他克莫司试剂盒、雅培cmia和lc-ms/ms测定这些标本中的他克莫司浓度;其中,abbott tacrolimus cmia在architect i1000分析仪上严格按照试剂盒说明书进行。
[0150]
lc-ms/ms按下述方法实施:
[0151]
lc-ms/ms:采用sciex triple quad 4500md-jasper tm系统(ab sciex)进行lc-ms/ms分析。将标本和校准品各200μl加入2ml ep管中,再加入1000μl含5ng安定(diazepam,内标)的乙腈,混合物漩涡1min,13000
×
g离心5分钟。取600μl上清至2ml ep管中,与600μl纯水混合,涡旋10秒后再次13000
×
g离心5分钟,将上清转移到自动采样瓶中,注射10μl上清标本于lc-ms/ms系统中。他克莫司在hypersil gold c-18柱(3μm,2.1
×
100mm)上分离,梯度流动相由溶剂a(乙腈)和溶剂b(纯水)组成。所有程序的流速均为0.4ml/min。柱温45℃。初始2分钟的流动相为10%a和90%b的混合物,随后将溶剂a增加到90%,保持3分钟。最后,在5.1分钟时将溶剂a降至10%,保持2分钟;然后注射下一个标本。质谱仪设置:喷雾电压5.5kv,幕气:30psi,碰撞气体(cad):9,源gs1:45psi,源gs2:45psi,落差温度400℃。他克莫司和内标安定监测的mrm m/z比值分别为m/z 821.5
→
768.5/786.6和285.0
→
222.1。采用triple quadtm4500md系统对离子色谱峰进行集成和定量。
[0152]
样本比对数据如表9:
[0153]
表9
[0154][0155]
[0156]
对基于本发明的他克莫司试剂盒、lcms/ms和abbott cmia检测的标本他克莫司浓度作线性回归和bland-altman分析,线性回归方程分别为y=1.0373x+0.4159(r2=0.9599)和y=0.9435x+0.5881(r2=0.9738),分别如图7和图10所示。lc-ms/ms和abbott cmia对本发明的他克莫司试剂盒的平均绝对偏离分别为-0.68g/ml和-0.16ng/ml,相对偏离分别为-10.7%和-4.0%,分别如图8和图9、图11和图12所示。
[0157]
从上述实施例可知本发明研究制备的他克莫司测定试剂盒具有较高灵敏度,并且可进行大批量工业化生产,相比hplc-ms等方法来说检测方便性更优,符合国内需求。
[0158]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1