恶性间皮瘤的血浆蛋白生物标志物及其应用的制作方法
1.本发明属于生物医学分析领域,具体涉及恶性间皮瘤的血浆蛋白生物标志物及其应用。
背景技术:
2.恶性间皮瘤(malignant mesothelioma,mm),是一种罕见的侵袭性恶性肿瘤,发生于胸膜或腹膜。间皮瘤的主要原因是接触石棉,这是许多国家禁止的矿物纤维。不幸的是,在未来几十年内,受影响的人口几乎不会减少,因为许多国家仍然允许使用石棉。此外,由于恶性间皮瘤潜伏期长,通常持续20~40年才会出现症状,因此其致癌作用会逐渐在先前暴露的个体中显现出来。由于其罕见且临床症状往往不明确,患者偶尔会在恶性肿瘤晚期被误诊或诊断。而且,恶性间皮瘤的预后仍然很差,中位生存时间少于2年。因此,更准确的诊断和更有效的治疗目标有机会为临床医生定制个性化治疗赢得时间,从而提高患者的生存机会。
3.已经有新兴研究使用蛋白质组学技术结合液体活检来检测与恶性间皮瘤检测和预后相关的生物标志物。目前,得到广泛认可的恶性间皮瘤患者和健康个体之间的差异标记包括高迁移率组框1(hmgb1)、fibulin-3、透明质酸(ha)和可溶性间皮素相关蛋白(smrp)等。然而,由于敏感性和特异性较差,仍然迫切需要发现新的生物标志物以改善恶性间皮瘤患者的诊断和预后。
技术实现要素:
4.有鉴于此,本发明的目的在于提供恶性间皮瘤的血浆蛋白生物标志物及其应用,所述血浆蛋白生物标志物对于恶性间皮瘤患者和健康人群的区分具有高灵敏度和强特异性,可用于制备恶性间皮瘤的诊断和治疗产品。
5.恶性间皮瘤的血浆蛋白生物标志物,选自以下蛋白中的一个:orm2、orm1、lrg1、c9、saa1、itih3。
6.所述恶性间皮瘤的血浆蛋白生物标志物的筛选方法,包括以下步骤:
7.(1)向恶性间皮瘤患者和健康受试者采集血液样品,经过抗凝处理后,得到恶性间皮瘤患者血浆样品和健康对照血浆样品;对所述恶性间皮瘤患者血浆样品和健康对照血浆样品逐个进行前处理,分别得到恶性间皮瘤患者质谱分析样本和健康对照质谱分析样本;
8.(2)从每个质谱分析样本中取出相同体积的溶液,混合在一起,形成混合样本;运用dda方法扫描混合样本,得到ms谱图;从每一帧扫描得到的ms谱图中选取丰度top20的肽段离子获取ms2谱图;对所述ms2谱图进行分析和鉴定,利用鉴定得到的蛋白肽段构建dia库;所述质谱分析样本包括所述恶性间皮瘤患者质谱分析样本和健康对照质谱分析样本;
9.(3)逐一对每个质谱分析样本进行dia质谱检测分析,得到所有质谱分析样本的dia原始文件;使用dia-nn软件以默认参数分析上述所有质谱分析样本的dia原始文件,并基于步骤(2)构建的所述dia库匹配所述dia原始文件,同时结合现有数据库以鉴定和注释
每个质谱分析样本中的蛋白;所述质谱分析样本包括所述恶性间皮瘤患者质谱分析样本和健康对照质谱分析样本;
10.(4)对于上述注释的蛋白进行预处理:排除在全部质谱分析样本中缺失值超过70%的蛋白,并通过naguider使用k-最近邻方法进行插补,得到预处理后的数据集;
11.(5)对预处理后的数据集进行t检验,计算每个蛋白的表达水平的p值;计算每个蛋白的log2(fc)值,依据p值<0.05和|log2(fc)|》0.585的标准,筛选出所有差异蛋白;
12.(6)对上述差异蛋白进行受试者工作特征分析,并计算曲线下面积auc
roc
值,采用auc
roc
大于0.9和log2(fc)大于1的标准,筛选得到6种蛋白:orm2、orm1、lrg1、c9、saa1、itih3,作为mm检测的生物标志物。
13.在本发明的一些具体实例中,步骤(1)中,所述抗凝处理,包括以下步骤:向采集的血液样品中加入乙二胺四乙酸的二钾盐作抗凝剂,在4℃离心,收集上清液得到血浆样品。
14.在本发明的一些具体实例中,步骤(2)中,对所述ms2谱图进行分析和鉴定包括:用uniprotkb数据库对所述ms2谱图进行分析鉴定,通过proteome discoverer、sequest ht搜索引擎匹配肽段,并使用forward decoy方法去除假阳性肽段,鉴定得到蛋白肽段。
15.在本发明的一些具体实例中,步骤(3)中,所述dia质谱检测的过程如下:首先,以35,000的分辨率获得了350-1250m/z的全ms扫描,agc目标值为3e6,最大进样时间为20ms;接着,收集了33次ms/ms扫描,分辨率为17,500,agc目标值为1e6,归一化碰撞能量为27%,默认电荷状态设置为2,最大进样时间设置为自动,其中,具有宽隔离窗口的33次ms/ms扫描的循环如下(m/z):410m/z、430m/z、450m/z、470m/z、490m/z、510m/z、530m/z、550m/z、570m/z、590m/z、610m/z、630m/z,650m/z,670m/z,690m/z,710m/z,730m/z,750m/z,770m/z,790m/z,810m/z,830m/z,850m/z,870m/z,890m/z,910m/z,930m/z,950m/z,970m/z,990m/z,1025m/z,1075m/z,1125m/z。
16.本发明还提供了所述恶性间皮瘤的血浆蛋白生物标志物的应用。
17.在本发明的一些具体实例中,所述恶性间皮瘤的血浆蛋白生物标志物用于制备恶性间皮瘤的诊断试剂。
18.在本发明的一些具体实例中,所述恶性间皮瘤的血浆蛋白生物标志物用于制备恶性间皮瘤的治疗试剂。
19.相对于现有技术,本发明具有以下有益的技术效果:
20.(1)本发明首次提出恶性间皮瘤的血浆蛋白生物标志物,具有容易检测、非侵入型检测的优势。
21.(2)本发明中作为恶性间皮瘤的血浆蛋白生物标志物的六种蛋白,每种蛋白对恶性间皮瘤样本的鉴别均具有良好的敏感性和特异性,具有良好的诊断能力,对于恶性间皮瘤的诊断与治疗具有十分重要的意义。
22.(3)本发明的血浆蛋白生物标志物,可应用在制备用于鉴别恶性间皮瘤的诊断试剂中,有助于恶性间皮瘤的诊断,提高筛查效率,降低筛查成本,为个体化治疗提供方向,改善病人的存活率和生存质量。
附图说明
23.图1是本发明恶性间皮瘤的血浆蛋白生物标志物的筛选方法的流程示意图。
24.图2为能够展示处理后的数据集的蛋白在mm组和hc组的变化的火山图。
25.其中,横坐标log2(fold change)表示蛋白的变化方向(up或dwon)及差异倍数,纵坐标-log10(p-value)表示蛋白在统计学意义上的差异显著性(t检验中p值)。
26.图3为基于差异蛋白的所有mm和hc质谱分析样本的pca得分图。
27.图4显示每个差异蛋白的auc
roc
值和log2(fc)值,其中,每个差异蛋白的log2(fc)值以条形图可视化显示。
28.图5a显示蛋白orm2的roc(receiver operating characteristic,接受者操作特性)曲线,其auc
roc
=1.000。
29.图5b显示蛋白orm2在mm和hc中的相对丰度,log2(fc)=1.356,p=9
×
10-6
。
30.图5c显示蛋白orm1的roc曲线,其auc
roc
=0.995。
31.图5d显示蛋白orm1在mm和hc中的相对丰度,log2(fc)=2.017,p=2.9
×
10-6
。
32.图5e显示蛋白lrg1的roc曲线,其auc
roc
=0.982。
33.图5f显示蛋白lrg1在mm和hc中的相对丰度,log2(fc)=2.003,p=2.2
×
10-5
。
34.图5g显示蛋白c9的roc曲线,其auc
roc
=0.935。
35.图5h显示蛋白c9在mm和hc中的相对丰度,log2(fc)=1.005,p=2.9
×
10-6
。
36.图5i显示蛋白saa1的roc曲线,其auc
roc
=0.920。
37.图5j显示蛋白saa1在mm和hc中的相对丰度,log2(fc)=4.495,p=2.8
×
10-2
。
38.图5k显示蛋白itih3的roc曲线,其auc
roc
=0.900。
39.图5l显示蛋白itih3在mm和hc中的相对丰度,log2(fc)=1.001,p=5.4
×
10-6
。
具体实施方式
40.下面结合附图和具体实施例对本发明的实施方案进行详细描述。应理解,这些事实例仅用于说明本发明,而不应视为限定本发明的范围。
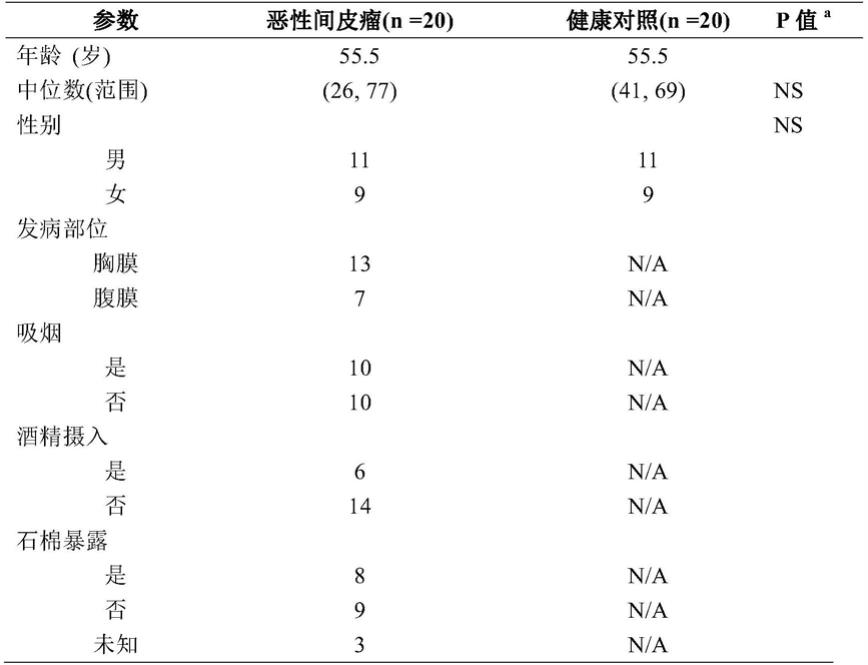
41.研究对象:本研究共包含来自于浙江省肿瘤医院的20例恶性间皮瘤患者(mm患者)血液样品以及20例正常的健康对照(hc对照)血液样品。患者在样本采集前未接受任何抗癌治疗。所有mm患者和hc对照样品的临床信息如表1所示。
42.表1:样品临床信息
[0043][0044]
注:通过卡方检验得到的p值《0.05定义为存在显著差异;ns定义为不存在显著差异。
[0045]
实验仪器包括:带紫外检测器(280nm)的高效液相色谱系统(u3000/dionex,germering,germany)、q-exactive质谱仪(thermo fisher scientific,bremen,germany,)、4℃冷藏冰箱、超滤装置(microcon,millipore-merck)、离心机、酶标仪等。实验耗材包括:xbridge peptide beh c18柱(4.6mm
×
250mm,粒径:5μm)、2cm acclaim
tm pepmap
tm c18预柱(内径:75μm,粒径:5μm)(thermo fisher scientific,waltham,usa)、25cm acclaim
tm pepmap
tm c18柱(内径:75μm,粒径:5μm)(thermo fisher scientific,waltham,usa)、1.5ml fp管、1.5ml进样瓶、300ml内插管、移液枪、1000μl枪头、200μl枪头、记号笔、乳胶手套、口罩等。实验试剂包括:丙酮、十二烷基硫酸钠、尿素、二硫苏糖醇、碘乙酰胺、胰蛋白酶(酶:蛋白质=1:100(w/w),50mm abc,0.4%sdc)、三氯乙酸、纯净水(娃哈哈)。
[0046]
以下实施例中浓度单位采用的是领域内惯用书写方式:m,mm或μm,分别代表mol/l,mmol/l或μmol/l。log2(fold change),也可简写为log2(fc)。
[0047]
图1给出了本发明恶性间皮瘤的血浆蛋白生物标志物的筛选方法的流程示意图。以下将对恶性间皮瘤的血浆蛋白生物标志物的筛选过程进行详细说明。
[0048]
一、质谱分析样本的制备
[0049]
收集来自于浙江省肿瘤医院的20例恶性间皮瘤患者的血液样品以及20例健康受试者的对照血液样品。样品临床信息如上表1所述。
[0050]
1.1制备血浆样品
[0051]
按如下方法进行抗凝处理得到血浆样品:向每份血液样本中加入乙二胺四乙酸的
二钾盐(k2-edta)做抗凝剂,并立即在4℃下以3000rpm的速度离心15分钟,收集上清液用作血浆样品,储存在-80℃下。
[0052]
1.2恶性间皮瘤患者血浆样品和健康对照血浆样品逐个进行以下前处理,分别得到恶性间皮瘤患者(mm)质谱分析样本和健康对照(hc)质谱分析样本。前处理包括以下步骤:
[0053]
1.2.1取单个血浆样品(10μl),在冰上解冻后,加入40μl冰冷的丙酮在-20℃过夜;在4℃、15,000g离心15分钟后,收集蛋白质沉淀;用300μl缓冲液(质量终浓度为4%的脱氧胆酸钠,0.1m tris-hcl ph 8.5)将所得蛋白质沉淀重新溶解,得到蛋白质溶液。使用bca(bicinchonic acid)蛋白浓度测定试剂盒beyotime,上海,中国),测定上述蛋白质溶液中蛋白质水平。
[0054]
1.2.2按照常规的基于超滤辅助的样品制备方法(fasp,filter-aided sample preparation)结合脱氧胆酸钠(sodium deoxycholate,sdc)进行蛋白质消化和脱盐,具体如下:
[0055]
量取一定量的上述蛋白质溶液,使得其中蛋白质的量为50μg,将200μl 8m尿素溶液添加其中形成混合物,再将该混合物转移到超滤离心管(10kda截断值,microcon,millipore-merck)中,在20℃、14,000r/min离心15分钟;弃去流出液,向超滤离心管中加入200μl 8m尿素溶液,在20℃、14,000r/min离心15分钟;弃去流出液,随后向超滤离心管中加入二硫苏糖醇dtt(dtt终浓度为0.1m)在65℃加热20分钟,再加入碘乙酰胺iam(iam终浓度为0.05m)在室温(20~30℃)避光放置30分钟,14,000r/min离心15分钟;弃去流出液,向超滤离心管中加入200μl8m尿素,14,000r/min离心15分钟,重复两遍;弃去流出液,向超滤离心管中加入100μl 50mm碳酸氢铵溶液,打匀,14,000r/min离心15分钟,重复两遍;最后,将超滤离心管移到新的收集管中,加入100μl胰蛋白酶消化液(酶0.5μg,50mm碳酸氢铵溶液,质量终浓度为0.4%的sdc),浓缩的蛋白质在湿室中在37℃下消化12小时,14,000r/min离心15分钟,收集流出的洗脱液,然后用50μl 0.5m nacl冲洗过滤器一次,收集洗脱液。两次收集的洗脱液用10μl体积浓度为10%三氟乙酸酸化沉淀sdc,14,000r/min离心15分钟后,收集上清液并转移至新管中。如手册(thermo fisher scientific,rockford,usa)中所述,使用c18吸头(100μl)对上述上清液进行脱盐(按手册(thermo fisher scientific,rockford,usa)中所述进行操作),并用20μl体积浓度为0.1%的甲酸溶液进行重溶,得到多肽溶液作为质谱分析样本,用于进行质谱分析。
[0056]
二、测试条件
[0057]
2.1进样说明:
[0058]
对于所有的恶性间皮瘤患者(mm)质谱分析样本和健康对照(hc)质谱分析样本,每个样本取15μl,分别转移到单独的进样瓶中,依次排序,逐个进样,每个样本的进样量为3μl,进行ms检测和分析。
[0059]
2.2液相色谱条件
[0060]
如下表2所示。
[0061]
表2 dda和dia扫描模式分离梯度条件
[0062][0063]
2.3质谱条件
[0064]
如下表3所示。
[0065]
表3 dda和dia扫描模式的质谱条件
[0066][0067]
2.4质量控制
[0068]
按照常规方法进行质控。具体如下:
[0069]
从上述所有血浆样品中,自每份血浆样品各取等体积溶液进行混合,得到混合液;再平均分装为多份,每一份为一个质量控制(qc)血浆样品。对于质量控制血浆样品,按照前述1.2的步骤进行前处理,得到质量控制(qc)质谱分析样本。每个qc质谱分析样本取15μl,分别转移到单独的进样瓶中,逐个进样(每个样本的进样量为3μl),以检测分析过程中仪器稳定性。
[0070]
使用r语言(r包corrplot)对6个质量控制(qc)质谱分析样本的原始蛋白指纹图谱进行相关性分析,显示qc质谱分析样本之间显著正相关,这表明质谱平台的稳定性较好。
[0071]
三、dia建库
[0072]
从每个质谱分析样本(包括恶性间皮瘤患者质谱分析样本和健康对照质谱分析样本)中取出相同体积的溶液,混合在一起,形成混合样本;运用dda方法扫描混合样本,得到ms谱图(一级质谱谱图);从每一帧扫描得到的ms谱图(一级质谱谱图)中选取丰度top20的肽段离子获取ms2谱图(二级质谱谱图),这样能尽可能得到更多ms2图谱,避免忽略一些丰度较低的肽段。
[0073]
用uniprotkb数据库对ms2谱图进行分析鉴定,通过proteome discoverer、sequest ht搜索引擎匹配肽段,并使用forward decoy(向前诱饵)方法去除假阳性肽段,最后将鉴定得到的蛋白肽段综合,构建成dia库。
[0074]
说明:forward指的是蛋白质组学中从提取蛋白、消化后得到肽段来鉴定的顺序方式;decoy是去除假阳性肽段的方法,通过分析软件中拟定的虚拟不存在的肽段匹配仪器检测到的肽段,然后在真实样本中删去这些肽段。
[0075]
四、质谱dia-ms检测样品
[0076]
逐一对每个质谱分析样本(包括恶性间皮瘤患者质谱分析样本和健康对照质谱分析样本)进行dia质谱检测分析,得到所有样本的dia原始文件(ms2图谱):在质量扫描方法中,首先以35,000的分辨率获得了350-1250m/z的全ms扫描,agc目标值为3e6,最大进样时间为20ms;接着,收集了33次ms/ms扫描,分辨率为17,500,agc目标值为1e6,归一化碰撞能量为27%,默认电荷状态设置为2,最大进样时间设置为自动,其中,具有宽隔离窗口的33次ms/ms扫描(隔离窗口中心)的循环如下(m/z):410、430、450、470、490、510、530、550、570、590、610、630,650,670,690,710,730,750,770,790,810,830,850,870,890,910,930,950,970,990,1025,1075,1125。
[0077]
所有样本均采用相同的色谱条件和质谱条件(如上表2和表3所示)进行分析。
[0078]
五、蛋白注释
[0079]
使用dia-nn软件(版本1.7.16)以默认参数(默认参数见https://github.com/vdemichev/diann)解析所有样品的dia原始文件,得到特征序列,根据上述构建的dia库来匹配dia-ms得到的dia原始文件中的特征序列,并同时结合uniprotkb中智人fasta数据库,对检测到的特征序列进行注释。共检测和注释了374个蛋白。通过uniprot(https://www.uniprot.org/uploadlists/)获得了相应的蛋白名称和基因名称。
[0080]
六、数据预处理
[0081]
排除在所有质谱分析样本中缺失值超过70%的蛋白(即,在超过70%的所有质谱分析样本中未检测到的蛋白),并通过na guider(https://www.omicsolution.org/wukong/naguider/)使用k-最近邻(knn)方法进行插补,得到预处理后的数据集。插补后留下了253个蛋白。即,预处理后的数据集中包含有253个已注释蛋白以及各蛋白在各样本中相对浓度。
[0082]
七、差异蛋白筛选
[0083]
7.1对上述预处理后的数据集进行学生t检验,以计算每个变量(蛋白的表达水平)在mm组和hc组中是否有显著差异,以p值(p-value)表示。用benjamini&hochberg校正法计算得到校正p值。
[0084]
7.2采用p值《0.05和|log2(fold change)|》0.585的标准,选择差异蛋白。log2(fold change)简写为log2(fc),为进行log2变换后的差异倍数。差异倍数(fold change),是指单个蛋白相对浓度在mm组中平均值除以其在hc组中平均值。
[0085]
图2为能够展示上述预处理后的数据集中的全部蛋白在mm和hc的变化(或差异)的火山图。火山图由r语言ggplot包可视化。
[0086]
图2中,down代表下调的蛋白,up代表上调的蛋白,ns代表没有显著差异的蛋白。由图2可见,相对于hc组,mm组中存在显著上调和下调的蛋白。39个蛋白满足p值《0.05和|log2(fold change)|》0.585(即,log2(fc)》0.585或《-0.585)的标准,被选为差异蛋白。39个差异蛋白中,22种蛋白上调,17种蛋白下调。蛋白名称及其相应的p值和log2(fc)如表4所示。
[0087]
表4:恶性间皮瘤和健康对照血浆差异蛋白
[0088][0089]
7.3基于上述筛选的差异蛋白,采用r包对所有样本的预处理数据进行主成分分析(principal component analysis,pca),以评估这些差异蛋白在非监督条件下(即不给分组信息)分离mm和hc方面的性能。pca模型得分图如图3所示。
[0090]
图3给出了不给分组信息的情况下主成分分析方法基于差异蛋白对健康组样品
(hc)和恶性间皮瘤组样品(mm)的分类的区分情况:健康组样品(hc)和恶性间皮瘤组样品(mm)有明显的分类趋势。即,mm组和hc组的点在基于差异蛋白的pca图中很好地分离。说明,差异蛋白能够明确分离mm和hc基团。
[0091]
7.4对上述差异蛋白进行受试者工作特征(roc)分析,并计算曲线下面积auc
roc
值,具体见上表4。
[0092]
以所有差异蛋白为横坐标,将所有差异蛋白的auc
roc
值标出并连线,将log2(fc)值通过r语言(ggplot2)可视化为条形图,显示在图4中。图4中,log2(fc)值大于0,意味着表达上调,以浅色直条表示,记为log2(fc)up;log2(fc)值小于0,意味着表达下调,以深色直条表示,记为log2(fc)down。
[0093]
选择曲线下面积(auc)值大于0.9000的差异蛋白作为显著差异蛋白。在39种差异蛋白中,共有15种差异蛋白的auc
roc
值大于0.9000,作为显著差异蛋白。
[0094]
进一步,采用auc大于0.9和log2(fc)大于1的标准,从15种显著差异蛋白中进一步筛选,得到6种蛋白(orm2、orm1、lrg1、c9、saa1、itih3),作为mm检测的生物标志物。
[0095]
通过检测每种蛋白(orm2、orm1、lrg1、c9、saa1、itih3)在所有mm样本中的敏感性和特异性,得到每种蛋白的roc曲线和每种蛋白在mm和hc中的相对丰度比较图,分别如图5a~图5l所示。
[0096]
根据检测结果,这六种蛋白的情况如下:
[0097]
①
orm2,auc
roc
=1.000(如图5a所示),log2(fc)=1.356,p=9
×
10-6
(如图5b所示);
[0098]
②
orm1,auc
roc
=0.995(如图5c所示),log2(fc)=2.017,p=2.9
×
10-6
如图5d所示);
[0099]
③
lrg1,auc
roc
=0.982(如图5e所示),log2(fc)=2.003,p=2.2
×
10-5
(如图5f所示);
[0100]
④
c9,auc
roc
=0.935(如图5g所示),log2(fc)=1.005,p=2.9
×
10-6
(如图5h所示);
[0101]
⑤
saa1,auc
roc
=0.920(如图5i所示),log2(fc)=4.495,p=2.8
×
10-2
(如图5j所示);
[0102]
⑥
itih3,auc
roc
=0.900(如图5k所示),log2(fc)=1.001,p=5.4
×
10-6
(如图5l所示)。
[0103]
上述结果表明它们作为mm检测的生物标志物具有出色的灵敏度。
[0104]
上述6种蛋白中,orm1、orm2和saa1在急性期反应中富集,而orm1、orm2和itih3在血小板脱颗粒中富集。saa1也是一种有据可查的急性期蛋白,它对炎症发挥保护作用,也被认为在癌症进展中发挥作用。itih3是inter-α-胰蛋白酶抑制剂的重链之一,通过与透明质酸共价连接来稳定细胞外基质;c9和lrg1在许多免疫相关通路中富集。c9是构成膜攻击成分(mac)的五种蛋白之一,可通过在靶细胞的膜上形成孔来引起补体依赖性细胞毒性(cdc);orm属于急性期蛋白,已被认为具有免疫抑制作用,有助于肿瘤的免疫逃逸,炎症和癌症中orm的循环水平升高。
[0105]
由此可见,根据上述鉴定方法,我们成功鉴定出六种蛋白(orm2、orm1、lrg1、c9、saa1、itih3)作为适用于恶性间皮瘤的检测标志物。本发明首次从血浆样本中筛选恶性间
皮瘤的生物标志物,揭示了一组具有重要诊断价值的检测蛋白。本发明首次提出恶性间皮瘤的血浆蛋白生物标志物,可以用于制备恶性间皮瘤的诊断试剂和治疗试剂,以及作为诊断标志物用于构建诊断模型和进行诊断应用,对于恶性间皮瘤的诊断与治疗具有十分重要的意义。
[0106]
最后,应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1