一种同时测定CAH六种相关类固醇激素的方法与流程
一种同时测定cah六种相关类固醇激素的方法
技术领域
1.本发明涉及先天性肾上腺皮质增生症筛查领域,具体涉及一种同时测定cah六种相关类固醇激素的方法。
背景技术:
2.先天性肾上腺皮质增生症(cah),是较常见的常染色体隐性遗传病,由于皮质激素合成过程中所需酶的先天缺陷所致。皮质醇合成不足,使血中浓度降低,由于负反馈作用,刺激垂体分泌促肾上腺皮质激素增多,导致肾上腺皮质增生并分泌过多的皮质醇前身物质,如11-去氧皮质醇和肾上腺雄酮等,从而发生一系列的临床症状。临床症状主要表现为:1、失盐型,为临床表现最重的一型,可表现出严重的低钠血症、嗜睡、呕吐和体重增加缓慢等情况;2、单纯的男性化,除没有严重的失盐表现外,其他雄性激素过高表现大多都会存在;3、非经典型,也就是女性患者在出生时,外生殖器正常或轻度的阴蒂肥大,没有外生殖器两性畸形。最常见的症状可能会表现为儿童的阴毛提早出现,或年轻女性中表现为严重的囊性痤疮、多毛症、多囊卵巢、月经稀发,甚至闭经。cah根据酶类型的缺乏分为6型,分别为21-羟化酶缺陷(21-ohd)、11β-羟化酶缺陷(11-ohd)、17-羟化酶缺陷、3β羟脱氢酶缺陷、皮质酮甲基氧化酶缺陷及先天性类脂质性肾上腺增生,其中最常见的是21-羟化酶缺乏症,占90%~95%,其次为11-羟化酶缺乏症,占5%~8%,其它类型的较少见。
3.由于失盐型cah患儿常有危及生命的低钠血症、高钾血症、血容量降低及休克发生,因此即使诊断筛查尤为重要。经典的21-羟化酶缺乏的病人血清17α-羟孕酮水平显著增高,因此国内cah新生儿筛查技术主要是时间分辨荧光分析法和酶联免疫法测定干滤纸片中17α-羟孕酮浓度。但是该技术由于存在交叉反应,特异性低,导致假阳性率高,阳性预测值低。而且无法有效检测出占cah中发病率相对较高的11β-羟化酶缺陷。
4.因此,提供一种更有效的cah筛查方法,提高筛查的特异性和阳性预测值具有重要的意义。
技术实现要素:
5.有鉴于此,有必要针对上述的问题,提供一种同时测定cah六种相关类固醇激素的方法,提高cah筛查的特异性和阳性预测值。
6.为实现上述目的,本发明采取以下的技术方案:
7.一种同时测定cah六种相关类固醇激素的方法,所述六种相关类固醇激素为17α-羟孕酮、雄烯二酮、11-脱氧皮质醇、21-脱氧皮质醇、皮质醇和皮质酮;包括以下步骤:
8.步骤s1:分别制备混合内标准品、质控品和标准曲线制品:所述混合内标准品为17α-羟孕酮同位素内标准品、雄烯二酮同位素内标准品、11-脱氧皮质醇同位素内标准品、21-脱氧皮质醇同位素内标准品、皮质醇同位素内标准品和皮质酮同位素内标准品的混合物;所述质控品为含有已知浓度的17α-羟孕酮、雄烯二酮、11-脱氧皮质醇、21-脱氧皮质醇、皮质醇和皮质酮六种类固醇激素的人全血滤纸干血片;所述标准曲线制品为含有已知系列浓
度的17α-羟孕酮、雄烯二酮、11-脱氧皮质醇、21-脱氧皮质醇、皮质醇和皮质酮六种类固醇激素的人全血滤纸干血片;
9.步骤s2:制备样本提取液:在混合内标准品中加入有机溶剂,溶解后稀释;
10.步骤s3:提取和孵育样本:用样本提取液分别提取标准曲线制品以及待测样本,然后进行孵育;
11.步骤s4:浓缩复溶样本:分别对孵育后的上清液进行浓缩后,并加入50%甲醇复溶,得到复溶液;
12.步骤s5:测试:用液相色谱串联质谱仪对复溶液进行测定,绘制校准曲线,计算待测样本中17α-羟孕酮、雄烯二酮、11-脱氧皮质醇、21-脱氧皮质醇、皮质醇和皮质酮的浓度。
13.进一步的,所述标准曲线制品的系列浓度为8个,依次为0.5ng/ml、2.5ng/ml、12.5ng/ml、25ng/ml、50ng/ml、100ng/ml、20ng/ml和400ng/ml。
14.进一步的,所述质控品包括低浓度、高浓度两套质控品。
15.进一步的,所述标准曲线制品的制备方法为在空白全血中加入六种相关类固醇激素的混合内标准品,配制成含不同浓度混合内标准品的全血溶液;取50μl含不同浓度混合内标准品的全血溶液在采集卡上,通风橱内晾干4h以上后,密封保存。
16.进一步的,步骤s2中所述有机溶剂为甲醇。
17.进一步的,步骤s3中提取样本的具体方式为分别将标准曲线制品以及待测样本干血斑打出血点,放入96孔v型板对应孔中,每个样本每孔需2个血点,然后将96孔v型板盖上封口膜,并密封。
18.进一步的,步骤s3中所述孵育的条件为孵育温度25~40℃、孵育转速500rpm~700rpm、孵育时间35~70分钟。
19.进一步的,步骤s4中浓缩的具体方式为对孵育后的样本以4000rpm离心5min,吸取150μl上清液加入另一空白96孔v型板中,采用氮气吹干的方式进行浓缩;复溶的具体方式为加入75μl的50%甲醇,密封后震荡,然后在4℃,4000rpm离心2分钟,取上清液为复溶液;
20.进一步的,步骤s5中液相色谱串联质谱仪的色谱条件为:流动相包括流动相一和流动相二,所述流动相一由水中添加乙酸铵和甲酸制成;所述流动相二由甲醇中添加乙酸铵和甲酸制成;色谱柱温为40~55℃。
21.优选的,所述流动相一为2~3mmol/l乙酸铵+0.1~12%甲酸的水溶液;所述流动相二为2~3mmol/l乙酸铵+0.1~12%甲酸的甲醇溶液。
22.进一步的,步骤s5中液相色谱串联质谱仪的质谱条件为:检测方式:多反应监测;毛细管电压:2.8~3kv;离子源温度:100~200℃;脱溶剂气温度:550~600℃;锥孔气流:100~200l/hr;脱溶剂气流:1000~1200l/hr。
23.本发明的有益效果为:本发明提供了一种可以同时测定cah六种相关类固醇激素的方法,六种相关类固醇激素为17α-羟孕酮、雄烯二酮、11-脱氧皮质醇、21-脱氧皮质醇、皮质醇和皮质酮。本发明能够有效提高cah筛查的特异性和阳性预测值。检测分析物中包含皮质酮,使得cah筛查更有效的区分11-ohd和21-ohd,提高cah筛查效率。
附图说明
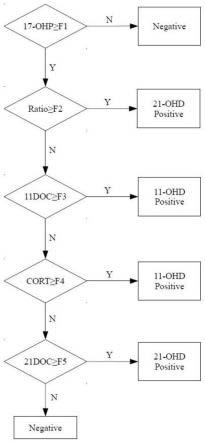
24.图1是cah判读流程图;
25.图2是六种相关类固醇激素的mrm色谱图。
具体实施方式
26.为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明实施例,对本发明的技术方案作进一步清楚、完整地描述。需要说明的是,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
27.本发明中17α-羟孕酮同位素内标准品、雄烯二酮同位素内标准品、11-脱氧皮质醇同位素内标准品、21-脱氧皮质醇同位素内标准品、皮质醇同位素内标准品和皮质酮同位素内标准品,均可采用市售的各种同位素标准品。
28.本发明实施例中所用的六种相关类固醇激素内标准品分别为美国剑桥公司提供的17α-羟孕酮同位素标准品、皮质醇同位素标准品、皮质酮同位素标准品;cerilliant公司提供的11-脱氧皮质醇同位素标准品、21-脱氧皮质醇同位素标准品,sigma公司提供的雄烯二酮同位素标准品;
29.本发明实施例中所用液相色谱-串联质谱仪为waters acquity uplc i-class/xevotm tq-s;
30.本发明实施例中甲醇、甲酸、乙酸铵均为色谱纯。
31.实施例1
32.一种同时测定cah六种相关类固醇激素的方法,所述六种相关类固醇激素为17α-羟孕酮、雄烯二酮、11-脱氧皮质醇、21-脱氧皮质醇、皮质醇和皮质酮;包括以下步骤:
33.步骤s1:分别制备混合内标准品、质控品和标准曲线制品;
34.所述混合内标准品为17α-羟孕酮同位素内标准品、雄烯二酮同位素内标准品、11-脱氧皮质醇同位素内标准品、21-脱氧皮质醇同位素内标准品、皮质醇同位素内标准品和皮质酮同位素内标准品的混合物;混合内标准品中包括25ng的17α-羟孕酮同位素内标准品、25ng的雄烯二酮同位素内标准品、12.5ng的11-脱氧皮质醇同位素内标准品、12.5ng的21-脱氧皮质醇同位素内标准品、25ng的皮质醇同位素内标准品和12.5ng的皮质酮同位素内标准品;
35.所述标准曲线制品为含有已知系列浓度的17α-羟孕酮、雄烯二酮、11-脱氧皮质醇、21-脱氧皮质醇、皮质醇和皮质酮六种类固醇激素的人全血滤纸干血片;所述标准曲线制品的制备方法为在空白全血中加入六种相关类固醇激素的混合内标准品,配制成含系列浓度混合内标准品的全血溶液;取50μl含不同浓度混合内标准品的全血溶液在采集卡上,通风橱内晾干4h以上后,密封保存。标准曲线制品的系列浓度为8个,依次为0.5ng/ml、2.5ng/ml、12.5ng/ml、25ng/ml、50ng/ml、100ng/ml、20ng/ml和400ng/ml,分别标记为a为h。
36.所述质控品为含有已知浓度的17α-羟孕酮、雄烯二酮、11-脱氧皮质醇、21-脱氧皮质醇、皮质醇和皮质酮六种类固醇激素的人全血滤纸干血片;所述质控品的制备方法为在空白全血中加入六种相关类固醇激素的混合内标准品,配制成已知浓度混合内标准品的全血溶液;取50μl含已知浓度混合内标准品的全血溶液在采集卡上,通风橱内晾干4h以上后,密封保存。所述质控品包括低浓度、高浓度两套质控品,低浓度质控品中六种类固醇激素的浓度均是10ng/ml、高浓度质控品中六种类固醇激素的浓度均是125g/ml。
37.步骤s2:制备样本提取液:在混合内标准品中600μl甲醇,震荡溶解,作为内标品储备液;按照内标品储备液:甲醇为1:99的比例进行稀释,作为样本提取液;
38.步骤s3:提取样本:用样本提取液分别对质控品、标准曲线制品以及待测样本进行孵育,孵育方式为将96孔v型板置于恒温混匀仪上,设置25℃,500转/分钟,混匀30分钟;样本的制备方法为分别将标准曲线制品以及待测样本干血斑打出血点,放入96孔v型板对应孔中,每个样本每孔需2个血点,然后将96孔v型板盖上封口膜,并密封;
39.步骤s4:浓缩复溶样本:分别对孵育后的样本以4000rpm离心5min,吸取150μl上清液加入另一空白96孔v型板中,采用氮气吹干的方式进行浓缩;然后并加入75μl的50%甲醇复溶,密封后震荡,然后在4℃,4000rpm离心2分钟,取上清液为复溶液;
40.步骤s5:测试:用液相色谱串联质谱仪对复溶液进行测定,绘制校准曲线,以保留时间和特征离子对定性,内标法定量,计算待测样本中17α-羟孕酮、雄烯二酮、11-脱氧皮质醇、21-脱氧皮质醇、皮质醇和皮质酮的浓度。
41.测试过程的色谱条件为:
42.色谱柱:waters acquity uplc hss t3 1.8μm(2.1
×
50mm)column;
43.流动相一:2~3mmol/l乙酸铵+0.1~12%甲酸的水溶液;
44.流动相二:2~3mmol/l乙酸铵+0.1~12%甲酸的甲醇溶液;
45.柱温40~55℃;进样体积10μl,流速0.5~1ml/min;梯度洗脱:0~2.5min,45%流动相二~57%流动相二;2.5min~4min,90%流动相二;4.1min~5min,57%流动相二~45%流动相二。
46.测试过程的质谱条件为:
47.采用esi+电喷雾正离子模式;检测方式:多反应监测(mrm);毛细管电压:2.8~3kv;离子源温度:100~200℃;脱溶剂气温度:550~600℃;锥孔气流:100~200l/hr;脱溶剂气流:1000~1200l/hr。
48.实施例2
49.采用实施例1的同时测定cah六种相关类固醇激素的方法,得到六种相关类固醇激素的定量测定结果,用于筛查11-ohd和21-ohd两大类常见的缺陷型cah。判读流程如图1所示,图中,y=yes,n=no,negative代表阴性,即健康人群,positive代表阳性,即患病;f1=17α-ohp新生儿阈值为1.0~2.0,小于f1为健康,大于f1进行下一步判读;f2=(17α-ohp+a4)/f,f2的阈值为0.05~0.1,大于f2为21-ohd,小于f2进行下一步判读;f3=s,f3的阈值为2.0~2.5,大于f3为11-ohd,小于f3进行下一步判读;f4=cort,f4的阈值为1.0~2.0,小于f4为11-ohd,大于f4进行下一步判读;f5=21doc,f5的阈值为1.0~2.0,大于f5为21-ohd,小于f5为健康。
50.其中,17-ohp即17α-羟孕酮的浓度,a4即雄烯二酮浓度,f即皮质醇浓度,s即11-脱氧皮质醇的浓度,21doc即21-脱氧皮质醇浓度,cort即皮质酮浓度,浓度单位ng/ml。
51.检测方法分析
52.一、按照实施例1的检测方法对质控品采用液相色谱串联质谱仪检测,检测适配性,mrm监测模式下六种类固醇激素的液相色谱串联质谱参数如表1和图1所示。
53.表1六种类固醇激素的液相色谱串联质谱参数
[0054][0055][0056]
由表1和图1可知,检测的各个分析物均有明显的响应,符合灵敏度要求。
[0057]
二、检测方法线性范围及检出限
[0058]
采用实施例1的检测方法检测六种相关类固醇激素,采用内标法,以待测样品的质量浓度作为横坐标,以待测样品定量离子峰面积与内标物峰面积之比作为纵坐标,绘制标准曲线。六种类固醇激素的线性方程、相关系数如表2所示。相关系数(r2)均大于0.99。
[0059]
表2六种类固醇激素的线性方程和相关系数
[0060]
类固醇激素名称线性方程相关系数17α-羟孕酮y=1.2354x-1.72030.9991雄烯二酮y=1.1359x+0.15330.999811-脱氧皮质醇y=1.0539x-1.01330.999921-脱氧皮质醇y=1.2196x-2.51060.9993皮质醇y=1.1359x-2.36180.9997皮质酮y=1.0461x-1.21290.9999
[0061]
此外,用实施例1的检测方法对空白干血斑样品进行检测,以3倍信噪比为检出限。六种类固醇激素的检出限均<1.5ng/ml。
[0062]
三、检测方法准确度和精密度
[0063]
采用实施例1的检测方法分别平行检测两套质控品各10次,计算检测浓度平均值(m)、标准差(sd)。分别得到六种相关类固醇激素的变异系数(cv)和回收率。结果如表3,显示六种类固醇激素的回收率在91.7%~107.0%之间,变异系数(cv)小于20%。以上实验结果表明本检测方法的回收率高,结果可靠,适用于同时检测六种类固醇激素。
[0064]
表3六种类固醇激素的回收率和变异系数(n=10)
[0065]
类固醇激素名称回收率/%变异系数(cv)/%17α-羟孕酮107.0%3.12%雄烯二酮101.4%5.30%11-脱氧皮质醇91.7%6.11%21-脱氧皮质醇104.6%4.01%皮质醇98.5%3.51%皮质酮99.1%5.00%
[0066]
四、临床样本实例
[0067]
采用实施例1的检测方法检测六例临床样本,检测结果见表4。根据图1的判读流程和标准:样本一、样本二、样本四、样本五、样本六判为阴性,样本三判为11-ohd阳性,均与基因检测结果一致。表明本发明的检测方法准确。
[0068]
其中,样本三仅根据17α-羟孕酮、雄烯二酮、皮质醇、11-脱氧皮质醇、21-脱氧皮质醇五种类固醇激素的浓度进行疾病判读,仅能判读为21-ohd,无法确认病例属于更罕见的11-ohd。而根据该病例的六种类固醇激素的检测结果一起评判,很好区分了11-ohd和21-ohd。
[0069]
表4临床样本实例
[0070][0071][0072]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1