一种同时鉴别10种龟鳖甲类中药的液质联用法的制作方法
1.本发明涉及龟鳖甲类中药的鉴别法。特别涉及一种同时鉴别10种龟鳖甲类中药的液质联用法。
背景技术:
2.中国药典2020年版一部规定,龟甲为龟科动物乌龟chinemys reevesii(gray)的背甲及腹甲,鳖甲为鳖科动物鳖trionyx sinensis wiegmann的背甲,来源均为单一种
1.。龟鳖目动物是现存爬行动物中特化的类群,是种类较多的科属,常有用其他来源龟鳖混充正品龟鳖甲的情况。
3.常见正伪品龟鳖甲性状如下:
4.1、乌龟甲(正品)
5.背甲:呈椭圆形拱状,边缘整齐,前端略凹入,后端圆,前窄后宽,背棱3条,其正中的1条隆起较明显。长9-16cm,宽6-12cm,高3-6cm。外表面棕色。椎盾、肋盾上的偏心多角环形角质层纹及缘盾上的“》”形角质层纹明显。颈盾1枚,类倒心形,前端平截,后端凹入,明显宽于前端。第3椎盾六边形前窄后宽。缘盾左右各11枚,类长方形,纵列,盾片外侧缘及内侧缘前后排列基本整齐,第11缘盾明显较臀盾小。臀盾2枚,类长方形,横列,连接处稍凹入。
6.腹甲:呈板片状,近长方椭圆形,长8~15cm,宽5~8cm,前端平截,后端具三角形深缺刻,两侧有呈翼状向后弯曲的甲桥。外表面淡黄色。角质盾片12块,每块具紫褐色放射状纹理或大部分呈紫褐色。
7.2、巴西龟甲(伪品)
8.背甲:其背面为翠绿色或苹果绿色,颜色鲜艳,背部中央有一条显著的脊棱。背甲上每一块盾片都有较细的黄色和绿色相间的平行或环行条纹,盾片之间的界线十分清晰,缘盾有11块盾片,外边缘为金黄色,背甲的边缘呈不显著的锯齿状。
9.腹甲:从喉盾至肛盾共有12块盾片,全为淡黄色,每一块上面均有左右对称的圆形、椭圆形、棒形或略呈蝶形的色斑。
10.3、花龟甲(伪品)
11.背甲:背甲具3棱,脊棱明显,略断续。侧棱由每枚肋板的一个突起相间连接而成。颈盾梯形或长方形。椎盾5枚,第一枚五边形,第二至第四枚六边形,宽均大于长。肋盾4对,呈不规则四边形。缘盾12对,两侧的缘盾微向上翻。各盾片均有同心纹及中心疣轮。缘盾的中心疣轮位于外侧后缘。肋盾的位于背上方。椎盾的位于后缘中线。
12.腹甲:腹甲平,前缘平直,后缘凹入。腹部淡棕黄色,每块盾片的中部有一粟色大斑。各腹盾缝的长度依次为:腹盾缝》胸盾缝》股盾缝》喉盾缝》肛盾缝》肱盾缝。腋盾及胯盾大。无下缘盾。各盾缝不平直。
13.4、黄喉拟水龟甲(伪品)
14.背甲:呈椭圆形拱状,背棱3条,正中1条起隆明显。长9~14cm,宽6~11cm,高3~6cm。表面黄棕色。盾片的角质层纹不明显。颈盾类梯形,后端略凹入。第3椎盾六边形。缘盾
及臀盾类方形。
15.腹甲:呈板片状,近长方椭圆形,长8~12cm,宽5~9cm,前端平截,后端具三角形深缺刻,两侧有呈翼状向后弯曲的甲桥。外表面黄色,有放射状黑色斑纹。股盾间的中缝线最长,喉盾间的中缝线最短。内表面黄白色,肱盾与胸盾缝的交叉处在内板之下。
16.5、黄缘闭壳龟甲(伪品)
17.背甲:呈椭圆形拱状,背棱3条,中央有1条明显隆起。长10~16cm,宽7~11cm,高4~7cm。表面棕褐色。盾片角质层纹十分明显,环纹中心色泽稍浅,并多具密集的点状突起。颈盾前宽后窄。第3椎盾八边形。缘盾近方形,渐变横列的长方形。臀盾长方形,横列。
18.腹甲:呈板片状,近长方椭圆形,长9~12cm,宽7~10cm,前后两端圆钝,两侧无甲桥。外表面黑褐色,板缘黄色。腹盾间的中缝线最长,肱盾及股盾间的中缝线最短,胸腹盾间为韧带组织相连。内表面灰白色,肱盾与胸盾缝的交叉处在内板中,舌板和下板间具一横褶纹。
19.6、缅甸陆龟甲(伪品)
20.背甲:有颈盾、臀盾1枚,拱起显著,颈盾长而窄,前后缘盾稍翻卷.略成锯齿.黄绿色,每一盾片上有黑斑块。
21.腹甲:呈板片状,近长方椭圆形,长9~21cm,宽8~12cm,前端微凹入,后端具三角形深缺刻,两侧有呈翼状向后弯曲的甲桥。外表面黄绿色。各盾片上均有与盾片大小成正比的黑斑及向外缘折射的“[”形纹理。腹盾中间的中缝线最长,肛盾间的中缝线最短,有腑盾和胯盾。内表面灰白色,颈板上部明显增厚,肱盾与胸盾缝的交叉处在内板中。
[0022]
7、小鳄龟甲(伪品)
[0023]
背甲:呈卵圆形,棕褐色,长与宽相近,每块盾片均有棘状突起,且从棘的顶点向左、右、前三个方向形成放射状条纹,背甲后缘呈锯齿状。颈盾l块,近似矩形;椎盾5块,前3块几乎等宽,第4块略小,第5椎盾近似五边形;肋盾左右各4块,第l块最长,第4块最小;缘盾单行,左右各11块,后2块呈锯齿状;臀盾2块,亦呈锯齿状。
[0024]
腹甲:较小,十字形。喉盾2块,最短小,呈不规则形;肱盾2块,呈三角形;胸盾2块,呈矮梯形,是腹甲中最大、最宽的一对盾片;股盾2块,近似倒矮梯形;胸盾与股盾接界内侧呈近似菱形缺刻;腹盾2块,着生于胸盾与股盾接界外缘,近似方长条形;肛盾2块,呈近似倒三角形,两前缘线未连成直线。甲桥宽短。腋盾每侧1块,小而不规则;胯盾每侧1块,不规则形,小于腋盾;下缘盾每侧2块,不规则形,明显大于腋盾。
[0025]
8、印度棱背龟甲(伪品)
[0026]
背甲:呈椭圆形拱状,背棱1条,前后缀连。长14~18cm,宽11~13cm,高5~6cm。表面灰褐色。肋盾及椎盾的盾缘具黑色不规则斑纹。盾片的角质层纹不明显。颈盾类方形,后端略凹入。第3椎盾倒心形,其脊棱突起明显且前低后高。缘盾类方形,后侧缘盾外缘略齿状突出,臀盾类方形。
[0027]
腹甲:呈板片状,近长方椭圆形,长13~17cm,宽6~11cm,前段平截,后端三角形浅刻缺,两侧有翼状向后弯曲的甲桥。腹、股盾中缝最长,喉盾中缝最短、盾片较薄,对光透视,呈半透明状,外表面浅黄色,每盾片及甲桥上均有1~4块条状黑斑。
[0028]
9、鳖(正品)
[0029]
鳖甲(背甲):呈类椭圆形,背部稍隆起,长10-15cm,宽9-14cm。外表面灰褐色或墨
绿色,有不规则细密蠕虫状凹坑纹理及灰黄色或灰白色斑点。中间可见椎板7-8枚,前端有翼状颈板、块,两侧各有左右对称的肋板8块,椎板纵列,每块椎板呈不规则长方形,其中第1对肋板于背脊部彼此相接,无缘板。内表面类白色,中部有突起的椎骨,颈骨翼状,其外侧下缘与第1肋骨相接,肋骨8对,分列于椎骨两侧,呈长条状,先端多伸出肋板外缘。
[0030]
10、佛罗里达鳖(伪品)
[0031]
佛罗里达鳖甲(背甲):体形较大,呈长椭圆形,背部稍隆起,长可达50厘米,背甲前缘较光滑,有数列疣粒,背甲周围有一条黄色条纹,佛罗里达鳖又称美国山瑞,原产于美国,为鳖科软鳖属动物。
[0032]
长期以来龟甲及鳖甲存在混伪品充斥市场的现象,真伪鉴别一直是难点,特别是加工成饮片需要经高温蒸煮、去皮及砂烫醋淬并捣碎,其性状鉴别特征消失,难以鉴别,不利于龟鳖甲的质量控制体系建立
[2-3]
。
[0033]
近年来dna测序、特异性pcr等方法已用于龟鳖甲类中药鉴别,但目前还有许多不足,如无法确定掺伪量、对醋制品鉴定效果不理想
[4-5]
。特征肽技术已成功应用于胶类药材的鉴别和掺伪检测
[6-9]
,随着研究的深入,现有的特征肽检测方法尚不能满足需要,需将研究重点转移到近缘动物药材质量控制上,例如龟甲胶特征肽肽段(质荷比(m/z):631.3),仅能用于龟甲胶与驴皮源,牛皮源、鹿源性等胶类成分的区别,并不能用于正伪品龟甲之间的区别。
[0034]
涉及的参考文献如下:
[0035]
[1]国家药典委员会.中华人民共和国药典(2020年版一部)[m].北京:化学工业出版社,2020:180,384
[0036]
[2]肖凌,张飞,康帅,等.龟甲本草考证及现代药用品种整理[j].中药材,2018,41(3):740-744
[0037]
[3]刘宇文,邹耀华,侯娜.特征肽技术用于龟甲(浙龟甲)中掺巴西龟的检查研究[j].中国现代应用药学,2019,36(22):2810-2813
[0038]
[4]程素倩,袁媛,刘富艳,等.特异性pcr方法鉴别鳖甲药材和饮片[j].中国中药杂志,2018,43(23):4569-4574
[0039]
[5]茅纯,郑娟,施思,等.浙龟甲的pcr鉴别研究[j].中国现代应用药学,2019,36(11):1363-1366
[0040]
[6]李明华,龙国友,程显隆,等.超高效液相色谱-三重四极杆质谱法用于中成药中胶类成分的检测研究[j].中国药学杂志,2015,50(24):2151-2153
[0041]
[7]徐清,李梦,罗雪梅,等.采用聚丙烯酰氨凝胶电泳技术鉴别龟甲及其混伪品[j].中国现代中药,2019,21(09):1251-1255
[0042]
[8]唐敏,严建业,任杰,等.基于uplc-qtof/ms和unifi二元比较鉴别巴西龟龟甲胶和草龟龟甲胶(英文)[j].digital chinese medicine,2019,2(01):50-58
[0043]
[9]刘宇文,杨直,谌宇,等.液质联用多肽识别技术鉴别鳖甲胶的研究[j].中国现代应用药学,2019(24):3061-3063
技术实现要素:
[0044]
本发明要解决的技术问题是提供一种同时鉴别10种龟鳖甲类中药的液质联用法。
[0045]
为解决上述技术问题,本发明提供一种同时鉴别10种龟鳖甲类中药的液质联用法,包括如下步骤:
[0046]
1)、获得待测样品溶液(样品预处理);
[0047]
2)、设定色谱及质谱检测条件;
[0048]
3)、数据计算分析。
[0049]
具体如下:
[0050]
1)、获得待测样品溶液(样品预处理):
[0051]
当待测样品为固体时,将待测样品先进行提取,所得提取液进行预处理,得待测样品溶液;
[0052]
当待测样品为液体时,将待测样品直接进行预处理,得待测样品溶液;
[0053]
2)、设定色谱及质谱检测条件:
[0054]
①
、色谱条件:
[0055]
色谱柱:zorbax eclipse plus c18(1.8μm,2.1mm
×
150mm);
[0056]
流速:0.3ml
·
min-1
;柱温:35℃;
[0057]
流动相包括流动相a和流动相b,流动相a:0.1%甲酸(即,体积浓度为0.1%的甲酸水),流动相b:乙腈;
[0058]
梯度洗脱程序为:0~25min,a:95%
→
80%,b:5%
→
20%;25~50min,a:80%
→
5%,b:20%
→
95%;后运行时间(平衡系统时间):3min;进样量1μl。
[0059]
②
、质谱条件:
[0060]
仪器:6540超高效液相色谱-串联三重四级杆质谱联用仪;
[0061]
质谱条件:esi+离子源;扫描范围100~3200da;
[0062]
扫描模式:多反应检测(mrm);
[0063]
离子源参数:雾化气(氮气):50psi;干燥气(氮气):流速为14l
·
min-1
;干燥气温度:200℃;鞘气流速:11l
·
min-1
;鞘气温度:325℃;毛细管电压:4kv;碎裂电压:166v;二级质谱碰撞气:高纯氮气;
[0064]
特征离子mrm采集参数如下:
[0065][0066][0067]
乌龟的背甲及腹甲、鳖的背甲为正品;
[0068]
巴西龟、花龟、黄喉拟水龟、黄缘闭壳龟、缅甸陆龟、小鳄龟、印度楞背龟的背甲及腹甲和佛罗里达鳖的背甲为伪品;
[0069]
3)、数据计算分析:
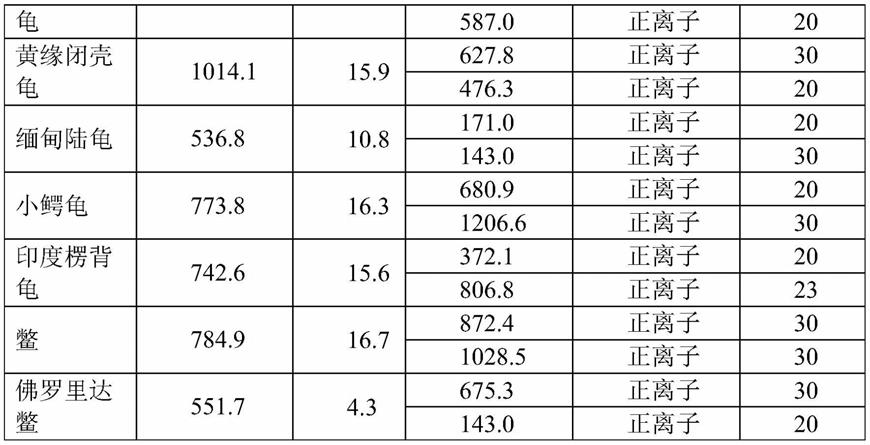
[0070]
取步骤1)所得的待测样品溶液1μl,注入超高效液相色谱-质谱联用仪,按照步骤2)设定的条件进行测定;并根据测定结果来判断待测样品是正品还是伪品。
[0071]
作为本发明的同时鉴别10种龟鳖甲类中药的液质联用法的改进,所述步骤3)为:
[0072]
待测样品溶液按照步骤2)设定的条件进行测定,待测样品溶液的mrm提取离子流图色谱中,在如上表所示的10个品种相应的保留时间,同时获得该品种对应的2对特征肽提取离子流色谱峰,且信噪比大于3,认为检出该品种,反之,则判断为未检出该品种。
[0073]
作为本发明的同时鉴别10种龟鳖甲类中药的液质联用法的进一步改进,所述步骤1)为:
[0074]
当待测样品为固体时:将待测样品粉碎(过4号筛),取1g粉碎后待测样品,加入50ml水,先室温浸泡1h,然后加热回流提取1h;回流提取液冷却至室温后,再加入nh4hco
3 0.5g搅拌至溶解,静置(静置至溶液澄清),取上清液用0.22μm微孔滤膜过滤;取100μl滤液,加胰蛋白酶溶液10μl,混匀,37℃恒温酶解12h,得待测样品溶液;
[0075]
当待测样品为液体时,在待测样品中加入碳酸氢铵搅拌至溶解,使碳酸氢铵的终浓度为1%(质量%),静置(静置至溶液澄清),取上清液用0.22μm微孔滤膜过滤,取100μl滤
液,加胰蛋白酶溶液10μl,混匀,37℃恒温酶解12h,得待测样品溶液;
[0076]
胰蛋白酶溶液的制备方法为:在质量浓度为1%的nh4hco3水溶液1ml中,加入1mg胰蛋白酶并搅拌溶解,得胰蛋白酶溶液。
[0077]
说明:该胰蛋白酶溶液临用前现配制。
[0078]
本发明借鉴胶类药材的特征肽鉴别技术,应用液相色谱质谱联用仪,将该技术用于市场上常见10种龟鳖甲类正伪品中药的鉴别及含龟鳖类成分产品投料情况的检测,以期为龟鳖甲类中药正本清源提供准确、简便、可靠的鉴别方法。
[0079]
本发明在发明过程中考虑了以下问题:
[0080]
当前保护野生动物资源已经成为广大中药工作者的共识,使用野生动物作为药用的安全性问题也不能得到保障,乌龟与鳖的养殖已经获得成功,养殖技术也非常成熟,完全能够满足中药临床用药需要,因此杜绝将印度棱背龟、缅甸陆龟等国外野生龟鳖甲混入正品龟鳖甲中是当务之急;而巴西龟、佛罗里达鳖等外来物种也在大量养殖,有可能破坏生态平衡,且不符合龟鳖甲的基源要求,不宜作为药用。此前研究认为鳖甲混伪品还包括鼋、斑鳖和山瑞鳖,但目前斑鳖几近绝灭,而鼋及山瑞鳖1994年开始就已列入濒危物种,已难以进入中药市场,因此未纳入本发明研究范围。
[0081]
利用特征肽段离子鉴别动物类中药的第一步也是关键的一步就是确定合适的特征肽段,由于龟鳖甲类中药所涉及的龟鳖动物蛋白研究较少,多数龟鳖动物蛋白序列都未录入蛋白质序列数据库中,无法通过对采集的数据进行蛋白质鉴定来查找特征肽段,因此本发明采用超高效液相色谱-四级杆飞行时间质谱与化学统计分析方法相结合对酶解样品溶液进行分析,筛选出了10种市场上常见的正伪品龟鳖甲类中药各自的特征肽段,这些特征肽段具有很强的重复性和专属性,能很好地区分龟鳖甲类中药的正伪品,可达到对龟鳖类中药正本清源的目的,同时该系列特征段还可用于含龟鳖甲类中成药的鉴别研究。胶原蛋白的提取有很多方法,如碱提法、酸提法、酶提法,方法均较为复杂,考虑到临床用药主要采用煎煮法,也考虑方法的简便性和可操作性,供试品提取方法是在2020年版中国药典龟甲浸出物提取方法基础上,通过实验考察粉碎程度、取样量、提取时间等因素,最终确定下来。
[0082]
2020年版中国药典一部规定龟甲胶为龟甲经水煎煮、浓缩制成的固体胶,而龟甲为龟科动物乌龟chinemys reevesii(gray)的背甲及腹甲。本发明经过研究发现,2020年版中国药典一部所收载的龟甲胶特征肽(m/z:631.3)在多种龟甲混淆品中有检出,例如巴西龟、花龟等,因此龟甲胶特征肽(m/z:631.3)的专属性有待商榷。另外,文献研究报道牛皮特征肽段a(m/z:641.3)可以用于巴西龟甲胶与乌龟甲胶的区分
[8]
,但本研究发现,牛皮特征肽段a(m/z:641.3)仅存在于巴西龟甲的外皮部分,去皮后的巴西龟甲并不能检出牛皮特征肽段a(m/z:641.3),因此该特征肽段并不能很好地作为巴西龟甲的特征离子,而本发明所查找的巴西龟甲特征肽(m/z:400.2)在去皮巴西龟甲中也能很好地检出,专属性更强。
[0083]
本发明的提取方法与2020年版中国药典龟甲浸出物提取方法的区别在于:1、样品的粉碎程度不一样,浸出物提取方法要求过二号筛即可,本发明的提取方法要求样品过四号筛,粉末更细,提取效果更好;2、取样量不一样,浸出物提取方法要求取2~4g,本发明的提取方法要求样品取1g,取样量更少。
[0084]
本发明的有益效果(技术优势)主要体现在:本发明的技术方案可以同时检测多种
龟鳖甲类中药,准确度高、专属性强,能够有效识别龟鳖甲类中药正伪品,防止掺伪情况,保障龟鳖甲类中药的质量,同时也打击非法销售保护动物的行为。
附图说明
[0085]
下面结合附图对本发明的具体实施方式作进一步详细说明。
[0086]
图1为乌龟甲的总离子流图;
[0087]
图2为巴西龟甲的总离子流图;
[0088]
图3为黄喉拟水龟甲的总离子流图;
[0089]
图4为黄缘闭壳龟甲的总离子流图;
[0090]
图5为花龟甲总离子流图;
[0091]
图6为小鳄龟甲总离子流图;
[0092]
图7为缅甸陆龟甲总离子流图;
[0093]
图8为印度棱背龟甲的总离子流图;
[0094]
图9为鳖甲的总离子流图;
[0095]
图10为佛罗里达鳖甲的总离子流图;
[0096]
图11为维恩图;
[0097]
图12为乌龟甲的特征肽段二级质谱图;
[0098]
图13为巴西龟甲的特征肽段二级质谱图;
[0099]
图14为花龟甲的特征肽段二级质谱图;
[0100]
图15为黄喉拟水龟甲的特征肽段二级质谱图;
[0101]
图16为黄缘闭壳龟甲的特征肽段二级质谱图;
[0102]
图17为缅甸陆龟甲的特征肽段二级质谱图;
[0103]
图18为小鳄龟甲的特征肽段二级质谱图;
[0104]
图19为印度棱背龟甲的特征肽段二级质谱图;
[0105]
图20为鳖甲的特征肽段二级质谱图;
[0106]
图21为佛罗里达鳖甲的特征肽段二级质谱图;
[0107]
图22为乌龟甲的特征肽段mrm色谱图;
[0108]
图23为巴西龟甲的特征肽段mrm色谱图;
[0109]
图24为花龟甲的特征肽段mrm色谱图;
[0110]
图25为黄喉拟水龟甲的特征肽段mrm色谱图;
[0111]
图26为黄缘闭壳龟甲的特征肽段mrm色谱图;
[0112]
图27为缅甸陆龟甲的特征肽段mrm色谱图;
[0113]
图28为小鳄龟甲的特征肽段mrm色谱图;
[0114]
图29为印度棱背龟甲的特征肽段mrm色谱图;
[0115]
图30为鳖甲的特征肽段mrm色谱图;
[0116]
图31为佛罗里达鳖甲的特征肽段mrm色谱图;
[0117]
图32是典型样品图。
具体实施方式
[0118]
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
[0119]
1仪器与试药
[0120]
1.1仪器
[0121]
6540超高效液相色谱-串联四级杆飞行时间质谱联用仪(美国,agilent);tw-8电热恒温水浴锅(德国,julabo);xs105电子天平(瑞士,mettler)。
[0122]
1.2试剂
[0123]
胰蛋白酶为质谱级(批号:slbz8570,sigma公司);甲酸、乙腈均为质谱级;碳酸氢铵为分析纯;超纯水为milli-q纯水。
[0124]
1.3样品
[0125]
通过药材市场购买、活龟鳖宰杀、标本室调用等形式获得乌龟(chinemys reevesii(gray))、巴西龟(trachemys scripta elegans(wied))、花龟(ocadia sinensis(gray))、黄喉拟水龟(clemmys mutica(cantor))、黄缘闭壳龟(cyclemys flavomarginata gray)、缅甸陆龟(testudo elongate(blyth))、印度棱背龟(kachuga tectum(gray))、小鳄龟(chelydra serpentina(linnaeus))、鳖(trionyx sinensis wiegmann)和佛罗里达鳖(apalone ferox(schneider))等研究用龟鳖甲样品,典型样品见图32,所有样本均由资深中药师鉴定,均保存于杭州市食品药品检验研究院标本室;龟甲(乌龟甲)对照药材(121494-201403,中国食品药品检定研究院)。
[0126]
2方法与结果
[0127]
2.1供试品溶液的制备
[0128]
取样品适量,粉碎,过4号筛,取1g,置具塞锥形瓶中,精密加水50ml,浸泡1h,电热套中加入回流提取1h,放冷,再加入碳酸氢铵0.5g并使溶解,静置,取上清液用0.22μm微孔滤膜过滤,取100μl滤液,至微量进样瓶中,加胰蛋白酶溶液(取胰蛋白酶,加1%碳酸氢铵溶液溶解,制成每1ml中含1mg胰蛋白酶的溶液,临用前现配制)10μl,混匀,37℃恒温酶解12h,即得供试品溶液。
[0129]
2.2色谱及质谱条件
[0130]
2.2.1色谱条件
[0131]
色谱柱:zorbax eclipse plus c18(1.8μm,2.1mm
×
150mm);柱温:35℃;
[0132]
流动相:a:0.1%甲酸,b:乙腈;梯度洗脱:0~25min,a:95%
→
80%,b:5%
→
20%;25~50min,a:80%
→
5%,b:20%
→
95%;流速:0.3ml
·
min-1
;后运行时间(平衡系统时间):3min;进样量5μl。
[0133]
2.2.2质谱条件
[0134]
质谱条件:esi+离子源;扫描范围100~3200da;二级质谱扫描模式:target ms/ms;提取离子窗范围:0.5ppm。离子源参数:雾化气(氮气):35psi;干燥气(氮气):流速为8l
·
min-1
;干燥气温度:300℃;鞘气流速:11l
·
min-1
;鞘气温度:350℃;毛细管电压:4kv;碎裂电压:120v;参比离子:121.050 6和922.009 8。
[0135]
2.3酶解肽图的建立
[0136]
分别以乌龟、巴西龟、花龟、黄喉拟水龟、黄缘闭壳龟、缅甸陆龟、小鳄龟、印度棱背
龟、鳖、佛罗里达鳖的腹甲(背甲)作为样品,按照上述“2.1供试品溶液的制备”,分别获得10种供试品溶液。
[0137]
将上述10种供试品溶液分别进行如下操作:
[0138]
精密吸取供试品溶液5μl注入超高效液相色谱-串联四级杆飞行时间质谱联用仪,按“2.2色谱及质谱条件”进行检测,分别获得10种龟鳖甲的总离子流图,如图1~图10所示。
[0139]
同时取质控样品(龟甲(乌龟甲)对照药材)1g,按“2.1供试品溶液的制备”进行操作,按“2.2色谱及质谱条件”的方法每10针研究样品进样结束后进1次样,记录肽图,以肽段(m/z:641.3)为提取色谱峰,计算保留时间和精确质量数,结果表明,色谱峰的保留时间和精确质量数基本一致,rsd均小于2.0%,因此证明上述检测仪器性能稳定、且“2.2色谱及质谱条件”设置合理。
[0140]
2.4数据分析参数
[0141]
先用安捷伦masshunter profinder软件进行数据预处理,以分子特征提取模式(molecular feature extraction)提取保留时间和质荷比(m/z)作为一个数据对(emrt数据对),分析参数设定为:保留时间范围为1~45min,质谱范围为100~3200da,最大允许电荷数设定为5,强度阈值设为1000,质谱窗口设为2.00mda,保留时间窗口设为0.2min。提取结果剔除异常数据,保存为cef文件,备用。再采用安捷伦mass profiler professional(mpp)分析软件(version.b.14.00,agilent technologies)对各总离子流图进行统计分析,查找特征肽,并利用studio 10.5软件测序。
[0142]
2.5特征肽段的查找
[0143]
为查找各种龟鳖甲类的差异性,利用维恩图模型进行质谱数据比较。以乌龟甲特征离子的查找为例,将乌龟甲设为一类样本,而其他9种设为另外一类样本,处理后得到特征物质维恩图(图11)。
[0144]
从图11上可以看出,每一个圆代表一类样本,圆重叠部分数字代表样本间共有化合物个数,非重叠部分为各自独有的化合物。导出乌龟甲样本特有(即无重叠其他圆的部分)的97个化合物,即本发明关注备选的特征离子,其他样本同法处理。根据数据分析的结果,得到不同种龟鳖甲的备选特征离子,筛选出带2+电荷以上的特征离子。
[0145]
将维恩图查找到的潜在特征离子再导入安捷伦定性分析软件(agilent qualitative analysis b.10.00)进行验证,通过对样本进行eic提取,筛查,验证,确定10种龟鳖甲类的特征肽段,对经确定的特征离子进行二级质谱扫描,二级质谱图如图12~图21所示,具体结果见表1。
[0146]
表1 特征肽信息表(小数点后保留一位)
[0147][0148][0149]
2.6特征肽段序列鉴定
[0150]
为初步鉴定特征肽段序列,选择表1中各龟鳖甲类的特征离子的高分辨二级质谱数据导出为mascot generic文件,利用studio 10.5软件进行数据库检索,结合从头测序(de novo),以ncbinr中所有的龟鳖目物种蛋白质序列为数据库,初步鉴定特征肽的序列:
[0151]
乌龟甲特征肽(m/z:442.7)与vgpagslqr匹配度较高;
[0152]
巴西龟甲特征肽(m/z:400.2)与lgvvglggk匹配度最高;
[0153]
花龟甲特征肽(m/z:574.8)与atqervgpyk匹配度最高;
[0154]
黄喉拟水龟甲特征肽(m/z:709.9)与yyweewlgpsglsgpsgsr匹配度最高;
[0155]
黄缘闭壳龟特征肽(m/z:1014.1)与vslpasqsagaggggggaggnggdagtggvggiggnggng匹配度最高;
[0156]
缅甸陆龟甲特征肽(m/z:536.8)与glagelglagsk匹配度最高;
[0157]
小鳄龟甲特征肽(m/z:773.8)与wpgpvgpcgpccdcr匹配度最高;
[0158]
印度棱背龟甲特征肽(m/z:742.6)与wmcccedqgcynqgmlwr匹配度最高;
[0159]
鳖甲特征肽(m/z:784.9)与getgpvgvtgsvgpagar匹配度最高;
[0160]
佛罗里达鳖甲特征肽(m/z:551.7)与glagccgmgcck匹配度最高。
[0161]
由此证明:表1所述的特征肽离子的正确性。
[0162]
实施例1、一种龟鳖甲类中药(固态)的液质联用鉴别法,依次进行以下步骤:
[0163]
一)、样品预处理
[0164]
将固态待测样品进行如下的包括提取的预处理:
[0165]
取样品适量,粉碎,过4号筛,取1g,置具塞锥形瓶中,精密加水50ml,常温浸泡1h后,再回流提取1h,放冷(至室温),再加入碳酸氢铵0.5g并使溶解,静置(静置至溶液澄清),取上清液用0.22μm微孔滤膜过滤,取100μl滤液,至微量进样瓶中,加胰蛋白酶溶液(取胰蛋白酶,加1%碳酸氢铵溶液溶解,制成每1ml中含1mg胰蛋白酶的溶液,临用前现配制)10μl,混匀,37℃恒温酶解12h,即得供试品溶液。
[0166]
二)、色谱及质谱条件
[0167]
1、色谱条件:
[0168]
色谱柱:zorbax eclipse plus c18(1.8μm,2.1mm
×
150mm);
[0169]
流速:0.3ml
·
min-1
;柱温:35℃;
[0170]
流动相包括流动相a和流动相b,流动相a:0.1%甲酸(即,体积浓度为0.1%的甲酸水),流动相b:乙腈;
[0171]
梯度洗脱程序为:0~25min,a:95%
→
80%,b:5%
→
20%;25~50min,a:80%
→
5%,b:20%
→
95%;后运行时间:3min(平衡系统时间);进样量1μl。
[0172]
2、质谱条件:
[0173]
仪器:6540超高效液相色谱-串联三重四级杆质谱联用仪;
[0174]
质谱条件:esi+离子源;扫描范围100~3200da;
[0175]
扫描模式:多反应监测(mrm);
[0176]
离子源参数:雾化气(氮气):50psi;干燥气(氮气):流速为14l
·
min-1
;干燥气温度:200℃;鞘气流速:11l
·
min-1
;鞘气温度:325℃;毛细管电压:4kv;碎裂电压:166v;二级质谱碰撞气:高纯氮气;
[0177]
针对筛选出的10种龟鳖甲特征离子,依据上表1的信息,通过三重四级杆质谱平台建立mrm方法,获得特征离子mrm采集参数,典型mrm色谱图见图22-31,参数见表2。
[0178]
表2 特征离子mrm采集参数列表
[0179][0180]
三)、数据计算分析:
[0181]
精密吸取步骤1)所得的待测样品溶液1μl,注入超高效液相色谱-质谱联用仪,按照上述“二)、色谱及质谱条件”测定,待测样品溶液的mrm提取离子流图色谱中,在如上表所示的10个品种相应的保留时间,同时获得该品种对应的2对特征肽提取离子流色谱峰,且信噪比大于3,认为检出该品种,反之,则判断为未检出该品种。
[0182]
说明:信噪比,通过超高效液相色谱-质谱联用仪软件计算产生的。
[0183]
具体而言:
[0184]
以种类“乌龟甲”为例:当待测样品在如表2所述的“母离子(m/z)442.7,子离子(m/z)631.0、560.0,保留时间(min)10.1”的条件下进行检测,当能获得色谱峰(如图22所示)时,判定此待测样品中含有“乌龟甲”,属于正品;
[0185]
其余以此类推。
[0186]
当信噪比≤3时,由于2020年版中国药典9101分析方法验证指导原则规定,信噪比为3:1为方法检测限,因此,不对检测结果进行判断;
[0187]
反之,当信噪比>3时,才按照上述判定条件对检测结果进行判断。
[0188]
依据实施例1所述的一种龟鳖甲类中药(固态)的液质联用鉴别法,以下进行方法学考察:
[0189]
实验1、专属性试验
[0190]
按“一)、供试品溶液的制备”方法制备各类龟鳖甲样品溶液,平行测试,即,按照上述步骤“二)、色谱及质谱条件”进行检测,所得结果为10种龟鳖甲类中药,在相应的保留时间检出各自对应的特征肽提取离子流色谱峰,相互之间无干扰。
[0191]
以事先已知为乌龟甲的中药药材为阳性样品,分别以事先已知为其他9种龟鳖甲的中药药材作为阴性样品,选择乌龟甲特征分子离子峰m/z 442.7
→
560.0,631.0作为检测离子,结果其他品种龟鳖甲类中药的色谱图,均在与乌龟甲相应的位置上无相应的色谱峰,认为其他9种龟鳖甲中药对测定无干扰。因此表明:各龟鳖甲类的特征离子峰相互之间无干扰,该方法专属性良好。
[0192]
实验2、精密度试验
[0193]
取事先已知为乌龟甲的中药药材,按“一)、供试品溶液的制备”方法制得样品溶液,按“二)的色谱及质谱条件”的方法进样,以乌龟甲特征肽(m/z:442.7)特征峰作为选择离子进行检测,连续进样6次,记录保留时间(具体为:10.09min,10.18min,10.21min,10.21min,10.08min,10.03min),特征峰的保留时间rsd为0.8%,表明方法的精密度良好。
[0194]
其余药材的检测结果也均能证明本发明方法的精密度良好。
[0195]
实验3、稳定性试验
[0196]
取事先已知为乌龟甲的中药药材,按“一)、供试品溶液的制备”方法制得样品溶液,按“二)的色谱及质谱条件”的方法进样,以乌龟甲特征肽(m/z:442.7)特征峰作为选择离子进行检测,分别于0,2,4,8,24,48h测定,记录保留时间(具体为10.09min,10.23min,10.03min,10.11min,10.26min,,10.04min),特征峰的平均保留时间rsd为1.0%,说明样品溶液在48h内均可满足定性需求。
[0197]
其余药材的检测结果也均能证明本发明方法的精密度良好。
[0198]
实验4、样品测定
[0199]
按照上述实施例1所述的“一种龟鳖甲类中药(固态)的液质联用鉴别法”对收集的25批样品进行检测。
[0200]
每个批次的样品,按“二)的色谱及质谱条件”所得数据如下表3所示,因此按照步骤三)的判定条件,相应的所得结果如下表3所示。
[0201]
表3 样品(验证)信息及测定结果表
[0202][0203][0204]
说明,上表中饮片(生)、饮片(醋)的制备方法均属于常规技术:
[0205]
饮片(生)的制备方法是:置蒸锅内,沸水蒸45分钟,取出,放入热水中,立即用硬刷除净皮肉,洗净,晒干。
[0206]
饮片(醋)的制备方法是:取饮片(生),用砂子炒至表面淡黄色,取出,醋淬,干燥。
[0207]
实验5、
[0208]
将事先已知是乌龟、巴西龟、花龟、黄喉拟水龟、黄缘闭壳龟、缅甸陆龟、小鳄龟、印度棱背龟、鳖、佛罗里达鳖的甲壳,按照等重的比例进行混合,以此作为待测品。该待测品按
照实施例1所述方法进行检测,所得结果为:
[0209]
在“母离子(m/z)442.7,子离子(m/z)631.0、560.0,保留时间(min)10.1”条件下,获得乌龟甲特征峰;
[0210]
在“母离子(m/z)400.2,子离子(m/z)374.2、143.1,保留时间(min)11.2”条件下,获得巴西龟甲特征峰;
[0211]
在“母离子(m/z)574.8,子离子(m/z)223.1、464.2,保留时间(min)19.1”条件下,花龟甲特征峰。
[0212]
在“母离子(m/z)709.9,子离子(m/z)647.1、587.0,保留时间(min)20.3”条件下,获得黄喉拟水龟甲特征峰;
[0213]
在“母离子(m/z)1014.1,子离子(m/z)627.8、476.3,保留时间(min)15.9”条件下,获得黄缘闭壳龟甲特征峰;
[0214]
在“母离子(m/z)536.8,子离子(m/z)171.0、143.0,保留时间(min)10.8”条件下,获得缅甸陆龟甲特征峰;
[0215]
在“母离子(m/z)773.8,子离子(m/z)680.9、1206.6,保留时间(min)16.3”条件下,获得小鳄龟甲特征峰;
[0216]
在“母离子(m/z)742.6,子离子(m/z)372.1、806.8,保留时间(min)15.6”条件下,获得印度棱背龟甲特征峰;
[0217]
在“母离子(m/z)784.9,子离子(m/z)872.4、1028.5,保留时间(min)16.7”条件下,获得鳖甲特征峰;
[0218]
在“母离子(m/z)551.7,子离子(m/z)675.3、143.0,保留时间(min)4.3”条件下,获得佛罗里达鳖甲特征峰。
[0219]
对比例1-1、将实施例1中的乌龟甲特征肽由“(m/z:442.7)”改成“(m/z:631.3)”,对实验5所述的混合物作为样品进行检测,所得结果发现:
[0220]
在“母离子(m/z)631.3,子离子(m/z)631.0、560.0,保留时间(min)10.1”条件下,不能检测获得乌龟甲特征峰;
[0221]
即,依据该检测法,所得结果为:待测样品中不含乌龟甲,这显然与实际情况不一致。
[0222]
对比例1-2、将实施例1中的巴西龟甲特征肽由“(m/z:400.2)”改成“(m/z:641.3)”,对实验5所述的混合物作为样品进行检测,所得结果发现:
[0223]
在“母离子(m/z)641.3,子离子(m/z)374.2、143.1,保留时间(min)11.2”条件下,不能检测获得巴西龟甲特征峰;
[0224]
即,依据该检测法,所得结果为:待测样品中不含巴西龟甲,这显然与实际情况不一致。
[0225]
实验6、含龟鳖甲类成分产品测定:
[0226]
含鳖甲类成分产品23批:乌鸡白凤丸12批、鳖甲消痔胶囊1批、小儿肺咳颗粒1批、三甲散1批、复方鳖甲软肝片1批、乳癖散结胶囊1批、蛤蚧定喘胶囊1批、肝爽颗粒1批、调经益灵片1批、回生口服液1批、化癥回生口服液1批、恒古骨伤愈合剂1批;含龟甲类成分产品23批:健脑安神片1批、妇科止带胶囊1批、人参再造丸2批、参茸延龄片1批、龟蛇粉1批、大补阴丸2批、龟鹿二仙膏1批、龟鹿补肾片2批、坤宝丸2批、河车大造丸1批、三宝胶囊2批、健脾
生血颗粒1批、妙济丸3批、固经丸1批、通脉养心丸1批、佛山人参再造丸1批。
[0227]
当上述待测样品为固体时,直接按照实施例1所述方法进行检测;
[0228]
当上述待测样品为液体时,将“一)、样品预处理”改成为如下所述:
[0229]
在待测样品中加入碳酸氢铵,使碳酸氢铵的终浓度为1%(质量%),静置(静置至溶液澄清),取上清液用0.22μm微孔滤膜过滤,取100μl滤液,至微量进样瓶中,加胰蛋白酶溶液(取胰蛋白酶,加1%碳酸氢铵溶液溶解,制成每1ml中含1mg胰蛋白酶的溶液,临用前现配制)10μl,混匀,37℃恒温酶解12h,即得供试品溶液。
[0230]
其余,等同于实施例1。
[0231]
检测结果显示:23批次含鳖甲中成药中,均检出鳖甲成分,其中还有1批检出佛罗里达鳖甲成分。23批次含龟甲成分中成药中,5批只检出正品乌龟甲成分;9批只检出巴西龟甲成分;3批同时检出乌龟甲及巴西龟甲成分;2批同时检出乌龟甲、巴西龟甲及小鳄龟甲成分;2批检出巴西龟甲和小鳄龟甲成分;1批同时检出乌龟甲、巴西龟甲、小鳄龟甲、缅甸陆龟甲、花龟甲及鳖甲成分;1批未检出任何龟鳖甲类中药成分,说明含龟鳖成分产品不投料或者掺伪的情况较为严重。
[0232]
上述结果表明:采用本技术方案后,能够同时鉴别龟鳖甲类中药饮片真伪,且可用于含龟鳖甲类成分产品的投料情况测定。
[0233]
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1