基于脂肪酸成分指纹图谱的羚羊角真伪鉴别方法与流程
1.本发明涉及中药材的指纹图谱技术领域,尤其涉及一种基于脂肪酸成分指纹图谱的羚羊角真伪鉴别方法。
背景技术:
2.羚羊角为牛科动物赛加玲羊saiga tatarica linnaeus的角。羚羊角是我国传统的名贵中药,具有平肝息风、清肝明目、散血解毒的功效,临床主要用于高热惊厥,对小儿发热有很好的疗效。近年来,由于赛加羚羊种群数量稀少,已成为濒危动物,被列入国家一级保护动物目录,严禁捕杀,这导致羚羊角药材库存资源进一步紧张和短缺,商品价格高昂,市场上存在不法商家在利益驱动下在失去外观特征的羚羊角类饮片(如羚羊角粉末、磅片等)用价格便宜的其它动物角(如山羊角、黄羊角、水牛角、牦牛角等)充伪的情况。
3.目前国内外关于羚羊角真伪鉴定的主要方法是性状观察、显微鉴定及生物鉴别,性状观察、显微鉴定法虽然简单快捷,但对于失去外观特征的角类药材缺乏专属性,鉴定难度较高;生物鉴别(如特异性pcr鉴别)虽然专属性强,但是对实验条件及人员操作技术要求高,全面推广尚存难度。
4.中药指纹图谱是近年来迅速发展的一种中药质量控制方法,在中药整体评价方面已得到广泛应用,该技术能够根据多批次样本整体综合信息,建立共有模式,并根据不同算法建立模板,测定相似度,从总体上描述样本特性。相对于用单个或少数成分为指标来控制中药质量的方法,中药指纹图谱通过对所得到的能够体现中药整体特性的图谱识别,提供一种能够比较全面的控制中药质量的方法,较为全面的反映中药的内在质量,保证中药及其制剂的稳定和可靠。
5.目前,现有技术中还没有报道羚羊角基于脂肪酸成分分析的指纹图谱及其建立方法,因此,开发出一种能够利用脂肪酸成分对羚羊角真伪进行评价的指纹图谱具有实际应用的意义。
技术实现要素:
6.本发明要解决的技术问题是提供一种基于脂肪酸成分指纹图谱的羚羊角真伪鉴别方法。
7.为解决上述技术问题,本发明提供一种基于脂肪酸(脂肪酸类)成分指纹图谱的羚羊角真伪鉴别方法,包含以下步骤:
8.(1)待测品(供试品)的制备:
9.将待测的角类样品粉碎后,以氯仿甲醇混合溶液作为提取溶剂进行提取,所得的提取液先蒸发回收溶剂,而后烘干,得到提取的脂肪;
10.将提取的脂肪进行甲酯化处理,得到用于气相色谱检测的样品溶液;
11.(2)气相色谱检测:
12.将步骤(1)所得的样品溶液注入气相色谱仪中进行检测,得到待测样品气相色谱
图;
13.(3)、将待测样品气相色谱图与羚羊角标准指纹图谱(羚羊角的脂肪酸成分指纹图谱,包含19个指纹峰)进行对比,当相似度≥0.90,则判定待测样品为羚羊角。
14.作为本发明的基于脂肪酸成分指纹图谱的羚羊角真伪鉴别方法的改进:羚羊角标准指纹图谱(羚羊角的脂肪酸成分指纹图谱),包含19个指纹峰,相对保留时间和相对峰面积如下:
15.1号峰:相对保留时间范围:0.63,相对峰面积:0.0356;
16.2号峰:相对保留时间范围:0.80,相对峰面积:0.0258;
17.3号峰:相对保留时间范围:0.96,相对峰面积:0.1160;
18.4号峰:相对保留时间范围:0.97,相对峰面积:0.0741;
19.5号峰:相对保留时间范围:1.00,相对峰面积:1.0000;
20.6号峰:相对保留时间范围:1.33,相对峰面积:0.9139;
21.7号峰:相对保留时间范围:1.38,相对峰面积:0.4039;
22.8号峰:相对保留时间范围:1.66,相对峰面积:0.0734;
23.9号峰:相对保留时间范围:1.70,相对峰面积:0.0423;
24.10号峰:相对保留时间范围:1.71,相对峰面积:0.0945;
25.11号峰:相对保留时间范围:1.74,相对峰面积:0.0279;
26.12号峰:相对保留时间范围:2.06,相对峰面积:0.0575;
27.13号峰:相对保留时间范围:2.07,相对峰面积:0.0381;
28.14号峰:相对保留时间范围:2.10,相对峰面积:0.0342;
29.15号峰:相对保留时间范围:2.38,相对峰面积:0.0437;
30.16号峰:相对保留时间范围:2.39,相对峰面积:0.0399;
31.17号峰:相对保留时间范围:2.43,相对峰面积:0.0448;
32.18号峰:相对保留时间范围:2.67,相对峰面积:0.0469;
33.19号峰:相对保留时间范围:2.72,相对峰面积:0.1510。
34.作为本发明的基于脂肪酸成分指纹图谱的羚羊角真伪鉴别方法的进一步改进:步骤(2)的色谱检测条件为:
35.色谱柱为hp-5毛细管柱(柱长30m
×
内径320μm
×
膜厚0.25μm,安捷伦科技);载气:高纯氮(99.999%);流速:1.0ml/min,恒流模式;进样口:温度250℃,分流比10:1,自动进样器进样,进样量1μl;柱温:程序升温,初始160℃,保持3min,再以10℃/min升温至250℃,保持8min;氢火焰检测器:温度280℃,氢气40ml/min,空气400ml/min,尾吹10ml/min。
36.作为本发明的基于脂肪酸成分指纹图谱的羚羊角真伪鉴别方法的进一步改进:步骤(3)为:
37.将待测样品气相色谱图与羚羊角标准指纹图谱(羚羊角的脂肪酸成分指纹图谱,包含19个指纹峰)进行对比,采用相似度软件进行处理,采用多点校正以及mark峰匹配法,从而确定待测样品图谱与所述的指纹图谱的相似度,当相似度≥0.90,则判定待测样品为羚羊角。
38.作为本发明的基于脂肪酸成分指纹图谱的羚羊角真伪鉴别方法的进一步改进:步骤(1)为:
39.将待测的角类样品粉碎(过24目筛),在容器中,加入样品粉末2g以及60ml氯仿甲醇混合溶液,回流提取1
±
0.1h,过滤,得滤液;
40.用氯仿甲醇混合溶液对容器、过滤所用的滤器以及过滤所得的残渣进行洗涤,所得洗涤液与滤液进行合并;蒸发回收溶剂后,于105
±
10℃烘至恒重,得到提取的脂肪;
41.将提取的脂肪用10ml氯仿甲醇混合溶液溶解,而后吸取5-10ml先蒸干(80
±
10℃),而后加入5%(体积%)硫酸甲醇溶液2ml,振荡(使分散均匀),于60
±
5℃水浴甲酯化60
±
10min,冷却,加入2ml正己烷,振荡后静置,收集正己烷层(静置后分为上下2层,此为上层),正己烷层干燥处理后,作为用于气相色谱检测的样品溶液;
42.所述氯仿甲醇混合溶液由氯仿∶甲醇=2:1体积比混合而得。
43.上述样品溶液,可直接用于后续的进样,也可先冷藏备用。
44.说明:当提取所得的脂肪≥30mg,取30mg;当提取所得的脂肪<30mg时,取全部的提取所得的脂肪。
45.本发明是通过气相色谱法检测不同来源的角类药材,比较其图谱与羚羊角脂肪酸成分指纹图谱的差异,来区分羚羊角与黄羊角、牦牛角、山羊角、水牛角的差异,实现对羚羊角真伪的鉴别。
46.本发明具体如下:
47.一、获取指纹图谱:
48.(1)供试品的制备:
49.将角类样品(按《中国药典》经性状鉴别为羚羊角的正品)粉碎,精密称取样品粉末(过24目筛)2g,置于具塞三角烧瓶内,加入作为提取溶剂的氯仿甲醇混合溶液(氯仿∶甲醇混合体积比2:1)60ml,连接提取装置,于60℃水浴中加热,从微沸开始计时回流提取1h。取下具塞三角烧瓶,提取液用玻璃过滤器(g3,约为4.5至9μm滤径)过滤,用另一恒重具塞三角烧瓶收集滤液。用氯仿甲醇混合溶液分别洗涤烧瓶、滤器及滤器中试样残渣,洗涤液并入滤液中,把烧瓶置于65-70℃水浴中蒸发回收溶剂,于105℃烘箱中烘至恒重,作为提取所得的脂肪;
50.取提取的脂肪(约30mg),用10ml氯仿甲醇混合溶液溶解,而后精密吸取5-10ml于15ml具塞试管中,水浴80℃蒸干,加入5%硫酸甲醇溶液2ml,振荡使分散均匀,于60℃水浴甲酯化60min,冷却,加入2ml正己烷,振荡,静置,收集正己烷层(静置后分为上下2层,此为上层),加入少量无水硫酸钠,密封,得供试品溶液,冷藏备用(直接进样)。
51.说明:当提取所得的脂肪≥30mg,取30mg;当提取所得的脂肪<30mg时,取全部的提取所得的脂肪。
52.(2)气相色谱检测:
53.吸取上述步骤(1)所得供试品溶液,注入气相色谱仪中进行检测,得到指纹图谱;
54.其中,色谱检测条件如下:
55.色谱柱为hp-5毛细管柱(柱长30m
×
内径320μm
×
膜厚0.25μm,安捷伦科技);载气:高纯氮(99.999%);流速:1.0ml/min,恒流模式;进样口:温度250℃,分流比10:1,自动进样器进样,进样量1μl;柱温:程序升温,初始160℃,保持3min,再以10℃/min升温至250℃,保持8min;氢火焰检测器:温度280℃,氢气40ml/min,空气400ml/min,尾吹10ml/min。
56.从而获得如下:
57.一种羚羊角的脂肪酸成分指纹图谱,包含19个指纹峰,相对保留时间和相对峰面积如下(相对保留时间和相对峰面积以5号峰为参照峰进行计算):
58.1号峰:(相对保留时间:0.63,相对峰面积:0.0356);
59.2号峰:(相对保留时间:0.80,相对峰面积:0.0258);
60.3号峰:(相对保留时间:0.96,相对峰面积:0.1160);
61.4号峰:(相对保留时间:0.97,相对峰面积:0.0741);
62.5号峰:(相对保留时间:1.00,相对峰面积:1.0000);
63.6号峰:(相对保留时间:1.33,相对峰面积:0.9139);
64.7号峰:(相对保留时间围:1.38,相对峰面积:0.4039);
65.8号峰:(相对保留时间:1.66,相对峰面积:0.0734);
66.9号峰:(相对保留时间:1.70,相对峰面积:0.0423);
67.10号峰:(相对保留时间:1.71,相对峰面积:0.0945);
68.11号峰:(相对保留时间:1.74,相对峰面积:0.0279);
69.12号峰:(相对保留时间:2.06,相对峰面积:0.0575);
70.13号峰:(相对保留时间:2.07,相对峰面积:0.0381);
71.14号峰:(相对保留时间:2.10,相对峰面积:0.0342);
72.15号峰:(相对保留时间:2.38,相对峰面积:0.0437);
73.16号峰:(相对保留时间:2.39,相对峰面积:0.0399);
74.17号峰:(相对保留时间:2.43,相对峰面积:0.0448);
75.18号峰:(相对保留时间:2.67,相对峰面积:0.0469);
76.19号峰:(相对保留时间:2.72,相对峰面积:0.1510);
77.其中,5号峰为参照峰,其他保留时间范围为与5号峰的相对值。
78.本发明基于此19个识别的脂肪酸成分色谱峰的信息,中药色谱指纹图谱相似度评价系统依据明确来源的23个羚羊角的脂肪酸成分图谱,经采用多点校正以及mark峰匹配法,产生了羚羊角脂肪酸成分对照指纹图谱。指纹图谱如图2所示。
79.二、对待测样品进行鉴定
80.以待测角类样品(即,待评价的角类样品)替代上述步骤一(1)中的“角类样品”,
81.其余同步骤一;得到待测物的气相色谱图。
82.将得到的气相色谱图与上述步骤一所得的羚羊角的脂肪酸成分指纹图谱(包含19个指纹峰)进行比较,采用相似度软件进行处理,采用多点校正以及mark峰匹配法,确定待测样品图谱与所述的指纹图谱的相似度,若相似度在0.90以上,则判定待测样品为羚羊角。
83.相似度软件为常规软件,例如可选用中药色谱指纹图谱相似度评价系统(国家药典委员会2012版)。
84.研究表明,羚羊角中主要含有脂肪酸类、角蛋白类以及肽类成分,不同物种的脂肪酸组成和含量具有特异性,因此脂肪酸类成分可以作为羚羊角真伪鉴别的目标成分之一。
85.本发明与现有技术相比,具有如下有益效果:
86.(1)本发明首先确立了羚羊角脂肪酸成分指纹图谱,且给出了待测样品(角类样品)获得气相色谱图的方法,根据所得的气相色谱图与所确立的羚羊角脂肪酸成分指纹对照图谱中特征峰的有无及大小,通过采用中药色谱指纹图谱相似度评价系统计算其相似
度,能有效地鉴别羚羊角的真伪,完善了羚羊角的质量评价体系,为羚羊角质量的全面、有效控制提供了理论和实践基础。
87.(2)本发明所建立的指纹图谱对羚羊角的脂肪酸成分能够实现较好的分离和标识,避免其他组分的干扰,具有较高的灵敏度。
附图说明
88.下面结合附图对本发明的具体实施方式作进一步详细说明。
89.图1为实施例1得到的23批羚羊角药材的脂肪酸成分色谱图;
90.图2为实施例1中得到的羚羊角药材的脂肪酸成分对照指纹图谱;
91.图3为实施例2得到的3批黄羊角药材的脂肪酸成分色谱图;
92.图4为实施例3得到的4批牦牛角药材的脂肪酸成分色谱图;
93.图5为实施例4得到的4批山羊角药材的脂肪酸成分色谱图;
94.图6为实施例5得到的4批水牛角药材的脂肪酸成分色谱图;
95.图7为实施例6得到的4批羚羊角药材的脂肪酸成分色谱图。
具体实施方式
96.下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
97.仪器与试剂
98.1.仪器:
99.美国安捷伦6890气相色谱仪(7683b全自动进样器,氢火焰离子化检测器),色谱工作站chemstation;ag 245电子天平(mettler toledo);milliq advantage a10超纯水仪(millipore公司)。中药色谱指纹图谱相似度评价系统(国家药典委员会2012版)。
100.2.试剂:
101.甲醇(merck公司,色谱纯);水为超纯水;其余试剂均为分析纯。
102.实施例1、指纹图谱的建立:
103.角类样品为已知为羚羊角的样品;
104.(1)供试品溶液的制备:将角类样品粉碎(过24目筛),精密称取样品粉末2g,置于具塞三角烧瓶内,加入氯仿甲醇混合溶液(氯仿∶甲醇=2:1的体积比)60ml,连接提取装置,于60℃水浴中加热,从微沸开始计时回流提取1h。取下具塞三角烧瓶,提取液用玻璃过滤器(g3)过滤,用另一恒重具塞三角烧瓶收集滤液。用氯仿甲醇混合溶液(20ml、10ml、10ml)分别洗涤烧瓶、滤器及滤器中试样残渣,所得的全部洗涤液并入滤液中,把烧瓶置于65-70℃水浴中蒸发回收溶剂(即,氯仿甲醇混合溶液),于105℃烘箱中烘至恒重,得到提取的脂肪,计算可得其重量,约30mg左右。
105.取上述提取的脂肪用10ml的氯仿甲醇混合溶液溶解,再取一定体积(10ml)溶液于15ml具塞试管中,水浴80℃蒸干,加入5%硫酸甲醇溶液2ml,振荡使分散均匀,于60℃水浴甲酯化60min,冷却至室温后,加入2ml正己烷,振荡5分钟,静置15分钟,从而形成分层,收集正己烷层(位于上层),加入少量(约0.2g)无水硫酸钠进行干燥处理,干燥处理后的所得液作为供试品溶液;供试品溶液可直接进行后续的色谱检测,或者密封后冷藏(约2~10℃)备
用。
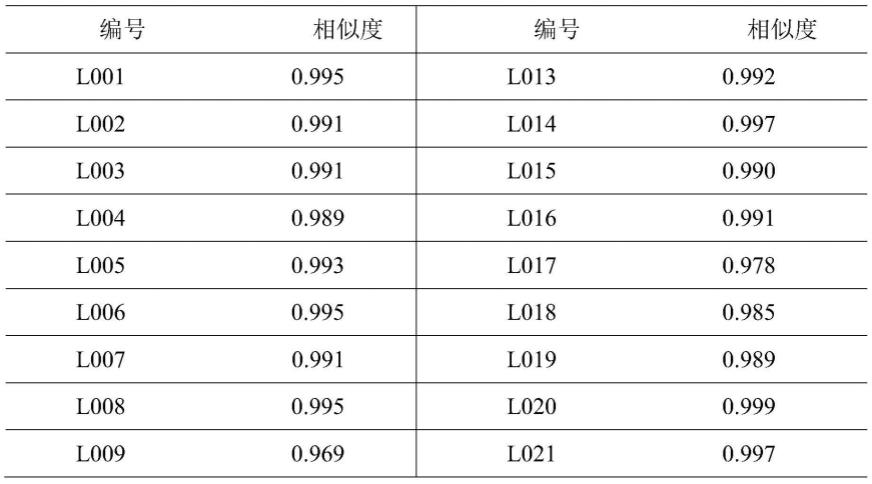
106.(2)按以下色谱条件,进行进样分析,记录色谱图。
107.色谱条件:hp-5毛细管柱(柱长30m
×
内径320μm
×
膜厚0.25μm,安捷伦科技);载气:高纯氮(99.999%);流速:1.0ml/min,恒流模式;进样口:温度250℃,分流比10:1,自动进样器进样,供试品溶液进样量1μl;柱温:程序升温,初始160℃,保持3min,再以10℃/min升温至250℃,保持8min;氢火焰检测器:温度280℃,氢气40ml/min,空气400ml/min,尾吹10ml/min。
108.(3)按供试品溶液的制备方法分别制备23批次羚羊角样品的供试品溶液,按以上色谱条件分别进样测定,得到各批羚羊角样品的色谱图。选取23批羚羊角样品的色谱图输入相似度软件(中药色谱指纹图谱相似度评价系统(国家药典委员会2012版))进行处理,采用多点校正以及mark峰匹配法,确定了23批羚羊角样品中19个共有峰,生成对照指纹图谱,计算23批羚羊角样品图谱与对照指纹图谱的相似度结果为0.944~0.999,23批样品叠加的脂肪酸成分色谱图见图1,生成的对照指纹图谱见图2:
109.包含19个指纹峰,相对保留时间和相对峰面积如下(相对保留时间和相对峰面积以5号峰为参照峰进行计算):
110.1号峰:(相对保留时间:0.63,相对峰面积:0.0356);
111.2号峰:(相对保留时间:0.80,相对峰面积:0.0258);
112.3号峰:(相对保留时间:0.96,相对峰面积:0.1160);
113.4号峰:(相对保留时间:0.97,相对峰面积:0.0741);
114.5号峰:(相对保留时间:1.00,相对峰面积:1.0000);
115.6号峰:(相对保留时间:1.33,相对峰面积:0.9139);
116.7号峰:(相对保留时间:1.38,相对峰面积:0.4039);
117.8号峰:(相对保留时间:1.66,相对峰面积:0.0734);
118.9号峰:(相对保留时间:1.70,相对峰面积:0.0423);
119.10号峰:(相对保留时间:1.71,相对峰面积:0.0945);
120.11号峰:(相对保留时间:1.74,相对峰面积:0.0279);
121.12号峰:(相对保留时间:2.06,相对峰面积:0.0575);
122.13号峰:(相对保留时间:2.07,相对峰面积:0.0381);
123.14号峰:(相对保留时间:2.10,相对峰面积:0.0342);
124.15号峰:(相对保留时间:2.38,相对峰面积:0.0437);
125.16号峰:(相对保留时间:2.39,相对峰面积:0.0399);
126.17号峰:(相对保留时间:2.43,相对峰面积:0.0448);
127.18号峰:(相对保留时间:2.67,相对峰面积:0.0469);
128.19号峰:(相对保留时间:2.72,相对峰面积:0.1510);
129.其中,5号峰为参照峰,相对保留时间为与5号峰保留时间比较所得的相对值;相对峰面积为与5号峰峰面积比较所得的相对值。
130.说明:通过设置色谱系统自带的积分条件得到色谱图信息(含保留时间、峰面积数据),然后以第5号峰的保留时间与峰面积为对照,得出各峰的相对保留时间与相对峰面积。
131.23批羚羊角与对照指纹图谱的相似度结果见表1。
132.表1、23批羚羊角相似度结果
[0133][0134][0135]
实施例2、黄羊角检测
[0136]
取3批黄羊角样品,按法制备供试液,并按以上色谱条件测定,所得的色谱图如图3所述,将其与实施例1所得的对照指纹图谱(图2)均输入相似度软件进行处理,结果相似度为0.384~0.743。
[0137]
与羚羊角对照指纹图谱的相似度结果具体见表2。
[0138]
表2、3批黄羊角相似度结果
[0139][0140]
实施例3、牦牛角检测
[0141]
取4批牦牛角样品,按法制备供试液,并按以上色谱条件测定,所得的色谱图如图4所述,将其与实施例1所得的对照指纹图谱(图2)均输入相似度软件进行处理,结果相似度为0.795~0.837。
[0142]
与羚羊角对照指纹图谱的相似度结果具体见表3。
[0143]
表3、4批牦牛角相似度结果
[0144][0145]
实施例4、山羊角检测
[0146]
取4批山羊角样品,按法制备供试液,并按以上色谱条件测定,所得的色谱图如图5所述,将其与实施例1所得的对照指纹图谱(图2)均输入相似度软件进行处理,结果相似度为0.420~0.829。
[0147]
与羚羊角对照指纹图谱的相似度结果具体见表4。
[0148]
表4、4批山羊角相似度结果
[0149][0150]
实施例5、水牛角检测
[0151]
取4批水牛角样品,按法制备供试液,并按以上色谱条件测定,所得的色谱图如图6所述,将其与实施例1所得的对照指纹图谱(图2)均输入相似度软件进行处理,结果相似度为0.797~0.884。
[0152]
与羚羊角对照指纹图谱的相似度结果见表5。
[0153]
表5、4批水牛角相似度结果
[0154][0155]
实施例6、取羚羊角检测
[0156]
取4批羚羊角样品,按法制备供试液,并按以上色谱条件测定,所得的色谱图如图7所述,将其与实施例1所得的对照指纹图谱(图2)均输入相似度软件进行处理,结果相似度为0.907~0.996。
[0157]
与羚羊角对照指纹图谱的相似度结果见表6。
[0158]
表6、4批羚羊角相似度结果
[0159][0160][0161]
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1