基于固态纳米孔传感器的过氧化氢检测试剂及其定量检测方法
1.本发明提供了基于固态纳米孔传感器的过氧化氢检测试剂及其定量检测方法,将h2o2的酶促反应介导的纳米颗粒的形貌变化和纳米孔传感技术结合,属于纳米孔传感器检测领域。
背景技术:
2.h2o2在化工、生物、制药、临床、环境和食品加工领域中都有广泛应用,其含量与分析鉴定对于工农业的持续发展以及环境安全具有重大的意义。特别在生物医学领域中,h2o2是一种重要的生化分子,参与细胞增殖,分化和迁移以及疾病发生相关的信号通路。正常生理条件下,细胞内h2o2的生理浓度非常低(10-8
~10-6
m)参与维持细胞内信号转导等各项功能(nat commun,2019,10,4526)。一旦异常,过高浓度的h2o2会诱导各种生物损害,导致衰老,癌症和中枢神经系统等疾病,如癌细胞中h2o2的浓度较正常细胞高约1-2个数量级,因此对生理环境中h2o2进行准确灵敏的检测在生物医学领域具有十分重要的意义。
3.目前不同技术对h2o2的检测方法已经发展起来,主要包括比色法、荧光法、高效液相色谱法以及电化学方法等,其中比色法和电化学方法应用最多。然而,比色法存在样本量大、灵敏度较低问题,而电化学方涉及酶的固定以及载体电极材料严格,稳定性差等限制,难以满足目前环境安全、食品卫生,特别是生理环境下存在的h2o2的超低浓度,低成本,高通量的检测需求。因此本发明基于固态纳米孔传感开发一种简单操作,高灵敏的h2o2的定量检测试剂和方法。
技术实现要素:
4.固态纳米孔具有无标记、高灵敏和低成本的优势,在单分子传感领域有重要的应用前景。在纳米孔传感检测中,单个分子穿过一个纳米量级的孔道会造成孔内电导的瞬间变化,形成可以检测的离子电流变化,通过分析离子电流信号的幅值和时间等特征信息,实现单分子水平的检测。不同于传统方法是对溶液环境中大量分子测量系综的平均行为的检测,纳米孔的高分辨率更能揭示单分子、单颗粒的动态变化以及局域环境中分子涨落等丰富的信息,同时该方法无需标记,装置简单,易于操作,样本量低,提供了一个高效的单分子传感平台。
5.基于上述纳米孔传感单分子检测平台,第一方面,本发明提出一种基于固态纳米孔传感器的过氧化氢检测试剂,所述试剂包括:具有类过氧化物酶活性的纳米酶或生物酶、贵金属纳米颗粒、十六烷基三甲基溴化铵ctab和缓冲液;
6.其中,所述具有类过氧化物酶活性生物酶优选为辣根过氧化物酶hrp;进一步优选地,所述辣根过氧化物酶hrp的浓度范围1.0~5.0μm,最佳酶活性浓度为2μm,具有高的酶活性同时节约成本。
7.其中,具有类过氧化物酶活性的纳米酶包括类过氧化物酶,类氧化物酶,类过氧化
氢酶以及类超氧化物歧化酶纳米酶等纳米酶及其衍生物,可以对h2o2进行氧化还原分解。如fe3o4纳米酶(acs biomaterials science&engineering,2021,7(1):299-310),铂纳米酶(acs nano,2021,15(3):5735
–
5751)及其他类似金属氧化物纳米材料及其衍生物(analyst,2021,146(23):7284-7293;biomolecules,2021,11(7):1015)。
8.优选地,所用ctab为1-5mm,缓冲液为柠檬酸缓冲液(0.05m,ph 3.0-5.0)或磷酸缓冲液(0.01m pbs,ph 3-5.0),本发明优选柠檬酸缓冲液(0.05m,ph 4.0),同时ctab 2mm。
9.优选地,所述贵金属纳米颗粒为银纳米颗粒或金纳米颗粒中的任意一种或两种的组合,进一步优选金纳米颗粒。
10.进一步的,所述金纳米颗粒优选为棒状金纳米颗粒即金纳米棒,棒状金纳米颗粒相较于球状或立方结构的金纳米颗粒具有长径比高、结构各向异性明显、过孔信号信噪比高的优势,且所述固态纳米孔的孔径为孔径为20-200nm,厚度为20-100nm。
11.进一步优选的,为了保证刻蚀效果显著和纳米孔过孔信号的高信噪比以及颗粒刻蚀前后产生显著信号特征变化差异,所述棒状金纳米颗粒最佳长径比约为3:1,直径16
±
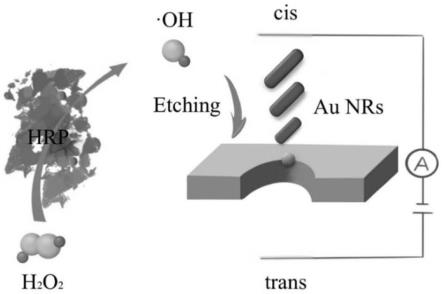
2nm,长度50
±
3nm。
12.优选地,所述贵金属纳米颗粒溶液中金纳米棒浓度范围为0.01-1nm,该浓度的金棒在纳米孔中具有足够高的捕获率,捕获率≥1000个/min,同时利于酶促反应快速进行,节约成本,本发明优选金纳米棒浓度为0.2nm。
13.优选地,为了提高酶促反应效率,所述贵金属纳米颗粒与所述辣根过氧化氢酶的摩尔浓度比≥1000为佳,本发明优选摩尔浓度比为10000.
14.优选的,所述辣根过氧化物酶催化h2o2生成羟基自由基刻蚀金纳米棒的反应时间控制在20min左右,既能使刻蚀产生显著效果,又避免时间过长造成刻蚀产物耗尽。
15.优选的,当金纳米棒直径约16nm,长度约50nm,所选固态纳米孔最佳直径为60-80nm,厚度为50nm,在纳米孔实验中可以获得高的信噪比,同时提高捕获率,减少颗粒堵孔现象的发生。
16.第二方面,本发明提供一种基于固态纳米孔传感器的过氧化氢定量检测标准曲线的绘制方法,所述方法包括:配置不同浓度梯度的h2o2溶液,其中包含浓度为零的h2o2溶液,分别加入上述检测试剂进行孵化,终止反应后使用纳米孔传感器对充分反应后的混合溶液进行检测,将溶液注入流体装置的一侧,利用电压驱动溶液中刻蚀后的贵金属纳米颗粒通过纳米孔,将产生的贵金属纳米颗粒纳米孔离子电流信号进行统计,得到离子电流脉冲幅值的峰位变化值(δip)与h2o2浓度之间的线性关系,并绘制标准曲线。
17.优选地,所述棒状金纳米颗粒长度为30~70nm;直径为15~20nm;长径比为2:1~4:1,长径比的调控依赖于硝酸银溶液与种子液的比例。
18.第三方面,本发明提供一种基于固态纳米孔传感器的过氧化氢定量检测方法,包括以下步骤:将待测样品加入制备的上述检测试剂进行酶促反应,然后将反应后的金纳米颗粒产物加入固态纳米孔传感器进行检测,在电压驱动下粒子过孔产生离子电流信号,统计其离子电流幅值的峰位变化值(δip),带入上述标准曲线,确定对应的样品中的h2o2浓度值,最终实现对样品中h2o2浓度的检测。
19.有益效果:
20.如图1所示,本发明所述基于固态纳米孔传感器的过氧化氢检测试剂及其定量检
测方法,利用刻蚀技术将检测对象转化为纳米材料结构的变化,巧妙地利用了纳米孔高灵敏,高通量的特点;所述固态孔大小可控,性质稳定,选择性强,适合多种检测环境(酸碱、浓度),极大地扩展了纳米孔的应用范围,使纳米孔传感器成为一种高通量,低成本的检测平台;
21.单纯的h2o2蚀刻金纳米颗粒需要很高的浓度并且需要高温和酸性环境,本发明利用过氧化物酶对h2o2的还原具有特定的高催化活性的优点,使其能快速的还原为羟基自由基(
·
oh),具备较高氧化性的羟基自由基能加快h2o2刻蚀贵金属颗粒的速度,从而实现在超低浓度及低样本量条件下利用h2o2对贵金属颗粒进行高效刻蚀的要求。
22.针对其他检测方法分辨率低等问题,本发明所述过氧化氢定量检测方法利用氮化硅纳米孔传感平台,利用金纳米棒等贵金属颗粒为反应载体,通过过氧化物酶催化h2o2生成具有较高氧化性的羟基自由基,将h2o2浓度转化为纳米材料刻蚀过程中形貌结构的差异,实现对h2o2的高灵敏检测;
23.本发明还解决了比色法、电化学方法等现有技术方法样本量大、颜色变化易干扰、以及酶固定化引起的活性下降和电极材料高要求,性能不稳定等问题,扩大了固态纳米孔对于h2o2等小分子的检测应用范围。
附图说明
24.图1为本发明所述的基于固态纳米孔传感的酶催化反应介导的金纳米棒刻蚀法来检测h2o2的原理示意图;
25.图2a为本发明实施例1制备的不同长径比的金纳米棒紫外图和tem图;
26.图2b为不同长径比的棒状金纳米颗粒在纳米孔中电信号的不同的特征事件图;
27.图3为本发明实施例1制备的金纳米棒与金球、金立方的纳米孔电信号的特征事件对比图;
28.图4为本发明实施例2中酶催化金纳米棒刻蚀反应得到不同形貌的纳米颗粒产物的电镜图及产物通过纳米孔的特征事件的电信号图;
29.图5为本发明实施例2中金纳米棒刻蚀反应的时间动力学变化图;
30.图6为本发明实施例2中不同浓度的hrp酶活性对蚀刻反应的影响;
31.图7为本发明实施例3中不同浓度的h2o2在酶催化介导的金纳米棒aunrs刻蚀后产物在纳米孔中产生的电信号的三维统计图;
32.图8为本发明实施例3中h2o2浓度定量分析曲线;
33.图9为本发明实施例4中不同数量细胞的电信号柱状图。
34.具体实施方法
35.下面结合说明书附图和具体实施例来对本发明的技术方案作进一步的说明。
36.实施例1:金纳米棒的制备
37.首先制备金种子溶液:取10ml 0.1m的ctab溶液和0.25ml 0.01m的haucl4混合,加入磁子;然后加入0.6ml 0.01m的冰水现配的nabh4溶液,边加边剧烈搅拌2min,后放入30℃水浴锅反应2h;
38.然后制备生长液:取40ml 0.1m ctab溶液,2ml 0.01m的haucl4溶液和350μl 0.01m agno3溶液混合,并加入磁子搅拌。加入0.76ml 1m的hcl溶液调节ph值为2左右;加入
0.32ml的0.1m的抗坏血酸(aa)溶液,搅拌至溶液变为无色。加入250μl制备的金种子溶液,搅拌混匀放置30℃水浴锅内生长8h;
39.最后将生长8h后的金纳米棒aunrs溶液使用50ml离心管在8000rpm转速下离心30min,吸取上清液保留沉淀,加入超纯水进行复溶,重复三次,将离心后的aunrs溶液加入44ml超纯水使用广口瓶密封保存。
40.如图2a所示,所制备的棒状金纳米颗粒长度为30~70nm;直径为15~17nm;长径比为2:1~4:1,金纳米棒长径比的调控依赖于硝酸银溶液与种子液的比例,控制250μl金种子溶液量不变,改变0.01m硝酸银溶液添加量分别为230μl、350μl、470μl时,可得到长径比为2:1(长度约为31nm,直径约为16nm),3:1(长度约为48nm,直径约为16nm),4:1(长度约为63nm,直径约为16nm)的棒状金纳米颗粒,图2a中ar表示长径比。图2b所示为不同长径比的棒状金纳米颗粒在纳米孔中电信号的不同的特征事件图。
41.金纳米棒类似dna线性结构,在纳米孔中具有更高的分辨率,如图3所示,采用上述制备的长径比约为3:1的金纳米棒与金球、金立方纳米颗粒在纳米孔中电信号的不同的特征事件图。图3中(a)图为金纳米棒的纳米孔信号特征事件图,具有高的幅值和长的滞留时间,图3中(b)图为实验室制备的金纳米球的纳米孔信号特征事件图,幅值较小同时滞留时间短,因此相比球状的金纳米颗粒,金纳米棒在纳米孔中具有更高的信噪比,且当金纳米棒刻蚀成为球状,产生明显的信号差异,分辨率高。图3中(c)图为实验室制备的金立方的纳米孔信号特征事件图,也具有较高的信噪比,但由于制备的金立方的体积大(≥50nm)且各向同性,在刻蚀过程中比较耗时耗量,因此,本发明优选采用金纳米棒作为反应载体。
42.其中,上述金纳米颗粒的具体制备过程如下:
43.取50ml 0.01%氯金酸溶液加热煮沸,迅速加入5ml40 mm柠檬酸钠溶液,在煮沸状态下大力搅拌10分钟后关闭热源,继续搅拌15分钟,冷却至室温,作为种子溶液备用;向20ml超纯水中加入2ml种子溶液和0.5ml盐酸羟氨溶液,室温下混合均匀,逐滴加入0.1%氯金酸溶液,随着氯金酸溶液的滴加,生长液颜色逐渐变深,当纳米金生长液在波长520nm附近出现的吸收峰,约为20nm。
44.其中,上述金立方纳米颗粒具体制备过程如下:
45.首先将配好的0.01m的nabh4(0.0189g溶于50ml容量瓶)置于冰水域中备用;将反应瓶放入32℃的水浴锅中,依次加入磁子,haucl4,(0.125ml,0.01m)ctab(3.75ml,0.1m),搅拌,最后加入还原剂nabh4(0.3ml,0.1m)。搅拌三分钟,静置2h,此时反应液为褐色,实验在水浴锅中完成(32℃);将反应瓶放入32℃的水浴锅中,依次加入磁子,超纯水(8ml),ctab(1.6ml,0.1m),haucl4(0.2ml,0.01m),aa(0.95ml,0.1m);取10μl seed溶液于240μl水中(稀释25倍),再取其中的10μl加入生长液中,静置过夜,溶液颜色为粉红色。最后,将合成好的aunc颗粒溶液进行离心纯化,4000转,15分钟的条件下,离心两次,最后重新溶解于超纯水中,约50nm。
46.实施例2:酶催化介导的金纳米棒的刻蚀反应
47.根据实施实例1制备金纳米棒,其长度50nm,直径16nm,长径比约为3:1,然后加入酶和不同浓度的双氧水溶液进行金棒的刻蚀。首先取制备的金纳米棒aunrs10 ul(2.0nm),加入10ul的hrp溶液(20um)和10ul的ctab(0.02m),分别加入0ul,1ul,6ul的h2o2溶液(1m/l),然后加入70-60ul的柠檬酸缓冲液(0.05m,ph 4.0)得到0um,10um,60um的h2o2酶促反应
体系100ul,在25℃下孵育20min,最后加入10ul 5m hcl终止反应。
48.将反应产物进行电镜观测同时进行纳米孔过孔实验,得到图4的结果。随着h2o2浓度的提高,aunrs的长度逐渐缩短,而直径几乎保持不变,见图4中的(a)图和(b)图。当浓度为60um时,在一定的时间内,aunrs已经被蚀刻成了球状,见图4中的(c)图。同时通过产物的纳米孔特征事件信号,可以看出随着酶催化反应的进行,金纳米棒刻蚀的产物通过固态纳米孔产生的离子电流幅值越小,这一现象与蚀刻过程中aunrs的形貌变化是完全相符合的,随着蚀刻的进行,aunrs的直径保持不变而长度越来越短,导致过孔颗粒的体积变小,同时颗粒所带的电荷减少,进一步导致颗粒通过固态纳米孔时造成的离子电流阻塞变小。
49.为了提高反应效率,对酶促反应的时间进行优化,如图5为60nm金纳米棒在不同时间(0、10min、20min以及30min)的刻蚀后产物在纳米孔中特征信号统计的幅值峰位变化图,我们可以看出随着蚀刻的进行,金纳米颗粒通过固态纳米孔所需要的时长越来越短,在20min时已经具有明显的信号差异,因此为了提高反应效率,同时防止过度刻蚀,以20min作为酶催化的反应终止时间。
50.同时为了节约成本,对hrp浓度进行了优化,在含h2o2(60μm)的金纳米棒刻蚀溶液中加入不同浓度的hrp进行酶催化,催化后产物加入纳米孔传感器进行信号检测。如图6所示,当hrp浓度达到2μm时,纳米孔产生的电流峰值的变化是最大的,表明2μm的hrp对于h2o2蚀刻的催化效果是最佳的,并且过度的hrp存在会反而抑制hrp活性,降低反应效率。
51.实施例3:绘制h2o2检测用标准曲线
52.制备不同浓度的h2o2的金纳米棒刻蚀反应体系。取金纳米棒aunrs终浓度为0.2nm,长径比约为3:1,其长度50nm,直径16nm。加入hrp溶液(终浓度2um)和ctab(终浓度为0.01m),分别加入不同体积的1m/l的h2o2溶液,使其终浓度为0μm,2μm,5μm,10μm,20μm,40μm,60μm,80μm和100μmh2o2,并补充柠檬酸缓冲液(0.05m,ph 4.0)使其反应体系达到100ul,在25℃下孵育20min,最后加入10ul 5m hcl终止反应。
53.取60nm的氮化硅纳米孔进行纳米孔传感实验,将不同浓度的h2o2进行酶促反应后的金纳米颗粒产物进行纳米孔过孔实验。在电压驱动下,金纳米棒及刻蚀后产物穿过纳米孔通道,引起一系列电流脉冲信号,通过将纳米孔检测的电信号的幅值变化进行直方图统计分析,拟合得到相对电流峰值变化,带入双氧水浓度,即可得到对应的h2o2标准曲线。
54.如图7所示为h2o2溶液浓度分别为0、2μm、5μm、10μm、20μm、40μm、60μm、80μm和100μm时,酶催化刻蚀反应得到金纳米棒产物在纳米孔中检测的电信号的三维统计图,x轴为电流阻塞信号的幅值变化值,y轴为双氧水浓度,z轴为特征事件的比例,可以看出随着随着双氧水浓度的提高,产物的电流信号的幅值峰位也发生移动,逐渐变小。通过拟合得到了离子电流幅值的峰位的变化值(δip)与h2o2浓度之间的线性关系。如图8所示,随着h2o2浓度增加,纳米孔电信号的峰值变化值(δip)与之成线性关系,其函数关系式为y=0.01047+0.00141x(r2=0.996),按照信噪比s/n=3进行计算,相对应的可以得到该方案的检出限为31nm。
55.实施例4:待测样本中的h2o2的定量检测
56.取用含10%牛血清和1%青霉-链霉素的dmem培养基孵育的hela细胞培养液,细胞在含有5%co2/95%空气的37℃恒温箱中孵育培养,生长周期大约为36h。在细胞指数生长时期收集细胞,吸出培养瓶中的原培养液,使用3ml 1x pbs溶液反复清洗,清洗后吸出pbs
并加入2ml胰蛋白酶溶液进行消化,等待3min后细胞从培养瓶壁上脱落下来,立即加入4ml dmem培养液终止消化,随后吸出细胞溶液加入到离心管中,使用离心机离心3min,转速为750rpm,最后取出离心管,去除上清液,保留下面的细胞沉淀物,加入1ml培养液复溶,并用计数板计数约100万/ml,震荡均匀。然后超声破碎(功率20%,超声3s,间隔10s,重复30次),然后离心取上清(8000g,4℃离心10min),置冰上待测。
57.分别取待测样品(hela细胞悬浮液),加入金纳米棒(0.2nm),hrp(2um)和ctab(0.01m),并加入柠檬酸酸缓冲液(0.05m,ph 4.0),混合均匀在25℃下孵育20min,最后加入10ul 5m hcl终止反应。
58.将反应后产物加入使用固态纳米孔传感器,其中纳米孔直径为60nm,厚度为50nm,通过施加电压600mv,进行纳米颗粒过孔信号分析,统计产生的电信号的特征事件的幅值和时间信息,并对其事件的幅值进行拟合,其峰位的变化值,带入标准曲线y=0.01047+0.00141x(r2=0.996),确定对应的样品中的h2o2浓度,最终实现对样品中h2o2浓度的检测。如图9所示,细胞个数与检测浓度之间的关系。对比无细胞时,当数量为106,δip≈0.1048,约0.1um,当数量为107时,δip≈0.1294,约1.7um。
59.综上所述,所有的测试结果表明,本发明所设计的氮化硅纳米孔传感器可以实现对h2o2的定量测试,解决了传统方法中灵敏度低,稳定性差等问题,该方法将纳米孔单分子传感和酶催化刻蚀反应相结合,通过纳米孔对金纳米棒形貌变化的高分辨率,实现了固态纳米孔对于h2o2小分子的定量分析,同时该方法简单操作,适应多种环境反应,特别适用于h2o2低样本,高灵敏度的定量分析。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1