一种人血管炎检测试剂盒的制作方法
1.本技术涉及医学检测的技术领域,更具体地说,它涉及一种人血管炎检测试剂盒。
背景技术:
2.系统性血管炎(systemic vasculitis)是一组以血管坏死和炎症为主要病理改变的疾病,临床表现因受累血管的类型、大小、部位及病理特点不同而表现各异。常见的血管炎有魏格纳氏肉芽肿、显微镜下血管炎、肺出血-肾炎综合征和结节性多动脉炎等。其常累及全身多个系统,既可以引起多系统多脏器功能障碍,但也可局限于某一脏器。由于血管炎的临床表现复杂,病情偏重,早期诊治困难,致残率、病死率高,预后差,因此,血管炎的早期治疗非常重要。
3.特征性的抗中性粒细胞胞质抗体(anti-neutrophil cytoplasmic antibody,anca)是一种以中性粒细胞和单核细胞胞质成分为靶抗原的自身抗体,包括了大量的自身抗体,其中,抗蛋白酶3(pr3)抗体和抗髓过氧化物酶(mpo)抗体是最重要的anca抗体。研究表明,抗pr3抗体和抗mpo抗体参与了血管炎的发病机制。上述两种抗体可以激活人中性粒细胞并致脱颗粒反应,使中性粒细胞释放大量有害的蛋白水解酶和氧自由基,从而导致血管壁的损害,造成血管炎的发生。另外,肺出血-肾炎综合征患者中还能检测到抗肾小球基底膜(gbm)抗体。因此,抗pr3抗体、抗mpo抗体、抗gbm抗体均为血管炎的检测指标。
4.目前,上述检测指标的检测方法通常有酶联免疫吸附法(enzyme linked immunosorbent assay,elisa)、放射免疫法(radioimmunoassay,ria)、间接免疫荧光法(indirect immunofluorescence,iif)等。其中,elisa法操作繁琐,且样本需要预处理,检测时间较长;ria法虽可以直接以血浆为样本检测,但该法不仅会污染环境,还会对操作者有一定的放射性辐射,同时还需要尖端复杂的设备,成本也较高;iif法操作相对复杂,需要价格较昂贵的荧光显微镜,只能进行定性检测,不能进行定量测定,在分析结果时无法根据分子量的大小区分非特异性识别。同时,上述检测方法仅能实现对上述单一检测指标的定性或定量检测。
技术实现要素:
5.为了能够同时获得抗pr3抗体、抗mpo抗体、抗gbm抗体的定性以及定量结果,本技术提供一种人血管炎检测试剂盒。
6.本技术提供的一种人血管炎检测试剂盒,采用如下的技术方案:
7.一种人血管炎检测试剂盒,所述试剂盒包括:
8.由pr3抗原、mpo抗原、gbm抗原分别包被的荧光编码磁性微球的混合液;
9.利用荧光素标记的二抗溶液;
10.样本稀释液;
11.微球清洗液。
12.本技术的试剂盒主要包括混合液和二抗溶液。混合液中包含利用pr3抗原、mpo抗
原和gbm抗原分别包被的荧光编码磁性微球;在进行抗pr3抗体、抗mpo抗体和抗gbm抗体定量联合检测的过程中,先将待测样本与混合液反应,通过混合液中的pr3抗原、mpo抗原和gbm抗原分别与待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体的识别和结合,从而使得待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体间接与荧光编码磁性微球结合。
13.利用荧光素标记的二抗溶液中包含抗人igg抗体。在待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体间接与荧光编码磁性微球结合后,再利用荧光素标记抗人igg抗体与待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体识别和结合,从而完成对待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体的荧光标记。再利用流式细胞仪对待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体进行检测,获得待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体各自对应的荧光信号强度,再根据利用校准品制备的标准曲线中抗体相对浓度与荧光信号强度的关系,以检测获得的待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体各自对应的荧光信号强度为基础,找到与之对应的抗体相对浓度,从而获得待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体各自对应的浓度,完成对待测样本中抗pr3抗体、抗mpo抗体和抗gbm抗体的相对浓度检测。
14.试剂盒中除了包括混合液和二抗溶液外,还包括校准品和缓冲液。校准品为含有抗pr3抗体、抗mpo抗体和抗gbm抗体的标准浓度溶液,通过利用上述试剂盒检测不同浓度的标准溶液的荧光信号强度,从而获得抗pr3抗体、抗mpo抗体和抗gbm抗体与荧光信号强度的标准曲线。因此,利用本技术的试剂盒,可同时检测获得待测样本中抗pr3抗体、抗mpo抗体和抗gbm抗体的相对浓度。
15.所述样本稀释液为包含1%的bsa的1xpbs。
16.所述微球清洗液为包含1%的吐温-20的1xpbs。
17.优选的,所述混合液中,pr3抗原与荧光编码磁性微球的包被比例为:40-50μg的抗原包被1
×
107个磁性荧光编码微球。
18.优选的,所述混合液中,mpo抗原与荧光编码磁性微球的包被比例为:40-50μg的抗原包被1
×
107个磁性荧光编码微球。
19.优选的,所述混合液中,gbm抗原与荧光编码磁性微球的包被比例为:40-50μg的抗原包被1
×
107个磁性荧光编码微球。
20.通过采用上述技术方案,经过试验分析,制备混合液的过程中,将pr3抗原、mpo抗原和gbm抗原分别与荧光编码磁性微球的包被比例控制在上述范围内时,相同抗原相对浓度下检测获得的荧光信号强度基本一致;当pr3抗原、mpo抗原和gbm抗原分别与荧光编码磁性微球的包被比例小于或大于上述范围时,相同抗原相对浓度下检测获得的荧光信号强度均小于两者包被比例在上述范围内时的荧光信号强度。由此可知,将pr3抗原、mpo抗原和gbm抗原分别与磁性荧光编码微球的包被比例控制在上述范围内时,能够获得较为稳定的荧光信号强度,故最终获得的待测样本中抗pr3抗体、抗mpo抗体和抗gbm抗体的相对浓度较准确,因此,将pr3抗原、mpo抗原和gbm抗原与荧光编码磁性微球的包被比例控制在:40-50μg抗原包被1
×
107个磁性荧光编码微球。
21.优选的,所述二抗溶液中,包含抗人igg抗体,抗人igg抗体的浓度为0.5-4μg/ml。
22.通过采用上述技术方案,经过试验分析,制备二抗溶液的过程中,将荧光素标记的抗人igg抗体浓度控制在上述范围内,相同抗体相对浓度下检测获得的荧光信号强度的变
化梯度基本一致;当荧光素标记的抗人igg浓度为0.3μg/ml时,抗体相对浓度在高点值时检测获得的荧光信号强度较低,而当荧光素标记的抗人igg的浓度为6μg/ml时,抗体相对浓度在0点值时检测获得的荧光信号强度过高。由此可知,将溶液b中荧光素标记的抗人igg抗体浓度控制在上述范围内时,能够获得较为稳定的荧光信号强度,故最终获得的待测样本中抗pr3抗体、抗mpo抗体和抗gbm抗体相对浓度较准确。因此,将二抗溶液中荧光素标记的抗人igg抗体的浓度控制在0.5-4μg/ml的范围内。
23.优选的,所述荧光素包括藻红蛋白(pe)、pe-cy7、异硫氰酸荧光素(fitc)、多甲藻黄素-叶绿素-蛋白复合物(percp)、别藻蓝蛋白(apc)、alexa fluo488。
24.通过采用上述方案,本技术中用到的荧光素如上所述,利用上述荧光素均可以对抗人igg抗体进行荧光标记。
25.藻红蛋白是从红藻中分离纯化的一种荧光蛋白,是一种新型荧光标记染料,因为其具有强烈的荧光,很好的吸光性能和很高的量子产量,在可见光谱区有很宽的激发及发射范围,故在免疫荧光、免疫组化、流式细胞仪检测等抗体的荧光标记和活体成像中有着广泛的应用。pe-cy7是一种基于藻红蛋白的偶联荧光染料。
26.异硫氰酸荧光素是生化试剂,也是医学诊断药品,主要用于荧光抗体技术中的荧光染料,能和各种抗体蛋白结合,结合后的抗体不丧失与一定抗原结合的特异性,并在碱性溶液中具有强烈的绿色荧光,用于医学、农学和畜牧等多方面,可对由细菌病毒和寄生虫等所致疾病进行快速诊断。alexa fluo488是一种小分子荧光染料,激发及发射波长与异硫氰酸荧光素类似,但光稳定性更强。
27.多甲藻黄素-叶绿素-蛋白复合物是从横烈甲纲门中分离出来的,它具有非常高的淬灭系数、高量子能效和很大的斯托克位移。percp属于活体荧光成像蛋白标记染料,能产生更高、耐光性更好的荧光,相对短波长的青蓝素染料而言,活体荧光成像蛋白标记染料是青蓝素染料卓越的替代品。percp通常用于荧光免疫标记,另外,percp还用于多色彩细胞的流式细胞分析,故percp可以和fitc、pe和其他荧光物质一同用于多色彩分析中。
28.本技术提供的试剂盒的检测方法如下:
29.(1)利用样本稀释液对待测样本进行稀释,获得稀释样;
30.(2)将步骤(1)获得的稀释样与混合液混合,37℃反应20min,获得抗体-抗原-微球复合物;
31.(3)利用微球清洗液对步骤(2)获得的抗体-抗原-微球复合物进行清洗,并去除微球清洗液;
32.(4)将步骤(3)清洗后的抗体-抗原-微球复合物与二抗溶液混匀,37℃反应20min,获得标记后的二抗-抗体-抗原-微球复合物;
33.(5)利用微球清洗液对步骤(4)获得的二抗-抗体-抗原-微球复合物进行清洗,并去除微球清洗液;
34.(6)利用微球清洗液对步骤(5)清洗后的二抗-抗体-抗原-微球复合物重悬,进行上样检测,并分析检测结果。
35.利用上述试剂盒及其检测方法,对待测样本进行检测,具体包括待测样本与混合液的反应,将待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体与荧光编码磁性微球上pr3抗原、mpo抗原和gbm抗原结合,获得抗体-抗原-微球复合物,从而实现待测样本中的待
测抗pr3抗体、抗mpo抗体和抗gbm抗体的定位;然后将抗体-抗原-微球复合物与二抗溶液反应,利用二抗溶液中荧光素标记的抗人igg抗体与定位在荧光编码磁性微球上的待测抗pr3抗体、抗mpo抗体和抗gbm抗体反应,进行抗原抗体结合反应,从而完成待测样本中待测抗pr3抗体、抗mpo抗体和抗gbm抗体的荧光标记,获得二抗-抗体-抗原-微球复合物;最后,二抗-抗体-抗原-微球复合物进行定容,获得检测液,并利用流式细胞仪对检测液进行检测,获得待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体各自对应的荧光信号强度,再根据利用检测校准品获得的抗原抗体相对浓度与荧光信号强度关系的标准曲线,以检测获得的待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体各自对应的荧光信号强度为基础,找到与之对应的抗原抗体相对浓度,从而获得待测样本中的待测抗pr3抗体、抗mpo抗体和抗gbm抗体各自对应的浓度,完成对待测样本中抗pr3抗体、抗mpo抗体和抗gbm抗体的相对浓度检测。
36.待测样本与混合液的反应时间可以是10-30min。经过试验分析,待测样本与混合液的反应时间控制在上述范围内时,检测获得的抗pr3抗体、抗mpo抗体和抗gbm抗体的荧光信号强度呈现持续增长的趋势;当待测样本与混合液反应时间小于上述范围时,检测获得的抗pr3抗体、抗mpo抗体和抗gbm抗体的荧光信号强度小于反应时间处于上述范围内时检测获得的抗pr3抗体、抗mpo抗体和抗gbm抗体的荧光信号强度;当待测样本与混合液的反应时间大于上述范围时,检测获得的抗pr3抗体、抗mpo抗体和抗gbm抗体的荧光信号强度增长趋势已减缓,且基本不变。因此,为了能够获得更加准确的待测样本中抗pr3抗体、抗mpo抗体和抗gbm抗体的信息,待测样本与混合液的反应时间选择控制在10-30min的范围内。
37.优选的,待测样本与混合液的反应时间为20min。
38.抗体-抗原-微球复合物与二抗溶液的反应时间可以是10-30min。经过试验分析,抗体-抗原-微球复合物与二抗溶液的反应时间控制在上述范围内时,检测获得的抗pr3抗体、抗mpo抗体和抗gbm抗体的荧光信号强度呈现持续增长的趋势;当抗体-抗原-微球复合物与二抗溶液的反应时间小于上述范围时,检测获得的抗pr3抗体、抗mpo抗体和抗gbm抗体的荧光信号强度小于反应时间处于上述范围内时检测获得的抗pr3抗体、抗mpo抗体和抗gbm抗体的荧光信号强度;当抗体-抗原-微球复合物与二抗溶液的反应时间大于上述范围时,检测获得的抗pr3抗体、抗mpo抗体和抗gbm抗体的荧光信号强度增长趋势已减缓,且基本不变。因此,为了能够获得更加准确的待测样本中抗pr3抗体、抗mpo抗体和抗gbm抗体的信息,抗体-抗原-微球复合物与二抗溶液的反应时间选择控制在10-30min的范围内。
39.优选的,抗体-抗原-微球复合物与二抗溶液的反应时间为20min。
40.优选的,待测样本与混合液、抗体-抗原-微球复合物与二抗溶液的反应温度为37
±
1℃。
41.经过试验分析,反应温度为37℃时,检测获得的抗pr3抗体、抗mpo抗体和抗gbm抗体的荧光信号强度均大于孵育温度为室温(18-25℃)时检测获得的抗pr3抗体、抗mpo抗体和抗gbm抗体的荧光信号强度。因为,为了能够获得更加准确的待测样本中抗pr3抗体、抗mpo抗体和抗gbm抗体的信息,孵育温度选择控制在37
±
1℃的范围内。
42.优选的,所述待测样本为全血样本。
43.优选的,所述待测样本为血清或血浆样本。
44.优选的,待测样本与混合液的添加比例为:每1μl待测样本对应加入50-500个抗原
包备的荧光编码磁性微球。
45.优选的,待测样本的添加量为10-100μl。优选为50μl。
46.通过采用上述技术方案,经过试验分析,将待测样本与混合液的添加比例控制在上述范围内,能够保证最终检测获得较为准确的荧光信号强度,从而获得较为准确的抗体相对浓度。同理,将待测样本的添加量控制在上述范围内时,能够保证最终检测获得较为准确的荧光信号强度,从而获得较为准确的抗原抗体相对浓度。
47.综上所述,本技术具有以下有益效果:
48.本技术提供的试剂盒能够单次同时完成待测样本中抗pr3抗体、抗mpo抗体和抗gbm抗体的定性和定量检测。即通过一次检测,得出3个检测指标的检测结果。相比相关技术中的线性免疫印迹法只能提供定性/半定量检测结果,酶联免疫吸附法则是只能定量检测,本技术提供的试剂盒能够同时实现定性和定量检测。同时,利用该试剂盒的检测降低了对人力的依赖,降低了测试人员的负担。
具体实施方式
49.本技术提供了一种人血管炎检测试剂盒,所述试剂盒包括:由pr3抗原、mpo抗原、gbm抗原分别包被的荧光编码磁性微球的混合液;利用荧光素标记的二抗溶液;样本稀释液;微球清洗液。
50.其中,所述混合液中,pr3抗原与荧光编码磁性微球的包被比例为:40-50μg的抗原包被1
×
107个磁性荧光编码微球。所述混合液中,mpo抗原与荧光编码磁性微球的包被比例为:40-50μg的抗原包被1
×
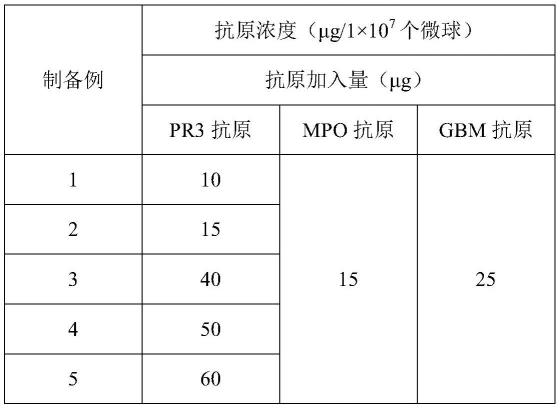
107个磁性荧光编码微球。所述混合液中,gbm抗原与荧光编码磁性微球的包被比例为:40-50μg的抗原包被1
×
107个磁性荧光编码微球。
51.利用荧光素标记的二抗溶液中包含抗人igg抗体,抗人igg抗体的浓度为0.5-4μg/ml。该二抗溶液的制备方法如下:
52.1.配制pbs-tbp溶液,配方如下:
53.将na2hpo4·
12h2o 2.9g、kh2po
4 0.2g、nacl 8g、kcl 0.2g、di h2o 0.9l混合,并加入t-20 0.2ml、pc-300 0.5ml、bsa 1g;调ph至7.4,然后利用无菌水定容至1l。
54.2.将配制好的pbs-tbp溶液,将用荧光素标记的二抗以1:2500-1:20000比例稀释,使终浓度为0.5~4ug/ml。优选地,将用荧光素标记的二抗以1:10000比例稀释,使终浓度为1ug/ml。
55.所用的荧光素包括藻红蛋白(pe)、异硫氰酸荧光素(fitc)、多甲藻黄素-叶绿素-蛋白复合物(percp)、别藻蓝蛋白(apc)。所述试剂盒的待测样本为全血样本或血清、血浆样本。所述混合液与待测样本的反应时间为10-30min。所述混合液与待测样本反应后的物质与二抗溶液的反应时间为10-30min。所述待测样本与混合液的添加比例为:每1μl待测样本对应加入50-500个抗原包备的荧光编码磁性微球。
56.以下结合实施例1-18、对比例1-18以及检测试验对本技术作进一步详细说明。
57.制备例
58.制备例1
59.本制备例提供了一种由pr3抗原、mpo抗原、gbm抗原分别包被的荧光编码磁性微球的混合液。该混合液制备方法具体包括以下步骤:
60.(1)预处理:
61.获取微球:分别取100μl荧光编码磁性微球悬浮液(约1
×
107个微球)于3个离心管中,并将3个离心管置于磁力架,进行磁性吸附,分离弃去上清液;
62.微球洗涤与重悬:分别向3个离心管中加入200μl微球洗涤液,涡旋10s,并将离心管置于磁力架,进行磁性吸附,分离弃去上清液;继续重复洗涤两次;分别向3个离心管中加100μl微球洗涤液重悬微球,涡旋10s以混匀微球,获得3个微球重悬液a。
63.(2)活化:
64.活化微球:分别向3个微球重悬液a中加入10μl活化剂溶液,涡旋10s后,室温下避光反应20-30min,并将3个离心管置于磁力架,进行磁性吸附,分离弃去上清液;
65.活化后微球的洗涤与重悬:分别向3个离心管中加入200μl微球洗涤液,涡旋10s,并将3个离心管置于磁力架,进行磁性吸附,分离弃去上清液;继续重复洗涤两次;分别向3个离心管中加入100μl微球洗涤液重悬微球,涡旋10s以混匀微球,获得3个微球重悬液b。
66.(3)包被:
67.微球包被:分别向3个微球重悬液b中加入pr3抗原、mpo抗原、gbm抗原;涡旋混匀后,室温下避光反应24h;将反应后的3个离心管置于磁力架,进行磁性吸附,分离弃去上清液;
68.包被后封闭:分别向3个离心管中加入等体积的封闭液,进行封闭反应,室温下避光封闭4h,将反应后的3个离心管置于磁力架,进行磁性吸附,分离弃去上清液;
69.包被后微球的洗涤与重悬:分别向3个离心管中加入200μl微球保存缓冲液,涡旋10s,将3个离心管置于磁力架,进行磁性吸附,分离弃去上清液;继续重复洗涤两次;分别向3个离心管中加入1ml微球保存缓冲液重悬微球,涡旋10s以混匀微球,获得3种荧光编码磁性微球重悬液。
70.(4)保存:分别将3种荧光编码磁性微球重悬液置于2-8℃避光保存;将3种荧光编码磁性微球重悬液按1:1:1的比例混合,即为混合液。
71.制备例2-13
72.制备例2-13分别提供了一种由pr3抗原、mpo抗原、gbm抗原分别包被的荧光编码磁性微球的混合液。
73.制备例2-13与制备例1的不同之处在于制备方法的包被步骤中pr3抗原、mpo抗原、gbm抗原的加入量。具体如表1所示。
74.表1制备例1-13中pr3抗原、mpo抗原、gbm抗原的加入量
[0075][0076][0077]
制备例14-28
[0078]
制备例14-28分别提供了一种由pr3抗原、mpo抗原或gbm抗原包被的荧光编码磁性微球的混合液。制备例14-28与制备例1的不同之处在于制备方法的包被步骤中加入的抗原种类及其加入量。具体如表2所示。
[0079]
其中,制备例14-18分别提供了由pr3抗原包被的荧光编码磁性微球的混合液。
[0080]
制备例19-23分别提供了由mpo抗原包被的荧光编码磁性微球的混合液。
[0081]
制备例24-28分别提供了由gbm抗原包被的荧光编码磁性微球的混合液。
[0082]
表2制备例14-28中pr3抗原、mpo抗原或gbm抗原的加入量
[0083][0084][0085]
制备例29
[0086]
本制备例提供了一种利用荧光素标记的二抗溶液。该利用荧光素标记的二抗溶液的制备方法具体包括以下步骤:
[0087]
1.配制pbs-tbp溶液,配方如下:
[0088]
将na2hpo4·
12h2o 2.9g、kh2po
4 0.2g、nacl 8g、kcl 0.2g、di h2o 0.9l混合,并加入t-20 0.2ml、pc-300 0.5ml、bsa 1g;调ph至7.4,然后利用无菌水定容至1l。
[0089]
2.将配制好的pbs-tbp溶液,将用荧光素标记的二抗溶液以1:10000的比例稀释,使终浓度为1ug/ml。
[0090]
制备例30-31
[0091]
制备例30-31分别提供了利用荧光素标记的二抗溶液。制备例30-31与制备例29的不同之处在于:利用荧光素标记的二抗溶液的稀释比例。具体如表3所示。
[0092]
表3制备例29-31中利用荧光素标记的二抗溶液的稀释比例
[0093]
制备例稀释比例291:10000301:2500311:20000
[0094]
实施例
[0095]
实施例1-15
[0096]
实施例1-15分别提供了一种人血管炎检测试剂盒。实施例1-15的不同之处在于其中的混合液和利用荧光素标记的二抗溶液。具体如表4所示。
[0097]
上述提供的人血管炎检测试剂盒的组分如下:
[0098]
由pr3抗原、mpo抗原、gbm抗原分别包被的荧光编码磁性微球的混合液;利用荧光素标记的二抗溶液;样本稀释液;微球清洗液。
[0099]
表4实施例1-15中混合液和二抗溶液的种类
[0100][0101]
实施例16
[0102]
本实施例提供了一种人血管炎检测试剂盒。本实施例与实施例11的不同之处在于:利用荧光素标记的二抗溶液在4℃下保存一年。
[0103]
实施例17
[0104]
本实施例提供了一种人血管炎检测试剂盒。本实施例与实施例14的不同之处在于:利用荧光素标记的二抗溶液在4℃下保存一年。
[0105]
实施例18
[0106]
本实施例提供了一种人血管炎检测试剂盒。本实施例与实施例15的不同之处在于:利用荧光素标记的二抗溶液在4℃下保存一年。
[0107]
对比例
[0108]
对比例1-15
[0109]
对比例1-15分别提供了一种人血管炎检测试剂盒。对比例1-15的不同之处在于组分中的混合液。具体如表5所示。
[0110]
表5对比例1-15中混合液和二抗溶液的种类
[0111][0112]
检测试验一
[0113]
分别利用上述实施例1-18以及对比例1-15提供的人血管炎检测试剂盒进行待测样本的检测。
[0114]
待测样本的类型分别为1-pr3阳性、2-mpo阳性、3-gbm阳性、4-阴性。
[0115]
利用实施例1-18提供的人血管炎检测试剂盒分别对上述4种待测样品进行检测。
[0116]
利用对比例1-5提供的人血管炎检测试剂盒分别对上述1-pr3阳性、4-阴性2种待测样品进行检测。
[0117]
利用对比例6-10提供的人血管炎检测试剂盒分别对上述2-mpo阳性、4-阴性2种待测样品进行检测。
[0118]
利用对比例11-15提供的人血管炎检测试剂盒分别对上述3-gbm阳性、4-阴性2种待测样品进行检测。
[0119]
上述人血管炎检测试剂盒的检测方法如下:
[0120]
(1)利用样本稀释液对待测样本进行稀释,获得稀释样;
[0121]
(2)将步骤(1)获得的稀释样100μl与混合液混合,37℃反应20min,获得抗体-抗原-微球复合物;
[0122]
(3)利用微球清洗液对步骤(2)获得的抗体-抗原-微球复合物进行清洗,并去除微球清洗液;
[0123]
(4)将步骤(3)清洗后的抗体-抗原-微球复合物与二抗溶液混匀,37℃反应20min,获得标记后的二抗-抗体-抗原-微球复合物;
[0124]
(5)利用微球清洗液对步骤(4)获得的二抗-抗体-抗原-微球复合物进行清洗,并去除微球清洗液;
[0125]
(6)利用微球清洗液对步骤(5)清洗后的二抗-抗体-抗原-微球复合物重悬,进行上样检测,并分析检测结果。
[0126]
检测结果如表6、表7所示。
[0127]
表6利用实施例1-18提供的人血管炎试剂盒的检测结果
[0128]
[0129]
[0130][0131]
结合表6,通过对比实施例1-5的检测结果可知,在保持mpo抗原和gbm抗原的加入量不变的条件下,调整pr3抗原的添加量,由四种样本的检测结果可知,当pr3抗原的添加量控制在10-50μg的范围内时,能够提高对三种抗体检测结果的准确性。尤其是当将pr3抗原的添加量控制在40-50μg的范围内时,能够进一步提高三种抗体检测结果的准确性。
[0132]
通过对比实施例3、6-9的检测结果可知,在保持pr3抗原和gbm抗原的加入量不变的条件下,调整mpo抗原的添加量,由四种样本的检测结果可知,当mpo抗原的添加量控制在10-50μg的范围内时,能够提高对三种抗体检测结果的准确性。尤其是当将mpo抗原的添加量控制在40-50μg的范围内时,能够进一步提高三种抗体检测结果的准确性。
[0133]
通过对比实施例8、10-13的检测结果可知,在保持pr3抗原和mpo抗原的加入量不变的条件下,调整gbm抗原的添加量,由四种样本的检测结果可知,当gbm抗原的添加量控制在10-50μg的范围内时,能够提高对三种抗体检测结果的准确性。尤其是当将gbm抗原的添加量控制在40-50μg的范围内时,能够进一步提高三种抗体检测结果的准确性。尤其是,当混合液中pr3抗原的添加量为40μg,mpo抗原的添加量为50μg,gbm抗原的添加量为40μg时,待测样本中三种抗体检测结果的准确性最佳。
[0134]
通过对比实施例11、14-15的检测结果可知,在混合液中pr3抗原的添加量为40μg,mpo抗原的添加量为50μg,gbm抗原的添加量为40μg时,将利用荧光素标记的二抗溶液以1:10000的比例稀释,终浓度为1ug/ml时,待测样本中三种抗体检测结果的准确性最佳。
[0135]
通过对比实施例11、14-15以及实施例16-18的检测结果可知,当利用荧光素标记
的二抗溶液以1:10000的比例稀释,终浓度为1ug/ml时,利用荧光素标记的二抗溶液在4℃下保存一年后对待测样本中三种抗体的检测结果仍具有较佳的准确性。
[0136]
表7利用对比例1-15提供的人血管炎试剂盒的检测结果
[0137][0138]
结合表7,通过对比实施例1-5的检测结果可知,单独检测pr3抗体时,当pr3抗原的添加量控制在15-25μg的范围内时,能够提高对pr3抗体检测结果的准确性。尤其是当将pr3抗原的添加量控制在15-20μg的范围内时,能够进一步提高pr3抗体检测结果的准确性。
[0139]
通过对比实施例6-10的检测结果可知,单独检测mpo抗体时,当mpo抗原的添加量控制在15-25μg的范围内时,能够提高对mpo抗体检测结果的准确性。尤其是当将mpo抗原的添加量控制在15-20μg的范围内时,能够进一步提高mpo抗体检测结果的准确性。
[0140]
通过对比实施例11-15的检测结果可知,单独检测gbm抗体时,当gbm抗原的添加量控制在15-30μg的范围内时,能够提高对gbm抗体检测结果的准确性。尤其是当将gbm抗原的添加量控制在20-30μg的范围内时,能够进一步提高gbm抗体检测结果的准确性。
[0141]
进一步地,通过对比实施例1-13以及对比例1-15的检测结果可知,当对pr3抗体、mpo抗体、gbm抗体进行联合检测时,混合液中pr3抗原、mpo抗原、gbm抗原的添加量与单独对
三种抗体进行检测时混合液中三种抗原的添加量完全不同。
[0142]
检测试验二
[0143]
分别利用上述实施例11提供的人血管炎检测试剂盒进行待测样本的检测。
[0144]
检测方法与“检测试验一”的不同之处在于两次反应的条件。具体如表8所示。
[0145]
表8检测试验二中两次反应的条件
[0146][0147]
待测样本的类型同“检测试验一”。检测结果如表9所示。
[0148]
表9不同反应条件下的检测结果
[0149][0150]
结合表9,通过编号1-2与编号3-5检测结果的对比可知,待测样本稀释后的稀释样与混合液的反应温度、抗体-抗原-微球复合物与二抗溶液的反应温度,控制在37℃的条件下比室温条件更能够提高待测样品中三种抗体检测结果的准确性。
[0151]
通过对比编号3-5的检测结果可知,待测样本稀释后的稀释样与混合液的反应温度为37℃、反应时间为20min,同时,抗体-抗原-微球复合物与二抗溶液的反应温度为37℃、反应时间为20min时,能够进一步提高待测样品中三种抗体检测结果的准确性。
[0152]
对比例16
[0153]
本对比例提供了一种利用酶联免疫吸附法对待测样本进行检测的方法。
[0154]
上述检测方法具体包括以下步骤:
[0155]
(1)吸取100ul稀释好的样本、标准和质控血消(不用稀释)放入各反应孔中,并使用稀释缓冲液代替血滴做空白;使用不干胶盖板封口。在室温下孵育1h;
[0156]
(2)用洗液(每孔每次300μl)洗孔3次;
[0157]
(3)去除洗涤缓冲液,在滤纸或布上吸干;每孔加入100ul的酶标。在室温下孵育30分钟;
[0158]
(4)用洗液(每孔每次300μl)洗孔3次;
[0159]
(5)去除洗涤緩冲液,在滤纸或布上吸干;每孔加入100ul tmb底物。在室温下避光
孵育10min;在25℃以上时所需的孵育时间可以缩短,但也不应少于5min;
[0160]
(6)每孔加入100ul的终止液;10min内在450nm下检测。
[0161]
对比例17
[0162]
本对比例提供了一种利用线性免疫印迹法对待测样本进行检测的方法。
[0163]
上述检测方法具体包括以下步骤:
[0164]
(1)使用样本稀释缓冲液1:101稀释待测样本;
[0165]
(2)将膜条放入加样槽,每槽加入洗涤缓冲液1ml,润湿膜条,室温孵育1min;去除洗涤缓冲液;
[0166]
(3)每槽加入稀释样本1ml,室温孵育30min;去除液体,洗涤3次;
[0167]
(4)每槽加入酶结合物1ml,室温孵育30min;去除液体,洗涤3次;
[0168]
(5)每槽加入底物液1ml,室温孵育10min;
[0169]
(6)每槽加入纯化水1ml,室温孵育1min;
[0170]
(7)去除液体,每槽加入终止液1ml,室温孵育5min;
[0171]
(8)去除液体,彻底干燥膜条。
[0172]
检测试验三
[0173]
分别利用实施例11提供的人血管炎试剂盒及其检测方法、对比例16提供的酶联免疫吸附法、对比例17提供的线性免疫印迹法对待测样本进行检测。检测结果如表10-表11所示。
[0174]
待测样本的类型同“检测试验一”。
[0175]
利用本技术实施例11提供的试剂盒及其检测方法,获得的检测结果如表6所示。
[0176]
利用对比例16提供的酶联免疫吸附法,获得的检测结果如表10所示。
[0177]
表10对比例16-酶联免疫吸附法的检测结果
[0178][0179]
结合表10可知,虽然酶联免疫吸附法能够获得各种抗体的浓度,但是酶联免疫吸附法每次仅能获得一种抗体的浓度,若需要对多种抗体进行检测时,则需要分别进行多次的检测试验。而与表6相比,本技术提供的试剂盒仅检测一次便可获得多种抗体的检测结果,简单、方便、快捷,提高了抗体的检测效率。
[0180]
利用对比例17提供的线性免疫印迹法,获得的检测结果如表11所示。
[0181]
表11对比例17的检测结果
[0182][0183]
结合表11可知,线性免疫印迹法仅能对待测样本是否为阳性进行定性,不能获得定量结果。而与表6相比,本技术提供的试剂盒不仅能够对待测样本是否为阳性进行定性,还能够获得定量结果,检测效率更高。
[0184]
本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1