一种同时测定土壤中异丙噻菌胺及其代谢物PPA残留的方法
一种同时测定土壤中异丙噻菌胺及其代谢物ppa残留的方法
技术领域
1.本发明涉及农药残留检测技术领域,尤其是涉及一种同时测定土壤中异丙噻菌胺及其代谢物ppa残留的方法。
背景技术:
2.农药作为植物化学保护的有效手段,在农作物病、虫、草、鼠害防治和保证农业生产安全,以及满足人们日益增长的农副产品需求等方面发挥着重要作用,并且在今后一定时间内不会为其它手段所完全取代。农药在使用中只有一部分附着在农作物上,大部分挥发进入大气或是喷洒过程中落入土壤和地表水,而降水也会将附着在农作物上的农药淋入土壤及地表水中,土壤中因吸附存在的部分农药也会通过交换、渗透作用进入地下水或地表水。因此,建立土壤中农药的检测方法及进行检测非常重要,可为土壤修复及环境治理提供重要参考数据。
3.异丙噻菌胺,英文名称为isofetamid,化学名称为n-[1,1-二甲基-2-(4-异丙氧基-邻甲苯基)-2-氧代乙基]-3-甲基噻吩-2-甲酰胺,结构式为图1,是日本石原产业公司研发的第3代sdhi杀菌剂,主要作用于病原菌中的琥珀酸脱氢酶,抑制它的呼吸从而发挥预防和治疗作用。2014年以来,相继在加拿大、美国获登记上市,多用于防治葡萄、莴苣、油菜籽、矮生浆果、高尔夫球场及草皮农场上草坪草的多种灰霉病和菌核病害,但目前尚未在中国取得登记使用;异丙噻菌胺的代谢物ppa的结构式如图2。
[0004]
一些研究表明,许多农药的代谢物与母体化合物相同或毒性更大。现有的生态毒理学数据表明,异丙噻菌胺对地表水中的水生生物的生存具有很高的危险性,代谢物毒性数据尚不能完整地得出他们对陆地生物没有潜在的危险的结论。要想明确上述问题,需要采取适宜的方式检测异丙噻菌胺及其代谢物ppa在土壤中的含量,然而异丙噻菌胺及其代谢物ppa在土壤中的检测方法未见相关报道。
[0005]
有鉴于此,特提出本发明。
技术实现要素:
[0006]
本发明提供了一种同时测定土壤中异丙噻菌胺及其代谢物ppa残留的方法,以解决现有技术中缺乏检测土壤中异丙噻菌胺及其代谢物ppa含量方法的问题。
[0007]
为解决上述问题,本发明采用以下方案:
[0008]
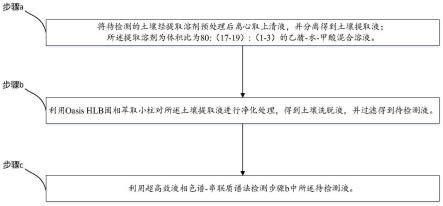
一种同时测定土壤中异丙噻菌胺及其代谢物ppa残留的方法,包括制备待检测液和利用超高效液相色谱-串联质谱法检测所述待检测液;
[0009]
其中,制备待检测液所用提取溶剂为体积比为80:(17-19):(1-3)的乙腈-水-甲酸混合溶液。
[0010]
本方案提供的方法,先利用体积比为80:(17-19):(1-3)的乙腈-水-甲酸混合溶液对土壤进行预处理,制备待检测液,再根据母体和代谢物的理化性质的巨大差异,利用超高效液相色谱-串联质谱法检测对净化液进行检测,从而提供了一种同时测定土壤中异丙噻
菌胺及其代谢物ppa残留的方法,对土壤中异丙噻菌胺及其代谢物ppa的检测准确度高、灵敏度高,且当提取溶剂中甲酸的含量在1%~3%时,样品损失较小,能保证较高水平的回收率。
[0011]
在进一步优选的方案中,在利用超高效液相色谱-串联质谱法检测所述待检测液时,异丙噻菌胺和ppa采用液相梯度洗脱程序。在进一步优选的方案中,在利用超高效液相色谱-串联质谱法检测所述待检测液时,高效液相色谱条件为:
[0012]
色谱柱尺寸:2.1mm
×
100mm
×
(1.6-1.8)μm;流速:0.2-0.3ml/min;柱温:35-45℃;进样体积:1.5-2.5μl;运行时间:3-5min。
[0013]
在进一步优选的方案中,在利用超高效液相色谱-串联质谱法检测所述待检测液时,质谱条件为:
[0014]
电离方式为esi+,毛细管电压为0.6-0.8kv,离子源温度为120-180℃,脱溶剂温度为350-450℃,脱溶剂气流量为700-900l/hr。
[0015]
在进一步优选的方案中,在利用超高效液相色谱-串联质谱法检测所述待检测液时,流动相为a相和b相;
[0016]
其中,所述a相为0.1%甲酸/甲醇的溶液,所述b相为0.1%甲酸和10mmol/l甲酸铵水混合溶液。
[0017]
在进一步优选的方案中,包括以下步骤:
[0018]
a.将待检测的土壤经提取溶剂预处理后,离心取上清液,并分离得到土壤提取液;所述提取溶剂为体积比为80:(17-19):(1-3)的乙腈-水-甲酸混合溶液;
[0019]
b.利用oasis hlb固相萃取小柱对所述土壤提取液进行净化处理,得到土壤洗脱液,并过滤得到待检测液;
[0020]
c.利用超高效液相色谱-串联质谱法检测步骤b中所述待检测液。
[0021]
在进一步优选的方案中,所述提取溶剂为体积比为80:18:2的乙腈-水-甲酸混合溶液,当提取溶剂中甲酸的含量为2%时,能使得样品损失率最小。
[0022]
在进一步优选的方案中,还包括采用基质匹配外标法进行定量分析。
[0023]
在进一步优选的方案中,所述基质匹配外标法具体包括用空白样品提取液分别配制不同浓度范围的异丙噻菌胺及其代谢物ppa的混合标准工作液,以浓度为横坐标,定量离子对峰面积为纵坐标,进行线性回归计算。
[0024]
与现有技术相比,本发明具有以下有益效果:
[0025]
本技术提供的一种同时测定土壤中异丙噻菌胺及其代谢物ppa残留的方法,先利用体积比为80:(17-19):(1-3)的乙腈-水-甲酸混合溶液对土壤进行预处理,当提取溶剂中甲酸的含量在1%~3%时,样品损失较小,能保证较高水平的回收率;再根据母体和代谢物的理化性质的巨大差异,利用oasis hlb固相萃取小柱对所述土壤提取液进行净化处理,最后利用超高效液相色谱-串联质谱法检测对净化液进行检测,从而提供了一种同时测定土壤中异丙噻菌胺及其代谢物ppa残留的方法,而且前处理过程简单,对土壤中异丙噻菌胺及其代谢物ppa的检测准确度高、灵敏度高。
附图说明
[0026]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体
实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0027]
图1为本发明异丙噻菌胺的结构示意图;
[0028]
图2为本发明异丙噻菌胺代谢物ppa的结构示意图;
[0029]
图3为本发明实施例提供的一种具体的同时测定土壤中异丙噻菌胺及其代谢物ppa残留的方法的流程图;
[0030]
图4为本发明实施例中异丙噻菌胺标准溶液(溶剂标)的标准曲线图;
[0031]
图5为本发明实施例中异丙噻菌胺标准溶液(基质标)的标准曲线图;
[0032]
图6为本发明实施例中异丙噻菌胺代谢物ppa标准溶液(溶剂标)的标准曲线图;
[0033]
图7为本发明实施例中异丙噻菌胺代谢物ppa标准溶液(基质标)的标准曲线图;
[0034]
图8为异丙噻菌胺子离子色谱图;
[0035]
图9为异丙噻菌胺代谢物ppa子离子色谱图;
[0036]
图10为0.05μg/l异丙噻菌胺混合标准工作液谱图;
[0037]
图11为0.1μg/lppa混合标准工作液谱图;
[0038]
图12为土壤添加异丙噻菌胺回收样品(添加水平5μg/kg)的标准工作液谱图;
[0039]
图13为土壤添加ppa回收样品(添加水平5μg/kg)的标准工作液谱图。
具体实施方式
[0040]
为了使本发明的上述以及其他特征和优点更加清楚,下面结合附图进一步描述本发明。应当理解,本文给出的具体实施例是出于向本领域技术人员解释的目的,仅是示例性的,而非限制性的。
[0041]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0042]
请参考图3,本发明提供了一种同时测定土壤中异丙噻菌胺及其代谢物ppa残留的方法,包括以下步骤:
[0043]
a.将待检测的土壤经提取溶剂预处理后,离心取上清液,并分离得到土壤提取液;提取溶剂为体积比为80:(17-19):(1-3)的乙腈-水-甲酸混合溶液。
[0044]
需要说明的是,步骤a主要针对土壤中异丙噻菌胺及其代谢物ppa残留检测的样品处理,与异丙噻菌胺及其代谢物ppa在蔬菜及瓜果中的检测区别较大,尤其是甲酸的加入,能将溶液调节为酸性环境,使得土壤中异丙噻菌胺及其代谢物ppa的提取更为彻底,回收率更高,此处加入甲酸是在大量实验后经推理得知,现有技术中尚无甲酸在此方面的应用,且本方案中通过大量实验,对提取溶剂中甲酸的含量进行了针对性地优化设计。
[0045]
需要补充的是,此处“80:(17-19):(1-3)”指代体积占比,当甲酸的体积含量为1%
~3%时,水的体积含量对应为19%~17%时,即甲酸和水的体积之和占总提取溶剂体积的20%。
[0046]
b.利用oasis hlb固相萃取小柱对土壤提取液进行净化处理,得到土壤洗脱液,并过滤得到待检测液。
[0047]
需要补充的是,美国waters oasis hlb吸附剂是由亲脂性二乙烯苯和亲水性n-乙烯基吡咯烷酮两种单体按一定比例聚合成的大孔共聚物,其保留机理为反相,通过一个“特殊的极性捕获基团”来增加对极性物质的保留,提供很好的水浸润性。
[0048]
步骤b中的oasis hlb固相萃取小柱即采用oasis hlb吸附剂,这是一种通用的聚合反相吸附剂,用于从各种基质中提取大量酸性、碱性和中性化合物,具有亲水亲脂性。由于oasis hlb吸附剂是水润湿性的,所以即使吸附剂干了也可以保持较高的保存率和优异的回收率,这意味着在取样前的关键步骤中,不需要采取特别措施来防止吸附剂干透。
[0049]
c.利用超高效液相色谱-串联质谱法检测步骤b中待检测液;高效液相色谱-串联质谱法(hplc-msims)是一种集高效分离和多组分定性、定量于一体的方法,对高沸点、不挥发和热不稳定化合物的分离和鉴定具有独特优势。
[0050]
本发明先利用体积比为80:(17-19):(1-3)的乙腈-水-甲酸混合溶液对土壤进行预处理,再根据母体和代谢物的理化性质的巨大差异,利用oasis hlb固相萃取小柱对所述土壤提取液进行净化处理,最后利用超高效液相色谱-串联质谱法检测对净化液进行检测,从而提供了一种同时测定土壤中异丙噻菌胺及其代谢物ppa残留的方法,而且前处理过程简单,对土壤中异丙噻菌胺及其代谢物ppa的检测准确度高、灵敏度高。
[0051]
以下结合具体实施例进行阐述。
[0052]
实施例1
[0053]
a.称取5g土壤样品至50ml离心管中,加入25ml乙腈:水:甲酸(80:17:3,v:v:v)溶液,涡旋振荡30min后于4000r/min条件下离心3min,上清液转入100ml具塞量筒中;
[0054]
土壤残渣再加入25ml乙腈:水:甲酸(80:17:3,v:v:v)重复提取1次,合并上清液,用乙腈:水:甲酸(80:17:3,v:v:v)定容至50ml;
[0055]
吸取4ml土壤提取液,加入20ml水,混匀,待净化。
[0056]
需要补充的是,乙醚、二氯甲烷、二硫化碳、丙酮等都是使用较普遍的洗脱剂,但使用上述溶剂洗脱时,必须先浓缩蒸干,再用甲醇或乙腈定容后才能测定;另外,由于酚易挥发,在浓缩蒸干过程中损失较大,不宜选做洗脱剂。故在本方案中选用乙腈为洗脱剂,洗脱定容后直接测定,干扰少,回收率较高。
[0057]
b.依次用5ml甲醇、5ml水预淋oasis hlb固相萃取小柱,除去干扰杂质,将待净化的土壤溶液上样,即让样品溶液流过oasis hlb固相萃取小柱,再弃去淋出液,然后用4ml乙腈:水(2:8,v:v)淋洗,弃去淋出液,再用10ml色谱纯乙腈:水(8:2,v:v)洗脱,收集洗脱液,并过0.22μm滤膜,过滤得到待检测液。
[0058]
c.利用超高效液相色谱-串联质谱法检测步骤b中所述待检测液。
[0059]
步骤c中异丙噻菌胺和ppa采用液相梯度洗脱程序。a相为0.1%甲酸/甲醇的溶液,b相为0.1%甲酸和10mmol/l甲酸铵水混合溶液。
[0060]
高效液相色谱条件为:
[0061]
色谱柱尺寸为:2.1mm
×
100mm
×
1.6μm;流速:0.2ml/min;柱温:35℃;进样体积:
1.5μl;运行时间:3.0min。
[0062]
质谱条件为:
[0063]
电离方式为esi+,毛细管电压为0.6kv,离子源温度为120℃,脱溶剂温度为350℃,脱溶剂气流量为700l/hr。
[0064]
在步骤c后还包括采用基质匹配外标法进行定量分析。
[0065]
基质匹配外标法具体包括用空白样品提取液分别配制不同浓度范围的异丙噻菌胺及其代谢物ppa的混合标准工作液,以浓度为横坐标,定量离子对峰面积为纵坐标,进行线性回归计算(具体定量分析方法在此实施例中不做赘述)。混合标准工作液的配制方法具体为(其他实施例中,混合标准工作液均参照此配制方法):
[0066]
1)分别称取一定量的异丙噻菌胺及其代谢物ppa,用色谱纯乙腈配制成浓度为200mg/l的标准储备溶液,在0-4℃冰箱中保存;
[0067]
2)吸取标准储备液0.50ml至10ml容量瓶中,用色谱乙腈定容,得到10.0mg/l的异丙噻菌胺及其代谢物ppa的混合标准中间溶液,再吸取浓度为10.0mg/l的混合标准中间溶液1.0ml至10ml容量瓶中,用乙腈:水(80:20,v:v)定容,得到1.0mg/l的异丙噻菌胺及其代谢物ppa的混合标准中间溶液;
[0068]
3)吸取适量的混合标准中间溶液,用土壤空白样品提取净化液逐级稀释得到100、20、10、5.0、1.0、0.50、0.10和0.05μg/l系列混合标准工作液,在0-4℃冰箱中保存。
[0069]
实施例2
[0070]
a.称取5g土壤样品至50ml离心管中,加入25ml乙腈:水:甲酸(80:19:1,v:v:v)溶液,涡旋振荡30min后于4000r/min条件下离心3min,上清液转入100ml具塞量筒中;
[0071]
土壤残渣再加入25ml乙腈:水:甲酸(80:19:1,v:v:v)重复提取1次,合并上清液,用乙腈:水:甲酸(80:19:1,v:v:v)定容至50ml;
[0072]
吸取4ml土壤提取液,加入20ml水,混匀,待净化。
[0073]
b.依次用5ml甲醇、5ml水预淋oasis hlb固相萃取小柱,除去干扰杂质,将待净化的土壤溶液上样,即让样品溶液流过oasis hlb固相萃取小柱,再弃去淋出液,然后用4ml乙腈:水(2:8,v:v)淋洗,弃去淋出液,再用10ml色谱纯乙腈:水(8:2,v:v)洗脱,收集洗脱液,并过0.22μm滤膜,过滤得到待检测液。
[0074]
c.利用超高效液相色谱-串联质谱法检测步骤b中所述待检测液。
[0075]
步骤c中异丙噻菌胺和ppa采用液相梯度洗脱程序。a相为0.1%甲酸/甲醇的溶液,b相为0.1%甲酸和10mmol/l甲酸铵水混合溶液。
[0076]
高效液相色谱条件为:
[0077]
色谱柱尺寸为:2.1mm
×
100mm
×
1.8μm;流速:0.3ml/min;柱温:45℃;进样体积:2.5μl;运行时间:5.0min。
[0078]
质谱条件为:
[0079]
电离方式为esi+,毛细管电压为0.8kv,离子源温度为180℃,脱溶剂温度为450℃,脱溶剂气流量为900l/hr。
[0080]
在步骤c后还包括采用基质匹配外标法进行定量分析。
[0081]
基质匹配外标法具体包括用空白样品提取液分别配制不同浓度范围的异丙噻菌胺及其代谢物ppa的混合标准工作液,以浓度为横坐标,定量离子对峰面积为纵坐标,进行
线性回归计算(具体分析方式在此实施例不做赘述)。
[0082]
实施例3
[0083]
a.称取5g土壤样品至50ml离心管中,加入25ml乙腈:水:甲酸(80:18:2,v:v:v)溶液,涡旋振荡30min后于4000r/min条件下离心3min,上清液转入100ml具塞量筒中;
[0084]
土壤残渣再加入25ml乙腈:水:甲酸(80:18:2,v:v:v)重复提取1次,合并上清液,用乙腈:水:甲酸(80:18:2,v:v:v)定容至50ml;
[0085]
吸取4ml土壤提取液,加入20ml水,混匀,待净化。
[0086]
b.依次用5ml甲醇、5ml水预淋oasis hlb固相萃取小柱,除去干扰杂质,将待净化的土壤溶液上样,即让样品溶液流过oasis hlb固相萃取小柱,再弃去淋出液,然后用4ml乙腈:水(2:8,v:v)淋洗,弃去淋出液,再用10ml色谱纯乙腈:水(8:2,v:v)洗脱,收集洗脱液,并过0.22μm滤膜,过滤得到待检测液。
[0087]
c.利用超高效液相色谱-串联质谱法检测步骤b中所述待检测液。
[0088]
步骤c中异丙噻菌胺和ppa采用液相梯度洗脱程序,参数见下表1:,a相为0.1%甲酸/甲醇的溶液,b相为0.1%甲酸和10mmol/l甲酸铵水混合溶液。
[0089]
表1液相色谱梯度洗脱参数
[0090][0091]
高效液相色谱条件为:
[0092]
色谱柱为acquitybeh c18色谱柱(2.1mm
×
100mm
×
1.7μm,美国waters公司);流速:0.25ml/min;柱温:40℃;进样体积:2.0μl;运行时间:4.0min。
[0093]
质谱条件为:
[0094]
电离方式为esi+,毛细管电压为0.7kv,离子源温度为150℃,脱溶剂温度为400℃,脱溶剂气流量为800l/hr。农药质谱检测离子对信息见下表2。
[0095]
表2质谱检测参数
[0096]
[0097]
根据上述参数,将异丙噻菌胺及其代谢物ppa子离子色谱图绘制成图8和图9。
[0098]
在步骤c后还包括采用基质匹配外标法进行定量分析。
[0099]
基质匹配外标法具体包括用空白样品提取液分别配制不同浓度范围的异丙噻菌胺及其代谢物ppa的混合标准工作液,以浓度为横坐标,定量离子对峰面积为纵坐标,进行线性回归计算(实施例1及实施例2均可参照下述操作方法进行定量分析)。
[0100]
混合标准工作液的配制方法具体为:
[0101]
1)分别称取一定量的异丙噻菌胺及其代谢物ppa,用色谱纯乙腈配制成浓度为200mg/l的标准储备溶液,在0-4℃冰箱中保存;
[0102]
2)吸取标准储备液0.50ml至10ml容量瓶中,用色谱乙腈定容,得到10.0mg/l的异丙噻菌胺及其代谢物ppa的混合标准中间溶液,再吸取浓度为10.0mg/l的混合标准中间溶液1.0ml至10ml容量瓶中,用乙腈:水(80:20,v:v)定容,得到1.0mg/l的异丙噻菌胺及其代谢物ppa的混合标准中间溶液;
[0103]
3)吸取适量的混合标准中间溶液,用土壤空白样品提取净化液逐级稀释得到100、20、10、5.0、1.0、0.50、0.10和0.05μg/l系列混合标准工作液,在0-4℃冰箱中保存。
[0104]
采用基质匹配外标法进行定量分析的具体操作为:
[0105]
如下表3,分别将异丙噻菌胺标准溶液(溶剂标)的浓度分为0.05μg/l、0.1μg/l、0.5μg/l、1.0μg/l、5.0μg/l、10μg/l和20μg/l,每一浓度均做三组实验,测得三组峰面积,将三组峰面积的平均值作为该浓度所对应的色谱响应值,并以峰面积(色谱响应值)为纵坐标,以浓度为横坐标,绘制成图4。
[0106]
表3不同浓度异丙噻菌胺标准溶液(溶剂标)对应的峰面积
[0107][0108][0109]
如下表4,分别将异丙噻菌胺标准溶液(基质标)的浓度分为0.05μg/l、0.1μg/l、0.5μg/l、1.0μg/l、5.0μg/l、10μg/l和20μg/l,每一浓度均做三组实验,测得三组峰面积,将三组峰面积的平均值作为该浓度所对应的色谱响应值,并以峰面积(色谱响应值)为纵坐标,以浓度为横坐标,绘制成图5。
[0110]
表4不同浓度异丙噻菌胺标准溶液(基质标)对应的峰面积
[0111][0112]
如下表5,分别将异丙噻菌胺代谢物ppa标准溶液(溶剂标)的浓度分为0.05μg/l、0.1μg/l、0.5μg/l、1.0μg/l、5.0μg/l、10μg/l和20μg/l,每一浓度均做三组实验,测得三组峰面积,将三组峰面积的平均值作为该浓度所对应的色谱响应值,并以峰面积(色谱响应值)为纵坐标,以浓度为横坐标,绘制成图6。
[0113]
表5不同浓度异丙噻菌胺代谢物ppa标准溶液(溶剂标)对应的峰面积
[0114][0115]
如下表6,分别将异丙噻菌胺代谢物ppa标准溶液(基质标)的浓度分为0.05μg/l、0.1μg/l、0.5μg/l、1.0μg/l、5.0μg/l、10μg/l和20μg/l,每一浓度均做三组实验,测得三组峰面积,将三组峰面积的平均值作为该浓度所对应的色谱响应值,并以峰面积(色谱响应值)为纵坐标,以浓度为横坐标,绘制成图7。
[0116]
表6不同浓度异丙噻菌胺代谢物ppa标准溶液(基质标)对应的峰面积
[0117][0118]
由图4和图5可知,在0.05-20μg/l范围内,异丙噻菌胺的溶剂标回归方程为y=226205x-184.677(r=0.9999),基质标回归方程为y=228862x+2494.41(r=0.9999)。
[0119]
基质效应的计算公式为:其中,me为基质效应(%),a为溶剂标曲线斜率,b为基质标曲线斜率;故异丙噻菌胺的基质效应为1.2%,样品均采用基质标定量。
[0120]
由图6和图7可知,在0.1-20μg/l范围内,异丙噻菌胺代谢物ppa的溶剂标回归方程为y=44332.8x-211.251(r=0.9999),基质标回归方程为y=47150.2x+164.009(r=0.9998)。同理,异丙噻菌胺代谢物ppa的基质效应为6.4%,样品均采用基质标定量。
[0121]
在测定本方法的准确度和精密度时,采用加标回收方式,提取溶剂为体积比为80:18:2的乙腈-水-甲酸混合溶液,实验结果如下表7(具体操作流程在此不做赘述):
[0122]
表7异丙噻菌胺及其代谢物ppa在土壤中添加回收率及相对标准偏差
[0123][0124]
图10为异丙噻菌胺0.05μg/l混合标准工作液谱图,图11为0.1μg/lppa混合标准工作液谱图;图12为土壤添加异丙噻菌胺回收样品(添加水平5μg/kg)谱图,图13为土壤添加ppa回收样品(添加水平5μg/kg)谱图。
[0125]
由表7可知,当土壤中添加水平为5μg/kg和50μg/kg时,异丙噻菌胺的平均回收率为91%~93%,rsd为0.76%~1.2%,异丙噻菌胺代谢物ppa的平均回收率均为96%,rsd为1.1%~1.6%,即此方法可用于测定土壤中异丙噻菌胺及其代谢物ppa的残留量。
[0126]
经查阅相关资料可知,当提取溶剂中水的体积比例在20%左右时压力最大,提取
效果较佳。
[0127]
在补充的对照实施例中,当提取溶剂中不含甲酸时,异丙噻菌胺及其代谢物ppa的平均回收率约为40%;当提取溶剂中甲酸体积含量为0.5%时,异丙噻菌胺及其代谢物ppa的平均回收率约为60%;当提取溶剂中甲酸体积含量为1%时,异丙噻菌胺及其代谢物ppa的平均回收率约为70%;当提取溶剂中甲酸体积含量为2%时,异丙噻菌胺及其代谢物ppa的平均回收率约为95%;当提取溶剂中甲酸体积含量为2.5%时,异丙噻菌胺及其代谢物ppa的平均回收率约为95%;当提取溶剂中甲酸体积含量超过3%时,虽然对提取步骤不产生实质性影响,但会影响后续的净化过程,产生较大的损失率,从而导致回收率至少下降20%~25%。故在其他较优的实施例中,将提取溶剂中甲酸的体积含量尽可能控制在1%~3%。
[0128]
实施例4
[0129]
a.称取5g土壤样品至50ml离心管中,加入25ml乙腈:水:甲酸(80:18:2,v:v:v)溶液,涡旋振荡30min后于4000r/min条件下离心3min,上清液转入100ml具塞量筒中;
[0130]
土壤残渣再加入25ml乙腈:水:甲酸(80:18:2,v:v:v)重复提取1次,合并上清液,用乙腈:水:甲酸(80:18:2,v:v:v)定容至50ml;
[0131]
吸取4ml土壤提取液,加入20ml水,混匀,待净化。
[0132]
b.依次用5ml甲醇、5ml水预淋oasis hlb固相萃取小柱,除去干扰杂质,将待净化的土壤溶液上样,即让样品溶液流过oasis hlb固相萃取小柱,再弃去淋出液,然后用4ml乙腈:水(2:8,v:v)淋洗,弃去淋出液,再用10ml色谱纯乙腈:水(8:2,v:v)洗脱,收集洗脱液,并过0.22μm滤膜,过滤得到待检测液。
[0133]
c.利用超高效液相色谱-串联质谱法检测步骤b中所述待检测液。
[0134]
步骤c中异丙噻菌胺和ppa采用液相梯度洗脱程序,a相为0.1%甲酸/甲醇的溶液,b相为0.1%甲酸和10mmol/l甲酸铵水混合溶液。
[0135]
高效液相色谱条件为:
[0136]
色谱柱尺寸为:2.1mm
×
100mm
×
1.8μm;流速:0.3ml/min;柱温:45℃;进样体积:2.5μl;运行时间:5.0min。
[0137]
质谱条件为:
[0138]
电离方式为esi+,毛细管电压为0.8kv,离子源温度为180℃,脱溶剂温度为450℃,脱溶剂气流量为900l/hr。
[0139]
在步骤c后还包括采用基质匹配外标法进行定量分析。
[0140]
基质匹配外标法具体包括用空白样品提取液分别配制不同浓度范围的异丙噻菌胺及其代谢物ppa的混合标准工作液,以浓度为横坐标,定量离子对峰面积为纵坐标,进行线性回归计算(具体分析方式参考实施例3)。
[0141]
本发明采用电喷雾正离子多重反应监测(mrm)模式对异丙噻菌胺及其代谢物ppa进行检测,线性范围分别为0.05-20μg/l和0.1-20μg/l,定量限loq均为5μg/kg,检出限lod分别为1.37μg/kg和2.60μg/kg。本方案的前处理方法简单,且对土壤中异丙噻菌胺及其代谢物ppa的检测准确度高、灵敏度高,值得推广。
[0142]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述
实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1