基于一级质谱分析的双氨基酸稳定同位素标记方法及应用与流程
1.本发明属于同位素标记方法技术领域,具体涉及一种基于一级质谱分析的双氨基酸稳定同位素标记方法。
背景技术:
2.稳定同位素标记技术结合质谱检测已成为一种复杂生物样本中蛋白质的定量分析方法。现有的稳定同位素标记技术主要是通过对蛋白质或蛋白质酶解产物(即肽段)中特定氨基酸(例如,赖氨酸)的标记,然后对蛋白质酶解产物肽段分子进行数据依赖性(data dependent acquisition,dda)质谱分析,即在一级质谱(ms)分析中选择某种质荷比(m/z)的母离子肽段分子(例如,m/z 537.827,+2)经过一定质量范围(例如,
±
0.6da)的离子隔离窗口(isolation window)进入充有高纯(》99.999%)惰性气体的高能量碰撞室而发生离子碎片化(fragmentation),获得二级质谱(ms/ms)分析图谱(即子离子图谱)。通过对二级质谱中带有同位素标记的子离子或报告离子(reporter ions)检测而达到对蛋白质定量分析目的。例如,thermo scientific公司研发的tmt(tandem mass tag,tmt)和ab sciex公司研发的itraq(isobaric tags for relative and absolute quantification,itraq)标记技术。这两种标记技术均通过测定二级质谱中同位素标记的报告离子峰面积实现对多种不同样品中蛋白质的定量分析。
3.然而,这些定量分析技术的主要问题是:
4.①
一级质谱中(ms)除了被选择的母离子肽段分子外,离子隔离窗口(isolation window)内(例如,
±
0.6da)的其它肽段母离子也被同时选择并发生二级质谱分析,因此对二级质谱报告离子的准确检测产生无法克服的干扰。
5.②
一级质谱分析中选择的位于离子隔离窗口(isolation window)内的两种或两种以上肽段母离子混合物在二级质谱中所产生的报告离子峰面积来自这些肽段母离子各自报告离子峰面积的叠加,无法准确测定一级质谱中指定母离子的报告离子峰面积,也就无法对该母离子肽段所代表的蛋白质进行准确的定量分析。
6.随着高分辨质谱的广泛应用,基于一级质谱分析的稳定同位素标记技术可以获得较为准确的定量分析结果。然而,现有技术由于一次只能标记一种氨基酸(例如,半胱氨酸)而导致产生有限的可定量分析的肽段母离子,所以极大限制了该技术的广泛应用。因此,开发一种可以同时标记一种以上氨基酸的稳定同位素标记技术对提高定量分析效率意义重大。
技术实现要素:
7.本技术的主要目的在于提供一种通过对两种不同的氨基酸进行稳定同位素标记而提高蛋白质定量分析产率和效率的基于一级质谱分析的双氨基酸稳定同位素标记方法。
8.为了实现上述目的,本发明提供如下技术方案:
9.一种基于一级质谱分析的双氨基酸稳定同位素标记方法,包括以下步骤:
10.(1)将至少两种具有不同分子量的蛋白质混合均匀制得蛋白质样本,向蛋白质样本中依次加入蛋白质还原反应溶液,蛋白质还原剂,并混合搅拌均匀,备用;
11.(2)向步骤(1)所得还原后的蛋白质样本溶液中加入丙烯酰胺标记半胱氨酸,然后再加入丁二酸酐标记赖氨酸;
12.(3)将步骤(2)所得双氨基酸标记的蛋白质溶液通过脱盐柱除去未反应的试剂;
13.(4)向步骤(3)所得双氨基酸标记的蛋白质样本中加入胰蛋白酶-trypsin进行酶解;对酶解产物进行色谱-质谱分析。
14.上述一种基于一级质谱分析的双氨基酸稳定同位素标记方法,作为一种优选的实施方案,步骤(1)中,所述蛋白质还原反应溶液为含4m尿素、20mm tris-hcl、3%异丙醇的水溶液;蛋白质样本与蛋白质还原反应溶液的用量比为1mg:1ml。
15.上述一种基于一级质谱分析的双氨基酸稳定同位素标记方法,作为一种优选的实施方案,步骤(1)中,所述蛋白质还原剂为含500mm tcep水溶液,蛋白质样本与蛋白质还原剂的用量比为1mg:50ul;混合搅拌的温度为37℃,混合搅拌的时间为30min。
16.tcep为三(2-羧乙基)膦,是一种非常有效的硫醇类还原剂,广泛用作蛋白质化学及蛋白质组学研究中二硫键的定量还原剂。该试剂在水溶液中的稳定性和溶解性都很好。在酸性、碱性溶液中的稳定性也不错。与其他类别的硫醇类还原剂如dtt相比,tcep不仅是一种高效的二硫键还原剂,而且在某些巯基的交联反应中不需要除掉。tcep将蛋白质中由半胱氨酸之间所形成的分子内或分子间二硫键打开形成-sh方可与丙烯酰胺发生丙烯酰化标记反应。
17.上述一种基于一级质谱分析的双氨基酸稳定同位素标记方法,作为一种优选的实施方案,步骤(2)中,所加丙烯酰胺的量为蛋白质样本的5-7倍,标记半胱氨酸为:将还原后的蛋白质样本溶液和丙烯酰胺混合均匀,在20-25℃的条件下,避光反应30min;
18.所加丁二酸酐的量为蛋白质样本的7-10倍,标记赖氨酸为:加入丁二酸酐混合均匀,在20-25℃的条件下,避光反应30min。
19.丙烯酰胺(c3h5on)与还原后的蛋白质肽链中的半胱氨酸侧链上的巯基(-sh)发生共价反应形成丙烯酰化基团,即每个半胱氨酸侧链上的巯基(-sh)结合上71.0366da的丙烯酰胺基团(s-c3h4on)。
20.丁二酸酐(c4h4o3)与蛋白质肽链中的赖氨酸侧链上的一级胺(-nh2)发生共价反应形成琥珀酰化基团,即每个赖氨酸侧链上的一级胺(-nh2)结合上100.0160da的琥珀酰胺基团(nh-c4h4o3)。
21.上述一种基于一级质谱分析的双氨基酸稳定同位素标记方法,作为一种优选的实施方案,步骤(3)中,通过脱盐柱的置换溶液为50mm nh4hco3。所述脱盐柱(zeba spin desaltingcolumns,thermoscientific)除去剩余的未反应掉的标记试剂丙烯酰胺、丁二酸酐和tcep。
22.上述一种基于一级质谱分析的双氨基酸稳定同位素标记方法,作为一种优选的实施方案,步骤(4)中,所述酶解为37℃下,酶解反应5h,然后加入甲酸终止酶解反应。
23.本技术的第二方面,提供一种基于一级质谱分析的双氨基酸稳定同位素标记方法在血清定量蛋白质组学分析中的应用。
24.本发明的有益效果为:本发明所述基于一级质谱分析的双氨基酸稳定同位素标记
方法通过对两种不同的氨基酸进行稳定同位素标记而提高蛋白质定量分析的产率和效率,克服了现有单氨基酸稳定同位素标记方法定量分析产率和效率低的缺点,可用于复杂生物样本中(例如血清样本)蛋白质的定量分析。
25.本发明所述基于一级质谱分析的双氨基酸稳定同位素标记方法提高了复杂生物样本(例如血样和组织样本)蛋白质鉴定和定量分析通量(蛋白质数目)和覆盖度(检测到更多的低浓度蛋白质),因此本发明可以实现通过定量白质组学分析对从包括血液、尿液和组织样本等复杂生物样本中发现与疾病相关的蛋白质生物标志物。
附图说明
26.图1为本发明所述基于一级质谱分析的双氨基酸稳定同位素标记方法定量分析蛋白质的流程图;
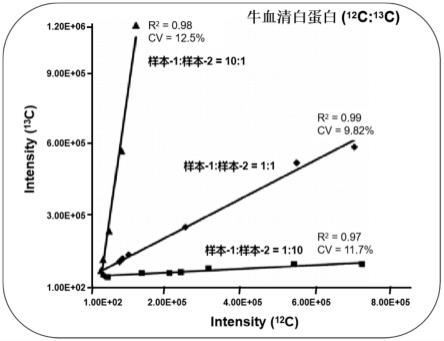
27.图2为本发明所述基于一级质谱分析的双氨基酸稳定同位素标记不同摩尔比牛血清白蛋白(
12
c:
13
c)定量分析;
28.图3为为本发明所述基于一级质谱分析的双氨基酸稳定同位素标记不同摩尔比转铁蛋白(
12
c:
13
c)定量分析。
具体实施方式
29.为了使本技术领域的人员更好地理解本技术方案,下面将结合案例对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分的实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本技术保护的范围。
30.氨基酸的标记反应效率(例如半胱氨酸的丙烯酰胺化标记和赖氨酸的琥珀酰化标记)与氨基酸侧链上被标记官能团(例如半胱氨酸侧链的-sh和赖氨酸侧链的-nh2)所处蛋白质多肽链的微环境空间结构有关,单一蛋白质无法体现生物样本中蛋白质复杂的微环境空间结构。因此,本发明使用几种蛋白质的混合物作为待标记样本以较好体现蛋白质复杂的微环境空间结构状态。
31.实施例1
32.实施例1所述基于一级质谱分析的双氨基酸稳定同位素标记方法,包括以下步骤:
33.(1)各称取0.25mg的转铁蛋白、胎球蛋白、牛血清白蛋白和α-酸性糖蛋白混合均匀得到1mg蛋白质混合样本,向蛋白质混合样本中加入1ml蛋白质还原反应溶液(所述蛋白质还原反应溶液为含4m尿素、20mm tris-hcl、3%异丙醇的水溶液)配制蛋白质样本溶液,向蛋白质样本溶液中加入50ul、500mm的蛋白质还原剂(所述蛋白质还原剂为含500mm tcep水溶液),在37℃下,混合搅拌反应30min。
34.(2)向还原后的蛋白质样本溶液中加入7mg的丙烯酰胺混合搅拌均匀,在20-25℃的温度下避光反应30min,标记半胱氨酸;然后再加入10mg丁二酸酐混合均匀,在20-25℃的条件下,避光反应30min标记赖氨酸。
35.(3)将步骤(2)所得双氨基酸标记的蛋白质溶液通过脱盐柱(zeba spin desalting columns,thermoscientific)除去未反应的试剂(丙烯酰胺、丁二酸酐和tcep),置换溶液为50mm nh4hco3。
36.(4)向步骤(3)所得双氨基酸标记的蛋白质样本中加入20ug(过量的)胰蛋白酶-trypsin混合均匀,37℃下酶解5h,然后加入20ul,10%的甲酸终止酶解反应,对酶解产物进行色谱-质谱分析,然后通过数据分析系统完成蛋白质的鉴定和定量分析。
37.1、采用不同质量的标记试剂对双氨基酸标记效率的影响:
38.试验方法:
39.按照实施例1所述的双氨基酸稳定同位素标记方法,使用五种不同质量的标记试剂分别与1mg的蛋白质样本进行标记反应,利用色谱-质谱分析检测被标记肽段的峰面积,通过比较被标记肽段峰面积与未被标记肽段峰面积计算出标记反应效率,双氨基酸标记效率结果分别如表1和表2所示。
40.表1丙烯酰胺与半胱氨酸标记反应效率
[0041][0042]
从表1可以看出:当丙烯酰胺用量达到5mg时,其与四种蛋白质混合样本中半胱氨酸的标记效率达到100%,为了保证高标记效率,在实际生物样本的标记反应中使用7mg的丙烯酰胺标记半胱氨酸。
[0043]
表2丁二酸酐与赖氨酸标记反应效率
[0044][0045]
[0046]
从表2可以看出:当丁二酸酐用量达到10mg时,其与四种蛋白质混合样本中赖氨酸的标记效率达到100%,因此在实际生物样本的标记反应中使用10mg的丁二酸酐标记赖氨酸。
[0047]
2、本技术所述双氨基酸稳定同位素标记方法定量分析蛋白质
[0048]
本发明使用非同位素标记的丙烯酰胺(
12
c3h5on,light/
12
c3)和同位素标记的丙烯酰胺(
13
c3h5on,heavy/
13
c3)分别标记两种蛋白质样本中的半胱氨酸,同时使用非同位素标记的丁二酸酐(
12
c4h4o3,light/
12
c4)和同位素标记的丁二酸酐(
13
c4h4o3,heavy/
13
c4)分别标记这两种蛋白质样本中的赖氨酸,通过比较含有半胱氨酸肽段或赖氨酸肽段或同时含有半胱氨酸与赖氨酸肽段的非同位素标记的峰强度与同位素标记的峰强度(即light/heavy或
12
c/
13
c)而实现对蛋白质在这两种样本中的定量分析,技术流程如图1所示。
[0049]
2.1试验方法
[0050]
制备蛋白质样本:蛋白质样本由转铁蛋白和牛血清白蛋白组成,蛋白质样本分为3组,3组中转铁蛋白的摩尔比例分别为10:1,1:1,1:10;3组中牛血清白蛋白的摩尔比例分别为10:1,1:1,1:10。
[0051]
按照实施例1所述双氨基酸稳定同位素标记方法分别对上述3组摩尔比不同的蛋白质样本分别进行非同位素标记和同位素标记。
[0052]
例如:对于摩尔比为10:1的这组样本,(摩尔比:样本-1/样本-2=10:1),使用非同位素标记的丙烯酰胺(
12
c3h5on,light/
12
c)和丁二酸酐(
12
c4h4o3,light/
12
c)分别标记样本-1中的半胱氨酸与赖氨酸;使用同位素标记的丙烯酰胺(
13
c3h5on,heavy/
13
c)和丁二酸酐(
13
c4h4o3,heavy/
13
c)分别标记样本-2中的半胱氨酸与赖氨酸。将标记的样本-1与样本-2混合后进行胰蛋白酶(trypsin)酶解,酶解蛋白产物(即肽段)通过色谱-质谱检测和数据分析对肽段进行氨基酸测序和肽段峰强度的计算,结果见图2和图3所示。
[0053]
从图2和图3可以看出:本发明提出和设计的双氨基酸稳定同位素标记方法在3种不同摩尔比(即10:1、1:1和1:10)的样本之间的蛋白质定量分析的相关系数r2≥0.96,变异系数cv≤14.%,证明本发明提出的双氨基酸标记定量分析技术具有很好的可靠性和准确性。
[0054]
3、本发明所述双氨基酸稳定同位素标记方法在血清定量蛋白质组学分析中的应用。
[0055]
3.1将本发明所述双氨基酸稳定同位素标记方法应用于血清定量蛋白质组学分析,并与单氨基酸标记方法进行对比分析。主要的对比分析实验步骤如下:
[0056]
①
取两份15μl血清样本(1mg蛋白/每份血清),分别进行本发明的双氨基酸标记(即丙烯酰胺标记半胱氨酸、丁二酸酐标记赖氨酸)和常规的单氨基酸标记(即丙烯酰胺标记半胱氨酸),标记反应步骤参照实施例1所述的双氨基酸标记方法进行。
[0057]
②
对标记的两份血清样本分别加入20μg胰蛋白酶(trypsin)进行酶解反应,37℃下反应5小时。然后加入20μl 10%甲酸终止酶解反应,获得酶解产物。
[0058]
③
对酶解产物进行色谱-质谱(lc-ms/ms)检测和数据分析,获得蛋白质鉴定分析结果和蛋白质定量分析结果,如表3所示:
[0059]
表3双氨基酸稳定同位素标记方法在血清定量蛋白质组学分析中的应用
[0060][0061][0062]
④
由表3可知,相对于常规的单氨基酸标记技术,本发明提出的双氨基酸稳定同位素标记方法在蛋白鉴定数目和蛋白定量数目都高于单氨基酸标记方法。双氨基酸标记方法中94%的鉴定蛋白可获得定量信息,而单氨基酸标记技仅为63%。此外,单氨基酸标记方法比双氨基酸标记方法多产生3654个二级质谱,说明双氨基酸标记方法的血清蛋白样本经胰蛋白酶酶解反应所产生的肽段要少于单氨基酸标记方法。胰蛋白酶特异性地酶切蛋白质中的赖氨酸(lys/k)和精氨酸(arg/r)c-端,单氨基酸标记使用丙烯酰胺标记半胱氨酸,不阻止蛋白质中的赖氨酸(lys/k)和精氨酸(arg/r)的胰蛋白酶特异性地酶切反应,产生c-端包括赖氨酸(lys/k)或精氨酸(arg/r)的肽段;而双氨基酸标记中的赖氨酸(lys/k)由于被丁二酸酐标记无法发生胰蛋白酶的异性地酶切反应,仅产生c-端包括精氨酸(arg/r)的肽段。
[0063]
⑤
对从血清样本中鉴定和定量出的蛋白质进行了二级质谱数目的比较分析,结果见表4所示:
[0064]
表4双氨基酸稳定同位素标记方法和单氨基酸标记方法在蛋白定量深度的比较
[0065][0066]
[0067]
⑥
从表4可以看出:相对于常规的单氨基酸标记方法,本发明提出的双氨基酸稳定同位素标记方法有更多的二级质谱数目用于低浓度蛋白的鉴定和定量分析(例如500pg/ml),而单氨基酸标记方法则是由更多的二级质谱数目用于高浓度蛋白的鉴定和定量分析(例如》1.0mg/ml)。因此,本发明提出的双氨基酸标记为在血清中鉴定和定量低浓度蛋白提供了一个更为有效的分析技术。
[0068]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1