一种基于光栅与磁阵列式的单分子荧光检测方法与流程
1.本发明涉及一种单分子检测方法,尤其是指一种基于光栅与磁阵列式的单分子荧光检测方法,该种基于光栅与磁阵列式的单分子荧光检测方法可以有效解决目前单分子检测技术存在检测效率低,操作复杂,成本高的难题,可广泛应用于化学分析、蛋白分析、核酸分析、单细胞分析、外泌体分析、循环肿瘤细胞分析以及单分子反应动力学研究等领域。属于单分子荧光检测技术领域。
背景技术:
2.单分子检测(single molecule detection, smd)是近年来快速发展起来的一种超灵敏的检测技术,其是指从单分子水平上对目标物进行测定与分析,是一种全新的检测方法,也开辟了一种全新的检测领域。单分子荧光检测是单分子检测最常用的方法 ,通过标记在生物大分子上各个荧光基团的各种特性的变化反映了有关分子间相互作用、酶活性、反应动力学、分子构象、dna和rna的转录、蛋白质折叠等生物学信息。单分子荧光检测在化学分析、生物分析、纳米材料分析、医学诊断、法医分析、单细胞分析、分子动力学机理考察等方面都具有独特的应用价值,对许多学科领域的发展产生了和正在产生着深远的影响。单分子荧光检测形式可分为三种:光子爆发检测、单分子图像记录和单分子光谱测绘。光子爆发检测最为简单,直接测定爆发的光子数。单分子成像可指示分子在图像中的位置和发光强弱,实时跟踪记录单分子。其中,美国quanterix公司研发出一种simoa(single-molecule array)技术为目前最为先进的单分子荧光检测技术,该技术的灵敏度为elisa技术的1000倍以上,检测下限达到fg/ml,实现了单分子的有效检测和定量。但是,现有的simoa技术还存在一些问题,主要有:1、对制造工艺和精度要求较高:simoa技术使用了接近微米加工体系极限的3μm微孔阵列,加工精度要求高、生产成本高昂;2、需要专门的配套试剂:simoa技术对于微球的大小和均一程度有着极高的要求,一般粒径要求为2.7μm,尺寸太大的微球会导致其无法进入3μm的微孔,尺寸太小又会导致同一个微孔阵列中落入多个微球;3、检测时间较长:simoa检测系统单次检测耗时长达1小时以上,远超过目前免疫诊断市场中已经能轻易实现的15分钟报告时间;正是因为存在上述的一些不足,导致simoa技术的应用推广存在难度,为此很有必要对此加以改进。
3.通过查询检索发现有关于单分子检测的相关专利,但未发现与本技术技术方案相同的专利文献报道,相类似的专利文献主要有以下几篇:1、专利号为cn201611001903.7,名称为“单分子检测方法”,申请人为:清华大学;鸿富锦精密工业(深圳)有限公司的发明专利,该专利公开了一种单分子检测的装置,包括;一容器,所述容器包括一入口以及一出口;一分子载体,所述分子载体包括一基板以及设置于所述基板表面的金属层;一检测器;以及一控制电脑;其中,所述基板包括一基底以及多
个设置于该基底表面的图案化的凸起,所述图案化的凸起包括多个凸条交叉设置形成网状结构,从而定义多个孔洞;所述金属层设置于所述图案化的凸起的表面。由于金属层设置在图案化的凸起的表面,而图案化的凸起包括多个凸条交叉设置形成网状结构。因此,在外界入射光电磁场的激发下,金属表面等离子体发生共振吸收,而交叉设置的凸条起到表面增强拉曼散射(sers)的作用,可提高sers增强因子,从而增强拉曼散射。该专利只是提出对分子载体的改进,并未提出如何解决现有单分子检测所存在的检测时间长的问题。
4.2、专利号为cn201510256620.6,名称为“使用珠或其他捕获物对分子或颗粒的超灵敏检测”,申请人为:匡特里克斯公司的发明专利申请,该专利申请公开了一种用于检测在流体样品中分析物分子或颗粒,以及在一些情况下确定所述流体样品中分子或颗粒的浓度的量度的系统和方法。本发明的方法可包括将多个分析物分子或颗粒固定化于多个捕获物上。将至少一部分的所述多个捕获物在空间上划分入多个位置。流体样品中分析物分子浓度的量度至少部分地基于包含固定化于捕获物的分析物分子的反应容器数而确定。在一些情况下,所述测定可另外包括包含结合配体、前体标记试剂和/或酶组分的步骤。该专利为simoa技术的核心专利,所以自然存在前面所述的问题。
5.3、专利号为cn201780045669.4,名称为“用于单分子检测的阵列及其应用”,申请人为:【美国】卓异生物公司的发明专利申请,该专利申请公开了一种产生阵列的方法,所述方法包括:分别确定第一靶探针和第二靶探针与多个捕获探针的杂交效率,其中所述第一靶探针和第二靶探针以及所述多个捕获探针是寡核苷酸探针,所述第一靶探针包含第一标记或序列,所述第二靶探针包含与所述第一标记或序列不同的第二标记或序列;基于所述杂交效率预选择所述多个捕获探针在基板上将要被固定的密度,以及根据所述密度将所述多个捕获探针固定至所述基板,从而在所述基板上产生多个元件。
6.4、专利号为cn202110558668.8,名称为“一种用于单分子检测的磁珠及其制备方法”,申请人为:深圳市光与生物科技有限公司的发明专利申请,该专利申请公开了一种用于单分子检测的磁珠及其制备方法,所述用于单分子检测的磁珠由磁性氨基取代的聚苯乙烯微球、吡啶化合物、无水醋酸汞、琥珀酰亚胺基碳酸酯修饰的超支化聚缩水甘油醚组装而成;本发明首先通过对磁珠表面改性,将氨基引入磁性微珠表面,进而得到具有功能化的磁珠,然后跟吡啶化合物、无水醋酸汞、琥珀酰亚胺基碳酸酯修饰的超支化聚缩水甘油醚反应,得到表面包裹超支化聚缩水甘油醚和吡啶汞配合物改性的羧基磁性微珠,该羧基磁性微珠上的活性基团跟捕获抗体上的氨基反应,同时,吡啶汞配合物的汞金属可以与捕获抗体上的二硫键配位,使捕获抗体与固相载体紧密结合,提高检测的准确性。该专利也只是提出对分子载体检测磁珠进行改进,所以自然存在前面所述的问题。
7.上述这些专利虽然都涉及到了单分子检测方法,也涉及到了相关的检测设备,其中专利cn201510256620.6为simoa技术的核心专利,但是现有的技术都未能有效解决单分子检测时间较长、对制造工艺和精度要求较高的难题,这样前面所述的问题仍然存在,所以很有必要对此加以改进。
技术实现要素:
8.本发明所要解决的技术问题是,克服以上背景技术中提到的单分子检测目前所存在的不足,提供一种新的基于光栅与磁阵列式的单分子荧光检测方法。通过对现有单分子
检测方法的改进,在满足现有检测的精确度的同时,大幅缩短检测时间,提升检测效率,并有效降低检测设备的制造难度。
9.本发明主要通过以下技术方案实现的:一种基于光栅与磁阵列式的单分子荧光检测方法,包括多个捕获珠、被检测分析物、功能性荧光颗粒和检测芯片;捕获珠表面与被检测分析物具有亲和力,在检测时捕获珠只有有一部分能捕获到被检测分析物,捕获到被检测分析物的捕获珠又能以一对一的方式结合功能性荧光颗粒,使得捕获到被检测分析物的捕获珠带有荧光;检测时,结合有功能性荧光颗粒的捕获珠与没有结合功能性荧光颗粒的所有多个捕获珠一起平铺在检测芯片上,形成阵列式排布,通过荧光检测装置对平铺在检测芯片上的所有捕获珠进行荧光识别,并通过荧光识别进行单分子荧光检测。
10.进一步地,所述的捕获珠指带有磁性的磁珠;在捕获珠的表面上包被有与被检测分析物具有亲和力的物质,使得捕获珠在检测时能够捕获到被检测分析物。
11.进一步地,所述的磁珠为超顺磁性纳米微球,磁珠必须要具备超强的顺磁性,即在磁场的存在下能迅速聚集,离开磁场能够均匀分散,不出现聚集显现现象。磁珠可以采用顺磁材料或铁磁材料制作。
12.进一步地,所述的被检测分析物包括化学分析、蛋白分析、核酸分析、细胞分析、外泌体分析、循环肿瘤细胞分析、纳米材料分析、医学诊断、法医分析、食品分析、环境分析以及单分子反应动力学检测中的各种被检测分析物质分子。
13.进一步地,所述的被检测分析物包括各种核酸、蛋白质、外泌体、循环肿瘤细胞和小分子物质等。
14.进一步地,所述的功能性荧光颗粒包括硅颗粒、量子点、上转换荧光纳米颗粒以及包被有有机小分子染料、量子点等荧光物质的荧光颗粒等,如基于异硫氰酸荧光素(fluorescein isothiocyanate, fitc),或藻红蛋白(pe),或alexafluor系列染料,以及量子点的功能性荧光颗粒。
15.进一步地,所述的检测芯片为带有磁性阵列的磁阵列芯片,在检测芯片上按照阵列分布有磁源,使得捕获磁珠落在芯片上将自动按照芯片的阵列进行隔离排布。
16.进一步地,所述的磁源为在芯片的底部按照阵列设有孔洞,在孔洞内安装有可以形成磁性的磁性物体,且磁性物体的磁性与捕获磁珠的磁性相吸,使得捕获磁珠落在芯片上时,由于磁性相吸,每一个捕获磁珠都会与一个芯片上的磁性物体相互吸住,形成捕获磁珠的阵列排布。
17.进一步地,所述的捕获到被检测分析物的捕获珠又能以一对一的方式结合功能性荧光颗粒是指捕获珠上的被检测分析物与功能性荧光颗粒按照一对一结合在一起的,并由功能性荧光颗粒点亮捕获到被检测分析物的捕获珠。
18.进一步地,所述的结合有功能性荧光颗粒的捕获珠与没有功能性荧光颗粒的所有多个捕获珠一起平铺在检测芯片上是指所有捕获珠全部平铺在检测芯片上。
19.进一步地,所述的通过荧光检测装置对平铺在检测芯片上的所有捕获珠进行荧光识别是在芯片的上方或下面设置激发光源,,且激发光源照射到检测芯片上,激发捕获珠上的功能性荧光颗粒,并通过光栅与光学识别装置组合的荧光识别系统,采用荧光识别系统与检测芯片相互之间的移动,来对检测芯片上的捕获珠阵列进行识别。
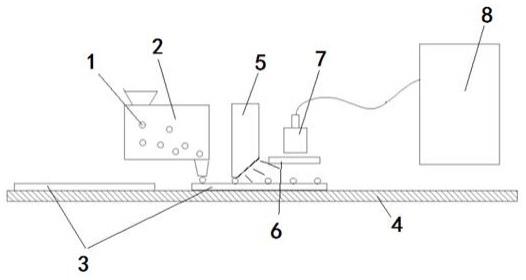
20.进一步地,所述的光栅设置在光学识别装置与检测芯片之间,且具光栅有与检测
芯片移动方向的阵列数量相同数量缝隙的光栅;光学识别装置的检测光源透过光栅,逐排对检测芯片上的捕获珠阵列进行逐一识别,并将检测的信息传送到荧光检测系统,进行单分子检测分析。
21.进一步地,所述的逐排对芯片上的捕获珠阵列进行逐一识别是利用荧光识别系统与检测芯片的之间的往返相互移动,荧光识别系统的光栅扫描芯片上的捕获磁珠阵列,并记录通过荧光识别系统的捕获珠的总数量和带有荧光的捕获珠的数量,进而计算出带所对应的分析物的浓度值,实现数字化单分子检测。
22.本发明的有益效果:本发明采取具有磁阵列的检测芯片,将捕获磁珠放置在检测芯片上,使得捕获珠在检测芯片上按照磁阵列排布,再利用荧光检测装置,通过光栅对检测芯片上的捕获珠进行识别,进行单分子检测;具有以下一些优点:1)通过具有磁阵列的检测芯片,使得捕获珠在检测芯片上自动形成阵列排布,不再需要制作simoa技术存放磁珠的反应容器,可以大大简化芯片制作工艺;2)检测芯片也因为没有simoa技术存放磁珠的反应容器,表面形成光洁表面,容易进行清洗,所以芯片可以重复使用,节约芯片资源,降低使用成本;3)检测芯片的磁源物质可以永磁材料,也可以软磁材料,有利于芯片制作;4)直接通过光栅与芯片上的捕获磁珠进行识别,完全改变了simoa技术通过多次拍照,再进行图片识别的方式,直接通过光栅读取数据可以大大提高检测速度;5)检测时磁珠的排布更加简单,不需要再先让磁珠进入反应容器,再进行发光培育,使得整个检测识别的过程更加直接快速;6)采用一对一的反应方式,更加有利于实现快速流水自动化作业。
附图说明
23.图1为本发明一个实施例的原理示意图;图2为本发明另一个实施例的原理示意图;图3为本发明一个采用非永久性磁源物质实施例的原理示意图;图4为本发明检测芯片的立体结构示意图;图5为本发明检测芯片的剖面结构示意图。
24.附图中:1磁性微珠、2磁性微珠混合箱、3检测芯片、4 输送带、5 激发光、6 光栅、7 光学识别装置、8 信息分析系统、9 磁源、10 孔洞、11 磁性物体、12 盲孔的端口部、201捕获磁珠、202磁珠箱体、203检测芯片、样本注入微流控通道204、205 清洗装置、206功能性荧光颗粒加入装置、207激发光装置、208 光栅、209荧光光学识别装置、210 荧光检测装置、211信息分析系统、301检测磁珠、302磁珠混合箱、303检测芯片、304传送带、308荧光检测装置、309磁感应装置、310消磁装置。
具体实施方式
25.下面结合具体实施例对本发明做详细说明。
26.应该说明的是:下述的基于光栅与磁阵列式的单分子荧光检测方法包括化学分析、dna测序、纳米材料分析、医学诊断、法医分析、单dna操纵、活细胞分析、分子动力学机理
等领域的单分子荧光检测;本发明并不局限于下面所阐述的实施例,本发明的主题内容为在很多情况下涉及相关产品、对特定问题的备选解决方案以及/或一种或多种系统和/或物品的多个不同用途。尽管以下具体实施方式所阐述的大部分是针对分析物分子,但是这仅仅是通过实例的方式,也可检测和/或定量其他材料例如微粒形式的分析物。一些示例性分析物分子和颗粒在本文有所描述。
27.实施例一一种单分子荧光免疫检测方法,主要用于针对低丰度的分析物,如对血清、血浆、脑脊液、尿液、唾液,细胞裂解液等样本中的靶标抗原进行单分子免疫检测。选择直径在2um-80um的磁性微珠为固相载体,磁性微珠为永久磁性的微珠;磁性微珠的表层修饰能够捕获靶标抗原的抗体分子;将多个功能化磁性微珠(所述多个为至少能覆盖所有检测芯片的阵列数量的50%以上)与待分析样本混合,当样本中靶标抗原分子表达丰度较低时,依据泊松分布原理,标本中的抗原分子将与部分包被有抗体分析物分子的磁性微珠进行一对一的结合,形成以磁性微珠为基底的固相抗原复合物;再将包被固相抗原复合物的磁性微珠及未包被固相抗原复合物的磁性微珠一起,所有的多个磁性微珠全部与修饰有抗体的功能性荧光颗粒混合,其中包被有固相抗原复合物的磁性微珠将以一对一的方式结合功能性荧光颗粒,形成带有功能性荧光颗粒的荧光磁性微珠,其它未结合抗原分子和功能性荧光标志物的磁性微珠将形成非荧光磁性微珠;再将所有荧光磁性微珠和非荧光磁性微珠一起放到检测芯片上;所述的检测芯片为带有磁性阵列的芯片,检测芯片上预制有多个磁源排列形成的阵列,且磁性与捕获磁珠的磁性相吸;当所有荧光磁性微珠和非荧光磁性微珠落在检测芯片上时,通过磁性相吸的原理,检测芯片上的每一个磁源都将可能吸附一个所有荧光磁性微珠或非荧光磁性微珠,并保证检测芯片上的磁源,有50%以上能吸附到荧光磁性微珠或非荧光磁性微珠,使得所有荧光磁性微珠和非荧光磁性微珠在检测芯片上形成阵列排布;然利用分子荧光分析法依次对芯片上的荧光磁性微珠和非荧光磁性微珠进行扫描,并根据荧光磁性微珠或非荧光磁性微珠所形成的光谱情况识别二类磁性微珠的总数及荧光磁性微珠与总微珠数量比,并将检测数据以光纤的方式传递到系统分析中心,进行单分子荧光免疫检测分析。具体检测包括如下实施步骤(如附图1所示):1)选择合适磁性微珠1,选择直径在2um-80um的永久磁性微珠为固相载体;磁性微珠1的表层修饰能够捕获靶标抗原的抗体分子;2)将多个磁性微珠1与待分析样本混合,形成以磁性微珠为基底的固相抗原复合物;3)再将多个磁性微珠1与修饰有抗体的功能性荧光颗粒混合,使得功能性荧光颗粒与多个磁性微珠1中的固相抗原复合物一对一结合,形成带有功能性荧光颗粒的检测磁性微珠;4)将多个磁性微珠1导入磁性微珠混合箱2中,由磁性微珠混合箱2将多个磁珠(包括荧光磁性微珠和非荧光磁性微珠)从出口平铺到带有磁性阵列的检测芯片3上,形成阵列排布;5)再让铺有多个磁性微珠的检测芯片3通过输送带4送到激发光5处由激发光5激活;同时,通过由光栅6和光学识别装置7组合形成的荧光识别系统予以检测,利用各
个磁性微珠所发出的荧光不同,对各个磁性微珠的身份进行识别;6)将荧光识别系统识别对多个磁性微珠的身份识别信息传送至信息分析系统8进行分析计算,确定检测结果。
28.需要补充说明的是:荧光磁性微珠与非荧光磁性微珠是平铺在包含有磁阵列的检测芯片上的,并通过检测芯片的所有磁阵列使得荧光磁性微珠和非荧光磁性微珠在芯片上相互之间位置形成隔离,也排列成阵列,且相互之间的磁性微珠不具备相互干扰的特性,便于荧光检测装置进行识别。
29.所述的检测磁性微珠的哺育过程也可以在磁珠混合箱中完成,哺育完毕后洗脱干净,再投放到检测芯片上。
30.所述的荧光磁性微珠是在磁性微珠表面上包被有抗体和抗原分析混合物,并结合有功能性荧光颗粒的磁性微珠;荧光磁性微珠在检测时,受到光激发时会产生高亮度荧光。而且所述的荧光磁性微珠上的抗体与抗原是以单分子形式一对一结合的,且功能性荧光颗粒也是一对一结合在磁性微珠上的。
31.所述的功能性荧光颗粒包括包裹或修饰有异硫氰酸荧光素(fluorescein isothiocyanate, fitc)、藻红蛋白(pe)以及alexafluor等的功能性荧光颗粒。功能性荧光颗粒通过蛋白质交联剂共价结合在单克隆抗体上。
32.所述的检测芯片3上按照阵列分布有磁源9,形成具有阵列式磁源的检测芯片,使得荧光磁性微珠与非荧光磁性微珠落在芯片上将自动按照芯片的阵列进行隔离阵列排布。
33.所述的磁源9为在检测芯片的底部按照阵列设有盲孔状的孔洞10,孔洞10的开口向检测芯片的底面,形成检测芯片的上表面为平面,在孔洞10内安装有可以形成磁性的磁性物体11,且磁性物体11的磁性与磁性微珠1的磁性相吸,使得磁性微珠1落在检测芯片上3时,由于磁性的异性相吸,每一个磁性微珠1都会与一个检测芯片3上的磁阵列分布的磁源9相互吸住,形成磁性微珠1的阵列排布。
34.所述的磁源内的磁性物体9为永久性磁铁;磁性物体的形态可以是圆柱状、球状、或粉体状;在盲孔的端口部12,在将磁性物质填充到盲孔内后,将采用与芯片基材相同的材料封闭起来,也可用不同材料进行封闭。
35.所述的利用分子荧光分析法依次对芯片上的荧光磁性微珠和非荧光磁性微珠进行扫描是在检测芯片的上方设置荧光检测装置,且在检测芯片与荧光检测装置之间设置光栅片,荧光检测装置的激发光源透过光栅片照射到检测芯片上,并采用光栅片与检测芯片相互之间的移动来对检测芯片上的所有磁性微珠进行逐一识别。
36.所述的光栅片为光源与检测芯片之间设置的、具有与检测芯片移动方向的阵列数量相同数量缝隙的光栅;荧光检测装置的检测光源透过光栅的缝隙,逐排对检测芯片上的所有磁性微珠进行逐一识别,并将检测的信息传送到荧光检测系统,进行单分子检测。所谓的逐排包括平行的或错位排布的两种方式。
37.所述的光栅片与检测芯片相互之间的移动包括光栅片不动,检测芯片在光栅片下单向或双向来回移动;或者检测芯片不动光栅片随荧光检测装置的探头一起单向或双向来回移动;逐排对检测芯片上的所有磁性微珠进行检测。
38.所述单分子检测是根据荧光磁性微珠与非荧光磁性微珠所形成的光谱情况识别二类磁性微珠的总数及荧光磁性微珠与总微珠数量比,利用荧光检测装置与检测芯片的之
间的移动,光栅扫描检测芯片上的磁性微珠阵列,并记录通过光栅的磁性微珠的总数量,以及利用泊松分布理论计算出荧光磁性微珠的数量对应的总数量的浓度值,实现数字化单分子检测。
39.实施例二实施例二与实施例一的检测原理是相同的,只是检测物和具体检测的方法有所不同。为一种单分子rna多重原位检测方法,如附图2所示;检测包括下述步骤:(1)选择永久性磁性微珠作为固相物,磁性微珠的直径为2-4μm;(2)将能够与单分子rna检测样本结合的捕获物固定至磁性微珠的表面上,形成捕获磁珠201,并根据所检查的项目对不同的捕获磁珠201进行编码,不同的捕获磁珠201表面包被不同的捕获物;(3)将捕获磁珠投入到磁珠箱体202中,并通过磁珠箱体202的出口依次按照阵列排布到检测芯片203上,由于捕获磁珠201带有磁性,同时检测芯片203也带有阵列磁源,且捕获磁珠201的磁性与检测芯片203的磁源磁性相吸,相互吸引;因此捕获磁珠201在检测芯片上形成阵列排布;(4)然后,利用微流控技术,通过样本注入微流控通道204原位加入rna检测样本,在检测芯片203上孵育样本;(5)孵育完成后,通过清洗装置205洗脱干净检测芯片203;(6)将洗脱后的检测芯片移动到功能性荧光颗粒加入装置206下,通过功能性荧光颗粒加入装置206加入功能性荧光颗粒,形成带有“三明治”结构检测磁珠的检测芯片203;(7)再将检测芯片203移动到激发光装置207处,利用激发光装置207激发检测芯片203上检测磁珠的功能性荧光颗粒,使得检测芯片203上带有功能性荧光颗粒的检测磁珠发光;(8)同时,利用由光栅和荧光光学识别装置组合形成的荧光检测装置208对检测芯片203进行光学识别;通过光栅208和荧光光学识别装置209组合形成的荧光检测装置210与带有阵列式磁源的检测芯片203相互之间的来回移动,由光栅和荧光光学识别装置组合形成的荧光检测装置210检测芯片203上检测磁珠的功能性荧光物质发出的光学信号;分别多重检测识别不同的性质的荧光信号,并进行检测磁珠数学统计;(9)将光栅和荧光光学识别装置组合形成的荧光检测装置208识别的检测磁珠信息传送到信息分析系统211,通过分析确定整个检测磁珠的特性。
40.实施例三实施例二与实施例一的检测原理是相同的,只是所述的检测芯片有所不同,所述检测芯片303的磁源为非永久性磁源的软磁材料制作,且在传送带304位于磁珠混合箱302至光栅和荧光光学识别装置组合形成的荧光检测装置308的区域段下面设置磁感应装置309,在荧光检测装置308之外的传送带304下面设置有消磁装置310,如附图3所示;所述的检测芯片303内的磁源采用软磁材料制作,并在传送带304带动下,检测芯片303进入磁珠混合箱302下面时,检测芯片303内的磁源物质便开始通过磁感应装置309变成强磁性体,且形成磁阵列磁场,检测芯片303成为磁阵列检测芯片;但在检测芯片303按照作业流程检测完毕后,检测芯片303离开检测区域,将通过设置在检测区域外设置消磁装置310,对检测芯片303内软磁材料制作的磁源物质进行消磁,使得芯片的磁阵列消退。这样检测磁珠301在检
测芯片302消磁后,可以更容易从检测芯片303上脱离;这样在检测芯片302上的检测磁珠脱离后,经过洗脱以后可以再次投入使用,进一步降低检测芯片302的使用成本。这样可以使得检测芯片在平时是不带有磁性,只是检测时通过磁感应显现强磁场,这样有利于检测芯片重复使用,而且检测芯片平时收藏和存放也更为简单,不会受到磁场干扰。
41.本实例的其它部分与实施例一是一样的。
42.实施例四实施例四为具体应用实例,为一种单分子基因检测分析方法,包括如下步骤:(1)选择永久性磁珠作为固相物,磁珠的直径为2-4μm(微米);(2)将能够与靶标分子结合的捕获探针固定到磁性微珠上,所述捕获探针与靶标分子的第一序列互补,利用捕获探针捕获样品中的靶标分子;(3)加入检测探针,所述检测探针能够与靶标分子的第二序列互补,形成捕获探针—靶标分子—检测探针的三链杂交结构,然后加入功能性荧光物质;所述功能性荧光物质能够直接或间接与检测探针结合;或先将检测探针与功能性荧光物质结合形成而复合材料,再将该复合材料加入;其中,所述功能性荧光物质含有发光材料和纳米粒子载体,且粒径为180-480nm;(4)将所有磁性微珠平铺到具有阵列式磁源的芯片上,磁性微珠依据泊松分布原理分布在芯片上;(5)用激光和光栅组成的光学成像设备,通过激光和光栅组成的光学成像设备与阵列式磁源的芯片相互之间的移动,检测由所述功能性荧光物质发出的光学信号;(6)统计功能性荧光物质的个数,进一步计算得到样品中靶标分子的浓度信息。
43.本实施方式中,靶标分子包括dna或rna。
44.所述检测试剂包括磁性微珠、捕获探针、检测探针以及功能性荧光物质。其中,所述磁性微珠用于检测样品与试剂的分离和清洗。所述捕获探针通过化学修饰而固定在磁性微珠表面,可与待测分子的一部分进行杂交结合,使其从样品中分离。所述检测探针可与待测分子的另一部分进行杂交结合,检测探针的远离杂交位置的一端通过化学共价键与功能性荧光物质相连接。所述功能性荧光物质能够发出足够强的光学信号,在所述光学成像设备上形成独立可辨别的图像信号。
45.所述磁性微珠按照形态分类,可以为微米尺度微球以及纳米尺度微球中的一种;按照材质分类,可以为有机聚合物、二氧化硅以及硅中的一种或多种;按照功能分类,可以为永久性磁性微珠和非永久性磁性微珠。这些磁性微珠中,优选永久性磁珠。以往认为,将磁珠应用于核酸的定量检测时存在下述问题:磁珠悬浮而难以定量检测,且存在方向性而使亮度存在区别。
46.本实施例中,所述磁性微珠的表面修饰有能够与探针共价偶联的活性官能团,包括羟基、羧基、氨基、巯基、烯基、炔基、琥珀酰亚胺酯基团及其衍生基团中的一种或多种。
47.本实施例中,所述捕获探针可以是核糖核酸或脱氧核糖核酸,其序列与待测分子的一段序列彼此互补,能够形成双链杂交。
48.本实施例中,所述捕获探针的一端修饰有羧基、氨基、巯基以及琥珀酰亚胺酯中的一种或几种,能够与磁性微珠的表面发生共价结合,从而稳定地结合在磁性微珠的表面。
49.本实施例中,所述检测探针可以是核糖核酸,其序列与待测分子的另一段序列(不
同于与捕获探针互补的序列)互补,能够形成双链杂交,从而形成捕获探针—靶标分子—检测探针三链杂交结构。
50.本实施例中,所述检测探针的一端修饰有羧基、氨基、巯基以及琥珀酰亚胺酯中的一种或几种,能够与功能性荧光物质共价偶联,从而稳定结合于功能性荧光物质的表面。
51.本实施例中,所述激光与光栅组合的光学成像设备主要包括以下部件:激发光源、光栅、滤光片、感光元件、数据采集模块、数据处理模块。其中,所述激发光源是用于将反应后的样品激发出光学信号的光学发射装置。所述光栅用于待测样品的信号采集和分割,光栅为光源与检测芯片之间设置,具有与检测芯片移动方向的阵列数量相同数量缝隙的光栅;荧光检测装置的检测光源透过光栅的缝隙,逐排对检测芯片上的所有磁性微珠进行逐一识别,并将检测的信息传送到荧光检测系统,进行单分子检测。所谓的逐排包括平行的或错位排布的两种方式。所述滤光片用于激发光波段的过滤和样品发射光信号的过滤。所述感光元件用于样品光学信号的采集。所述数据采集模块配置为接收感光元件捕获的光学信号,并转换为数字信号。所述数据处理模块配置为数字信号的转换以及光学图像的形成和处理。
52.所述的激光和光栅组成的光学成像设备与阵列式磁源的芯片相互之间的移动为相互之间的平行移动,使得阵列式磁源的芯片逐排通过激光和光栅组成的光学成像设备的光栅,以便激光和光栅组成的光学成像设备逐排对阵列式磁源的芯片上的磁性微珠进行识别。这样可以极大提高检测速度,检测效率可以提高100倍以上。
53.关于其他条件,例如功能性荧光物质,以及小分子浓度的计算方式等,与上述实施例一相同。
54.发明的有益效果本发明采取磁阵列芯片,将捕获磁珠放置在磁阵列芯片上,使得捕获磁珠在磁阵列芯片上形成阵列排布,再通过光栅对芯片上的捕获磁珠进行识别;具有以下一些优点:1)通过磁阵列芯片,不再需要制作simoa技术存放磁珠的反应容器,可以大大简化芯片制作工艺;2)磁阵列芯片没有simoa技术存放磁珠的反应容器,表面形成光洁表面,容易进行清洗,所以芯片可以重复使用,节约芯片资源,降低使用成本;3)直接通过光栅与芯片上的捕获磁珠进行识别,完全改变了simoa技术通过多次拍照,再进行图片识别的方式,直接通过光栅读取数据可以大大提高检测速度;4)检测芯片的磁源物质可以永磁材料,也可以软磁材料,有利于芯片制作;5)检测时磁珠的排布更加简单,不需要再先让磁珠进入反应容器,再进行发光培育,使得整个检测识别的过程更加直接快速;6)采用一对一的反应方式,更加有利于实现快速流水自动化作业。
55.本发明与用于进行类似测定的一般的常规系统和方法相比,在特定情况下,本发明可适应特异性或非特异性结合的检测,因此适应面可以更为广阔。本发明的特定方法可用于鉴定样品中的分析物分子。在一些情况下,这些方法可用于检测和/或定量怀疑含有至少一种类型的分析物分子的流体样品中分析物分子,本发明的测定法是通过拾取的包含含有分析物分子的捕获物的数量,或更一般地为包含分析物分子的总拾取群体的拾取捕获磁珠的数量或比例与流体样品中分析物分子的浓度相关。
56.因此本发明的特定实施方式提供了至少部分基于例如基底上的包含结合分析物分子的捕获物的位置的数量或比例的流体样品中分析物分子浓度的量度。在一些情况中,所述数量/比例可与包含捕获物(例如,具有或不具有相结合的分析物分子或标记试剂)的位置总数和/或与所拾取的位置总数相关。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1