一种用于检测烟曲霉和/或黄曲霉感染的多肽组合及试剂盒
1.本发明属于医学检测技术领域,具体涉及一种用于检测烟曲霉和/或黄曲霉感染的多肽组合及试剂盒。
背景技术:
2.曲霉菌病是由曲霉感染导致的一种疾病,临床上由曲霉引起的疾病有肺曲霉病,侵袭性曲霉病,变应性支气管肺部曲霉病以及浅表曲霉病等。曲菌病常发生在人体空腔部位,如肺部空腔,耳道或鼻窦。在鼻窦和肺内,曲霉病通常进展为由真菌菌丝缠结团块、血凝块和白细胞组成的球块状病灶。真菌球逐渐扩大,在此过程中破坏肺组织,但一般不会向其它区域播散。如果没有及时治疗,会变得非常凶险,可迅速扩散至全肺,并常经血液循环播散至脑、心、肝和肾。这种快速播散主要发生于免疫系统受损的人群。如果曲霉菌定植于气道内表面上,有些哮喘或囊性纤维化患者会出现慢性过敏反应,症状包括咳嗽、喘鸣和发烧。浅表曲霉病会在烧伤、绷带下、眼睛或鼻窦、口腔、鼻腔或耳道损伤后发生。曲霉菌病可无症状或出现咳血、发热、胸痛和呼吸困难。若真菌播散至肝或肾可导致相应器官功能障碍。
3.常见的可以引起曲霉病的曲霉菌有烟曲霉(aspergillus fumigatus)和黄曲霉(aspergillus flavus)。烟曲霉是常见真菌病原体,80%与曲霉有关疾病中的病原体为烟曲霉。烟曲霉的分生孢子被人体吸入后可以在肺部定植,在人体免疫力受损时会引发多种疾病。黄曲霉是一种自然界常见的霉菌,会引起食物的霉变。它会造成肺的曲菌症,有时候也会引起角膜、耳与鼻眼框的感染。黄曲霉会产生黄曲毒素,是一种剧毒的致癌物。
4.检测曲霉菌感染的主要方法有血培养法,聚合酶链式反应(pcr)法,质谱法,血清学方法,半乳甘露聚糖检测(gm试验)等。血培养法的需要的时间比较长,得到培养结果往往需要数天。pcr法测试的时间比较短,可以在数小时内出结果,但是的灵敏度不及血培养法。质谱法一般需要培养完之后得到较大量的病原体细胞之后方可操作。
技术实现要素:
5.基于此,本发明的目的在于提供一种用于检测烟曲霉和/或黄曲霉感染的多肽组合,其具有灵敏度高、特异度好和生物安全性好的优点。
6.为达到上述目的,本发明采用如下技术方案。
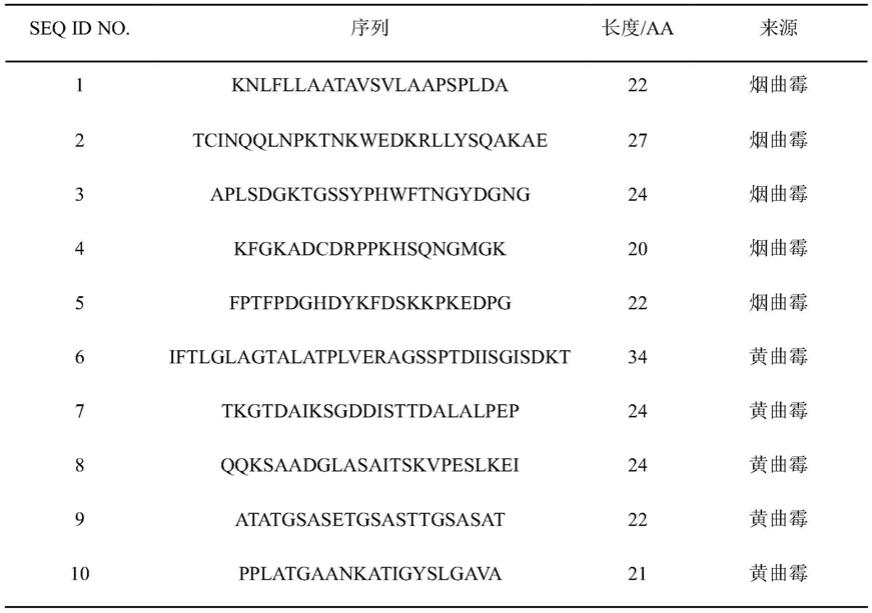
7.一种用于检测烟曲霉和/或黄曲霉感染的多肽组合,所述多肽组合包含seq id no.1~seq id no.5所示多肽中的至少一种和如seq id no.6~seq id no.10所示多肽中的至少一种。
8.在一些实施例中,所述多肽组合包含seq id no.1所示多肽和seq id no.6所示多肽。
9.在一些实施例中,所述多肽组合还包括如seq id no.2所示多肽和seq id no.7所示多肽。
10.在一些实施例中,所述多肽组合包含如seq id no.1~seq id no.5所示多肽中的至少两种和如seq id no.6~seq id no.10所示多肽中的至少两种。
11.在一些实施例中,所述多肽组合包含如seq id no.1~seq id no.5所示多肽中的至少三种和如seq id no.6~seq id no.10所示多肽中的至少三种。
12.在一些实施例中,所述多肽组合包含如seq id no.1~seq id no.5所示多肽中的至少四种和如seq id no.6~seq id no.10所示多肽中的至少四种。
13.在一些实施例中,所述多肽组合包含如seq id no.1~seq id no.10所示的多肽。
14.本发明还提供了一种检测烟曲霉和/或黄曲霉感染的试剂盒,所述试剂盒包含如上所述的多肽组合。
15.在一些实施例中,所述试剂盒还包括人γ干扰素(以下简称γ干扰素)含量测定试剂。
16.在一些实施例中,所述γ干扰素含量测定试剂为使用酶联免疫法、化学发光法、时间分辩法或放射性同位素标记免疫法测定测定γ干扰素含量的试剂。
17.本发明还提供了如上所述的多肽组合在制备检测烟曲霉和/或黄曲霉感染的试剂盒中的应用。
18.本发明通过优化获得了一组可用于同时检测烟曲霉和黄曲霉感染的多肽,所述多肽可以用于构建γ干扰素释放试验体系,检测烟曲霉和黄曲霉的特异性效应t细胞的存在,从而判断待测者是否有烟曲霉或黄曲霉的感染。发明人结合自身经验和大量的研究,分析获得了烟曲霉特有的核糖核酸酶丝裂鳃蛋白(ribonuclease mitogillin)和黄曲霉特有的抗原细胞壁蛋白mp1(antigenic cell wall protein mp1)序列中能够与主要组织相容性复合物ⅱ类(mhcii)分子产生较强结合的位置(与mhcii分子有较强的结合力可以保证多肽的有效性),并发现当多肽的序列长度为20-40时可以获得好的检测效果。本发明多肽特异性高、在水中溶解度好,且相互之间不会干扰,可实现在同一检测体系中稳定高效地实对烟曲霉和黄曲霉的感染进行检测,检测灵敏度高达97.58%,特异度高达85%,具有灵敏度高、特异度好和生物安全性好等优点。
附图说明
19.图1为本发明多肽组合用于识别烟曲霉和黄曲霉感染的原理。
20.图2gm阳性患者和健康对照者的空白对照管上清的γ干扰素浓度(n值)、本发明多肽培养管上清的γ干扰素浓度(t值)、阳性对照管上清的γ干扰素浓度(p值)、本发明多肽引起的γ干扰素释放水平(t-n值)以及阳性对照引起的γ干扰素释放水平(p-n值)的分布图。
21.图3gm阳性患者和健康对照者的空白对照管上清的γ干扰素浓度(n值)、本发明多肽培养管上清的γ干扰素浓度(t值)、阳性对照管上清的γ干扰素浓度(p值)、本发明多肽引起的γ干扰素释放水平(t-n值)以及阳性对照引起的γ干扰素释放水平(p-n值)的平均值及方差分布图。
22.图4为用本发明多肽培养管上清的γ干扰素浓度(t值)作为诊断指标识别烟曲霉和黄曲霉感染的roc曲线图。
23.图5为用本发明多肽引起的γ干扰素释放水平(t-n值)作为为诊断指标识别烟曲
霉和黄曲霉感染的roc曲线图。
24.图6为新型隐球菌感染者、念珠菌感染者、黑曲霉感染者、烟曲霉菌或黄曲霉感染者的多肽抗原引起的γ干扰素释放水平(t-n值)的平均值。
25.图7为将新型隐球菌感染者、念珠菌感染者、黑曲霉感染者作为阴性样本,烟曲霉菌或黄曲霉感染者作为阳性样本,对多肽抗原引起的γ干扰素释放水平(t-n值)作为诊断指标识别烟曲霉菌或黄曲霉感染者的性能做roc分析的结果图。
具体实施方式
26.本发明下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。
27.除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。
28.本发明的术语“包括”和“具有”以及它们任何变形,意图在于覆盖不排他的包含。例如包含了一系列步骤的过程、方法、装置、产品或设备没有限定于已列出的步骤或模块,而是可选地还包括没有列出的步骤,或可选地还包括对于这些过程、方法、产品或设备固有的其它步骤。
29.在本发明中提及的“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,同时存在a和b,单独存在b这三种情况。字符“/”一般表示前后关联对象是一种“或”的关系。
30.下面结合具体实施例进行说明。
31.实施例1
32.本实施例提供一种用于检测曲霉感染的多肽组合,所述多肽组合包含如seq id no.1~seq id no.10所示的多肽,具体序列如表1所示:
33.表1多肽的序列
[0034][0035]
实施例2
[0036]
本实施例使用实施例1所述多肽组合检测曲霉感染。
[0037]
使用所述多肽组合检测40例gm试验阳性的新鲜全血样本,246例健康人的新鲜全血样本。
[0038]
具体操作包括下列步骤:
[0039]
(1)合成多肽
[0040]
选择表1中的多肽序列,用化学法合成多肽,要求纯度高于95%。使用磷酸缓冲液(pbs)溶解多肽,每种多肽的最终浓度为500μg/ml,将溶液作为多肽母液。
[0041]
(2)准备试验培养管
[0042]
准备3个培养管(体积为2.0ml的无菌ep管),3个培养管分别添加10μl的pbs(空白对照管)、10μl的多肽母液(抗原培养管)和10μl 500μg/ml植物血凝素(阳性对照管)。
[0043]
(3)血液培养
[0044]
检测用的样本为新鲜的用肝素钠或肝素锂真空采血管采集的外周血。在生物安全柜中,将装有样本的采血管轻轻上下颠倒6次混匀,使用1ml无菌的吸嘴将血液分1.0ml到各培养管中,完成后将培养管盖上盖子,轻轻上下颠倒6次,以确保培养管中的内容物和血液混合均匀。将培养管置于37(
±
1)℃培养箱中,直立放置,培养16~22小时。培养完成后,用4500转每分钟的转速离心5分钟。取上清用于下一步γ干扰素浓度的检测。
[0045]
(4)γ干扰素的检测
[0046]
用免疫荧光法测定各培养管中γ干扰素的浓度,具体操作如下:将100μl校准品/样品加入微孔板(微孔板包被有鼠抗人γ干扰素单克隆抗体)里,盖上密封片,置于振荡器上(转速为220rpm),在室温下反应30分钟,用洗板机洗5次,拍干,每孔加入100μl生物素标记鼠抗人γ干扰素单克隆抗体工作液,在室温下用反应30分钟,用洗板机洗5次,将100μl铕
标记的链霉亲和素工作液加入各孔中,室温下反应15分钟,孵育第三步后,用洗板机洗6次,拍干,每孔加入100μl增强液,反应5分钟后,使用时间分辩仪光仪检测铕荧光强度。根据校准品的浓度和荧光值建立荧光强度与浓度值之间的关系,得到标准曲线,并依据该标准曲线计算各样本的浓度值。
[0047]
(5)统计分析
[0048]
用prism8软件绘制图形:采用wilson/brown方法,用prism8进行接收机工作特性(roc)分析,通过描述性统计分析得到各组数据的平均误差和标准误差,对可比组进行t检验。
[0049]
实验结果:
[0050]
如图2所示,gm阳性患者和健康对照者的空白对照管上清的γ干扰素浓度(n值)的均值分别为18.19pg/ml(95%ci,9.70~26.67)、27.71pg/ml(95%ci,19.20~36.21),二者的差别不具有统计学意义(p》0.05);依据空白对照管上清的γ干扰素浓度不能区分阴阳性感染者。gm阳性患者和健康对照者的抗原培养管上清的γ干扰素浓度(t值)的均值分别为683.3pg/ml(95%ci,227.6~1139)、43.02pg/ml(95%ci,28.52~57.52),二者的差别具有统计学意义(p《0.0001);依据抗原培养管上清的γ干扰素浓度可区分阴阳性感染者。gm阳性患者和健康对照者的阳性对照管管上清的γ干扰素浓度(p值)的均值分别为489.1pg/ml(95%ci,314.4~663.9)、471.4pg/ml(95%ci,387.3~555.4),二者的差别不具有统计学意义(p》0.05);依据阳性对照管上清的γ干扰素浓度不能区分阴阳性感染者。
[0051]
如图3所示,gm阳性患者和健康对照者的多肽组合引起的γ干扰素释放水平(t-n值)的均值分别为665.2pg/ml(95%ci,210.7~1120)、15.31pg/ml(95%ci,4.725~25.90),二者的差别具有统计学意义(p《0.0001);依据多肽组合引起的γ干扰素释放水平(t-n值)可以区分阴阳性感染者。gm阳性患者和健康对照者的阳性对照引起的γ干扰素释放水平(p-n值)的均值分别为470.9pg/ml(95%ci,295.2~646.7)、443.7pg/ml(95%ci,358.9~528.4)二者的差别不具有统计学意义(p》0.05);依据阳性对照引起的γ干扰素释放水平(p-n值)不能区分阴阳性感染者。
[0052]
对抗原培养管上清的γ干扰素浓度(t值)作为诊断指标(图4)和多肽组合引起的γ干扰素释放水平(t-n值)作为诊断指标的性能(图5)做roc分析,其roc曲线下面积分别为0.8808(95%ci,0.8110~0.9506,p《0.0001)和0.8816(95%ci,0.7958~0.9674,p《0.0001)。使用多肽组合引起的γ干扰素释放水平(t-n值)作为判断曲霉感染的依据较好,当临界值为10.00pg/ml时,系统的灵敏度为0.9758(95%ci,0.9482~0.9889),特异性为0.8500(95%ci,0.7093~0.9294)。
[0053]
上述结果表明,本发明所述多肽组合可用于检测曲霉感染,且灵敏度和特异性高。
[0054]
实施例3
[0055]
本实施例使用实施例1所述多肽组合检测20例新型隐球菌感染者、20例念珠菌感染者、10例黑曲霉、20例烟曲霉菌或黄曲霉感染者的新鲜全血样本。
[0056]
具体操作步骤同实施例2。
[0057]
实验结果:
[0058]
如图6所示,新型隐球菌感染者、念珠菌感染者、黑曲霉感染者、烟曲霉菌或黄曲霉感染者的多肽抗原引起的γ干扰素释放水平(t-n值)的均值分别为12.84pg/ml(95%ci,
8.81~18.87),38.03pg/ml(95%ci,-4.364~80.42),8.59pg/ml(95%ci,4.934~12.25),1076pg/ml(95%ci,179.4~1972)。新型隐球菌感染者、念珠菌感染者、黑曲霉感染者、烟曲霉菌或黄曲霉感染者的多肽抗原引起的γ干扰素释放水平(t-n值)的均值具有统计学差异,其p值均小于0.0001。
[0059]
如图7所示,将新型隐球菌感染者、念珠菌感染者、黑曲霉感染者作为阴性样本,烟曲霉菌或黄曲霉感染者作为阳性样本,将其多肽抗原引起的γ干扰素释放水平(t-n值)作为诊断指标的性能做roc分析,其roc曲线下面积为0.9470(95%ci,0.8644~1.000,p《0.0001)。当临界值为90.00pg/ml时,系统的灵敏度为0.9500(95%ci,0.7639~0.9974),特异性为0.9800(95%ci,0.8950~0.9990)。
[0060]
上述结果表明,本发明所述多肽组合可特异性检测烟曲霉菌或黄曲霉感染,对新型隐球菌、念珠菌和黑曲霉感染无交叉反应。
[0061]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对以上实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0062]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1