基于神经网络快速分割图像以及测定放射性药品吸收量的系统和方法与流程
相关申请的交叉参考本申请要求2018年1月8日提出申请的美国临时申请第62/614,935号、2018年6月7日提出申请的美国专利申请第16/003,006号和2018年10月23日提出申请的美国临时申请第62/749,574号的优先权和益处,所述申请中的每一者的内容以全文引用的方式并入本文中。本发明大概来说涉及用于自动化分析和/或呈现医学图像数据的方法、系统和架构。更具体来说,在某些实施例中,本发明涉及个体的图像内所关注的一或多个特定区域(例如对应于具体器官或组织)的自动化鉴别,以及所述区域内放射性药品的吸收量的测定,例如用于对疾病(例如前列腺癌)进行鉴别和/或分期。
背景技术:
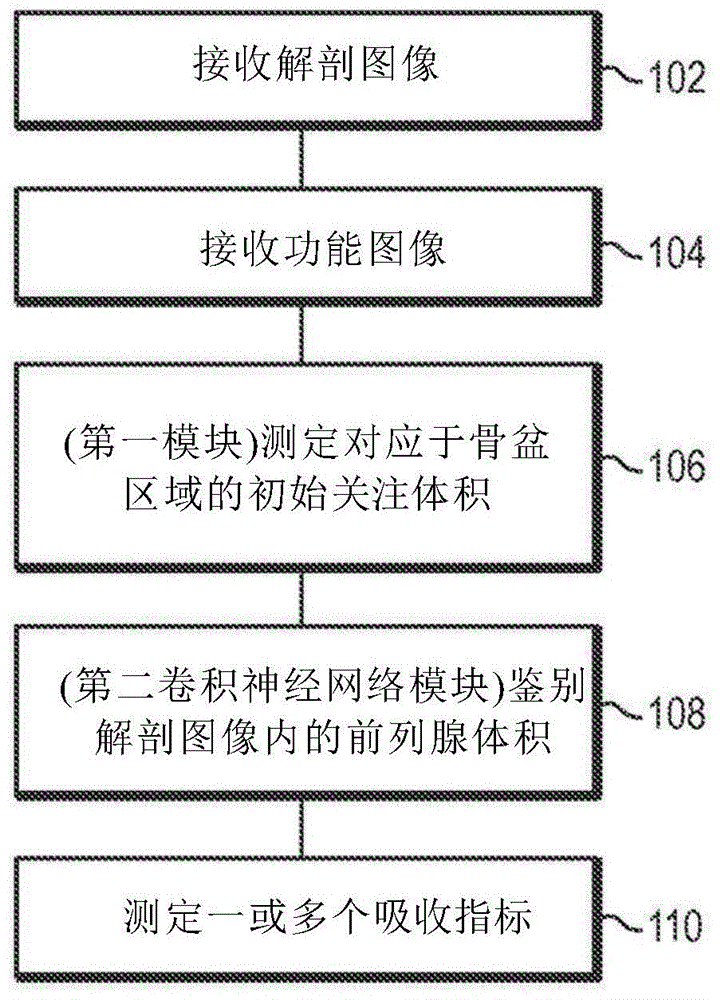
:靶向图像分析涉及使用放射标记的小分子,其结合到体内在疾病进化期间改变的具体受体、酶和蛋白质。在投与患者之后,这些分子在血液中循环直到找到其预期目标。结合的放射性药品保留在疾病部位,而药剂的其余部分自身体清除。分子的放射性部分用作信标,使得可使用在世界各地的大多数医院发现的通常可用的核医学摄像机(称为单光子发射计算机化断层摄影术(spect)或正电子发射断层摄影术(pet)摄像机)来获得绘示疾病位置和浓度的图像。然后医师可使用这个信息来确定患者中疾病的存在和程度。医师可使用这个信息以向患者提供推荐的疗程并跟踪疾病的进展。存在多种基于软件的分析技术可用于分析和增强可由放射师或医师使用的pet和spect图像。还存在多种放射性药品可用于使特定种类的癌症成像。例如,小分子诊断1404靶向前列腺特异性膜抗原(psma)的细胞外结构域,所述psma是在>95%的前列腺癌细胞表面上扩增的蛋白质且是用于检测原发性和转移性前列腺癌的验证目标。1404经锝-99m标记,所述锝-99m是广泛可用、相对便宜、有利于有效制备且具有对核医学成像应用有吸引力的光谱特征的γ-发射体同位素。放射性药品的另一实例是pyltm(还称为[18f]dcfpyl),其是用于前列腺癌的临床阶段的氟化psma靶向的pet成像剂。公开在分子成像和生物学期刊(journalofmolecularimagingandbiology)的2015年4月期刊上的概念验证研究展现,利用pyltm的pet成像在推定的转移疾病和原发性肿瘤的部位展示高水平的pyltm吸收量,这表明检测前列腺癌的高灵敏度和特异性的潜能。肿瘤学家可使用来自患者的靶向pet或spect研究的图像作为其关于患者是否具有特定疾病(例如,前列腺癌)、疾病的哪个阶段是明显的、推荐的是什么疗程(如果存在)、是否指示手术介入和可能预后的评价的输入。肿瘤科医生可在这个评价中使用放射师报告。放射师报告是由放射师为请求成像研究的医师准备的pet或spect图像的技术评估,并且包括(例如)所进行的研究类型、病史、图像之间的比较、用于进行研究的技术、放射师的观察和发现,以及放射师可能基于成像研究结果所具有的总体印象和建议。签名的放射师报告发送给排定研究的医师用于医师的审查,然后医师与患者之间关于治疗结果和建议进行讨论。因此,所述过程涉及让放射师对患者进行成像研究、分析所获得的图像、创建放射师报告、将报告转发给请求医师、让医师制定评价和治疗建议并让医师向患者传达结果、建议和风险。所述过程还可涉及由于不确定的结果而重复成像研究、或基于初始结果排定进一步的测试。如果成像研究展示患者具有特定疾病或病况(例如癌症),那么医师讨论各种治疗选择,包括手术,以及什么都不做或采取观察等待或主动监督方法而不进行手术的风险。从医师的角度和从患者的角度来看,存在与这个过程相关的限制。尽管放射师的报告肯定是有帮助的,但医师最终必须依靠其在为患者制定评价和建议方面的经验。此外,患者必须给予其医师极大信任。医师可向患者展示其pet/spect图像且可告诉患者与各种治疗选择相关的数字风险或特定预后的似然度,但患者可能很难理解这种信息。此外,患者的家人可能会有疑问,特别是如果诊断出癌症但患者选择不做手术。患者和/或其家庭成员可能在线搜索补充信息,并且可能得到的关于诊断病况的风险的消息不可靠。困难的折磨可能会变得更具创伤性。因此,仍然需要用于医学成像研究的改良分析以及对患者的那些结果、诊断、预后、治疗建议和相关风险的传达的系统和方法。技术实现要素:本文提供用于自动化分析个体的三维(3d)医学图像以自动地鉴别所述3d图像内对应于具体器官和/或组织的具体3d体积的系统和方法。在某些实施例中,一或多个所述体积的准确鉴别用于自动地测定表示特定器官和/或组织区域中放射性药品的吸收量的量化指标。这些吸收指标可用于评价个体的疾病状态、确定个体的预后和/或确定治疗方式的效能。值得注意的是,通过鉴别医学图像中的3d体积并以自动化方式测定吸收指标,本文所述的系统和方法为流线型医学图像分析工作流程打开了大门,同时改良了结果的准确度、一致性和再现性。例如,本文所述的图像分析技术的实施例可用于对患者的癌症状态进行初始完全自动化评价。然后可由医师审查完全自动化分析,医师可(i)接受自动化评价或(ii)选择在图像分析系统的指导下以半自动化方式调整参数。与不进行自动化3d分割或初始状态评价的常规方法相比,这种方法减少了医师和/或支持技术人员准备和审查图像以最终作出诊断所需的努力。相反,在这些常规方法中,医师和/或技术人员必须费力地逐片滚动3d图像,以人工鉴别所关注的两个二维区域。除了耗时之外,所述常规方法很大程度上基于图像审查者(例如医师和/或技术人员)的主观判断,并且因此易于读取器间或读取器内可变性。相反,基于本文所述的图像分析工作流程、系统和方法的结果可以完全或半自动化方式获得,其完全消除主观可变性或显著地减少主观可变性。例如,本文所述的系统和方法可用于医学图像的自动化分析以测定吸收指标,其提供个体的前列腺内放射性药品(例如放射性核素标记的psma结合剂(例如99mtc-mip-1404,例如[18f]dcfpyl))的吸收量的量化测量。所述吸收指标与评估个体内前列腺癌和/或前列腺癌严重程度/阶段的患者风险相关。例如,已发现,对于临床显著前列腺癌与临床不显著前列腺癌的自动化分类,可实现高灵敏度和特异性。在某些实施例中,本文所述的图像分析方法利用针对个体获得的3d解剖和功能图像的组合。解剖图像(例如x射线计算机断层摄影术(ct)图像)提供详细的解剖/结构信息。功能图像传达与具体器官和组织内的生理活动(例如代谢、血流、区域化学组成和/或吸收)有关的信息。尤其相关的是核医学图像,例如单光子发射计算机断层摄影术(spect)和/或正电子发射断层摄影术(pet)图像,其是通过检测从个体发射的辐射获得且可用于推断个体内投与的放射性药品的空间分布。例如,spect成像可用于评估放射性药品9mtc-mip-1404(其为经99mtc标记的1404)的吸收量。在某些实施例中,为了评估个体的前列腺中的99mtc-mip-1404吸收量,获得个体的ct图像和相应spect图像,使得ct图像的解剖/结构信息可与相应spect图像的功能信息相关联。通常使用单一多模态成像系统经由两次单独的扫描(例如,ct图像的第一次扫描和spect图像的第二次扫描)获取ct和spect图像,使得个体在两次扫描的持续时间内处于大体上固定的位置。以这种方式,确立ct图像的体素与spect图像的体素之间的映射,并且在ct图像内鉴别为对应于具体器官和/或组织区域的体积可用于鉴别spect图像中对应于那些相同具体器官/和或组织区域的那些体素。因此,在某些实施例中,本文所述的图像分析方法利用卷积神经网络(cnn)来准确地鉴别ct图像内对应于个体的前列腺的前列腺体积。经鉴别的前列腺体积可用于鉴别spect图像中也对应于个体的前列腺的那些体素。因此,可使用对应于个体的前列腺的spect图像体素的强度来计算提供前列腺中成像剂(例如经标记的psma结合剂,例如99mtc-mip-1404或[18f]dcfpyl)的吸收量的测量吸收指标。然后,可将吸收指标转化为鉴别个体是否患有前列腺癌和/或量化个体患有前列腺癌的风险、和/或对疾病进行分期(例如随时间追踪作为疾病的一部分),例如,其可由开业医师用于建议治疗选择和/或监测所投与疗法的效能。本文描述经由这种多图像方法(也就是,3d解剖图像与3d功能图像的组合的分析)改良前列腺(或更广泛地,所关注的特定器官或组织区域)中吸收指标的自动化测量的性能的各种进步。这些进步包括(例如)3d解剖图像中定界框的自动化鉴别(例如,使用第一卷积神经网络,cnn)来鉴别前列腺所在的骨盆区域。例如,具有经鉴别的生理学(例如经鉴别的骨盆区域)的3d解剖图像的集合用于训练表示骨盆区域的边界的点(例如立方形定界框的顶点)上的第一cnn,使得第一个cnn可用于在个体的3d解剖图像中自动鉴别骨盆区域。此提供了待随后处理(例如经由第二cnn)的3d解剖图像的更标准大小的初始体积区域用于初始体积区域内所关注区域的详细分割-例如,其中定界框定界图像中对应于个体的前列腺和/或膀胱和/或直肠和/或臀肌肉的区域。然后,可从3d功能图像中映射到3d解剖图像的一或多个鉴别区域的部分测定成像剂吸收指标。注意,如本文所用‘定界框’不一定是立方形,而是可具有其它形状。在某些实施例中,定界框是立方形。经由第一cnn对定界框的测定可使用比用于由第二cnn的定界框内前列腺和/或其它器官的分割明显更不密集的分辨率作为输入。例如,可经由第一cnn处理具有第一数量的体素(例如81x68x96体素)的全身3d解剖图像以找到定界框,然后第二cnn可处理对应于定界框区域但具有比第一数量的体素更密集的分辨率(例如更多的体素(例如94x138x253体素))的图像。例如在应用第二cnn(用于详细分割)之前鉴别与手头分析相关的3d解剖图像的一或多个部分的‘定界框’方法通过在更加计算密集的后续处理之前移除初始3d解剖图像的大部分提高了计算效率。这种方法比在整个初始3d解剖图像上进行详细的分割更计算有效,这是因为(例如)骨盆区域(例如,立方体定界框的顶点)的鉴别比前列腺、膀胱和/或所关注的其它组织的详细分割更简单。这种方法不仅更计算有效,而且还可导致更准确的后续处理,例如,第二cnn提供的更详细的分割。这是因为(例如)在不同医疗机构使用不同机器获得的3d解剖图像的大小可变(例如,其中可变大小意味着图像的体素数不同,和/或图像中表示的患者组织的体积不同),并且使用具有更标准化的图像体积大小并且所关注的器官和其它组织区域位于其中的3d解剖训练图像的部分训练第二cnn用于前列腺的自动化详细分割产生更稳健、准确的分割。本文所述经由这种多图像方法(也就是,3d解剖图像与3d功能图像的组合的分析)改良前列腺(或更广泛地,所关注的特定器官或组织区域)中吸收指标的自动化测量的性能的另一进步是准确鉴别除了前列腺之外的一或多个组织区域,并且在测定(i)前列腺中的吸收指标和/或(ii)前列腺癌的鉴别和/或分期中,虑及那些区域中的成像剂吸收量。包含psma结合剂的某些成像剂在某些器官中具有高吸收量,这可影响患病组织(例如前列腺癌)的鉴别。例如,放射性核素标记的psma结合剂由膀胱的吸收量可导致3d功能图像散射,并且可降低位于膀胱附近的前列腺中测量的成像剂强度的准确度。通过训练第二cnn用于详细分割个体的前列腺和膀胱,可准确地自动地说明‘泄放’或‘串扰’效应和/或由膀胱吸收成像剂引起的其它效应。此外,通过训练第二cnn用于鉴别3d解剖图像中的参考区域(例如,臀肌肉),可更准确地衡量/归一化成像剂强度测量并改良个体的前列腺中吸收测量的准确度和诊断值。因此,在某些实施例中,本文所述的系统和方法利用两个cnn模块的独特组合,其中第一cnn模块鉴别ct图像内初始所关注体积(voi)且第二cnn模块接收voi作为输入且鉴别其中的前列腺体积。如本文所述,这种方法允许第二cnn模块以较小的输入大小(例如voi而非完全ct图像)操作。可分配通过以这种方式减小输入大小的计算资源(例如存储器;例如,处理时间)的节省,以提高第二cnn模块的准确度和/或用于提高图像处理方法的速度。在某些实施例中,本文所述的系统和方法与前列腺一起鉴别ct图像内的各种额外组织体积。例如,除了前列腺外,可鉴别对应于个体的骨盆骨、膀胱、直肠和臀肌肉的额外组织体积。如本文所述,所述额外组织体积的鉴别可用于多种功能且赋予优于其它方法(例如二元分类方法)的优点,其中ct图像的体素鉴别为对应于前列腺或不对应于前列腺。具体来说,额外组织体积的鉴别可(例如)(i)改良cnn模块鉴别ct图像内前列腺体积的准确度,(ii)提供可用于计算吸收指标计算的归一化值的参考区域的鉴别,以及(iii)允许校正对应于前列腺的spect图像体素的强度的串扰,所述串扰由(例如)放射性药品在膀胱中的积累中产生。在某些实施例中,本文所述的图像分析方法可用于分析各种解剖和功能图像,并且不限于ct和spect图像。例如,正电子发射断层摄影术(pet)是提供关于放射性药品在个体内分布的信息的另一功能成像方式。与spect图像一样,pet图像可与ct图像组合使用,以测定所关注的各种器官和组织区域的吸收指标。本文所述的方法还可应用于各种所关注的器官和/或组织区域,例如骨、淋巴结、肝和肺。因此,通过快速且准确鉴别医学图像的具体器官和组织区域,本文所述的系统和方法提供了吸收指标的准确且自动化测定,其提供个体内各种器官和组织区域内放射性药品的吸收的量化测量。以这种自动化方式测定的吸收指标为评价患者内的疾病风险、状态和进展以及治疗效能提供了有价值的工具。在一方面中,本发明涉及自动化处理3d图像以鉴别3d图像内对应于个体的前列腺的3d体积并确定一或多个指示其中(也就是,前列腺中)的放射性药品吸收的吸收指标的方法,所述方法包含:(a)由计算装置的处理器接收使用解剖成像方式[例如,x射线计算机断层摄影术(ct)(例如全身ct图像;例如,身体局部ct图像);例如,磁共振成像(mri);例如,3d超声波]获得的个体的3d解剖图像,其中3d解剖图像包含个体内的组织(例如软组织和/或骨)的图形表示,其至少一部分对应于个体的骨盆区域;(b)由处理器接收使用功能成像方式[例如,单光子发射计算机断层扫描摄影术(spect);例如,正电子发射断层摄影术(pet)]获得的个体的3d功能图像,其中3d功能图像包含多个体素,每一体素表示个体内的特定物理体积且具有表示从特定物理体积发射的检测辐射的强度值,其中3d功能图像的多个体素的至少一部分表示个体的骨盆区域内的物理体积;(c)由处理器使用第一模块(例如第一机器学习模块)测定3d解剖图像内的初始关注体积(voi)(例如平行六面体,例如,立方体),初始voi对应于个体的骨盆区域内的组织且排除个体的骨盆区域以外的组织(例如,其中voi所排除的3d解剖图像的体素多于其所包括的体素;例如,其中voi包括小于25%的3d解剖图像的体素;例如,其中voi内的大多数体素表示个体的骨盆区域内的物理体积);(d)由处理器使用第二模块(例如第二机器学习模块)鉴别初始voi内对应于个体的前列腺的前列腺体积;和(e)由处理器使用3d功能图像和在3d解剖图像的初始voi内经鉴别的前列腺体积确定(例如,并显示)一或多个吸收指标[例如,基于对应于3d解剖图像的初始voi内经鉴别的前列腺体积的3d功能图像的体素的强度值计算个体的前列腺中放射性药品的数量;例如,计算表示由个体的前列腺占据的物理体积的3d功能图像的体素的强度的总和(加权总和)、平均值和/或最大值][例如,其中一或多个吸收指标包含肿瘤对背景比率(tbr)值和/或其中所述方法包含至少部分基于tbr值确定(例如,并显示)(i)临床显著或(ii)临床不显著前列腺癌分类状态]。在某些实施例中,第一模块接收3d解剖图像作为输入并输出多个坐标值,所述坐标值表示3d解剖图像内的矩形体积的相对角的(例如,表示矩形体积的相对角的两组坐标值)。(以下称“段落a”)在某些实施例中,步骤(c)包含使用第一模块确定3d骨盆骨掩模,其鉴别3d解剖图像内对应于个体的骨盆骨(例如,骶骨、尾骨、左髋骨和右髋骨中的一或多者(高达全部))的体积。在某些实施例中,第一模块是卷积神经网络(cnn)模块(例如利用一或多个卷积层的神经网络模块)。在某些实施例中,步骤(d)包含使用第二模块来鉴别3d解剖图像内的一或多个额外组织体积,每一体积对应于个体内的具体组织区域,其中一或多个额外组织体积对应于选自由以下组成的群组的一或多个具体组织区域:骨盆骨(例如,骶骨;例如,尾骨;例如,左髋骨;例如,右髋骨);个体的膀胱;个体的直肠;和个体的臀肌肉(例如左臀肌肉;例如,右臀肌肉)。在某些实施例中,步骤(d)包含使用第二模块将初始voi内的每一体素分类对应于个体内(预定)不同组织区域的集合中的特定组织区域{例如,所述组包含前列腺和任选地一或多个额外组织区域[例如,个体的骨盆骨(例如骶骨;例如,尾骨;例如,左髋骨;例如,右髋骨);个体的膀胱;个体的直肠;和臀肌肉(例如左臀肌肉;例如,右臀肌肉]}。在某些实施例中,对初始voi内的每一体素进行分类包含:经由第二模块测定初始voi内的多个体素中的每一者的似然值集合,其中所述似然值集合包含组织区域组的一或多个组织区域中的每一者的相应似然值,所述似然值表示体素体现组织区域内的物理体积的似然度(例如如通过第二模块计算);且对于初始voi内的多个体素中的每一者,基于针对体素测定的所述似然值集合,将体素分类对应于特定组织区域。在某些实施例中,第二模块接收初始voi(例如整个初始voi)作为输入并输出多个值,所述多个值针对初始voi内的每一体素包含如下(i)、(ii)和(iii)中的至少一种:(i)对体素进行分类的值[例如,将体素分类对应于具体组织区域,例如,选自预定组的不同组织区域的区域,例如,个体的前列腺;例如,个体的骨盆骨(例如骶骨;例如,尾骨;例如,左髋骨;例如,右髋骨);个体的膀胱;个体的直肠;和个体的臀肌肉(例如左臀肌肉;例如,右臀肌肉)];(ii)体素的似然值集合[例如,体素对应于具体组织区域的似然度,例如选自预定集合的不同组织区域的区域,例如,个体的前列腺;例如,个体的骨盆骨(例如骶骨;例如,尾骨;例如,左髋骨;例如,右髋骨);个体的膀胱;个体的直肠;和个体的臀肌肉(例如左臀肌肉;例如,右臀肌肉)];和(iii)鉴别与不同组织区域的任何预定集合不对应(例如或可能不对应,或鉴别不对应的体素的似然度)的体素(例如鉴别与背景区域对应或可能对应的体素,或与背景区域对应的体素的似然度,例如,所述背景区域不具有诊断意义)的值(例如使得第二模块在一轮中而非对每一体素一次一个地操作来分类和/或计算整个voi的似然值)。在某些实施例中,不同组织区域的(预定)集合包含选自由以下组成的群组的一或多个组织区域:个体的前列腺;个体的骨盆骨(例如骶骨;例如,尾骨;例如,左髋骨;例如,右髋骨);个体的膀胱;个体的直肠;和个体的臀肌肉(例如左臀肌肉;例如,右臀肌肉)。在某些实施例中,步骤(d)包含使用第二模块来鉴别一或多个基础组织体积之集合,一或多个基础组织体积包含经鉴别的前列腺体积和一或多个额外组织体积,并且其中所述方法进一步包含:由处理器使用一或多个辅助模块(例如辅助机器学习模块)鉴别3d解剖图像内的一或多个辅助组织体积,每一辅助组织体积对应于{例如,表示相同具体组织区域[例如,个体的前列腺;例如,个体的骨盆骨(例如骶骨;例如,尾骨;例如,左髋骨;例如,右髋骨);个体的膀胱;个体的直肠;和个体的臀肌肉(例如左臀肌肉;例如,右臀肌肉)]为}通过第二模块鉴别的基础组织体积;和由处理器合并每一辅助组织体积与通过第二模块鉴别的相应基础组织体积(例如通过纳入初始基础组织体积中不包括的相应辅助组织体积的部分添加到相应基础组织体积)。在某些实施例中,所述方法包含:由处理器(例如使用第二模块)鉴别3d解剖图像内(例如初始voi内)的参考体积,参考体积对应于个体内的参考组织区域(例如臀肌肉);在步骤(e)中,使用3d功能图像和3d解剖图像内经鉴别的参考体积来确定一或多个吸收指标中的至少一者(例如,3d功能图像中对应于3d解剖图像内经鉴别的参考体积的体素的强度值计算归一化值)。在某些实施例中,使用3d功能图像和参考体积确定的一或多个吸收指标中的至少一者包含肿瘤对背景比率(tbr)值,其中测定tbr值包含:使用3d功能图像中对应于3d解剖图像的初始voi内经鉴别的前列腺体积的一或多个体素的强度值测定目标强度值(例如其中目标强度值是3d功能图像中对应于前列腺体积的体素的强度的最大值);使用3d功能图像中对应于3d解剖图像内经鉴别的参考体积的一或多个体素的强度值测定背景强度值[例如,其中背景强度值是3d功能图像中对应于经鉴别的参考体积的多种(例如全部)体素的平均强度];和将目标强度值对背景强度值的比率测定为tbr值。在某些实施例中,所述方法包含基于tbr值与一或多个阈值(例如预定阈值)的比较确定个体的前列腺癌状态。在某些实施例中,使用多个参考tbr值测定一或多个阈值[例如,每一参考tbr值是从相应组的参考图像(例如参考3d解剖图像和参考3d功能图像;例如,ct/spect图像组)确定],每一参考tbr值与特定分类前列腺癌状态(例如由开业医师分配)相关[例如,测定参考tbr值所测定的同一个体的格里森(gleason)等级(例如基于根治性前列腺切除术的组织病理学)]。在某些实施例中,使用接收者操作特征(roc)曲线[例如,使用曲线下面积(auc)分析;例如,以提供具体灵敏度值和/或具体特异性值]测定一或多个阈值。在某些实施例中,一或多个阈值包含多个阈值,使得tbr值与多个阈值的比较能够按照非二元量表上的水平确定前列腺癌状态[例如,所述量表具有三个或更多个程度(例如明确负的、可能负的、可能正的、明确正的)](例如其中每一阈值与平均格里森评分相关)。在某些实施例中,所述方法包含如下确定个体的前列腺癌状态:(i)如果tbr值高于截止阈值,那么临床显著;或(ii)如果tbr值低于截止阈值,那么临床不显著。在某些实施例中,所述方法包含由处理器(例如使用第二模块)鉴别3d解剖图像内(例如初始voi内)对应于个体的膀胱的膀胱体积;和在步骤(e)中,使用3d功能图像中对应于3d解剖图像内经鉴别的膀胱体积的体素的强度校正膀胱的串扰(例如散射和/或部分体积效应,经由其,膀胱中的放射性药品的吸收影响3d功能图像中表示前列腺内的物理体积的体素的强度值)[例如,通过基于其与经鉴别的膀胱体积和/或膀胱吸收的接近度调整3d功能图像中对应于前列腺体积的体素的强度(例如,基于3d功能图像中对应于膀胱体积的体素的强度测定);例如,通过使用3d功能图像的体素的强度以确立膀胱的辐射散射模型和基于所述模型调整3d功能图像的体素的强度]。在某些实施例中,校正来自膀胱的串扰包含:测定一或多个膀胱强度泄放函数,所述函数对源自个体的膀胱内的放射性药品的强度对3d功能图像的一或多个体素的强度的贡献进行建模,所述一或多个体素对应于3d解剖图像中的位于经鉴别的膀胱体积之外的一或多个区域,其中一或多个膀胱强度泄放函数将所述贡献作为距经鉴别的膀胱体积的距离的函数建模[例如,其中一或多个膀胱强度泄放函数中的每一者对沿着特定方向的强度泄放进行建模且是通过将模板函数(例如,n次多项式)拟合到对应于3d解剖图像内经鉴别的膀胱体积的3d功能图像的体素的强度并沿特定方向横放来获得];和对于对应于3d解剖图像内经鉴别的前列腺体积的3d功能图像的一或多个体素中的每一者,使用一或多个膀胱强度泄放函数针对膀胱串扰调整体素的强度[例如,通过评估一或多个膀胱强度泄放函数来测定体素的膀胱强度泄放值并自体素的强度中减去膀胱强度泄放值以获得校正的体素强度]。在某些实施例中,所述方法包含:由处理器(例如使用第二模块)鉴别3d解剖图像内(例如初始voi)内对应于个体的膀胱的膀胱体积;由处理器通过对经鉴别的膀胱体积施加形态扩张操作测定扩张的膀胱体积;和在步骤(e)中,使用3d功能图像的体素的强度值确定一或多个吸收指标,所述体素的强度值(i)对应于3d解剖图像的voi内经鉴别的前列腺体积,但(ii)不对应于3d解剖图像的处于扩张的膀胱体积内的区域(例如由此从一或多个吸收指标的计算省略3d功能图像中对应于距经鉴别的膀胱体积预定距离内的3d解剖图像中的位置的那些体素;例如且因此,过度接近经鉴别的膀胱体积)。在某些实施例中,3d功能图像是在向个体投与放射性药品后个体的核医学图像(例如单光子发射计算机化断层摄影术(spect)扫描;例如,正电子发射断层摄影术(pet)扫描)。在某些实施例中,放射性药品包含psma结合剂(例如99mtc-mip-1404;例如,[18f]dcfpyl)。在某些实施例中,核医学图像是在向个体投与放射性药品后获得的个体的单光子发射计算机化断层摄影术(spect)扫描。在某些实施例中,放射性药品包含99mtc-mip-1404。在某些实施例中,所述方法包含基于一或多个吸收指标的至少一部分测定个体的一或多个诊断或预后值[例如,提供个体的疾病状态、进展、预期寿命(例如总体存活)、治疗效能和诸如此类的测量的值(例如格里森评分)]。在某些实施例中,测定一或多个诊断或预后值中的至少一者包含将吸收指标与一或多个阈值进行比较。在某些实施例中,一或多个诊断或预后值中的至少一个估计个体出现临床显著前列腺癌的风险。在某些实施例中,所述方法包含:(f)由处理器引起交互式图形用户界面(gui)的显示,以向用户呈现3d解剖图像和/或3d功能图像的视觉表示;和(g)由处理器在gui内产生3d解剖图像和/或3d功能图像的图形重现作为可选择且可重叠的层,以便能够选择任一者显示(例如经由相应用户可选的图形控制元件(例如切换元件))并单独重现,或选择二者显示且通过将3d解剖图像与3d功能图像叠加而一起重现。在某些实施例中,步骤(g)包含产生可选择且可重叠的分割层的图形重现,所述分割层包含3d解剖图像内一或多个经鉴别的具体组织体积,其中在选择分割层显示后,表示一或多个具体组织体积的图形叠加在3d解剖图像和/或3d功能图像上(例如作为轮廓;例如,作为半透明颜色编码的体积)。在某些实施例中,一或多个具体组织体积包含经鉴别的前列腺体积。在某些实施例中,所述方法包含在步骤(g),使3d解剖图像和/或3d功能图像的2d横断面图在交互式2d观看器内重现,以便用户能够调整2d横断面图的位置。在某些实施例中,所述方法包含在步骤(g),使得3d解剖图像和/或3d功能图像的交互式(例如可旋转的;例如,可切片的)3d视图重现。在某些实施例中,所述方法包含促使图形元件(例如十字准线、目标、彩色标记等)在gui内显示,所述图形元件指示对应于经鉴别的前列腺体积的体素的位置(例如所述位置还对应于与对应于经鉴别的前列腺体积的3d功能图像的其它体素相比具有最大强度(例如最大校正强度)的3d功能图像的体素),由此促进方法的用户审查和/或质量控制(例如允许开业医师检验对应于个体的前列腺的预计物理位置的鉴别位置)。在某些实施例中,所述方法包含促使文本和/或图形以及质量控制图形挂件(widget)在gui内显示,所述文本和/或图形表示步骤(e)中确定的一或多个吸收指标(例如和任选地从其测定的一或多个预后值),所述质量控制图形挂件用于引导用户经由质量控制和报告工作流程来审查和/或更新一或多个吸收指标(例如其中质量控制图形挂件包含用于接收用户输入的可选择图形控制元件,所述用户输入对应于(i)由处理器自动核准如所确定的一或多个吸收指标,或(ii)未核准一或多个吸收指标的自动化确定)。在某些实施例中,所述方法包含:经由质量控制图形挂件接收用户输入,所述用户输入对应于核准一或多个吸收指标(例如和从其确定的任何预后值)的自动化测定;且响应于与核准的一或多个吸收指标的自动化测定对应的用户输入的接收,生成个体的报告,所述报告包含一或多个自动化测定的吸收指标的表示[例如,所述报告包含:个体的鉴别(例如匿名患者id号);一或多个测定的吸收指标(例如和从其测定的任何预后值)的表示(例如文本);和用户核准自动化测定一或多个吸收指标(例如和从其测定的任何预后值)的表示(例如图形和/或文本)]。在某些实施例中,所述方法包含:经由质量控制图形挂件接收对应于未核准的一或多个吸收指标(例如和从其测定的任何预后值)的自动化测定的用户输入;响应于与未核准的一或多个吸收指标对应的自动化测定的用户输入的接收,促使体素选择图形元件(例如游标;例如,可调整的十字准线)显示,以便用户选择3d功能图像的一或多个体素(例如直接或间接,例如经由选择3d解剖图像的体素和随后测定3d功能图像的相应体素)用于测定一或多个吸收指标的更新值;经由体素选择图形元件接收3d功能图像的一或多个体素的用户选择用于测定一或多个吸收指标的更新值[例如,其中用户选择是一或多个校正的背景强度测量位置和/或一或多个校正的前列腺强度位置,例如,其中用户不考虑前列腺位置的自动化鉴别和/或其中用户不考虑背景区域(例如臀肌肉)的位置的自动化鉴别];由处理器使用用户选择的体素更新一或多个吸收指标的值;和由处理器生成个体的报告,所述报告包含一或多个更新的吸收指标的表示的[例如,所述报告包含:个体的鉴别(例如匿名患者id号);一或多个测定的吸收指标(例如和从其测定的任何预后值)的表示(例如文本);和使用用户选择的体素的用户核准自动化测定一或多个吸收指标(例如和从其测定的任何预后值)的表示(例如图形和/或文本)](例如指示吸收指标是经由半自动化分析测定的文本,并且从用户人工选择体素)]。在某些实施例中,所述方法包含:经由质量控制图形挂件接收对应于未核准的一或多个吸收指标(例如和从其测定的任何预后值)的自动化测定的用户输入;经由质量控制图形挂件接收对应于拒绝质量控制(例如由于低图像质量)的用户输入;和由处理器生成个体的报告,其中所述报告包含对拒绝质量控制的鉴别。在某些实施例中,3d功能图像的体素经由已知关系与3d解剖图像的体素相关[例如,3d功能图像的每一体素与3d解剖图像的一或多个体素相关联;例如,3d功能图像的一或多个体素的多个组中的每一者与3d解剖图像的一或多个体素之集合相关联;例如,与3d功能图像的体素相关联的坐标经由已知函数关系(例如经由第一和第二成像方式之间的已知空间关系)与解剖3d图像的体素相关联的坐标相关]。在某些实施例中,第一模块是第一cnn(卷积神经网络)模块且第二模块是第二cnn模块,其中第一cnn模块包含的卷积滤波器的数量比第二cnn模块大(例如多达至少1.5倍,例如多达至少两倍,例如多达约两倍,例如多达至少三倍,例如多达约三倍)。在某些实施例中,所述方法包含对于多个3d解剖图像中的每一者进行步骤(a)和(c),以测定多个初始voi,每一初始voi处于多个3d解剖图像之一内,其中初始voi的大小可变性小于(例如大体上小于)3d解剖图像的大小可变性(例如其中“大小”的可变性意味着如下(i)和(ii)中的任一者或二者:(i)图像中表示的解剖体积的一或多个维度的可变性,例如,如以mm测量,和(ii)沿着图像的一或多个维度中的每一者的图像中体素数量的可变性)(例如其中3d解剖图像(测定每一voi的每一完全图像)的大小沿着一或多个维度中的每一者变化至少200mm、和/或至少300mm、和/或至少400mm、和/或至少500mm、和/或多达400mm、和/或多达500mm、和/或多达1000mm、和/或多达1500mm);例如,其中3d解剖图像(测定每一voi的每一完全图像)的大小沿着一或多个维度中的每一者变化至少25个体素、和/或至少50个体素、和/或至少100个体素、和/或至少250个体素、和/或至少300个体素、和/或多达250个体素、和/或多达300个体素、和/或多达500个体素);例如,其中voi的大小沿着一或多个维度中的每一者变化小于或等于200mm(例如小于或等于100mm;例如,小于或等于50mm);例如其中voi的大小沿着一或多个维度中的每一者变化小于或等于250个体素(例如小于或等于200个体素;例如,小于或等于150个体素)]。在某些实施例中,第一模块是cnn模块,其接收具有第一分辨率的3d解剖图像的下取样版本(例如3d解剖图像的低分辨率版本)作为输入并对其进行操作,并且其中第二模块是cnn模块,其裁剪到初始voi并具有第二分辨率的3d解剖图像的高分辨率版本作为输入并对其进行操作,第二分辨率高于第一分辨率(例如至少高2倍;例如,至少高4倍;例如,至少高8倍)。在某些实施例中,第一模块接收3d解剖图像的至少一部分作为输入,并且其中由第一模块的输入表示的物理体积(i)为由初始voi表示的物理体积的至少2倍(例如4倍;例如,8倍)和/或(ii)在至少一个维度上为由初始voi表示的物理体积的2倍(例如4倍;例如,8倍)。在某些实施例中,第一模块是经训练以鉴别3d解剖图像内骨盆区域的图形表示的cnn模块且其中第二模块是经训练以鉴别3d解剖图像内前列腺组织的图形表示的cnn模块。(以下称“段落b”)在另一方面中,本发明涉及如下方法:自动化处理3d图像以鉴别3d图像内对应于个体的目标组织区域的3d体积和确定一或多个指示其中的放射性药品吸收的吸收指标,所述方法包含:(a)由计算装置的处理器接收使用解剖成像方式[例如,x射线计算机断层摄影术(ct);例如,磁共振成像(mri);例如,超音]获得的个体的3d解剖图像,其中3d解剖图像包含个体的特定解剖区域(例如有关组织的特定组,例如骨盆区域、胸区域、头和/或颈区域和诸如此类)内组织(例如软组织和/或骨)的图形表示,特定解剖区域包含目标组织区域;(b)由处理器接收使用功能成像方式[例如,单光子发射计算机断层扫描摄影术(spect);例如,正电子发射断层摄影术(pet)]获得的个体的3d功能图像,其中3d功能图像包含多个体素,每一体素表示个体内的特定物理体积且具有表示从特定物理体积发射的检测辐射的强度值,其中3d功能图像的多个体素的至少一部分表示个体的特定解剖区域内的物理体积;(c)由处理器使用第一模块(例如第一机器学习模块)测定3d解剖图像内的初始关注体积(voi)(例如矩形棱镜),初始voi对应于包含目标组织区域的特定解剖区域(例如有关组织之集合,例如骨盆区域、胸区域、头和/或颈区域和诸如此类)(例如,其中voi所排除的3d解剖图像的体素多于其所包括的体素;例如,其中voi包括小于25%的3d解剖图像的体素;例如,其中voi内的大多数体素表示特定解剖区域内的物理体积;(d)由处理器使用第二模块(例如第二机器学习模块)鉴别初始voi内对应于个体的目标组织区域的目标体积;和(e)由处理器使用3d功能图像和在3d解剖图像的voi内经鉴别的目标体积测定一或多个吸收指标[例如,基于对应于3d解剖图像的voi内经鉴别的目标体积的3d功能图像的体素的强度值计算个体的目标组织区域中放射性药品的数量;例如,计算表示由个体的目标组织区域占据的物理体积的3d功能图像的体素的强度的总和(加权总和)、平均值和/或最大值]。在某些实施例中,所述方法具有段落“a”-“b”中明确表达的一或多个特征。在另一方面中,本发明涉及自动化分析3d功能图像[例如,核医学图像(例如spect图像;例如,pet图像)]以校正前列腺体素强度的串扰的方法,所述串扰来自吸收至膀胱的放射性药品,所述方法包含:(a)由计算装置的处理器接收使用解剖成像方式[例如,x射线计算机断层摄影术(ct);例如,磁共振成像(mri);例如,3d超音]获得的个体的3d解剖图像,其中3d解剖图像包含个体内组织(例如软组织和/或骨)的图形表示,其至少一部分对应于个体的膀胱和前列腺;(b)由处理器接收个体的3d功能图像,其中3d功能图像包含多个体素,每一体素表示个体内的特定物理体积且具有表示从特定物理体积发射的检测辐射的强度值,其中3d功能图像的多个体素的至少一部分表示个体的膀胱和/或前列腺内的物理体积;(c)由处理器在3d解剖图像内自动鉴别:(i)对应于个体的前列腺的前列腺体积和(ii)对应于个体的膀胱的膀胱体积;(d)由处理器在3d功能图像内自动鉴别:(i)对应于经鉴别的前列腺体积的多个前列腺体素和(ii)对应于经鉴别的膀胱体积的多个膀胱体素;(e)由处理器基于膀胱体素的一或多个测量的强度(例如对应于经鉴别的膀胱体积和/或对应于经鉴别的膀胱体积中的每一和/或积累多个区域的强度的一或多个积累测量和/或峰测量和/或平均测量和/或中值测量)调整前列腺体素的一或多个测量的强度(例如对应于经鉴别的前列腺体积和/或对应于经鉴别的前列腺体积中的每一和/或积累多个区域的强度的一或多个积累测量和/或峰测量和/或平均测量和/或中值测量);和(f)由处理器使用前列腺体素的调整强度测定指示个体的前列腺内放射性药品的吸收的一或多个吸收指标。在某些实施例中,所述方法具有段落“a”-“b”中明确表达的一或多个特征。在另一方面中,本发明涉及基于个体的一部分的3d功能图像(例如spect图像)的自动化分析检测个体的前列腺癌状态和/或量化前列腺癌风险的方法,所述方法包含:(a)在向个体投与包含psma结合剂的放射性药品后获取3d功能图像(例如spect图像);(b)由计算装置的处理器鉴别3d功能图像内的3d目标体积,3d目标体积对应于个体的前列腺;(c)由处理器使用3d目标体积的体素的强度测定目标对背景比率(tbr)值;和(d)由处理器引起表示测定的tbr值的文本和/或图形的图形呈现以在交互式图形用户界面(gui)内显示[例如,其中所述方法包含至少部分基于tbr值确定(例如,并显示)(i)临床显著(ii)临床上显著前列腺癌分类状态]。在某些实施例中,所述方法具有段落“a”-“b”中明确表达的一或多个特征。在另一方面中,本发明涉及用于自动化处理3d图像以鉴别3d图像内对应于个体的前列腺的3d体积和确定一或多个指示其中(也就是,前列腺中)的放射性药品吸收的吸收指标的系统,所述系统包含:处理器;和存储器,其上存储有指令(例如在处理器外部或嵌入其中),其中所述指令在由处理器执行时引起处理器:(a)接收使用解剖成像方式[例如,x射线计算机断层摄影术(ct)(例如全身ct图像;例如,身体局部ct图像);例如,磁共振成像(mri);例如,3d超音]获得的个体的3d解剖图像,其中3d解剖图像包含个体内组织(例如软组织和/或骨)的图形表示,其至少一部分对应于个体的骨盆区域;(b)接收使用功能成像方式[例如,单光子发射计算机断层扫描摄影术(spect);例如,正电子发射断层摄影术(pet)]获得的个体的3d功能图像,其中3d功能图像包含多个体素,每一体素表示个体内的特定物理体积且具有表示从特定物理体积发射的检测的辐射的强度值,其中3d功能图像的多个体素的至少一部分表示个体的骨盆区域内的物理体积;(c)使用第一模块(例如第一机器学习模块)测定3d解剖图像内的初始关注体积(voi)(例如平行六面体,例如,立方形),初始voi对应于个体的骨盆区域内的组织且排除个体的骨盆区域以外的组织(例如,其中voi所排除的3d解剖图像的体素多于其所包括的体素;例如,其中voi包括小于25%的3d解剖图像的体素;例如,其中voi内的大多数体素表示个体的骨盆区域内的物理体积;(d)使用第二模块(例如第二机器学习模块)鉴别初始voi内对应于个体的前列腺的前列腺体积;和(e)使用3d功能图像和在3d解剖图像的初始voi内经鉴别的前列腺体积测定(例如,并显示)一或多个吸收指标[例如,基于对应于3d解剖图像的初始voi内经鉴别的前列腺体积的3d功能图像的体素的强度值计算个体的前列腺中放射性药品的数量;例如,计算表示由个体的前列腺占据的物理体积的3d功能图像的体素的强度的总和(加权总和)和/或平均值和/或最大值][例如,其中一或多个吸收指标包含肿瘤对背景比率(tbr)值,并且其中所述指令在由处理器执行时引起处理器确定(例如,并显示)(i)临床显著或(ii)临床上显著前列腺癌分类状态]。在某些实施例中,所述系统具有段落“a”-“b”中明确表达的一或多个特征。在另一方面中,本发明涉及用于自动化处理3d图像以鉴别3d图像内对应于个体的目标组织区域的3d体积和确定一或多个指示其中(也就是,目标组织区域中)的放射性药品吸收的吸收指标的系统,所述系统包含:处理器;和存储器,其上存储有指令(例如在处理器外部或嵌入其中),其中所述指令在由处理器执行时引起处理器:(a)接收使用解剖成像方式[例如,x射线计算机断层摄影术(ct);例如,磁共振成像(mri);例如,3d超音]获得的个体的3d解剖图像,其中3d解剖图像包含个体的特定解剖区域(例如有关组织的特定组,例如骨盆区域、胸区域、头和/或颈区域和诸如此类)内组织(例如软组织和/或骨)的图形表示,特定解剖区域包含目标组织区域;(b)接收使用功能成像方式[例如,单光子发射计算机断层扫描摄影术(spect);例如,正电子发射断层摄影术(pet)]获得的个体的3d功能图像,其中3d功能图像包含多个体素,每一体素表示个体内的特定物理体积且具有表示从特定物理体积发射的检测辐射的强度值,其中3d功能图像的多个体素的至少一部分表示个体的特定解剖区域内的物理体积;(c)使用第一模块(例如第一机器学习模块)测定3d解剖图像内的初始关注体积(voi)(例如矩形棱镜),初始voi对应于包含目标组织区域的特定解剖区域(例如有关组织之集合,例如骨盆区域、胸区域、头和/或颈区域和诸如此类)(例如,其中voi所排除的3d解剖图像的体素多于其所包括的体素;例如,其中voi包括小于25%的3d解剖图像的体素;例如,其中voi内的大多数体素表示特定解剖区域内的物理体积;(d)使用第二模块(例如第二机器学习模块)鉴别初始voi内对应于个体的目标组织区域的目标体积;和(e)使用3d功能图像和在3d解剖图像的voi内经鉴别的目标体积测定一或多个吸收指标[例如,基于对应于3d解剖图像的voi内经鉴别的目标体积的3d功能图像的体素的强度值计算个体的目标组织区域中放射性药品的数量;例如,计算表示由个体的目标组织区域占据的物理体积的3d功能图像的体素的强度的总和(加权总和)和/或平均值和/或最大值][例如,其中一或多个吸收指标包含肿瘤对背景比率(tbr)值,并且其中所述指令在由处理器执行时引起处理器至少部分基于tbr值确定(例如,并显示)(i)临床显著或(ii)临床上显著癌症分类状态]。在某些实施例中,所述系统具有段落“a”-“b”中明确表达的一或多个特征。在另一方面中,本发明涉及基于个体的一部分的3d功能图像(例如spect图像)的自动化分析检测个体的前列腺癌状态和/或量化前列腺癌风险的系统,所述系统包含:处理器;和存储器,其上存储有指令(例如在处理器外部或嵌入其中),其中所述指令在由处理器执行时引起处理器:(a)在向个体投与包含psma结合剂的放射性药品后获取个体的部分(例如任何或全部)的3d功能图像(例如spect图像);(b)鉴别3d功能图像内的3d目标体积,3d目标体积对应于个体的前列腺;(c)使用3d目标体积的体素的强度测定目标对背景比率(tbr)值;和(d)产生文本和/或图形的图形重现,所述文本和/或图形表示所述测定的tbr值用于在交互式图形用户界面(gui)内显示[例如,其中所述指令在由处理器执行时引起处理器至少部分基于tbr值确定(例如,并显示)前列腺癌分类状态为(i)临床显著或(ii)临床不显著]。在某些实施例中,所述系统具有段落“a”-“b”中明确表达的一或多个特征。在某些实施例中,本发明涉及包含本文所述系统中的任一者的计算机辅助检测(cade)装置。在某些实施例中,所述指令促使处理器鉴别个体分类为临床显著前列腺癌或临床不显著前列腺癌。在某些实施例中,本发明涉及包含本文所述系统中的任一者的计算机辅助诊断(cadx)装置。在某些实施例中,所述指令促使处理器鉴别个体分类为临床显著前列腺癌或临床不显著前列腺癌。在某些实施例中,本发明涉及包含以下的组合产品:(a)放射标记的psma结合剂(例如99mtc-mip-1404;例如,[18f]dcfpyl,例如,其它已知psma结合剂);和(b)包含本文所述系统中的任一者的计算机辅助检测(cade)装置。在某些实施例中,组合产品包含标签,所述标签指明放射标记的psma结合剂联合计算机辅助检测装置使用。在另一方面中,本发明涉及自动化处理3d图像以鉴别3d图像内对应于目标组织区域(例如前列腺;例如,肺;例如,一或多个骨;例如,淋巴结;例如,脑)的3d体积的方法,所述方法包含:(a)由计算装置的处理器接收使用解剖成像方式[例如,x射线计算机断层摄影术(ct);例如,磁共振成像(mri);例如,超音]获得的个体的3d解剖图像,其中3d解剖图像包含个体的组织(例如软组织和/或骨)的图形表示;(b)由处理器使用第一模块(例如第一机器学习模块)测定3d解剖图像内的初始关注体积(voi)(例如矩形棱镜),初始voi对应于包含目标区域的特定解剖区域(例如有关组织之集合,例如骨盆区域、胸区域、头和/或颈区域和诸如此类)(例如,其中voi所排除的3d解剖图像的体素多于其所包括的体素;例如,其中voi包括小于25%的3d解剖图像的体素;例如,其中voi内的大多数体素表示特定解剖区域内的物理体积;(c)由处理器使用第二模块(例如第二机器学习模块)鉴别初始voi内对应于个体的目标组织区域的目标体积;和(d)由处理器存储和/或提供对应于经鉴别的目标体积的3d分割掩模用于显示和/或进一步处理。在某些实施例中,第一模块接收3d解剖图像作为输入并输出多个坐标值,所述坐标值表示3d解剖图像内的矩形体积的相对角的(例如,表示矩形体积的相对角的两组坐标值)。(以下称“段落c”)在某些实施例中,第一模块是卷积神经网络(cnn)模块(例如利用一或多个卷积层的神经网络模块)。在某些实施例中,步骤(c)包含使用第二模块鉴别3d解剖图像内的一或多个额外组织体积,每一额外组织体积对应于个体内的具体组织区域。在某些实施例中,步骤(c)包含使用第二模块将初始voi内的每一体素分类对应于个体的(预定)不同组织区域的集合中的特定组织区域{例如,所述组包含目标组织区域和任选地一或多个额外组织区域[例如,个体的骨盆骨(例如骶骨;例如,尾骨;例如,左髋骨;例如,右髋骨);个体的膀胱;个体的直肠;和臀肌肉(例如左臀肌肉;例如,右臀肌肉]}。在某些实施例中,对初始voi内的每一体素进行分类包含:经由第二模块测定初始voi内的多个体素中的每一者的似然值集合,其中所述组似然值包含组织区域组的一或多个组织区域中的每一者的相应似然值,所述似然值表示体素体现组织区域内的物理体积的似然度(例如如通过第二模块计算);且对于初始voi内的多个体素中的每一者,基于针对体素测定的所述组似然值,将体素分类对应于特定组织区域。在某些实施例中,第二模块接收初始voi(例如整个初始voi)作为输入并输出多个值,所述多个值针对初始voi内的每一体素包含如下(i)、(ii)和(iii)中的至少一种:(i)对体素进行分类的值[例如,将体素分类对应于具体组织区域,例如,选自预定集合的不同组织区域的区域,例如,预定集合包含目标组织区域,例如,个体的前列腺;例如,个体的骨盆骨(例如骶骨;例如,尾骨;例如,左髋骨;例如,右髋骨);个体的膀胱;个体的直肠;和个体的臀肌肉(例如左臀肌肉;例如,右臀肌肉)];(ii)体素的似然值集合[例如,体素对应于具体组织区域的似然度,例如选自预定集合的不同组织区域的区域,例如,个体的前列腺;例如,个体的骨盆骨(例如骶骨;例如,尾骨;例如,左髋骨;例如,右髋骨);个体的膀胱;个体的直肠;和个体的臀肌肉(例如左臀肌肉;例如,右臀肌肉)];和(iii)鉴别与不同组织区域的任何预定集合不对应(例如或可能不对应,或鉴别不对应的体素的似然度)的体素(例如鉴别与背景区域对应或可能对应的体素,或与背景区域对应的体素的似然度,例如,所述背景区域不具有诊断意义)的值(例如使得第二模块在一轮中而非对每一体素一次一个地操作来分类和/或计算整个voi的似然值)。在某些实施例中,步骤(c)包含使用第二模块来鉴别一或多个基础组织体积之集合,一或多个基础组织体积包含经鉴别的目标体积和一或多个额外组织体积,并且其中所述方法进一步包含:由处理器使用一或多个辅助模块(例如辅助机器学习模块)鉴别3d解剖图像内的一或多个辅助组织体积,每一辅助组织体积对应于{例如,表示相同具体组织区域[例如,个体的前列腺;例如,个体的骨盆骨(例如骶骨;例如,尾骨;例如,左髋骨;例如,右髋骨);个体的膀胱;个体的直肠;和个体的臀肌肉(例如左臀肌肉;例如,右臀肌肉)]为}通过第二模块鉴别的基础组织体积;和由处理器合并每一辅助组织体积与通过第二模块鉴别的相应基础组织体积(例如通过纳入初始基础组织体积中不包括的相应辅助组织体积的部分添加到相应基础组织体积)。在某些实施例中,所述方法包含:(e)由处理器引起交互式图形用户界面(gui)的显示,以向用户呈现3d解剖图像的视觉表示;和(f)由处理器在gui内产生3d解剖图像以及包含3d解剖图像内的一或多个经鉴别的具体组织体积的可选择且可重叠分割层的图形重现,其中在选择分割层显示时,表示一或多个具体组织体积的图形叠加在3d解剖图像上(例如作为轮廓;例如,作为半透明颜色编码的体积)。在某些实施例中,一或多个具体组织体积包含经鉴别的目标体积。在某些实施例中,所述方法包含在步骤(f),使3d解剖图像的2d横断面图在交互式2d观看器内重现,以便用户能够调整2d横断面图的位置。在某些实施例中,所述方法包含在步骤(f)中,引起3d解剖图像的交互式(例如可旋转的;例如,可切片的)3d视图重现。在某些实施例中,第一模块是第一cnn(卷积神经网络)模块且第二模块是第二cnn模块,其中第一cnn模块包含的卷积滤波器的数量比第二cnn模块大(例如多达至少1.5倍,例如多达至少两倍,例如多达约两倍,例如多达至少三倍,例如多达约三倍)。在某些实施例中,所述方法包含对于多个3d解剖图像中的每一者进行步骤(a)和(b),以测定多个初始voi,每一初始voi处于多个3d解剖图像之一内,其中初始voi的大小可变性小于(例如大体上小于)3d解剖图像的大小可变性(例如其中“大小”的可变性意味着如下(i)和(ii)中的任一者或二者:(i)图像中表示的解剖体积的一或多个维度的可变性,例如,如以mm测量,和(ii)沿着图像的一或多个维度中的每一者的图像中体素数量的可变性)[例如其中3d解剖图像(测定每一voi的每一完全图像)的大小沿着一或多个维度中的每一者变化至少200mm、和/或至少300mm、和/或至少400mm、和/或至少500mm、和/或多达400mm、和/或多达500mm、和/或多达1000mm、和/或多达1500mm);例如,其中3d解剖图像(测定每一voi的每一完全图像)的大小沿着一或多个维度中的每一者变化至少25个体素、和/或至少50个体素、和/或至少100个体素、和/或至少250个体素、和/或至少300个体素、和/或多达250个体素、和/或多达300个体素、和/或多达500个体素);例如,其中voi的大小沿着一或多个维度中的每一者变化小于或等于200mm(例如小于或等于100mm;例如,小于或等于50mm);例如其中voi的大小沿着一或多个维度中的每一者变化小于或等于250个体素(例如小于或等于200个体素;例如,小于或等于150个体素)]。在某些实施例中,第一模块是cnn模块,其接收具有第一分辨率的3d解剖图像的下取样版本(例如3d解剖图像的低分辨率版本)作为输入并对其进行操作,并且其中第二模块是cnn模块,其裁剪到初始voi并具有第二分辨率的3d解剖图像的高分辨率版本作为输入并对其进行操作,第二分辨率高于第一分辨率(例如至少高2倍;例如,至少高4倍;例如,至少高8倍)。在某些实施例中,第一模块接收3d解剖图像的至少一部分作为输入,并且其中由第一模块的输入表示的物理体积(i)为由初始voi表示的物理体积的至少2倍(例如4倍;例如,8倍)和/或(ii)在至少一个维度上为由初始voi表示的物理体积的2倍(例如4倍;例如,8倍)。在某些实施例中,第一模块是经训练以鉴别3d解剖图像内特定解剖区域的图形表示的cnn模块且其中第二模块是经训练以鉴别3d解剖图像内目标组织区域的图形表示的cnn模块。在某些实施例中,所述方法进一步包含:由处理器接收使用功能成像方式[例如,单光子发射计算机断层扫描摄影术(spect);例如,正电子发射断层摄影术(pet)]获得的个体的3d功能图像,其中3d功能图像包含多个体素,每一体素表示个体内的特定物理体积且具有表示从特定物理体积发射的检测辐射的强度值,其中3d功能图像的多个体素的至少一部分表示个体的特定解剖区域内的物理体积;和使用3d分割掩模(例如通过将3d分割掩模映射到3d功能图像)鉴别3d功能图像内对应于经鉴别的目标体积的3d体积。在某些实施例中,3d功能图像的体素经由已知关系与3d解剖图像的体素相关[例如,3d功能图像的每一体素与3d解剖图像的一或多个体素相关联;例如,3d功能图像的一或多个体素的多个组中的每一者与3d解剖图像的一或多个体素之集合相关联;例如,与3d功能图像的体素相关联的坐标经由已知函数关系(例如经由第一和第二成像方式之间的已知空间关系)与解剖3d图像的体素相关联的坐标相关]。(以下称“段落d”)在另一方面中,本发明涉及用于自动化处理3d图像以鉴别3d图像内对应于目标组织区域(例如前列腺;例如,肺;例如,一或多个骨;例如,淋巴结;例如,脑)的3d体积的系统,所述系统包含:计算装置的处理器;和存储器,其上存储有指令,其中所述指令在由处理器执行时引起处理器:(a)接收使用解剖成像方式[例如,x射线计算机断层摄影术(ct);例如,磁共振成像(mri);例如,3d超音]获得的个体的3d解剖图像,其中3d解剖图像包含个体内组织(例如软组织和/或骨)的图形表示;(b)使用第一模块(例如第一机器学习模块)测定3d解剖图像内的初始关注体积(voi)(例如矩形棱镜),初始voi对应于包含目标区域的特定解剖区域(例如有关组织之集合,例如骨盆区域、胸区域、头和/或颈区域和诸如此类)(例如,其中voi所排除的3d解剖图像的体素多于其所包括的体素;例如,其中voi包括小于25%的3d解剖图像的体素;例如,其中voi内的大多数体素表示特定解剖区域内的物理体积;(c)使用第二模块(例如第二机器学习模块)鉴别初始voi内对应于个体的目标组织区域的目标体积;和(d)存储和/或提供对应于经鉴别的目标体积的3d分割掩模用于显示和/或进一步处理。在某些实施例中,所述系统具有段落“c”-“d”中明确表达的一或多个特征。关于本发明的一个方面描述的实施例的特征可应用于本发明的另一方面。附图说明本专利或申请案文件含有至少一个有色绘制的图式。在要求并支付必要费用之后专利事务局可提供本专利或专利申请公开案带彩图的复本。连同附图一起参考以下说明将更明了和更好地理解本发明的前述和其它目标、方面、特征和优点,附图中:图1是根据阐释性实施例展示自动鉴别3d图像内对应于个体的前列腺的3d体积和测定指示其中的放射性药品吸收的吸收指标的方法的方块图。图2a是根据阐释性实施例展示包含软组织的图形表示的ct图像的3d视图的图像。图2b是根据阐释性实施例展示包含骨的图形表示的ct图像的3d视图的图像。图2c是根据阐释性实施例展示包含骨的图形表示的ct图像的3d视图的图像,所述ct图像与spect图像和表示对应于个体的骨盆骨内的前列腺器官的经鉴别组织体积的图形叠加。图2d是根据阐释性实施例展示包含骨的图形表示的ct图像的3d视图的图像,所述ct图像与spect图像和表示对应于个体的骨盆骨内的前列腺器官的经鉴别的组织体积的图形叠加。图2e是根据阐释性实施例展示包含骨的图形表示的ct图像的3d视图的图像,所述ct图像与spect图像叠加。图3a是根据阐释性实施例的图像之集合,每一图像展示3dct图像的2d横断面图,所述3dct图像与表示3dct图像内经鉴别的初始关注体积(voi)的图形叠加。图3b是根据阐释性实施例的图像之集合,每一图像展示3dct图像的2d横断面图,所述3dct图像与表示3dct图像内经鉴别的初始关注体积(voi)的图形叠加。图4a是根据阐释性实施例展示个体的ct图像和鉴别为ct图像内的初始关注体积的立方形区域的2d横断面图的图像之集合。图4b是展示个体的ct图像以及对应于个体的骨盆骨和前列腺的经鉴别的组织体积的2d横断面图的图像之集合。图5a是根据阐释性实施例展示个体的ct图像和鉴别为ct图像内的初始关注体积的立方形区域的2d横断面图的图像之集合。图5b是展示个体的ct图像以及对应于个体的骨盆骨和前列腺的经鉴别的组织体积的2d横断面图的图像之集合。图6a是根据阐释性实施例展示个体的ct图像和鉴别为ct图像内的初始关注体积的立方形区域的2d横断面图的图像之集合。图6b是根据阐释性实施例的图像之集合,每一图像展示3dct图像的2d横断面图,所述3dct图像与表示3dct图像内经鉴别的初始关注体积(voi)的图形叠加。图6c是根据阐释性实施例的图像之集合,每一图像展示3dct图像的2d横断面图,所述3dct图像与表示3dct图像内经鉴别的初始关注体积(voi)的图形叠加。图7a-7e提供根据阐释性实施例用于鉴别对应于个体的ct图像内的骨盆区域的所关注体积(例如voi)的cnn模块架构(定位网络)的方块图(其中voi随后通过第二cnn模块经处理用于骨盆区域内前列腺和/或其它组织的更详细分割/鉴别)。图7f-7j提供根据阐释性实施例用于处理先前经鉴别的voi用于骨盆区域内前列腺和/或其它组织的精确分割的cnn模块架构(分割网络)的方块图。图8a是根据阐释性实施例的图像之集合,其各自展示3dct图像的2d横断面图,所述3dct图像与表示对应于三种不同骨盆骨(左和右髋骨和骶骨)的经鉴别的组织体积的图形叠加。图8b是根据阐释性实施例展示3dct图像的3d视图的图像,所述3dct图像与表示对应于三种不同骨盆骨(左和右髋骨和骶骨)的经鉴别的组织体积的图形叠加。图9a是根据阐释性实施例展示3dct图像的2d横断面图的图像,所述3dct图像与表示对应于个体的骨盆骨(左和右髋骨)和前列腺的经鉴别的组织体积的图形叠加。图9b是根据阐释性实施例展示3dct图像的不同2d横断面图的图像之集合,所述3dct图像与表示对应于个体的骨盆骨、臀肌肉、直肠、前列腺和膀胱的经鉴别的组织体积的图形叠加。图10是根据阐释性实施例展示低质量3dct图像的2d横断面图的图像,所述3dct图像与表示对应于个体的骨盆骨和前列腺的经鉴别的组织体积的图形叠加。图11是根据阐释性实施例展示实例性架构的示意图,其中通过专用模块进行用于鉴别如本文所述的前列腺体积的图像分割。图12是根据阐释性实施例展示用于进行基于cnn的图像分割的模块的实例性架构的方块流程图。图13是根据阐释性实施例展示cnn的结构的方块流程图。图14是根据阐释性实施例展示进行辅助预测的cnn的结构的方块流程图。图15是根据阐释性实施例图解说明个体的膀胱与前列腺之间的串扰的示意图。图16a是根据阐释性实施例用于审查患者图像数据的图形用户界面(gui)的截屏,其展示用于选择待分析和/或审查数据的个体的窗。图16b是根据阐释性实施例用于审查患者图像数据的图形用户界面(gui)的截屏,其展示用于选择待分析和/或审查数据的个体的窗以及用于起始患者图像数据的处理和审查患者图像数据的图形控制元件。图16c是根据阐释性实施例用于审查患者图像数据的图形用户界面(gui)的截屏,其展示用于选择待分析和/或审查数据的个体的窗以及用于起始患者图像数据的处理和审查患者图像数据的图形控制元件。图17a是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与个体的spect图像和表示经鉴别的组织体积的图形叠加。图17b是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与个体的spect图像和表示经鉴别的组织体积的图形叠加。图17c是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与个体的spect图像和表示经鉴别的组织体积的图形叠加。图17d是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与个体的spect图像和表示经鉴别的组织体积的图形叠加。图17e是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与个体的spect图像和表示经鉴别的组织体积的图形叠加。图18a是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含用于切换显示可选择层的图形控制元件的窗并图解说明用户关闭spect图像层。图18b是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与表示经鉴别的组织体积的图形叠加。图18c是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与表示经鉴别的组织体积的图形叠加。图18d是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与表示经鉴别的组织体积的图形叠加。图18e是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与表示经鉴别的组织体积的图形叠加。图18f是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与表示经鉴别的组织体积的图形叠加。图19a是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含用于切换显示可选择层的图形控制元件的窗并图解说明用户分别关闭spect图像层和分割层。图19b是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与个体的spect图像叠加。图19c是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与个体的spect图像叠加。图19d是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含各自展示个体的ct图像的不同2d横断面图的图像之集合的窗,所述ct图像与个体的spect图像叠加。图20a是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含软组织的图形表示的ct图像且与个体的spect图像叠加的3d视图。图20b是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含软组织的图形表示的ct图像且与个体的spect图像叠加的3d视图。图20c是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含软组织的图形表示的ct图像且与个体的spect图像叠加的3d视图。图21a是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含骨的图形表示的ct图像且与个体的spect图像叠加的3d视图。图21b是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含骨的图形表示的ct图像且与个体的spect图像叠加的3d视图。图22a是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含骨的图形表示的ct图像且与个体的spect图像叠加的3d视图。图22b是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含骨的图形表示的ct图像且与个体的spect图像叠加的3d视图。图22c是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含骨的图形表示的ct图像且与个体的spect图像和表示经鉴别的组织体积的图形叠加的3d视图。图22d是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含骨的图形表示的ct图像且与个体的spect图像和表示经鉴别的组织体积的图形叠加的3d视图。图22e是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含骨的图形表示的ct图像且与个体的spect图像和表示经鉴别的组织体积的图形叠加的3d视图。图22f是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含骨的图形表示的ct图像且与个体的spect图像和表示经鉴别的组织体积的图形叠加的3d视图。图23a是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含骨的图形表示的ct图像且与个体的spect图像叠加的3d视图。图23b是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含骨的图形表示的ct图像且与个体的spect图像叠加的3d视图。图24是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含个体的生成报告的窗。图25是根据阐释性实施例展示与gui的用户相互作用的工作流程的方块流程图,其中用户审查图像、分割结果和吸收指标且生成报告。图26a是根据阐释性实施例的gui窗的视图的截屏,所述gui窗允许用户上传图像。图26b是根据阐释性实施例的gui窗的视图的截屏,其展示由用户上传的图像的清单。图27a是根据阐释性实施例的展示患者的清单的gui窗的视图的截屏。图27b是根据阐释性实施例的展示患者的清单的gui窗的视图的截屏。图27c是根据阐释性实施例的gui窗的视图的截屏,其展示所选患者和为用户提供审查研究数据和生成报告的选择的菜单。图28a是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含骨的图形表示的ct图像且与个体的spect图像和表示经鉴别的组织体积的图形叠加的3d视图。图28b是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示包含图像的窗,所述图像展示个体的包含骨的图形表示的ct图像且与个体的spect图像叠加的3d视图。图29a是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示用于审查测定的吸收指标的窗。图29b是根据阐释性实施例用于审查患者图像数据的gui的截屏,其展示质量控制图形挂件。图29c是根据阐释性实施例允许用户签署所生成报告的质量控制图形挂件的视图的截屏。图29d是根据阐释性实施例展示所生成报告(例如自动生成报告)的截屏。图29e是根据阐释性实施例响应未核准的吸收指标的自动化测定的用户输入显示的质量控制图形挂件的视图的截屏。图29f是根据阐释性实施例展示拒绝质量控制的图形指示的生成报告的一部分的截屏。图29g是根据阐释性实施例允许用户人工更新用于测定吸收指标的一或多个值的质量控制图形挂件的截屏。图29h是根据阐释性实施例允许用户人工更新用于测定吸收指标的一或多个值的质量控制图形挂件的截屏。图30是根据阐释性实施例展示用于进行图像分割以鉴别图像内的前列腺体积、测定吸收指标且向客户端提供结果的微服务网络架构的方块图。图31是根据阐释性实施例展示基于云的应用的微服务之间的数据流以通过进行图像分割和测定吸收指标处理研究的方块流程图。图32是根据阐释性实施例展示基于云的应用的微服务与客户端之间的通信的方块流程图。图33是根据阐释性实施例用于进行包含基于云的应用的基于云的平台用于根据本文所述系统和方法进行图像分割和计算吸收指标的实例性架构的方块图。图34是根据阐释性实施例展示用于自动鉴别3d图像内的3d目标体积和测定指示其中的放射性药品吸收的吸收指标的过程的方块图。图35a是临床不显著和临床显著的图像的群集图。图35b是基于改变根据本文所述系统和方法计算的tbr阈值测定的roc曲线。图36是某些实施例中所用的实例性云计算环境的方块图。图37是某些实施例中所用的实例性计算装置和实例性移动计算装置的方块图。图38a是常规二维基于切片的图像分析软件包中所用的gui的截屏。图38b是常规二维基于切片的图像分析软件包中所用的gui的一部分的截屏,其展示ct图像切片。图38c是常规二维基于切片的图像分析软件包中所用的gui的一部分的截屏,其展示ct图像切片。图39是根据阐释性实施例展示ai辅助的图像分析工作流程的方块流程图。图40a是根据阐释性实施例在上传spect/ct图像后指示自动化分析完成的gui窗的截屏。图40b是根据阐释性实施例的gui窗的截屏,其指示在上传spect/ct图像后自动化分析的潜在误差且需要医师审查。图40c是根据阐释性实施例指示由于不完全数据组而不能完成自动化分析的gui窗的截屏。图41是根据阐释性实施例展示患者的清单的图像分析gui窗的截屏。图42a是根据阐释性实施例用于审查患者数据的图像分析gui的截屏,其展示个体的包含骨和组织的图形表示的ct图像与spect图像数据叠加和个体的前列腺的分割叠加的2d切片图。图42b是根据阐释性实施例用于审查患者数据的gui的截屏,其展示包含组织和骨的图形表示的ct图像与spect图像数据叠加和个体的前列腺的分割叠加的3d视图。图42c是用于审查患者数据的gui的一部分的截屏,其展示某些实施例中gui内显示的似然度严重程度量表。图42d是根据阐释性实施例用于审查患者数据且允许读取器以半自动化、引导方式更新tbr计算中所用的值的gui的截屏。图42e是根据阐释性实施例用于审查患者数据的gui的截屏,其展示读取器输入后的更新评价结果以更新tbr计算中所用的值。图43a是根据阐释性实施例展示包含以完全自动化方式测定的结果的生成报告的截屏。图43b是展示包含以半自动化方式测定的结果的生成报告的截屏。图44是根据阐释性实施例展示不可评价情形的生成报告的截屏。图45a是叠加有三个tbr阈值的临床不显著和临床显著图像的群集图。图45b是基于改变根据本文所述系统和方法计算的tbr阈值测定的roc曲线,鉴别三个不同tbr阈值。图45c是展示若干患者的总格里森评分和计算的tbr值的图。图45d是展示根据tbr值分类的病例的格里森评分与若干预定阈值相比较的表。图46是展示评估来自临床试验的患者数据所花费的时间的三个独立性ai辅助的读取器的三个直方图的组。图47是展现使用本文所述图像分析方法的实施例来分析临床实验数据而获得的结果的一致性和再现性的图之集合。图48a是比较使用单个独立ai辅助的读取器与三个独立人工读取器获得的结果的roc曲线的图。图48b是展示三个独立人工读取器和三个独立ai辅助的读取器的auc值的直方图之集合。图49a展示比较第一人工读取器的结果与ai辅助的读取器的那些结果的数据。图49b展示比较第二人工读取器的结果与ai辅助的读取器的那些结果的数据。图49c展示比较第三人工读取器的结果与ai辅助的读取器的那些结果的数据。当连同图式一起时,依据下文所陈述的详细说明将更明了本发明的特征和优点,其中在通篇中相似参考字符识别相应元件。在图式中,相似数字符号通常指示相同、功能上类似和/或结构上类似的数字。具体实施方式预期本发明的系统、架构、装置、方法和工艺涵盖使用来自本文所述的实施例的信息开发的变化和更改。本文所述系统、架构、装置、方法和工艺的更改和/或修改可如本说明所涵盖来进行。在通篇本说明中,其在将物品、装置、系统和架构描述为具有、包括或包含特定组件的情况下,或在将过程和方法描述为具有、包括或包含特定步骤的情况下,另外涵盖本发明的物品、装置、系统和架构基本上由所述组件组成或由所述组件组成,并且根据本发明的工艺和方法基本上由所述处理步骤组成或由所述处理步骤组成。应理解,步骤次序或执行特定动作的次序并不重要,只要本发明保持可操作即可。此外,可同时执行两个或更多个步骤或动作。本文中提到任何公开(例如在
背景技术:
章节中提到任何公开)并非承认所述公开充当关于本文中所提供的任一权利要求的现有技术。
背景技术:
章节是出于清楚目的而提供且并不希望成为对关于任一权利要求的现有技术的说明。文献如所述以引用方式并入本文中。如果特定术语的含义存在任何差异,那么以上述定义章节中提供的含义为准。为了方便读者提供标题-标题的存在和/或放置并不打算限制本文所述的标的物的范围。如本文所用的“放射性核素”是指包含至少一种元素的放射性同位素的部分。实例性适宜放射性核素包括(但不限于)本文所述的那些放射性核素。在一些实施例中,放射性核素是用于正电子发射断层摄影术(pet)中者。在一些实施例中,放射性核素是用于单光子发射计算机断层扫描摄影术(spect)中者。在一些实施例中,放射性核素的非限制性清单包括99mtc、111in、64cu、67ga、68ga、186re、188re、153sm、177lu、67cu、123i、124i、125i、126i、131i、11c、13n、15o、18f、153sm、166ho、177lu、149pm、90y、213bi、103pd、109pd、159gd、140la、198au、199au、169yb、175yb、165dy、166dy、105rh、111ag、89zr、225ac、82rb、75br、76br、77br、80br、80mbr、82br、83br、211at和192ir。如本文所用术语“放射性药品”是指包含放射性核素的化合物。在某些实施例中,放射性药品用于诊断和/或治疗目的。在某些实施例中,放射性药品包括经一或多个放射性核素标记的小分子、经一或多个放射性核素标记的抗体和经一或多个放射性核素标记的抗体的抗原结合部分。如本文中所用,在提到“图像”时“3d”或“三维”意指传达关于三维的信息。3d图像可再现为三维中的数据集和/或可显示为二维表示或三维表示的集合。如本文中所用,“图像”(例如,个体的3d图像)包括任何视觉表示,例如照片、视频帧、流式视频以及照片、视频帧或流式视频的任何电子、数字或数学类似物。在某些实施例中,本文所述的任何设备包括用于显示图像或由处理器产生的任何其它结果的展示器。在某些实施例中,本文所述的任何方法包括显示图像或经由所述方法产生的任何其它结果的步骤。如本文所用“个体”意指人类或其它哺乳动物(例如啮齿类动物(小鼠、大鼠、仓鼠)、猪、猫、狗、马、灵长类动物、兔和诸如此类)。如本文所用的“投与”试剂意指向个体中引入物质(例如成像剂)。一般来说,可利用任何投与途径,包括(例如)非经肠(例如静脉内)、经口、局部、皮下、腹膜、动脉内、吸入、阴道、直肠、经鼻、引入脑脊髓液中或滴入身体隔室。如本文所用术语“滤波器”和“过滤”(如在“过滤功能”或“滤波器”中)是指对数据(例如图像数据,例如由cnn层计算的值)的输入阵列(例如多维阵列)的局部部分操作的功能,本文中称作“子修补程序(subpatch)”,以对于给定子修补程序计算反应值。一般来说,跨阵列以滑动窗的方式应用滤波器以计算阵列的多个反应值。具体来说,对于给定的多维阵列,阵列的子修补程序可为具有具体大小(例如具有与阵列相同的维数)的阵列的矩形区域。例如,对于6x3x3阵列,给定的3x3x3子修补程序是指阵列的相邻值(例如邻域)的给定的3x3x3组,使得在6x3x3阵列中存在五个不同3x3x3子修补程序(每一修补程序沿第一维度移位一个位置)。例如,过滤功能可针对阵列的给定子修补程序使用子修补程序的值计算反应值。可跨阵列以滑动窗的方式应用过滤功能,从而针对阵列的多个子修补程序中的每一者计算反应值。计算的反应值可存储于输出阵列中,使得维持反应值与输入阵列的子修补程序之间的位置对应关系。例如,在第一步骤,以输入阵列的角中的子修补程序开始,滤波器可计算第一反应值,并将第一反应值存储于输出阵列的对应角中。在某些实施例中,在第二步骤,然后滤波器计算第二子修补程序的第二反应值,其沿着输入阵列的具体维度移位一个位置。第二反应值可存储于输出阵列的相应位置中-也就是沿着输出阵列的相同维度移位一个位置。可沿着输入阵列的每一维度针对整个输入阵列重复以下步骤:使子修补程序的位置移位、计算反应值以及将反应值存储于输出阵列的相应位置。在某些实施例中(例如跨步过滤方法),滤波器计算反应值的子修补程序沿着给定维度一次移位一个以上位置,使得并不计算输入阵列的每一可能的子修补程序的反应值。如本文所用术语“卷积神经网络(cnn)”是指一种人工神经网络,其中至少一层进行一或多个过滤功能。如本文所用术语“卷积层”是指接收输入阵列作为输入且计算输出阵列的cnn的层,其中通过将一或多个滤波器应用于输入阵列来计算输出阵列的值。具体来说,在某些实施例中,卷积层接收具有n+1个维度的输入阵列作为输入,并产生还具有n+1个维度的输出阵列。通过cnn的过滤层操作的输入和输出阵列的前n个维在本文中称为“空间维度”。输入的第(n+1)个维度在本文中称为“输入通道”维度。输入通道维度的大小在本文中称为“输入通道的数量”。输出的第(n+1)个维度在本文中称为“输出通道”维度。输入通道维度的大小在本文中称为“输出通道的数量”。在某些实施例中,卷积层通过应用滤波器来计算反应值,所述滤波器对沿着空间维度小于输入阵列、但在整个输出通道维度上延伸的子修补程序进行操作。例如,nxmxlxk0大小的输入阵列具有三个空间维度和k0输出通道。卷积层的滤波器可对具有nfxmfxlfxk0的大小的子修补程序进行操作,其中nf≤n,mf≤m且lf≤l。通常,卷积层的滤波器对其中nf<n、mf<m和/或lf<l的大小的子修补程序进行操作。例如,在某些实施例中,nf<<n,mf<<m和/或lf<<l。因此,对于由卷积层应用的一或多个滤波器中的每一者,将由给定滤波器计算的反应值存储于相应的输出通道中。因此,接收具有n+1个维度的输入阵列的卷积层计算还具有n+1个维度的输出阵列,其中第(n+1)个维度表示输出通道对应于由卷积层应用的一或多个滤波器。以这种方式,由给定卷积层计算的输出阵列可由后续卷积层接收作为输入。如本文所用术语“大小”在提到卷积层的滤波器时是指沿着滤波器操作的子修补程序的空间维度的大小(例如将沿着输出信道维度的子修补程序大小视为输出通道的全部数量)。如本文所述术语“大小”如在“卷积层的大小”中提到卷积层时是指卷积层的滤波器的大小(例如,具有相同大小的卷积层的每一滤波器)。在某些实施例中,卷积层的滤波器具有许多经由机器学习训练过程测定的可变参数。在某些实施例中,给定滤波器的参数的数量等于给定滤波器操作的子修补程序中的值的数量。例如,在具有k0输出通道的输入阵列上操作的大小为nfxmfxlf的滤波器具有nfxmfxlfxk0个参数。在某些实施例中,滤波器以阵列形式实现,并且由滤波器针对给定子修补程序测定的反应值计算为滤波器与给定子修补程序之间的点积。如本文所用术语“完全卷积神经网络(fcnn)”是指其中cnn的每一层是卷积层的cnn。如本文所用术语“体积”如在提到cnn层的输入或输出中使用时是指接收的输入阵列或由cnn层计算的输出阵列。如本文所用术语“cnn模块”是指计算机实现的过程,其实现具体cnn以便针对给定输入(例如图像(例如2d图像;例如,3d图像))测定一或多个输出值。例如,cnn模块可接收个体的3d图像(例如ct图像;例如,mri)作为输入,并且对于图像的每一体素,测定表示体素位于对应于个体的特定器官或组织的表示的3d图像的区域内的似然度的值。cnn模块可为软件和/或硬件。例如,cnn模块可完全实现为软件,或cnn模块的某些功能可经由专用硬件(例如经由应用专用集成电路(asic))来进行。如本文所用术语“组织”是指骨(骨组织)以及软组织。本文所述的系统和方法提供个体的医学图像的自动化分析,以便自动鉴别对应于图像中表示的特定器官和/或组织的所关注区域。在某些实施例中,采用卷积神经网络(cnn)模块来准确地使图像分割。在某些实施例中,个体的图像中特定器官和/或组织的准确自动化鉴别允许测定测量特定器官中放射性药品(例如放射标记的小分子;例如,放射标记的抗体;例如,放射标记的抗体的抗原结合部分)的吸收的量化指标。在某些实施例中,本文所述的系统和方法有利于自动化鉴别对应于可存在肿瘤和/或肿瘤转移的特定器官或组织的所关注区域。选择性结合到具体肿瘤细胞表面蛋白的放射性核素标记的分子可与本文所述的使肿瘤成像的方法组合使用。例如,分子1404特异性结合到前列腺特异性膜抗原(psma),其在许多癌细胞上过表达。分子1404可经放射性核素(例如99mtc)标记用于单光子发射计算机断层扫描摄影术(spect)成像。在某些实施例中,放射性药品的吸收指标与评价个体的疾病状态和预后有关。a.鉴别前列腺体积和测定吸收指标图1展示用于自动化处理3d图像以鉴别对应于个体的前列腺的3d体积和确定一或多个指示其中的放射性药品吸收的吸收指标的过程100。参考图1中的过程100的步骤102和104:图2的各个小图图解说明展示骨和软组织的ct图像(图2a和图2b),并且突出展示骨盆骨(图2c和2d中的绿色202和蓝色206)和前列腺(图2c和2d中的紫色204)。突出展示的区域是由本文所述的系统和方法自动生成,并且鉴别骨盆骨和前列腺。图2e展示叠加在ct图像上的spect图像(亮粉色和紫色区域252、254和256)。可看出,ct图像提供详细的解剖信息,而spect图像中的解剖结构/结构信息则更为有限。因此,例如,可对ct图像进行分割,并使用ct图像的体素与spect图像的体素之间的映射来鉴别spect图像中对应于所关注的组织体积(例如前列腺、膀胱、直肠和臀肌肉)的特定体素。参考图1中的过程100的步骤106和108:鉴别ct图像中的前列腺体积的方法首先使用第一机器学习模块(例如cnn模块)来鉴别ct图像内的初始关注体积。此产生了对第二机器学习模块(例如第二cnn模块)的标准化输入,其负责鉴别前列腺体积。第二cnn模块还可鉴别其它组织体积,例如骨盆骨、臀肌肉、直肠和膀胱。第一和第二机器学习模块可组合并实现为单一模块和/或单一软件应用。第一和第二机器学习模块还可单独实现为(例如)单独的软件应用。在某些实施例中,如本文所述,由第一和第二机器学习模块实现的cnn的架构(例如,层的类型和布置)是相同的,但两个cnn之间的参数(例如,各个层中的滤波器的数量和输入大小)可不同。另外,两个cnn经训练以进行不同功能。具体来说,第一cnn经训练以在各种3d解剖图像中识别具有解剖区域(例如,骨盆区域)的图形表示。第二cnn经训练以在更标准化的输入(初始关注体积)中识别具体目标组织(例如,前列腺)。以这种方式不同地训练两个cnn产生了构成cnn的滤波器的不同权重和偏差,并允许其进行其不同功能。i.定界框生成(定位机器)图3-5提供各种ct图像的处理的实例,其首先展示初始关注体积(voi)的鉴别(小图a)且其次展示前列腺和骨盆骨的分割(前列腺体积是由中间的蓝绿体积表示)。如这些实例中所示,初始ct图像大小可大体上取决于所使用的成像系统、放射师所遵循的成像方案以及其它因素,但初始voi大小是相当标准的。例如,初始3d解剖图像的大小范围可为大到700mmx700mmx1870mm(深度x宽度x高度)(也就是全身扫描)或甚至更大到小到180mmx240mmx290mm(覆盖骨盆骨)或甚至更小。在本文所述的实例中,初始3d解剖图像的最小测试矩阵大小是256x256x76像素。本文所述的实例的定界框(例如由第一cnn鉴别)具有180-220mmx240-320mmx290-380mm的近似大小范围。本文所述的实例的定界框的矩阵大小范围为80-220x150-390x50-300像素。在所述实例中,用于训练第一cnn以检测骨盆区域定界框的3d解剖图像具有以下图像尺寸:训练图像(3d解剖图像):行数:247-512(sp1.37),大小(mm):340-700列数:319-512(sp1.37),大小(mm):430-700切片数:274-624(sp3.0),大小(mm):820-1870在所述实例中,用于验证第一cnn用于检测定界框的3d解剖图像具有以下图像尺寸,具有由第一cnn鉴别的定界框的尺寸的所得范围:验证图像(3d解剖图像):行数:256-512,大小(mm):500-600列数:256-512,大小(mm):500-600切片数:76-427,大小(mm):380-1070定界框:行数:82-222,大小(mm):180-220列数:148-386,大小(mm):240-320切片数:50-295,大小(mm):290-380以下是用于从初始3d解剖图像自动生成骨盆区域的定界框(立方形)用于随后处理以详细鉴别前列腺的三个实例性方法。在第一方法中,第一cnn接收灰度ct图像(单一输入通道)作为输入,并输出定界框的相对角的坐标。在第二方法中,经由阈值化处理灰度ct图像以产生粗略鉴别骨盆区域的阈值化图像。在此第二方法中,第一cnn接收两个输入通道-一个是灰度ct图像且另一个是阈值化图像。第二cnn输出定界框的相对角的坐标。在第三方法中,第一cnn基本上是第二cnn的粗略型式-也就是,第一cnn鉴别前列腺、骨盆骨和骶骨(和背景)。定界框是使用经鉴别的骨盆骨(例如通过绘制适合骨盆骨骼的最小框,或可能添加一定缓冲距离)生成。此处区别在于,第一cnn的输出不仅仅是立方形顶点的坐标。在这种方法中,针对图像的每一体素自动测定似然值,其给出关于体素如何分类的似然度-例如,体素是(例如)前列腺、左/右骨盆骨、骶骨或背景。在这第三种方法的一个阐释性实施例中,定位和分割网络极为类似。定位网络在极为下取样的图像中使左和右骨盆骨、骶骨和背景(共4个类别)分割。基于骨盆骨的此粗略分割,创建定界框。分割网络然后在此定界框内以更高的分辨率使骨盆骨、前列腺和背景分割。定位cnn和分割cnn具有相同的架构。不同之处在于其需要何种输入形状,其中定位网络将图像调整大小为大小(81、68、96),并且分割cnn将骨盆图像(作为从定位网络的输出)调整大小为大小(94、138、253)。卷积滤波器的数量也不同。分割网络在第一层中具有20个卷积滤波器,而定位网络仅具有8个。后续层的滤波器的大小和数量可缩放,如本文的流程图中所示。为了在定位网络之后创建定界框,所述方法发现第一分割的角并以边距在其周围绘制正方形。定位网络的输入图像较小,这是因为其已经下取样到较低分辨率,而分割处理初始分辨率中的ct图像的裁剪版本。图6a展示方法1的实例。图6b和图6c展示方法1与方法3之间的比较。图7a-e展示本文所述的第一cnn网络的实例性架构700。cnn模块架构(定位网络)用于鉴别个体的ct图像内对应于骨盆区域的所关注体积(例如voi)(其中voi随后由第二机器学习模块(例如第二cnn模块)处理用于前列腺和/或骨盆区域内的其它组织的更详细分割/鉴别)。ii.前列腺体积和额外组织体积测定(单一分割机器)图7f-j展示本文所述的第二cnn网络的实例性架构750。如上所述,第二cnn对voi进行操作以鉴别前列腺体积以及各种额外组织体积。额外组织体积可包括左/右骨盆骨、骶骨、膀胱、臀肌肉和直肠。与进行二元分类(例如,其中体素简单鉴别为前列腺或背景)相反,鉴别多种组织体积提高了分类方法的准确度。图8a展示2d中的左和右骨盆骨(蓝色,806,和黄色,802)和骶骨(红色,804),并且图8b展示3d中的左和右骨盆骨。图9a展示左和右骨盆骨(红色,902,和黄色,906)和前列腺(蓝色,904)。图9b展示左和右骨盆骨(两个较浅绿色区域,952和956)、前列腺(深绿色,958)、膀胱(带绿米色,960)、直肠(褐色,962)和臀肌肉(蓝色,964,和红色,966)的分割。图10展示低质量的ct图像,其中分割仍然起作用。iii.分割模块架构数据输入和输出图11展示实例性架构1100,其中如本文所述的图像分割是由分割服务模块1104进行,所述分割服务模块从面向客户端的模块先锋网(pioneerweb)1102接收处理图像的请求(例如,如本文所述进行分割)。图11中所示的特定实例性架构1100用于本文所述的图像分割和分析系统和方法的实施例中,具体来说基于云的软件应用,称为先锋。先锋是使用mip-1404spect/ct图像数据辅助前列腺腺体中前列腺癌的评价和表征的软件装置。所述软件使用人工智能自动将图像数据分割成不同解剖区域且然后分析所关注的体积区域(roi)。先锋从roi中提取量化数据以辅助确定临床显著前列腺癌的存在或不存在。图11中所示的架构和模块组织以及本文中关于先锋描述的其它架构和模块组织可适用于其它成像方式和/或其它放射性药品。例如,在本文的下文m部分“成像剂”中描述适用于spect成像的各种放射性药品。各种3d功能成像方式还可用于使个体中放射性药品的吸收成像,并且与3d解剖成像方式(例如但不限于ct成像)组合,并且经由本文所述的关于先锋的方法的适应型式进行分析。例如,各种核医学成像方式(例如pet成像)可用于使放射性药品的吸收成像。与spect成像一样,pet成像可与ct成像组合进行以获得包含pet图像和ct图像的图像组-ct/pet图像。因此,本文描述的关于先锋和ct/spect图像的方法还可适用于ct/pet图像。在下文m部分“成像剂”中还描述适用于pet成像的各种放射性药品。再次参见图11,如图11中所示,先锋被实现为使用亚马逊网络服务(amazonwebservices)的基于云的服务,其中使用简单通知服务(simplenotificationservice,sns)和简单队列服务(simplequeueservice,sqs)通信来处理请求。分割服务1104倾听专用sqs队列上的请求。在先锋网1102中发生的事件被公开到专用sns课题“先锋事件”1106。为了允许平行异步处理,可使用扇出模式,使得将sns消息发送到课题且然后复制并推送到多个亚马逊sqs队列1108a、1108b,其中分割服务是消费者。分割服务1104可自由请求者(例如先锋网1102)提供且链接到本地文件系统中的数据集的来源统一资源定位器(uniformresourcelocators,url)下载输入数据(例如图像数据)。在某些实施例中,输入数据包含预处理的3d解剖图像,例如ct图像和3d功能图像,例如spect扫描。与3d解剖和功能图像一起,还可包括图像元数据。在某些实施例中,ct和spect图像具有满足针对系统确立的特定要求的分辨率。例如,可使用分辨率范围在x和y方向上为1.0到2.2mm且在z(切片)方向上介于1.0与5.0mm之间的ct图像。在某些实施例中,使用在所有方向上分辨率范围为2.9到4.8mm的spect图像。一旦分割服务1104已如本文所述进行图像分割以鉴别特定ct图像中的前列腺体积和任何额外组织体积,那么分割服务1104提供鉴别特定ct图像内的前列腺体积的分割输出数据用于存储和/或进一步处理(例如在gui中显示;例如,吸收指标的计算)。在某些实施例中,向分割服务1104提交的请求包括指定分割输出数据的存储位置的目标url。因此,分割服务1104可将分割输出数据上传到请求中包括的目标url。分割输出数据可包括诸如分割掩模块的数据,其将3d解剖图像(例如ct图像)的每一体素鉴别为对应于特定组织区域或背景,如由本文描述的第二机器学习模块所测定。分割掩模块可包括或用于针对每一特定组织区域测定相应分割掩模,其鉴别分类为属于所述特定组织区域的ct图像的体素。例如,分割掩模块可以.tiled.png格式存储,并且体素经鉴别不同特定组织区域或背景的不同数字标签来标记。下文展示各种组织区域的标签的实例组,其中鉴别为背景的体素标记为0:{'前列腺':1,'左臀大肌':2,'右臀大肌':3,'直肠':4,'膀胱':5,'骶骨及尾骨':6,'左髋骨':7,'右髋骨':8}在某些实施例中,分割掩模块鉴别前列腺体积和参考体积(例如左臀肌肉)且将所有其它体素标记为背景。在某些实施例中,分割掩模元数据还包括于分割输出数据中。分割掩模元数据可用于存储关于所处理的特定图像的信息,例如每一方向上的多个体素(例如行数、列数和切片数)和其间距。在某些实施例中,分割服务1104还使用分割的结果(例如经鉴别的前列腺和参考体积和3d功能图像(例如spect图像)的体素的强度)进行量化。这种量化在本文中(例如)下文标题为“吸收指标”的分部中更详细地讨论。例如,为用于计算如本文所述个体的目标对背景比率(tbr)值,分割服务1104可与背景值一起鉴别前列腺最大强度体素。前列腺最大强度体素是鉴别为在3d功能图像的体素之集合内具有对应于经鉴别的前列腺体积的最大强度的体素。在某些实施例中,如本文所述,校正3d功能图像中对应于经鉴别的前列腺体积的体素的来自个体的膀胱的串扰(还称为泄放),并且在对膀胱串扰进行校正后,鉴别前列腺最大强度体素。用于测定tbr值的背景值是对应于3d解剖图像内的参考体积(例如对应于个体的左臀肌肉的体积)的3d功能图像的多个体素的强度的平均值。如本文所述,对应于经鉴别的参考体积的所有体素通常用于计算背景值。对应于由分割服务1104进行的量化的数据可包括于分割输出数据中。例如,量化结果可包括于如下文的.json格式实例中所示的量化结果辞典中:{“前列腺_max”:988.0,“前列腺_max_pos”:{“z”:92,“y”:74,“x”:67},“背景”:9.056859205776174,}上述实例中的量化结果辞典的关键字如下:“前列腺_max”存储前列腺最大强度体素的强度;“前列腺_max_pos”存储spect图像中前列腺最大强度体素的位置;且“背景”存储背景值。包括cnn模块组织和相互作用的实例性分割服务架构图12展示用于进行如本文所述的基于cnn的图像分割的模块的实例性架构1200。实例性架构1200包括用于鉴别初始voi的第一机器学习模块(在图12中称为“定位机器”)1204,以及用于鉴别本文所述的前列腺体积、额外组织体积和参考体积的第二机器学习模块(在图12中称为“单分割机器(基础)”),简称为“基础单分割机器”)1208。还展示第一和第二机器学习模块的输入和输出,以及若干额外模块,包括辅助机器学习模块(在图12中称为单分割机器(aux),简称为“辅助单分割机器”)1212和模块1214,所述模块用于合并第二机器学习模块(基础单分割机器)和任何辅助机器学习模块(辅助单分割机器)的输出并进行后处理。由图12中所示的模块组织生成的输出包括鉴别3d解剖图像(例如ct图像)中的各种组织体积的分割掩模块1216以及分割元数据1218。如本文所述,第一机器学习模块1204接收ct图像1202作为输入,并产生鉴别对应于个体的骨盆区域的初始voi的定界框。第二机器学习模块1208接收初始voi以及ct图像1202作为输入。第二机器学习模块1208可向初始voi添加裁剪边距(例如在初始定界框周围添加边距以扩展定界框)并提供裁剪终点以辅助机器学习模块。如本文所述,第二机器学习模块1208鉴别初始voi内的前列腺体积。第二机器学习模块1208还可鉴别对应于个体的额外组织区域(例如左臀肌肉、膀胱和左和右髋骨)的额外组织体积。如本文所述,对应于个体的左臀肌肉的组织体积可用作参考体积以(例如)计算测定个体的tbr值中的背景值。对应于个体的膀胱的组织体积可用于校正spect图像的体素的强度值的膀胱串扰,例如如本文在b部分“校正膀胱强度渗背”中所述。对应于个体的左和右髋骨的经鉴别的组织体积可用于后处理。在某些实施例中,如本文所述,通过使用除了第二机器学习模块1208之外的一或多个辅助机器学习模块1212来改良性能,所述辅助机器学习模块1212以与第二机器学习模块类似的方式进行图像分割,鉴别前列腺体积和额外组织体积(如图12中所示,1208和1212)。由辅助机器学习模块鉴别的这些辅助组织体积可经由模块1214与使用第二机器学习模块1208鉴别的基础组织体积(前列腺体积和任何额外组织体积)合并。在某些实施例中,第一和第二机器学习模块以及任何辅助机器学习模块实现为经训练的cnn模块。每一经训练的cnn模块可表示(例如经由计算机代码)为包含具有模型结构和重量的相关的训练的神经网络的目录。神经网络库(例如克拉斯(keras))可用于以这种方式表示经训练的cnn模块。表示特定cnn模块的辞典还可包括元数据,其描述在将图像作为输入馈送到特定cnn模块之前待对图像进行的任何预处理。还可包括描述神经网络模型如何构建和训练的元数据。因此,特定cnn模块可进行如下步骤,例如(1)鉴于图像文件名和图像元数据,加载和预处理图像;(2)经由相关的训练的神经网络(例如,如表示特定cnn模块的目录中所包括)来馈送预处理的图像,以获得原始预测输出(例如,对于ct图像的一或多个体素中的每一者,包括体素属于如由经训练的神经网络确定的特定类别的似然度(例如机率)的图);及(3)后处理原始预测输出。如本文所述,第一机器学习模块1204可对由其相关的经训练的神经网络产生的原始预测输出进行后处理,以确定对应于初始voi的定界框的裁剪终点。第二机器学习模块1208可对由其相关的经训练的神经网络产生的原始预测输出进行后处理,以确定标记具有如下值(例如数值)的ct图像的体素的分割掩模块:指示其对应的特定组织体积或将体素鉴别为背景,如由第二机器学习模块所测定。第一机器学习模块(图12中的定位机器)1204的cnn模块实现的实例性模型结构示于图13中。第二机器学习模块(图12中的单分割机器)1208的cnn模块实现的实例性模型结构示于图14中。实例性第一机器学习模块(定位机器)实现如本文所述,第一机器学习模块鉴别初始voi-例如,鉴别ct图像中对应于个体的骨盆区域(其包括个体的骨盆骨)的区域以及组织区域(例如前列腺、膀胱、直肠、和左和右臀肌肉)的“定界框”。向第二机器学习模块以及任何辅助机器学习模块提供定界框(例如裁剪终点)的鉴别,从而允许其将其处理限制到ct图像的小的、具体目标区域,而非必须对整个ct图像进行操作和处理。此减少了由进行计算密集精细分割的这些机器学习模块处理的数据量,由此改良其性能和效率。在根据如本文所述的方法3的第一机器学习模块的实例性实现中,图12中的定位机器1204自由其相关经训练的神经网络(cnn)(称为定位cnn)进行的ct图像的粗分割中提取定界框(以鉴别初始voi)。在某些实施例中,ct图像经预处理以通过定位cnn准备分割。配置文件可用于指定预处理步骤和参数。预处理可包括如下步骤:例如裁剪ct图像以去除一或多个对应于周围空气的区域,归一化ct图像中的体素的强度,和调整ct图像的大小(例如以产生符合定位cnn预期的固定输入大小的大小调整的ct图像)。强度归一化预处理步骤调整ct图像的体素强度,以产生ct图像的所有体素的强度的特定平均值和标准偏差。例如,ct图像的体素强度可通过减去第一固定值且然后除以第二固定值而归一化,以产生其中所有体素的平均强度是具体平均值(例如0)且所有体素的强度的标准偏差是具体标准偏差值(例如1)的ct图像。可通过对ct图像进行取样来进行调整大小的步骤。定位cnn接收预处理的ct图像作为输入并使其通过一系列层,如图13中所示。定位cnn的输出是(例如)经由将预处理的ct图像的体素分类为属于四个类别中的一者的第一分割掩模块表示的粗分割,三个类别表示特定组织区域:(i)骶骨和尾骨,(ii)左髋骨,(iii)右髋骨,和第四类别表示(iv)背景(例如其它一切)。此粗分割是自由定位cnn生成的原始预测图获得。原始预测图具有相同的形状-与作为输入接收的预处理的ct图像具有相同的体素组,但具有四个通道。每一通道对应于特定分类类别-(i)骶骨和尾骨,(ii)左髋骨,(iii)右髋骨,以及(iv)背景。每一通道表示其对应的分类类别的机率图。也就是,对于预处理的ct图像的每一体素,对应于特定分类类别的每一特定通道包括表示体素属于所述特定类别的机率(例如表示所述类别表示的组织区域内的物理体积,或表示背景)的似然值。因此,对于每一体素,每一通道中所述体素的似然值的总和为1。为了确定将每一体素分类为属于特定类别的第一分割掩模块,将预处理的ct图像的每一体素分配到具有所述体素的最大似然值(例如机率)的类别(例如组织区域或背景)。所确定的第一分割掩模块具有与预处理的ct图像相同的形状,并且用鉴别其分类属于的类别的值标记每一体素。例如,特定体素可用数值标记,例如1、2或3对应于如上文所述的类别(i)、(ii)和(iii),或如果其分类为背景体素,那么值为0。鉴别初始voi的定界框可从作为最小盒(例如矩形体积)的第一分割掩模块测定,其包含标记为属于类别(i)-(iii)的所有体素。测定鉴别定界框的坐标(例如对应于定界框的矩形体积的对角的坐标)并输出作为裁剪终点。在某些实施例(其中输入到定位cnn的预处理的ct图像是初始ct图像的调整大小的版本)中,鉴别定界框的坐标转变为初始ct图像的坐标系统且输出作为裁剪终点。实例性第二机器学习模块(分割机器)实现在图12的实例性架构中,第二机器学习模块(还称为基础单分割机器1208(图12中的单分割机器(基础))进行ct图像的高分辨率分割以鉴别对应于个体的前列腺的前列腺体积,以及对应于具体组织区域(例如左和右臀肌肉、直肠、膀胱、骶骨和尾骨和左和右髋骨)的额外组织体积。在某些实施例中,ct图像经预处理以通过第二机器学习模块准备分割。与定位机器1204一样,配置文件可用于指定预处理步骤和参数。类似于上文关于定位机器1204描述的方法,预处理步骤可包括ct图像的强度的归一化。ct图像还可使用鉴别初始voi(定界框)的裁剪终点裁剪且由定位机器1204输出,以产生减小的固定大小的预处理ct图像输入用于作为输入提供到与单分割机器1208相关联且在其中实现的经训练的神经网络(经训练的cnn)。预处理还可包括调整大小的步骤。类似于定位机器的定位cnn,单分割机器实现训练的cnn,称为分割cnn,其接收预处理的ct图像作为输入。分割cnn使预处理的ct图像通过一系列层,并输出第二原始预测图。类似于由定位cnn产生的原始预测图,第二原始预测图包括多个通道,其各自对应于输入ct图像的每一体素将分类成的不同特定类别。每一通道表示其所对应的分类类别的机率图,并且对于预处理的ct图像的每一体素,包括对应于体素属于所述类别的机率(由分割cnn确定)的似然值。如上所述,由分割cnn输出的第二原始预测图包含对应于个体的前列腺的通道。第二原始预测图可包括对应于各种其它组织区域(例如左臀肌肉、右臀肌肉、直肠、膀胱、骶骨和尾骨、左髋骨和右髋骨)的其它通道。第二原始预测图还可包括背景通道。高分辨率cnn的某些变体从网络的多个级别给出预测,从而每个类别产生多个机率图。这些多个机率图称为辅助预测。图13中所示的cnn模型结构对应于不产生辅助预测的模型结构,并且图14中所示的cnn模型结构是针对产生辅助预测的模型。在某些实施例中,尽管顶层中的多个滤波器(例如图13中的20个滤波器和图14中的28个滤波器)可变化,但后续较低层中的多个滤波器使每一层向下翻倍。在某些实施例中,分割cnn产生单一机率图,并且不产生任何辅助预测。在某些实施例中,分割cnn产生辅助预测。在某些实施例中,当分割cnn产生辅助预测图时,如第二原始预测图和每一辅助机率图中所包括的每一类别的似然值一起平均化,使得对于特定体素,测定每一类别的单一似然值。在某些实施例中,为了确定将每一体素分类为属于特定类别的第二精细分割掩模块,将预处理的ct图像的每一体素分配到最高机率值。在某些实施例中,精细分割掩模块中的许多标签减少,使得精细分割掩模块中仅包括某些组织体积(前列腺体积和参考体积(例如左臀肌肉体积))。辅助单分割机器在某些实施例中,一或多个辅助机器学习模块用于产生类似于由第二机器学习模块生成的精细分割掩模块的辅助精细分割掩模块。这些辅助精细分割掩模块鉴别与由第二机器学习模块生成的精细分割掩模块相同组的组织体积。以这种方式,第二机器学习模块生成基础精细分割掩模块,并且一或多个辅助机器学习模块各自生成辅助精细分割掩模块,由此提供用于ct图像的体素的平行组的分类。在某些实施例中,对于表示特定组织区域的每一类别,合并基础精细分割掩模块的或使用其测定的相应基础精细分割掩模(例如ct图像中经由基础单分割机器测定为对应于特定组织区域的体积)和一或多个相应的辅助精细分割掩模(例如,其各自鉴别经由辅助单分割机器测定为对应于相同特定组织区域的ct图像的体积),以产生合并的精细分割掩模。例如,对于特定类别,一或多个辅助精细分割掩模中的某些体素可鉴别(例如标记)为属于特定类别,但不属于鉴别为属于特定类别的基础精细分割掩模中的体素之集合。可将这些体素添加(例如通过将其如此标记)到鉴别为属于基础精细分割掩模中的特定类别的体素之集合以产生最终合并的精细分割掩模。例如,在图12中所示的架构中,基础单分割机器1208产生基础精细分割掩模,并且一或多个辅助单分割机器1212各自产生辅助分割掩模。通过模块1214合并由基础单分割机器1208产生的基础精细分割掩模与由辅助单分割机器1212产生的一或多个辅助精细分割掩模,以产生包含每一类别的最终精细分割掩模的最终精细分割掩模块1216。在某些实施例中,对一或多个最终精细分割掩模进行过滤,使得仅保留最大的连接部分。在某些实施例中,当进行过滤以仅保留前列腺分割掩模的最大的连接组件(例如,鉴别对应于个体的前列腺的ct图像的体积的最终精细分割掩模)时,考虑前列腺分割掩模的连接的组件的亚组。所述亚组仅包含以下组件:(i)在轴向平面(x方向)的左-右方向上具有位于髋骨的质量中心之间的质量中心,并且(ii)位于所定义的定界框内,使得仅含有左和右髋骨。iv.吸收指标参考图1中的过程100的步骤110,测定一或多个吸收指标,从其可通知或自动地呈现病况(例如前列腺癌)的诊断或分期。使用3d功能图像和3d解剖图像的voi内经鉴别的前列腺体积测定一或多个吸收指标。例如,可基于对应于3d解剖图像的voi内经鉴别的前列腺体积的3d功能图像的体素的强度值计算个体的前列腺中放射性药品的量。此可涉及计算表示由个体的前列腺占据的物理体积的3d功能图像的体素的强度的总和(例如加权总和)、平均值和/或最大值。在某些实施例中,此涉及基于对应于3d解剖图像内经鉴别的参考体积的3d功能图像的体素的强度值计算归一化值。例如,前列腺中经鉴别的强度的归一化值可使用对应于臀肌肉的一或多个体素的强度值或voi内的另一参考体积(或在某些实施例中,在3d解剖图像内的别处)来归一化。然后,可将吸收指标转化为鉴别个体是否患有前列腺癌和/或量化个体患有前列腺癌的风险、和/或对疾病进行分期(例如随时间追踪作为疾病的一部分),例如,其可由开业医师用于建议治疗选择和/或监测所投与疗法的效能。目标对背景比率在某些实施例中,测定的一或多个吸收指标包括个体的目标对背景比率(tbr)值。测定tbr值包含(i)使用对应于3d解剖图像(例如ct图像)的初始voi内经鉴别的前列腺体积的3d功能图像(例如pet或spect图像)的一或多个体素的强度值测定目标强度值,和(ii)使用对应于经鉴别的参考体积的3d功能图像的一或多个体素的强度值测定背景强度值。tbr值计算为目标强度值对背景强度值的比率。具体来说,在某些实施例中,目标强度值是对应于经鉴别的前列腺体积的3d功能图像(例如pet或spect图像)的体素的强度的最大值。如上文所述,前列腺最大强度体素对应于鉴别为具有对应于经鉴别的前列腺体积的3d功能图像的体素之集合内的最大强度的体素。然后可将目标值视为前列腺最大强度体素的强度。背景强度值可计算为对应于经鉴别的参考体积的3d功能图像的多个体素的强度的平均值。如本文所述,臀肌肉(例如左臀肌肉)或其一部分可用作鉴别的参考体积。例如,tbr值可从在向个体投与放射性药品(例如1404)后记录的个体的spect/ct图像来计算。spect图像对应于3d功能图像且ct图像对应于解剖图像。本文所述的图像分割方法可用于鉴别ct图像内的前列腺体积以及对应于个体的左臀肌肉的参考体积。前列腺分割掩模和左臀肌肉分割掩模分别可用于鉴别前列腺体积和左臀参考体积。前列腺体积分割掩模鉴别ct图像的体素,基于本文所述的机器学习分割方法将其分类为属于个体的前列腺。在某些实施例中,为了鉴别对应于ct图像内的鉴别的前列腺体积的spect图像的体素,将前列腺分割掩模的体素映射到spect图像的相应体素。由于前列腺分割掩模鉴别ct图像中的体素,故其可具有与spect图像不同的分辨率(例如由于spect和ct图像可具有不同分辨率)。内插(例如双线性内插)和/或取样可用于使前列腺分割掩模的分辨率与spect图像的分辨率匹配,使得前列腺分割掩模的每一体素映射到spect图像的特定相应体素。以这种方式,获得spect前列腺掩模,其鉴别对应于ct图像内经鉴别的前列腺体积的spect图像中的体素。可以类似方式获得spect左臀肌肉掩模,其鉴别对应于ct图像中鉴别的左臀肌肉参考体积的spect图像中的那些体素。spect左臀肌肉掩模可用于测定背景强度值。具体来说,提取spect图像中由spect左臀肌肉掩模鉴别的体素的强度并划分成四分位数。背景值计算为落在第一和第三四分位数内的提取的左臀肌肉体素强度的平均值。还可使用用于计算背景值、例如计算所有提取的左臀肌肉体素强度的总体平均值或中值的其它方法。发现上述将提取的左臀肌肉体素强度划分成四分位数的方法针对离群值比计算总体平均值更稳定且比计算中值更精确(例如,因为强度离散化且其中许多都具有相同值)。可输出测定的背景强度值并将其存储于结果辞典中例如关键字‘背景’下。可使用spect前列腺掩模计算目标强度值。前列腺最大强度体素可鉴别为spect前列腺掩模的体素且具有最大spect图像强度。目标强度值测定为前列腺最大强度体素的强度。可存储目标值强度值和前列腺最大强度体素的位置。例如,结果辞典可将目标强度值和前列腺最大强度体素位置分别存储于例如“前列腺_最大值”和“前列腺_最大值_位置”等关键字下。在某些实施例中,在测定目标强度值之前,如下文部分b中所述校正spect图像中对应于经鉴别的前列腺体积的体素的强度的膀胱“串扰”或“泄放”,使得例如所存储的最大强度是最大校正强度且前列腺最大强度体素是具有最大校正的强度的spect前列腺掩模的体素。在某些实施例中,可通过比较个体的测定的tbr值与一或多个阈值来确定个体的前列腺癌状态。具体来说,可比较测定的tbr值与特定阈值(例如截止阈值)以区分患有临床显著前列腺癌(例如分配为临床显著的状态)的患者与不患有临床显著前列腺癌(例如分配为临床不显著的状态)的那些患者。下文实例4展示用于基于从参考图像计算的tbr值来测定tbr阈值以获得所需的灵敏度和特异性的实例性方法。b.校正膀胱强度渗背图15是图解说明从个体的膀胱到前列腺的成像剂强度的串扰的示意图。在所述图中,参考1502是膀胱,1506是从膀胱泄放的串扰/强度,并且1504是前列腺。包含psma结合剂的某些成像剂在膀胱中具有高吸收,此可能影响患病组织(例如前列腺癌)的鉴别。例如,放射性核素标记的psma结合剂由膀胱的吸收可导致3d功能图像散射,并且可降低位于膀胱附近的前列腺中测量的成像剂强度的准确度。通过训练第二cnn用于详细分割个体的前列腺和膀胱,可准确地自动地说明‘泄放’或‘串扰’效应和/或由膀胱吸收成像剂引起的其它效应。此外,通过训练第二cnn用于鉴别3d解剖图像中的参考区域(例如,臀肌肉),可更准确地衡量/归一化成像剂强度测量并改良个体的前列腺中吸收测量的准确度和诊断值。i.膀胱扩张在某些实施例中,膀胱串扰校正包括其中以两次迭代扩张(例如经由形态学扩张)鉴别的膀胱体积的步骤。这种扩张可用于禁止非常接近于分割的膀胱的高强度用于在计算tbr值(例如选择为最大强度)时测定目标强度值,并且还用于稳定下文所述的膀胱阻抑方法。ii.膀胱阻抑计算在某些实施例中,使用膀胱阻抑方法来去除从膀胱到功能图像的其它区域的强度泄放。阻抑的量、也就是从功能图像的特定体素去除的强度泄放取决于所述体素到对应于具有高强度体素的膀胱的区域的核心膀胱区域的距离。在某些实施例中,如果鉴别为对应于膀胱(例如对应于3d解剖图像内经鉴别的膀胱体积;例如如经由膀胱掩模所鉴别)的功能图像的体积内的最大功能图像强度大于具体乘数值乘以经测定背景强度值,那么产生膀胱阻抑。如本文所述,可基于对应于3d解剖图像内经鉴别的参考体积(例如臀肌肉体积)的3d功能图像的体素的强度测定背景强度值。例如,如果区域内对应于经鉴别的膀胱体积的最大功能图像强度是测定的背景值的15倍(例如,膀胱对背景比率应为至少15),那么可进行膀胱阻抑。在某些实施例中,膀胱阻抑是从3d功能图像的一部分计算并应用于3d功能图像的一部分,所述3d功能图像的一部分位于在鉴别的膀胱体积周围具有具体大小的膀胱阻抑定界框内。例如,可确定膀胱阻抑定界框,其含有在特定方向上具有预定大小的边距(例如在垂直方向上为40mm)的膀胱且在其它方向上具有相同数量的体素。例如,在掩蔽对应于前列腺的3d功能图像的区域之后,可将核心膀胱区域确定为在膀胱阻抑定界框内的3d功能图像的区域,所述膀胱阻抑定界框包含具有定界框内的最大强度的特定分率内的强度的体素(例如不包括掩蔽的前列腺区域的体素)。例如,核心膀胱区域可确定为包含具有强度大于或等于膀胱阻抑定界框内的最大强度的50%的体素的区域。核心膀胱区域可包括未包括于原始膀胱掩模中的高强度区域。在某些实施例中,测定一或多个膀胱强度泄放函数以进行膀胱阻抑,并且由此校正3d功能图像的体素强度的膀胱串扰。例如,可使用膀胱阻抑定界框裁剪3d功能图像,并且在裁剪的图像区域内自体素的强度减去测定的背景强度值。然后收集样品强度以确定随着远离膀胱移动,膀胱强度(例如源自个体的膀胱内的放射性药品的吸收的强度)如何降低。在核心膀胱区域的极顶部、极前部、极右侧和极左侧开始收集样品,并且然后分别直接向上、向前、向右或向左移动,一次一个体素。如果遇到裁剪的图像区域的边缘,那么可使用外推的强度作为样品,例如从前两个或更多个样品的线性外推。强度样品提供从膀胱核心减少的强度的四个曲线(例如,采样的强度数据点的集合),模板函数可拟合到其中的每一者以确立四个膀胱强度泄放函数,所述函数对膀胱强度随着距核心区域的距离变化建模。在进一步分析(例如拟合)之前,可进行离群值去除,例如以去除离其它曲线最远的曲线。将诸如n次多项式(例如,5次多项式)的模板函数拟合到其余三个曲线中的数据点,从而产生对膀胱强度泄放随着距核心膀胱的距离变化建模的函数。此膀胱强度泄放函数描述了应所述从原始强度中减去多少以获得校正的强度,这取决于到核心膀胱区域的距离。在某些实施例中,为了降低膀胱强度泄放函数低估在膀胱方向上泄放的风险(泄放可能在不同方向之间有一定程度的变化),在拟合到取样的强度数据点之前,将距离乘以扩大因子(例如,范围为1到2;例如,1.2),使得伸展拟合膀胱强度泄放函数。通过将取样的强度数据点乘以比例因子,还可降低低估膀胱强度泄放的风险。缩放因子可为具有取决于膀胱对背景强度比率的值的可变比例因子。例如,可使用当膀胱对背景比率足够高时具有特定值且随着膀胱对背景比率降低而增加(例如线性地)的比例因子。例如,当膀胱对背景比率足够高时,样品强度可乘以1.2的因子,并且对于较低的膀胱对背景比率,从针对15的膀胱对背景比率的0线性增加。取样的强度数据点与缩放因子相乘的这种方法还改良膀胱阻抑方法的稳健性。在某些实施例中,膀胱阻抑的范围、也就是距应用其的膀胱的最远距离是基于函数的衰减率足够小的地方。如果衰减率永远不会变得足够小,那么选择距离作为强度样品矢量的长度。在某些实施例中,确保在所有距离的膀胱阻抑是非负的。一旦确定,可在3d功能图像的各种体素的位置、例如在对应于个体的前列腺内的位置的体素位置评估膀胱强度泄放函数,以测定每一特定体素位置的膀胱强度泄放值。因此,可通过从特定体素的强度中减去特定体素位置的测定的膀胱强度泄放值来校正特定体素的强度的膀胱串扰。可以这种方式校正在3d功能图像内的各个位置、例如在对应于经鉴别的前列腺体积(例如,在3d解剖图像中的鉴别)的位置的体素强度的膀胱串扰。iii.校正的前列腺最大强度和位置在某些实施例中,本文所述的膀胱阻抑方法用于校正对应于3d解剖图像内经鉴别的前列腺体积的3d功能图像的体素的强度值,并且使用校正的强度值测定诸如tbr值的吸收指标。c.可视化图像数据和计算的吸收指标图16a展示gui界面的窗,其中列出了两个个体(患者)。用户可选择所需个体来处理并观看其图像数据。图16b展示具有用于处理和操纵个体数据的图形控制元件的实例性gui,其在用户选择个体“无名氏(johndoe)”之后出现。用户点击可选择的按钮元件以完成所选个体的图像数据的处理。在图16c中,在所选个体的图像数据的处理完成之后,用户点击另一可选按钮以观看处理的图像数据和计算的吸收指标。在图17a-17e中,显示2d观看器。图17a-17e展示与spect图像以及表示鉴别的组织体积(具体地,前列腺和骨盆骨)的图形叠加的ct图像数据的2d横断面图之集合。用户可扫描横断面切片,如图中所示。使ct图像和spect图像重现为可切换打开和关闭的可选择层。还使表示鉴别的组织体积的图形重现为可选择分割层。在图18a中,用户切换关闭spect图像层的显示,使得仅展示ct图像和分割层。在图18b-18f中,用户扫描横断面。在图19a中,用户切换spect图像层的显示打开,并且分割层关闭。图19b-19d展示用户再次扫描横断面图,此次仅展示ct图像和spect图像层。图20a-20c展示用于观看ct图像且与spect图像数据叠加的可旋转且可切片的3d观看器,其中ct图像包含软组织的图形表示。图21a-21b还展示可旋转且可切片的3d观看器,此次仅显示ct图像中的骨的图形表示。图22a-22f展示用户如何使用3d观看器来检查前列腺和其它额外组织区域的图像数据和自动化鉴别。用户向下切片以聚焦在图22b中的骨盆区域且打开分割层以显示表示作为彩色区域叠加在ct图像上的鉴别的前列腺体积和骨盆骨体积的图形。用户可切片且旋转图像以观看前列腺区域(紫色体积)中的spect图像强度的亮点。图23a和23b展示观看器,但具有黑色背景以改良对比度并模拟放射师扫描。图24展示具有各种吸收指标的报告(例如,自动生成的报告)。d.用户界面、质量控制和报告在某些实施例中,本文所述的系统和方法实现为基于gui的工作流程的一部分,所述工作流程允许用户(例如开业医师(例如放射师、技师))上传患者(个体)的图像、根据本文所述的方法启动自动化分析,其中前列腺体积是在3d解剖图像中鉴别并用于使用3d功能图像的相应体素来测定吸收指标。然后,用户可观看自动化分析的结果,包括所测定的吸收指标和和从其测定的任何预后值。可经由质量控制工作流程引导用户,其中用户选择核准或未核准的自动化分析的结果,并且如果核准结果,那么为患者生成报告。质量控制工作流程还可允许用户人工调整和更新自动化分析的结果,例如经由与gui的相互作用,并基于人工更新的结果生成报告。图25展示在某些实施例中用于分析spect/ct图像的实例性工作流程2500。如图25中所示,用户可上传符合具体接受的标准格式2502、具体来说图25的实例中的dicom标准的2504spect/ct图像。图26a展示基于网的入口网站的实例性gui窗2600a,其允许用户上传2504图像。图26b展示图26a中所示的gui窗的更新视图2600b,其中已经选择若干图像用于上传,并检查是否符合dicom标准。一个图像鉴别为不符合dicom标准,并指示无法上传2602b。参见图25,在另一步骤2506中,用户可观看已经上传了图像的患者清单。图27a展示通过匿名数字标识符列出患者的gui窗的视图2700a。图27b展示图27a中所示的gui窗的另一视图2700b,其中突出展示对应于具体患者的患者清单的一行用于选择。图27c展示gui的另一视图2700c,其中在选择对应于具体患者的行后,显示针对具体患者进行的列出研究的菜单,包括允许用户审查用于研究的图像数据并生成报告的可选按钮。在某些实施例中,图像数据的用户审查以及使用图像数据进行的任何自动化分析结果是用于生成报告的先决条件。可能需要图像数据的用户审查和自动化分析来验证图像分割的准确度。例如,如图25中所示,在观看患者清单2506和选择患者之后,在下一步骤2508中,用户审查患者的图像数据和如本文所述的自动化处理的结果。具体来说,在图25中所示的工作流程2500的审查步骤2508中,用户使用基于gui的观看器检查所选择的患者的spect/ct图像数据。用户可选择观看和检查spect/ct图像数据作为2d切片之集合或3d重现。图28a展示gui观看器2800的视图,其中spect/ct图像数据显示为2d切片2802a之集合。图28b展示基于gui的观看器2800的视图,其中spect/ct图像数据显示为3d重现2802b。如图28a和图28b中所示,gui观看器2800将spect图像和ct图像显示为彼此重叠的可选择层。用户可一次选择一个层,以观看单独spect和/或ct图像,或者可选择ct层和spect层两者以观看叠加在ct图像上的spect图像。用户可调整spect图像的不透明度,例如,以强调或不再强调叠加在ct图像上的spect图像特征。用户还可观看分割层,所述分割层展示经由第二机器学习模块在ct图像内经鉴别的各种组织区域的位置,如本文所述。以这种方式,用户可例如经由ct图像层和分割层的目视检查来验证由第二机器学习模块进行的图像分割。用户还可观看和验证经由本文描述的自动化图像分析方法测定的一或多个吸收指标。例如,图29a展示gui视图2900,其中gui的小组2902显示患者的自动测定的tbr值2904。所述小组还显示测定的基于tbr的分类2906,其指示tbr值与临床显著前列腺癌相关。在某些实施例中,为了帮助测定的吸收指标的用户验证,在gui内显示图形元件以指示鉴别的前列腺体积的体素的位置。例如,如本文所述,当tbr值计算为目标强度值对背景强度值的比率时,鉴别spect图像中对应于经鉴别的前列腺体积的体素的最大强度。因此,gui可显示图形元件,所述图形元件指示对应于经鉴别的前列腺体积且与spect图像中对应于经鉴别的前列腺体积的其它体素相比具有最大强度的spect图像的体素的位置。以这种方式,向用户显示对应于前列腺体积内的位置的最大spect强度体素的位置。然后,用户可例如通过检查与ct图像相比的图形元件的关系来可视地检验这个最大spect强度体素确实位于个体的前列腺内。例如,如图29a中所示,鉴别最大spect强度体素的位置的十字形图形元件2950、2952和2954之集合叠加在图像观看器中所示的2d切片上。参见图25,在另一步骤2510中,用户可选择生成概述使用上传的spect/ct图像针对患者进行的分析的报告,并且经由质量控制工作流程被引导。例如,如图29a中所示,用户可选择(例如点击)gui的生成报告按钮2908。在用户选择生成报告按钮2908时,如图29b中所示显示质量控制图形挂件2910。质量控制图形挂件2910可引导用户检查是否满足各种验收准则。例如,质量控制图形挂件2910引导用户检查是否满足图像要求,并且如用于测定tbr值的目标值和背景值是正确的。用户可经由选择按钮2912来核准自动化分析结果,或可经由选择按钮2914来未核准的自动化分析结果。如图25中所示,在用户核准质量控制检查2512之后,自动化评价结果2514用于生成患者的报告2532。如图29c中所示,在生成报告之前,可向用户呈现挂件2916,所述挂件请求用户确认质量控制的核准。图29d展示实例性报告2900d。所述报告可包括鉴别质量控制准则2918,以及鉴别核准所述质量控制并签署报告的用户2920。如图25中所示,如果用户未核准2516吸收指标(例如tbr)的自动化测定,那么质量控制挂件可开始引导的评价2518工作流程。在引导的评价工作流程中,用户可经由与gui的人工相互作用来人工更新用于测定一或多个吸收指标的值。用户还可提供指示患者的图像不能用于准确测定吸收指标的输入,还可经由质量控制挂件接收所述输入。例如,在对应于未核准的质量控制的用户输入之后,可向用户呈现诸如图29e中所示的gui元件。图29e中所示的gui元件2900e允许用户经由选择按钮2922来选择是否不能测定患者的tbr值,或者其是否想要经由选择按钮2924人工更新用于tbr值计算的目标和背景强度值。例如,如果用户确定(例如经由图像的目视检查)图像的质量太差而不能用于准确测定tbr值,那么用户可选择gui元件2900e中的按钮2922以将所述情形鉴别为不可评价。如图25中所示,在接收情形的用户鉴别为不可评价2520之后,所述情形标记为不可评价2530,并且产生报告2532,其将质量控制鉴别为拒绝。图29f展示图形和文本2900f的实例,其可包括于所述报告中以将质量控制鉴别为被拒绝。在某些实施例中,用户可选择经由与gui的人工相互作用来更新用于测定tbr值的目标和/或背景强度值。一旦接收到指示用户希望更新目标和/或背景强度值的用户输入2522,那么引导其人工设定目标值2524和/或背景值2526。图29g展示显示给用户的人工输入图形挂件的视图2900g,以允许其设定目标和/或背景值。用户可点击按钮2926以经由与gui相互作用来人工设定目标强度值。在选择按钮2926时,向用户呈现体素选择图形元件,其允许用户选择spect图像的体素以用作计算tbr值的最大强度体素。例如,可向用户提供可移动的十字准线,其允许用户定位spect和ct图像中的位置,例如图29a中所示的十字准线。用户可移动十字准线和/或点击观看器内的位置以选择特定体素以用作最大强度体素。如图29h中所示,人工输入图形挂件的更新视图2900h可展示所选择的最大强度体素的强度值2930,其将用作用于计算更新的tbr值的更新的目标强度值。用户还可选择按钮2928以设定背景值用于计算tbr值。在选择按钮2928时,可向用户呈现体素选择元件并引导其选择鉴别(例如基于gui观看器中显示之ct图像层和/或分割层的目视检查)属于左臀肌肉的多个体素。由于用于计算tbr的背景强度值是对应于左臀肌肉内的物理位置的spect图像的多个体素的强度的平均值,因此可引导用户选择足够数量的体素以确保测定准确背景强度值。例如,如图29h中所示的人工输入图形挂件的视图2900h中所示,当用户选择体素用于测定更新背景强度值时,可显示多个样品以及背景强度的更新值2932。在某些实施例中,需要用户选择至少预定数量的样品(例如,100),并且显示的背景强度值和样品数量2932包括视觉指示(例如颜色变化)以一旦选择足够数量的样品即让用户知道。参见图25,一旦用户完成更新的目标值和/或更新的背景强度值的人工输入,那么使用更新值计算更新的tbr值并将其存储为半自动评价2528。然后可使用半自动评价结果生成报告2532。e.实例性基于云的架构和服务组织在某些实施例中,本文描述的系统和方法实现为基于云的应用。基于云的应用可使用多个模块(例如面向客户端的模块,其提供用于接收来自用户的输入的界面并向其呈现图像数据和结果)来实现各种功能。面向客户端的模块又可与其它模块(例如分割服务模块,其进行自动化图像分割以鉴别前列腺体积并计算如本文所述的吸收指标)界接。图30展示用于实现本文描述为基于云的应用的系统和方法的实例性微服务网络架构3000。如本所述,特定实例性微服务网络用于称为先锋的实例性基于云的应用中。在图30的实例性微服务网络架构3000中,微服务先锋网3016是面向客户端的模块,其服务客户端3026以向其提供界面(例如通过服务代码指令,例如javascript和html),用于与存储的图像和分析结果相互作用。先锋网3016还与其它微服务通信,如图30中所示。认证服务3014记录事件并将事件日志保存在日志文件存储数据库3012中。科尼托(cognito)3020存储并认证用户。认证服务3022追踪用户组和消费者产品注册。注册服务3024是允许用户注册以例如使用基于云的系统的前端服务。切片盒3004以标准化dicom格式存储图像文件,包括诸如ct图像的3d解剖图像和诸如spect和pet图像的3d功能图像。图像存储于图像存储数据库3002中。图像服务3006读取图像(例如dicom文件)并将图像和图像元数据存储于具体(例如,方便;例如,标准化)格式中。分割服务3010进行如本文所述的自动化图像分割和吸收指标测定。分割服务3010从数据存储数据库3008获取由图像服务3006准备的图像数据,进行图像分割和吸收指标测定,并将结果存储于数据存储数据库3008中。图30中所示的架构可用于在各种数据中心(包括可公开获得的数据中心)上实现本文所述的应用和平台。数据中心以服务器和网络的形式提供基础结构,并为例如网络连接、通信、认证、日志记录和存储提供服务。用于所述应用的架构3000使用一系列具有有限范围的功能单元,称为微服务。每一微服务处理独立的任务之集合,例如图像存储、风险指数的计算、医学图像类型的鉴别和其它任务。服务(例如微服务)可使用诸如超文本传输协议(http)的标准协议彼此通信。如图30的架构3000中所示,将应用组织到微服务的网络中允许平台的各部分个别地缩放以满足高需求并确保最小的停机时间。在某些实施例中,所述架构允许改良或替换组件而不影响应用的其它部分,或者包括所述应用程序的平台以及其它部分。图31是展示用于使用诸如图30中所示的微服务网络进行ct/spect图像的自动化分割和分析的实例性数据流3100的方框流程图。由用户上传的图像存储于切片盒3110中。用户可启动对研究(例如,患者的图像)的处理以例如经由客户端3102a经由与先锋网3104a的相互作用而启动自动化图像分割和分析。研究的处理还可自动开始(例如,在上传图像之后;例如,以规则的时间间隔)。如图31中所示,一旦启动研究处理,先锋网3104a与图像服务3106相互作用,以启动图像数据的准备(例如预处理;例如,格式化)用于自动化分割和分析。图像服务3106将预处理的图像保存于数据库s33112中。先锋网3104a通过分割服务(例如通过发送sqs消息)启动图像分割和分析。分割服务3108从s33112获取包含3d解剖图像和3d功能图像(例如ct/spect图像)的图像数据。分割服务3108进行图像分割以鉴别3d解剖图像内的组织体积(包括前列腺体积),并使用鉴别的组织体积和3d功能图像来计算如本文所述的一或多个吸收指标。自动化图像分割和吸收指标测定的结果保存于s33112中。分割服务向先锋网3104a发回回叫,指示结果是否成功获得或是否发生误差/异常。在接收到回叫时,先锋网3104a在通道pubsub3118上发布研究的更新状态。多个先锋网服务3104a和3104b可接收研究的状态更新并将状态更新通知与其相互作用的客户端3102a和3102b。图32展示微服务之间的数据流3200,其展示客户端如何请求研究状态且以与上文所述的方式类似的方式参考图31通知研究状态更新。如图32中所示,客户端3202可将研究id发送到先锋网服务实例3204,其经由pub/sub通道3212接收状态更新。完成的计算(例如如本文所述的完成的图像分割和吸收指标分析)的回叫可从任何分割服务3208进入先锋网。研究的完成的计算的状态可保存于数据库3210中,并且研究的更新状态被发送到pub/sub通道3212。所有先锋网实例(例如3204和3206)订阅状态更新且可向其相互作用的客户端3202提供状态更新(例如,研究的完成的计算的通知)。在某些实施例中,例如如上文关于图30和图31所述,本文描述的系统和方法的实现可包括图像服务模块,其进行图像数据预处理和格式化,以例如将适当格式化的图像数据提供给进行自动化图像分割和吸收指标测定的分割服务。图像服务模块可预处理来自各种方式之不同图像,包括3d功能和3d解剖图像,以标准化和格式化图像。例如,3d功能图像(例如核医学图像,例如spect图像)的预处理可包括进行基本顺应性检查和解释如以标准格式(例如dicomps3nm图像iod)所指定的体素强度值。3d功能图像的框可以对应于沿着个体的方向的特定次序(例如头到脚的次序)布置。可调整位置以表示第一体素之外角。还可提取在进一步处理中可能需要的来自3d功能图像的属性。3d解剖图像(例如ct图像)的预处理还可包括进行基本顺应性检查和解释如以标准格式(例如dicomps3nm图像iod)所指定的体素强度值。3d解剖图像的切片可以对应于沿着个体的方向的特定次序(例如头到脚的次序)布置。还可确定裁剪边界以去除3d解剖图像的一或多个区域,其对应于成像患者周围的空气。可调整位置以表示第一体素之外角。还可提取在进一步处理中可能需要的来自3d解剖图像的属性。图33展示架构3300,其说明实现本文所述的图像分割和分析方法的基于云的应用可如何与用于进行其它类型的图像分析的其它系统组合,以提供客户端/用户可用于多个图像分析应用的基于云的平台。图33中所示的架构3300包括在两个或更多个应用之间共用的微服务组3320。左图3310和右图3330展示两个应用中的微服务。微服务网络3330实现如本文所述的先锋基于云的应用的版本,并提供ct/spect图像的自动化分析、吸收指标(例如tbr)的计算以及报告的生成。左图中所示的微服务网络3310实现基于网的应用,称为absi,其分析用γ摄像机获得的全身扫描,并计算自动化骨扫描指数(bsi)。关于absi和自动化bsi测定的其它详情提供于2017年10月10日提出申请的美国专利申请案第15/794,220号中,其内容的全文以引用方式并入本文中。f.鉴别所关注的其它目标体积和计算吸收指标关于图34,本文描述的方法能用于鉴别其它目标体积,例如肺、淋巴结、骨、肝。能使用其它图像类型。各种放射性药品能用于生成3d功能图像。例如,在某些实施例中,1404是用于spect图像的成像剂,并且在某些实施例中,pyl是用于pet图像的成像剂。在一个实施例中,对个体全身的组织(例如淋巴结)进行成像以检测疾病(例如肿瘤)。使用本文所述的方法自动化测定肿瘤的总数和/或大小和/或与患病组织(例如癌症)的扩散和/或数量相关的另一指标。例如,在方法3400中,在步骤3402和3404,分别接收3d解剖图像和相应3d功能图像。第一cnn可用于有效地鉴别3406初始3d解剖图像的一或多个子区域以便第二cnn进行更详细的分割3408,并且在鉴别的一或多个子区域内分析相应3d功能图像以量化总体成像剂吸收和/或提供指示个体的疾病水平和/或程度的计算指标3410。g.实例1:利用spect/ct成像对前列腺psma吸收进行自动化检测和量化在这个实例中,99mtcmip-1404(前列腺特异性膜抗原(psma)的小分子抑制剂)用于检测前列腺癌的临床显著疾病。这个实例的目的是研发利用spect/ct图像对前列腺mip-1404吸收进行自动化检测和量化的深度学习模型。基于卷积神经网络研发利用ct图像自动化分割前列腺和骨盆骨的深度学习算法。所述算法设计成可处理高剂量和低剂量ct图像以及全身和部分身体视野,而无需人工交互。训练材料由人工针对相关解剖区域进行完整且不同分割的100个诊断性ct图像(全部为男性)组成。在包括102名高风险前列腺癌患者的mip-1404ii期研究上验证所述算法,所述患者在根治性前列腺切除术之前都经历psma成像。使用osirix医学图像观看器(匹西莫sarl(pixmeosarl))通过测量切片中放置于前列腺内部的圆形roi中的最大吸收人工量化所有验证扫描,并且视觉上确定具有最高吸收值的区域。自动算法使用其体积分割来测量前列腺中每一体素的吸收,并且暂存最大吸收。皮尔森(pearson)相关系数用于评价前列腺吸收的人工和自动化量化之间的一致性。基于训练材料的算法具有270万个参数,并且使用亚当(adam)(梯度下降的变体)经优化。在测试组中,由于过多的ct伪影、不完整的数据和/或数据格式问题,排除了34例患者(33%;34/102)的1404图像。在商品硬件上,可评估的患者(n=68)的计算时间为13秒(每个病例)。自动化最大吸收值与前列腺中人工获得的值显著相关(r=0.95,95%ci=[0.91,0.97];斜率=0.89,95%ci=[0.80,0.98];p<0.0001)。算法是完全自动化和确定的,导致100%的可重复性。这个实例展现前列腺中mip-1404吸收的客观和自动化测量的可行性。h.实例2:自动化分割和吸收指标测定的技术和临床性能实例2展示经由称为先锋的实例性基于云的应用实现的本文所述自动化图像分割和吸收指标测定方法的实施例的技术和临床性能的评估。为了确立先锋的假设生成算法,使用来自两项临床研究的mip-1404spect/ct图像数据,包括健康志愿者(1期研究:mip-1404-1301)和患有前列腺癌且具有在根治性前列腺切除术后可获得的组织病理学数据的患者(2期研究:mip-1404-201)。数据比较接收者操作特征曲线(roc)、灵敏度、特异性、由先锋产生的正负预测值与传统人工读数获得的那些的数据展示先锋可成为在mip-1404图像解释中辅助放射师的有用工具;由此促进患有前列腺癌的患者的评估。i.技术性能分别如otha-2262和otha-2263中详述,前瞻性地定义算法的分割和量化性能准则和动机的分析检验。使用总共61个1404spect/ct图像和核医学医师的护理标准读数作为用以评估分析性能的基准。所有人工读取都独立且盲目地根据技术性能接受准则完成。前列腺分割性能测试展现平均戴斯(dice)为0.77且标准偏差为0.012。单侧95%置信区间的较低终点为0.75,高于otha-2262中预定义的阈值(0.70)。背景(左臀大肌)分割性能测试展现平均戴斯为0.94且标准偏差为0.002。单侧95%置信区间的较低终点为0.94,高于otha-2262中预定义的阈值(0.80)。由自动化先锋软件预测的总共61个(6.6%)目标位置中仅四个由人类专家(核医学读取器)分类为有缺陷。结果优于otha-2263中指定的结果(10%拒绝)。ii.临床性能在临床性能的回溯性特定分析中,将14名健康志愿者(1期研究mip-1404-1301)和105名前列腺癌个体(2期研究mip-1404-201)组合在单一同类群组中用于利用先锋进行分析。排除mip-1404-201中接受前列腺癌的先前疗法的个体。还排除具有ct伪影或不能重构用于自动化分析的图像。从61名前列腺癌患者和14名正常志愿者评估总共75个图像。针对在mip-1404spect/ct成像后已诊断患有前列腺癌且已经历根治性前列腺切除术的那些的组织病理学真实标准,评估先锋的自动化评价。对于健康志愿者来说,假设其在研究时基于其正常psa和骨盆mri无前列腺癌。斯皮尔曼(spearman)的rho用于评估与格里森评分的相关性。接受者操作特征征(roc)曲线下的面积用于确定检测前列腺腺体中的前列腺癌的算法的性能。从roc曲线的最优选阈值/截止值测定灵敏度和特异性。1404图像的自动化量化评价与格里森评分相关(rho:0.54;p<0.0001)。roc曲线展现auc为0.80(95%ci:67-94)。区分临床显著前列腺癌与临床不显著的癌症或正常前列腺的基于二元tbr的结果的最优选阈值经测定为25。使用这个阈值,先锋使用来自mip-1404-1301和mip-1404-201研究的1404spect/ct图像区分临床显著前列腺癌与临床不显著的前列腺癌或正常前列腺,灵敏度为75%且特异性为80%。因此,先锋通过提供(i)跨所有诊断终点的更客观且可再现的读取性能、以及(ii)关键诊断性能参数(例如灵敏度、特异性)的点估计值来改良人工读取,该等关键诊断性能参数使用组织病理学作为真实标准展示一致地>70%。i.实例3:用于1404ct/spect图像的自动化和半自动化分析的实例性基于云的软件实例3是基于云的软件平台的实例,称为先锋,其实现本文描述的自动化图像分析方法的实施例。先锋是根据规定和数据安全性标准实现的基于云的软件平台,其中用户可上传1404spect/ct图像数据,使用二维和三维医学图像观看器观看,经由用户的普通因特网浏览器评价,并审查和导出tbr值。所述软件还提供质量控制工作流程,其中用户可利用选项拒绝和/或调整自动化分析来评价分析的质量。因此,在用户的监督下,软件采用人工智能算法以自动鉴别并分析所关注区域(roi)。先锋从roi提取图像数据以提供基于前列腺和背景中的吸收的客观分析-目标对背景(tbr)。由于前脑腺中的信号经常被来自膀胱的信号所掩盖(mip-1404在尿液中排泄),因此在软件中还建立了使膀胱和阻抑膀胱相关信号分割的能力,从而使能够更准确地测量前列腺信号。先锋的非临床性能数据包括检验和验证(v&v)评价,包括测试方法的定义。预先测定的验收准则经设计以最小程度地确保与最先进等效的性能(人工评价)。检验包括具有所有软件要求的功能测试的软件单元测试、整合测试和软件系统测试。进行验证过程以确保系统满足用户要求的说明书。v&v测试结果展示,先锋满足其预期用途、用户和软件要求。j.实例4:临床显著发现的tbr阈值的选择实例4是展示可如何测定用于对患者前列腺癌病理学划分为临床显著性和临床不显著性进行划分的tbr阈值的实例。组合spect/ct图像的两个数据集以选择适当阈值。第一数据集包含取自1404药物的i期研究的健康个体的图像。此数据集最初含有14个图像。根据本文所述的方法进行图像内前列腺的分割,并排除前列腺分割明显失败的两个图像,导致剩余12个图像。第二数据集包含源自1404药物的ii期研究的患有前列腺癌的个体的图像。基于关于来自根治性前列腺切除术的组织病理学的个体的格里森等级对图像进行划分。总格里森评分为7分或以上被认为临床显著,并且总格里森评分为6分或以下被认为临床不显著。此数据集最初含有65个图像(63临床显著,2个临床不显著),在排除图像未覆盖整个骨盆区域的一个图像和前列腺分割明显失败的一个图像后,剩余63个(61个临床显著,2个临床不显著)。总之,使用无临床显著病理学的14个图像和具有临床显著病理学的61个图像。实现本文所述的自动化图像分割和吸收指标测定方法的实施例的软件包(ctseg包装版本1.0.0rciii)用于计算图像的tbr值。图35a展示临床不显著图像(在x轴上<=6)和临床显著图像(在x轴上>=7)的群集图。阈值为25指示,对测试数据的灵敏度为0.77(杰弗里斯(jeffreys)单侧95%置信区间的较低终点为0.67),并且特异性为0.71(杰弗里斯单侧95%置信区间的较低终点为0.50)。图35b展示基于改变tbr阈值的roc曲线。tbr阈值25的点标记为3502(红色圆形标记物)。如图35a和35b中所示,阈值25提供了用于区分具有临床显著前列腺癌的患者和不具有临床显著前列腺癌的患者的值。然而,由于几乎没有与阈值非常接近的数据点,因此对于数据的小的随机变化,灵敏度和特异性的估计不稳健。为了得到更稳健的估计,r包装'形状约束的内核密度估计(scdensity)'用于估计分别临床不显著和显著的图像的logtbr值分布的平滑单峰密度。由此,针对不同tbr阈值计算灵敏度和特异性的估计值,参见表1。表1.针对不同tbr阈值的灵敏度和特异性的稳健估计值.tbr阈值特异性灵敏度220.680.79230.700.78240.730.76250.750.75260.760.73270.780.72280.790.70因此,基于这个实例中描述的分析,基于所需特异性和灵敏度选择25的tbr阈值。这些基于1期和2期数据的初步研究展示,与人工读数相比,使用自动化方法改良了mip-1404spect/ct的诊断准确度。k.实例5:利用ai分析来自3期研究的图像这个实例展现在3期多中心、多读取器、开放标签研究的背景下使用本文所述的基于人工智能(ai)的图像分析系统和方法的实施例。具体来说,这个实例描述经由研究mip-1404-3302(下文称为“3302研究”)获得的结果,所述研究的标题为“评估99mtc-mip-1404spect/ct成像和先锋作为组合产品以检测具有生检证实的低级前列腺癌(prospect-a1)的男性的临床显著前列腺癌的安全性和效能的3期研究”。在3302研究中,基于云实现本文所述的图像分析技术(称为“先锋”)用于辅助医师基于使用99mtc-mip-1404作为成像剂(用于spect成像)获得的spect/ct图像的分析和解释鉴别具有和无临床显著前列腺癌的个体。如本文所用,词组“1404spect/ct图像”和“1404spect/ct成像”分别是指使用99mtc-mip-1404作为spect的成像剂获得的spect/ct图像,或用于获得所述图像的成像过程。3302研究建立于3期研究mip-1404-3301(下文称为“3301研究”)的基础上,所述研究的标题为“评估1404spect/ct成像的安全性和效能以检测具有生检证实的低级前列腺癌的作为主动监督的候选者的男性的临床显著前列腺癌的3期研究”。3301研究还评估使用1404spect/ct成像来鉴别具有和无临床显著前列腺癌的个体。然而,在3301研究中,诊断是由医师使用常规人工读取方法(本文中进一步详细描述)、而无先锋的辅助来进行。这个实例概述经由两种方法获得的结果,并将3302研究中进行的ai辅助的诊断的结果与3301研究的常规人工读取诊断进行比较。简单地说,3301和3302研究利用从还可获得组织病理学结果的个体获得的1404spect/ct图像的共同数据集。在3301和3302研究二者中,分析每一个体的spect/ct图像以将前列腺癌状态分配为临床显著或临床不显著,也就是呈临床显著前列腺癌阳性或阴性。将从1404spect/ct图像分析获得的结果与基础真实组织病理学结果进行比较,以评定1404spect/ct成像对鉴别临床显著前列腺癌的灵敏度和特异性。在3301研究中,经由常规人工读取方法分析1404spect/ct图像,其中医师使用标准成像观看软件滚动二维ct和spect图像切片、人工定位标记物以鉴别所关注区域,并计算tbr值。相反,在3302研究中,医师使用本文所述的系统和方法的实施例进行ai辅助的审查。具体来说,在3302研究的人工智能ai辅助的方法中,使用类似于图25所示的工作流程,其中医师在先锋软件的辅助下进行其图像分析。对于每一图像,先锋软件进行前列腺的3d分割,计算初始tbr值,并且基于初始tbr值与预定义阈值的比较,以完全自动化方式将个体分配为初始前列腺癌状态。经由关于由先锋软件实现的图26a-29h的上文所述的gui的略微修改版本,向医师提供此自动化分析的结果以供审查。医师可接受完全自动化分析的结果,或拒绝所述结果并使用gui来更新目标和/或背景值,并以半自动化方式重新计算tbr。如下文详细描述,发现3302研究中使用的ai辅助方法的结果比3301研究的常规人工读取方法更准确。此外,通过减少或大体上消除对主观人类判断的依赖,3302研究的ai辅助的方法提供了高度一致且可重现的结果,其是以快速方式获得,而在大多数情况下医师仅仅核准全自动化分析。i.3301研究、研究群体、成像和人工读取方案.3301研究是一项多中心、多读取器、开放标签研究。3301研究于2015年12月开始。3301研究于2017年12月完成入选和随访。结果的分析包括于本文中。3301研究的目的是评价1404ct/spect成像以检测男性的临床显著前列腺癌,所述男性具有组织病理学发现为总格里森评分小于或等于3+4的诊断反直肠超声波(trus)引导的生检,和/或是主动监督的候选者。两个同类群组的个体入选。第一同类群组(称为“同类群组a”)是患有生检证实低等级到中等等级前列腺癌的男性(也就是,其生检分配为总格里森评分为3+3或3+4),其是主动监督的候选者,但选择进行根治性前列腺切除术(rp)。第二同类群组(称为“同类群组b”)是生检证实风险极低的前列腺癌且经排定以经历常规重新生检作为常规主动监督的一部分的患者。研究目的是评估(1)1404spect/ct成像鉴别无临床显著的前列腺癌(例如,总格里森评分小于或等于3+4)的个体的特异性,以及(2)1404spect/ct成像鉴别具有临床显著前列腺癌(例如,总格里森评分大于3+4)的个体的灵敏度。进行1404spect/ct成像,其中所有入选个体都接受单剂量的20±3mci(740±111mbq)99mtc-mip-1404注射,之后在注射后3-6小时内进行spect/ct和全身平面成像。根据标准护理程序,个体在研究药物给药后42天内经历自愿rp手术(同类群组a)或前列腺生检(同类群组b),之后对样本进行组织学评价。对前列腺标本(同类群组a)或生检(同类群组b)进行组织病理学以确立每一患者的基础真实前列腺癌状态。中心病理学家对所有临床数据(包括成像结果)都是盲化的。使用常规人工读取方法分析图像。以这种方式进行的图像分析和诊断在下文中还称为“无辅助”。使用如在大多数医院中通常发现的常规spect/ct成像工作站软件(例如在这种情形中mim软件公司的mimvista)进行无辅助分析。图38a展示如在常规无辅助工作流程中使用的mimvistagui的截屏。在无辅助工作流程中,图像读取器(例如医师或技术专家)观看呈2d切片形式的ct和spect图像。如图38a中所示,展示ct切片3802a、3802b和3802c之集合以及相应spect图像切片3804a、3804b和3804c。读取器在ct图像切片(例如3802a)中定位前列腺(例如人工)。然后,读取器人工滚动切片以鉴别spect图像中其中读取器感知最大吸收的最大吸收切片。一旦读取器鉴别这个最大吸收切片,读取器(人工)将固定大小的圆形标记物3806放置于ct图像中的相应切片中以鉴别所关注区域,如图38b中所示。然后记录所关注区域中的最大吸收(也就是,在圆圈内)(诸如mimvista的常规软件仅显示这个数字,以及诸如平均吸收的其它值)。参见图38c,读取器进行类似的程序以测定背景值。读取器在前列腺附近的闭孔肌中放置圆形标记物以鉴别所关注区域3808,并记录所述区域中的平均吸收作为背景值。然后将tbr计算为最大吸收值对背景值的比率。值得注意的是,在这种常规方法中,未进行自动化3d分割。相反,读取器逐片检查spect/ct图像的切片,以最终在ct图像切片内鉴别所关注的两个区域。另外,与使用臀肌肉作为用于测定背景值的参考组织(如使用先锋系统所做的那样)相反,将闭孔肌用作参考组织区域。在3301研究中,三名独立的盲化医师读取器分析1404spect/ct图像,以基于所测定的tbr值分配每一个体为临床显著或临床不显著的前列腺癌状态。中心组织病理学评估用作评价1404spect/ct成像的诊断性能的基础事实,基于图像的分析结果与组织病理学结果进行比较。ii.3302研究3302研究建立于3301研究的基础上,使用相同的患者群体和图像数据,但评估本文所述的ai辅助图像分析方法的性能以检测临床显著前列腺癌。具体来说,3302研究是基于从3301研究获得的数据集的分析(spect/ct图像和组织病理学)的前瞻性定义的回溯性研究。如在3301研究中和本文中所述,中心组织病理学评估用作评价性能的基础事实。3302研究的两个主要终点如下:·与根治性前列腺切除术(同类群组a)或前列腺生检(同类群组b)后的组织病理学相比,用以检测临床显著前列腺癌的作为组合产品的99mtc-mip-1404和先锋的特异性;和·与根治性前列腺切除术(同类群组a)或前列腺生检(同类群组b)后的组织病理学相比,用以检测临床显著前列腺癌的作为组合产品的99mtc-mip-1404和先锋的灵敏度。本文描述使用的具体工作流程、分析方案和将3302研究的ai辅助方法的性能与3301研究的无辅助人工方法进行比较的结果。iii.ai辅助的图像分析工作流程使用本文所述的质量控制和报告工作流程的型式(例如关于图25),在3302研究中在先锋辅助下进行图像分析。图39展示3302研究中使用的特定工作流程3900的方块流程图。如所示,技术人员进行步骤3902之集合以通过先锋软件上传和启动初始自动化分析,之后医师审查质量控制和报告工作流程3904中的分析和进行的步骤。技术人员负责上传1404spect/ct图像数据并确保满足成像要求。然后启动自动化分析,导致三个结果之一,其经由如图40a-c中所示的分析gui的窗呈现。图40a展示分析gui的窗的截屏,其用于指示自动化分析成功完成且图像准备好进行审查(例如由医师)。图40b展示分析gui的窗的截屏,其指示由于分析误差而未完成自动化分析,在这种情形中,由医师进行的人工引导用于完成分析(所述情况也被视为准备好进行审查)。图40c展示分析gui的窗的截屏,其用于指示由于数据不完整而未完成自动化分析,并且需要由技术人员校正成像问题和/或重新上传数据。为了审查图像,医师使用类似于本文所述的gui遵循图39的工作流程。图41-44展示医师用于分析图像并进行诊断的gui的各种窗的截屏。图41展示展示待由医师审查的患者清单的截屏。医师读取器选择特定患者来审查其数据并分配前列腺癌状态。在选择患者后,医师读取器审查自动化分析的结果。图42a-e展示医师用于审查通过先锋软件进行的自动化分析的结果的分析gui的视图的的截屏。3302研究中使用的先锋软件中实现的分析gui类似于本文关于图29a-h所示和所述的分析gui。图42a是医师所呈递的分析gui的视图的截屏。图42a中的截屏类似于图29a中所示的视图,并且显示具有叠加在ct图像数据上的spect图像数据和鉴别前列腺的分割掩模的2d切片。与图29a一样,图42a中的gui视图还基于tbr值与如本文所述的阈值的比较,展示自动测定的tbr值和前列腺癌状态的分配(例如分配为“临床显著”)。图42b展示图42a中所示的观看器的另一截屏,其中医师切换到spect/ct图像数据和分割掩模的3d体积视图。如图42a中所示,并且在图42c中进一步详细展示,3302研究中使用的分析gui还包括将个体的结果分配为四个类别的临床显著性的似然度严重程度等级。具体来说,除了临床显著或临床不显著的二元分类外,基于计算的tbr值三个阈值的比较,将个体的前列腺癌状态分配为四个类别中的一者。在似然度严重程度量表上,对于tbr值低于第一阈值分配“非常不可能”的状态,对于tbr值大于或等于第一阈值且低于第二阈值分配“不可能”,对于tbr值范围为第二阈值到第三阈值分配“可能”,并且对于值大于第三阈值分配“非常可能”。使用实例4中描述的roc分析,参考图35a和35b,测定用于将个体分配为似然度严重程度量表上的类别的三个tbr阈值。选择三个阈值中的每一者以产生特定灵敏度和特异性值对。下表2展示与表1中相同的数据,但扩展到展示额外tbr阈值的特异性和灵敏度数据。图45a和45b重新绘制图35a和35b中所示的数据的图,但三个tbr阈值用于将个体分配为所指示的似然度严重程度量表上的类别。如表2和图45a和45b中所示,选择阈值为12作为第一个较低的阈值以提供0.95的目标灵敏度;选择阈值为25作为第二个中间阈值以提供0.75的灵敏度和特异性(对于二者),并选择阈值为45作为第三个上限阈值以提供0.9的特异性。下表3展示这三个阈值中每一者的杰弗里斯单侧95%置信区间(ci)的较低终点。表2.不同tbr阈值的灵敏度和特异性的稳健估计值表3.三个tbr阈值的灵敏度和特异性的直接估计值以及杰弗里斯单侧95%置信区间的较低终点图45c和45d展示这些阈值以及似然度严重程度量表上的相应类别如何与用于测定阈值的i期和ii期研究群体中的个体的总格里森评分(范围为2到10)相关。图45c和45d中所示的结果展示具有所指示的四类别标记方案的似然度严重程度量表,其随后被更新为图42a和42c中所示的四个等效类别。“确定阴性”(在图42c中所示的量表中称为“非常不可能”)类别4501对应于低于12的tbr值。“可能阴性”(在图42c中所示的量表中称为“不可能”)类别4502对应于范围为12到25的tbr值。如图45a和45b中所示,基于tbr值分配为“确定阴性”4501和“可能阴性”4502类别的患者的总格里森评分通常低于7。“可能阳性”(在图42c中所示的量表中称为“可能”)类别4503对应于范围为25到45的tbr值,并且捕获7和8的总格里森评分。tbr值高于45的患者被分配为“确定阳性”(在图42c中所示的量表中称为“非常可能”)类别4504,并且通常将具有9或10的总格里森评分。如本文先前所述,给予医师核准自动化评价或不考虑完全自动化评价并更新用于计算tbr的目标(最大吸收)值和背景值的选项。图42d展示由医师用于更新用于计算tbr的目标和背景值的gui视图的截屏。还给予医师更新如图42e中所示的临床显著性分类的选项。如图39中所示,一旦医师完成了质量控制工作流程,那么生成报告3903。图43a展示经由完全自动化评价生成的报告,其中医师仅仅核准了tbr计算和临床显著性状态,如经由先锋软件的自动化分析所测定。图43b展示经由半自动化分析生成的报告,其中医师由软件辅助,但更新目标和背景值。图44展示不可评价的情形所生成的报告。iv.3302研究结果3302研究使用三个独立读取器(新读取器,不同于在3301研究中进行数据分析的读取器)以经由本文所述的工作流程分析1404spect/ct图像,并且鉴别患者是否具有临床显著前列腺癌状态。在3301研究中的464例中,13例由于缺失病理(3例)或技术问题(10例)而被排除,而在3302研究中留下总共451例用于分析。第一读取器(称为“ai读取器1”)分析451例,第二读取器(称为“ai读取器2”)分析450例,并且第三读取器(称为“ai读取器3”)分析441例。如图46中所示,本文所述的ai辅助分析方法允许医师在很大程度上基于先锋软件产生的完全自动化评价,对每一患者的前列腺癌的临床显著性和严重程度做出快速评价。图46中的直方图展示每一读取器在特定量的时间内能够处理的病例数。在3302研究中使用先锋软件实施例的读取器每个病例花费平均3.5分钟。相反,在3301研究的人工读取方法中,对于每一病例,技术人员花费大约5到10分钟人工将所关注的区域放置于前列腺和背景(闭孔器)中,如上所述,放射师随后再花费5到10分钟来评估且然后填写一份病例报告表。因此,ai辅助方法提供显著的效率改良,每个病例花费的时间从单一病例的多达20分钟减少到每个病例平均3.5分钟。此外,如图47中所示,经由3302研究的ai辅助方法进行图像分析和前列腺癌状态诊断,可获得高度一致且可重现的结果。结果的一致性是指不同读取器之间结果的类似性。再现性是指读取器内部的变异性,也就是单一读取器重复分析所产生的结果之间的类似程度。图47中的图集展现经由3302研究的ai辅助方法获得的结果的一致性和再现性。值得注意的是,如所述图的直方图4702中所示,大多数(介于69%与85%之间)的病例是以完全自动化方式处理,并且医师读取器仅仅核准由先锋系统进行的二元分类。其余的病例是以半自动化方式处理,并且医师介入以更新最大吸收目标值。读取器介入以选择目标值的新的最大强度图像体素的主要原因是由于膀胱强度溢出到spect图像中的前列腺区域中。据信者主要是由于康普顿(compton)散射引起的。先锋系统包括如本文所述的膀胱溢出校正特征。然而,在某些病例下(特别是在3301和3302研究中检查的低等级疾病群体中,其中前列腺中的吸收很小),读取器不同意(例如认为目标体素的自动化选择不准确)自动化分析,并在先锋系统的辅助下更新目标体素选择。接受完全自动化结果的高速率是显著的,这是因为完全自动化诊断消除读取器内和读取器间的可变性(允许完全一致和可再现的结果)。图右侧的散布图4710a、4710b和4710c(统称为4710)以及4720a、4720b和4720c(统称为4720)展示读取器之间的可变性。每个图比较经由特定ai辅助读取器获得的tbr结果与通过内部参考读取器(其还使用先锋软件并遵循与3302研究的三个读取器相同的方案)获得的那些结果。每个点代表一病例,其中y轴值给出由内部读取器计算的tbr值,并且x轴值给出由特定读取器计算的tbr值。散布图4700展示经由完全自动化评价进行的病例,正如完全(r=1)相关系数所证明,其消除了读取器间的可变性并允许完全一致的结果。以本文所述的半自动化方式分析的病例示于图4720中。散布图和高相关系数(优于r=0.95)展示,即使当读取器介入以更新目标体素选择时,还获得高度一致的结果。因此,即使这个目标体素的放置是主观的,先锋系统的辅助也可获得高度一致的结果。展示在3302研究中分析图像的三个ai辅助读取器的性能以及来自图48a和图48b中的3301研究的三个人工读取器的性能。图48a展示3302研究的三个ai辅助读取器和3301研究的三个人工读取器中的每一者的接收器操作特征(roc)曲线。roc曲线展示灵敏度和特异性如何随着用于将患者二元分类为呈临床显著前列腺癌阳性或阴性的tbr阈值变化而变化。如本文所述,在3301和3302研究二者中,组织病理学用作灵敏度和特异性分析的基础事实。下表4展示1404spect/ct成像结果如何与组织病理学进行比较,以确定每一特定情况下成像结果是真阳性(tp)、真阴性(tn)、伪阳性(fp)抑或弱阴性(fn)。表4.通过组织病理学对99mtc-mip-1404和先锋成像结果进行分类阳性前列腺组织病理学结果定义为在mip-1404spect/ct成像后,在电子病例报告表上报告的以下中的临床显著疾病:(i)在至少一个前列腺叶中(对于同类群组a)或(ii)在前列腺生检中(同类群组b)。对于同类群组a,临床显著疾病的中心组织病理学实验室评价得到以下发现中的至少一者的支持:·前列腺内等级大于3+4的任何格里森等级疾病;·前列腺内大于或等于10%为等级4的任何格里森等级疾病3+4;和·前列腺内的任何大于或等于阶段t3(pt3,根据前列腺癌阶段分级系统)的疾病。在同类群组b中的个体随后经历rp的情况下,然后将从前列腺样本获得的组织病理学结果用作参考标准,其中同类群组b中其余个体用于亚组分析。阳性成像评价指示根据成像读取器的决定(也就是,基于1404spect/ct成像数据的评估)存在前列腺癌。特异性定义为组织病理学定义的非临床显著前列腺癌个体(也就是,具有小于或等于3+4的总格里森评分)中真阴性(tn)的比例。特异性如下计算:特异性=tn/(fp+tn)。灵敏度是组织病理学定义的临床显著前列腺癌个体(也就是,具有大于3+4的总格里森评分)中真阳性(tp)的比例。特异性如下计算:灵敏度=tp/(tp+fn)。改变tbr阈值给出不同的tp、fp、fn和tn的比率,并因此给出不同的灵敏度和特异性。对于每个读取器,图48a中所示的roc曲线绘制在tbr阈值变化时灵敏度和特异性的此所得变化。如所述图中所示,所有ai辅助读取器曲线都位于人工读取器的曲线之上,指示ai辅助方法的性能得以改良。此外,如图48b中所示,计算每一读取器的曲线下面积(auc)值,并且与人工读取器的性能相比,ai辅助读取器的性能得以改良(对于三个人工读取器之一与三个ai辅助读取器之一之间的九个可能的比较中的五个,p值为p<0.05)。另外,对于特定的tbr阈值,将通过3302研究的ai辅助方法计算的tbr值与tbr阈值进行比较,从而在进行临床显著前列腺癌的阳性或阴性的二元分类中提供高程度的特异性。特别地,对于前列腺癌风险极低、低和中等的患者,分别发现95%、96%和96%的特异性,灵敏度为21%。图49a-c比较内部参考读取器(图47中与其比较3302研究的三个ai辅助读取器)的性能与3301研究的人工读取器中的每一者的性能。如由图47中所示的数据所展现,内部参考读取器的性能与3302研究的三个ai辅助读取器高度相关并代表3302研究的三个ai辅助读取器。图49a-c比较ai辅助内部参考读取器(在所述图中称为“先锋读取”)与3301研究的每一人工读取器之间的二元分类(基于tbr值与阈值的比较分类为呈临床显著疾病阳性或阴性)的个体roc模型。在每一情况下,与人工读取器相比,ai辅助读取器的auc指标的改良是统计学显著的(p值为0.01、0.02和0.045)。如图49a-c中所示,ai辅助内部参考读取器的auc为0.66(95%ci:0.61-0.71)。逻辑式回归指示最优选tbr阈值为14.4,灵敏度为65%(95%ci:61%-70%)且特异性为62%(95%ci:58%-67%)。自动化性能明显优于人工读取器1(auc0.63;p=0.0445)、人工读取器2(auc0.62;p=0.0201)和人工读取器3(auc0.62;p=0.0122)。另外,当使用包括基线共变量(考虑患者年龄、体重和psa评分)的多变量模型时,将3302研究的ai辅助方法的性能与3301研究的人工读取方法进行比较。对于多变量模型,ai辅助内部参考读取器展现比人工读取方法(auc0.77)更高的预测临床显著疾病的准确度(auc0.80),p=0.0014。因此,这个实例展现,医师辅助的先锋评价与1404成像数据的组合表示,相对于人工读取器,评价前列腺癌的临床显著性的特异性和灵敏度显著改良。另外,先锋辅助医师在分析成像数据时非常有效且产生高度可重现的结果,以及关于诊断的临床严重程度的有用信息。l.实例6:由第一机器学习模块(本地化机器)和第二机器学习模块(分割机器)实现的卷积神经网络的训练和验证实例6是展示根据本文所述的方面和实施例用于将ct图像分割以鉴别各种组织体积(包括前列腺体积)的cnn模块的训练和验证的实例。在这个实例中,使用具有tensorflow后端的克拉斯框架来定义和训练神经网络。i.训练和验证数据训练和验证数据包括与由放射师校正的半自动化分割耦合的ct图像,其描绘以下全部或一些身体部位:(i)前列腺;(ii)膀胱;(iii)直肠;(iv)左臀大肌;(v)右臀大肌;(vi)左臀骨;(vii)右髋骨;和(viii)骶骨和尾骨。为了训练定位cnn,使用90个高质量ct图像来对上述所有身体部分进行分割。对于训练左臀大肌的高分辨率分割的分割cnn,使用这些和10个相同类型的图像。对于训练前列腺的高分辨率分割的分割cnn,使用73个低质量图像的额外数据集,其具有前列腺和膀胱的更多解剖变化(由于疾病)。这些额外图像仅与前列腺和膀胱的分割匹配。对于这73个图像,产生直肠、左和右髋骨以及骶骨和尾骨的伪标签。伪标签是使用先前训练的网络(在100个高质量ct图像上训练的网络)生成的预测标签。在训练之前,伪标签与人工标签合并。ii.训练配置每一训练运行由命名为config.json的配置文件定义。配置文件包括以下参数:(i)使用哪个数据集;(ii)数据预处理;(iii)将数据划分为训练和验证集;(iv)模型结构;和(v)训练超参数。当训练的模型用于推断时,使用这个配置文件,以确保在训练期间在推断期间完成相同的图像预处理。iii.预处理配置文件定义在训练期间施加哪些预处理步骤。包括若干预处理步骤。进行裁剪预处理步骤以去除周围空气以进行定位训练,并裁剪出用于分割的骨盆骨、膀胱、直肠和前列腺定义的定界框。通过减去固定值且然后除以另一固定值来进行固定的强度归一化步骤,其中选择所述值使得图像中体素的强度平均具有平均强度0和标准偏差1。还通过重新取样使图像重新定形为固定大小。对于定位,对于在每一方向上具有中值大小的图像,每一方向上的分辨率降低4倍。对于高分辨率分割,对于在每一维度上具有中值大小的图像,分辨率不会改变。其它预处理步骤包括分割标签的独热编码(one-hot-encoding),分割标签如部分iv中所定义重新加权。“优化”,下文,和数据增加,如部分iv中所定义。“优化”,下文。离线进行一些预处理步骤以便加速训练,从而产生预处理的数据集。属于训练的config.json仅定义在线完成的那些预处理步骤。对于定位训练,用于离线预处理的预处理步骤存储于训练的cnn目录中的单独文件meta_data/prep_config.json中。iv.优化用于训练的损失函数是逐体素分类交叉熵,经加权使得属于一类(在真实标记中)的所有体素一起具有与属于任何其它类别的所有体素相同的权重(当标签频率等于数据集中的中值频率时)。这种方法平衡各类别,并且对于前列腺分割是重要的,这是因为前列腺与(例如)背景相比非常小。使用小批量梯度下降利用亚当优化器将损失优化约2000-3000个世代。批大小等于1。批大小为1意味着批归一化变为实例归一化(这是因为批料是仅一个样品)。为了提高性能,在推断期间还进行实例归一化。通过对于前几个世代具有非常低的学习速率(例如1×10-5)的学习速率时间表测定学习速率,然后在步骤中从高学习速率(例如1×10-2)下降。在250个世代之后,学习速率减半,然后再500个世代之后再次减半,然后再1000个世代之后再次减半。为了减少过度拟合,使用丢弃。对于不同的网络,丢弃率在0.2和0.5之间变化(但在应用于给定网络的所有地方的所述比率相同,例如,如图13和图14中所示)。适当丢弃率是基于多重训练的经验以及其如何影响训练和验证集的性能差异。使用训练图像数据通过添加随机失真来增加的训练方法,以防止神经网络集中于图像中的精细细节。以这种方式训练神经网络(例如定位cnn和分割cnn)允许其处理具有在训练数据中不存在或不常见的图像伪影的图像(例如对其进行有效定位和/或分割)。为增加训练数据而添加的随机失真包括加性或乘性噪音和添加的平滑盐噪音。这些随机失真以某些概率独立应用。这些随机失真经排定以不用于前几百个世代,以便网络首先学会处理无伪影的图像,然后逐渐增加噪音水平。强度失真仅适用于100个高质量ct图像,而不适用于73个低质量图像,这是因为其已具有伪影。定位cnn经训练以处理(例如接收作为输入)全身图像以及不同的部分身体图像。为此,使用图像的随机裁剪的增加(始终保持整个骨盆定界框)。v.计算资源定位训练是在英韦达精视gtx1050(nvidiageforcegtx1050)上完成,其中训练需要几个小时。高分辨率分割训练是在英韦达精视gtx1080ti上完成,其中训练需要2-3天。vi.模型选择为了优化神经网络结构并选择超参数用于训练,必须具有测量性能的指标。评估训练进展的主要指标是索伦森-戴斯(-dice)评分(以下称为“戴斯评分”):加权评分(上文部分iv.“优化”中所述的加权)或个体身体部分(前列腺或左臀大肌)的评分。当在多个图像上增加结果时,最常使用评估的戴斯评分的平均值(例如作为指标)。在某些情况下,使用具有低于某一水平的戴斯评分的图像的频率。对于每一定位训练运行,选择具有训练图像的最优选平均加权戴斯评分的模型。对于用于训练分割神经网络以分割前列腺的分割训练,前列腺的戴斯评分用作选择的基础。对于用于训练分割神经网络以分割左臀大肌的分割训练,左臀大肌的戴斯评分是选择的基础。对于具有辅助预测的分割训练,戴斯评分是基于来自主输出的预测-也就是在无辅助预测时还存在的输出。当训练定位cnn时,90个ct图像中的30%被保留用于验证,使得可使用未经训练的图像来评估定位cnn的性能。为了训练分割cnn用于高分辨率前列腺分割,留出23个低质量ct图像用于验证,使得仅50个低质量图像用于训练(导致总共150个ct图像用于训练)。当在不同定位训练之间进行选择时,使用对应于裁剪中的精密度的指标。基于若干指标/方面评估裁剪精密度。具体来说,一个指标是90个训练和验证图像的尽可能少的图像应需要0.1以上的裁剪边距来涵盖整个骨盆骨。另一指标是到定界框壁的距离误差应尽可能小(通过观看误差框图来评估)。另一指标是在102个低质量ct图像(无可用的基础真实分割)上,粗分割与最终定界框重叠的其2d投影应在分割与解剖之间展示良好一致性,尤其是覆盖适当的区域。当在不同的高分辨率分割训练之间进行选择时,考虑以下指标/方面:(i)训练和验证数据的戴斯评分;(ii)精密度和召回前列腺的训练和验证数据;(iii)基础真实膀胱与预测前列腺之间的重叠;和(iv)ct图像观看器中叠加在ct图像上的分割的实例,其中可在矢状、轴向和冠状平面中滚动切片。因此,这个实例提供可用于训练本文所述定位机器学习模块(第一机器学习模块)和分割机器学习模块(第二机器学习模块和任何辅助分割机器学习模块)中所用的神经网络模型的方法的实例。m.成像剂在某些实施例中,3d功能图像是使用包含放射性药品的成像剂的核医学图像。核医学图像是在向患者投与放射性药品后获得,并提供关于患者中放射性药品的分布的信息。放射性药品是包含放射性核素的化合物。核医学图像(例如pet扫描;例如,spect扫描;例如,全身扫描;例如复合pet-ct图像;例如,复合spect-ct图像)检测从放射性药品的放射性核素发射的辐射以形成图像。特定放射性药品在患者内的分布可通过生物机制(例如血流或灌注)以及通过特异性酶促或受体结合相互作用来测定。不同的放射性药品可经设计以利用不同的生物学机制和/或特定特异性酶促或受体结合相互作用,并且因此,当投与患者时,在患者内的特定类型的组织和/或区域内选择性浓缩。从具有较高浓度的放射性药品的患者内的区域所发射的辐射的量大于其它区域,使得这些区域在核医学图像中看起来更亮。因此,核医学图像中的强度变化可用于映射放射性药品在患者内的分布。放射性药品在患者内的这种映射分布可用于(例如)推断在患者身体的各个区域内癌组织的存在。例如,在投与患者时,锝99m亚甲基二膦酸酯(99mtcmdp)选择性地在患者的骨骼区域内、特别是在与恶性骨病灶相关的异常成骨的位点积累。放射性药品在这些位点的选择性浓缩产生可鉴别的热点-核医学图像中高强度的局部区域。因此,可通过鉴别患者的全身扫描内的所述热点来推断与转移性前列腺癌相关的恶性骨病灶的存在。与患者总体存活率相关的风险指数和指示疾病状态、进展、治疗效能和诸如此类的其它预后指标可基于在向患者投与99mtcmdp后获得的全身扫描中的强度变化的自动化分析来计算。在某些实施例中,其它放射性药品还可以类似于99mtcmdp的方式使用。在某些实施例中,所使用的特定放射性药品取决于所使用的特定核医学成像方式。例如,18f氟化钠(naf)还在骨病灶中积累,类似于99mtcmdp,但可与pet成像一起使用。在某些实施例中,pet成像还可利用维生素胆碱的放射性形式,其容易被前列腺癌细胞吸收。在某些实施例中,可使用选择性结合到所关注的特定蛋白质或受体(特定来说在癌组织中表达增加的那些)的放射性药品。所关注的所述蛋白质或受体包括(但不限于)肿瘤抗原,例如cea,其在结肠直肠癌中表达;her2/neu,其在多种癌症中表达;brca1和brca2,其在乳癌和卵巢癌中表达;和trp-1和-2,其在黑色素瘤中表达。例如,人类前列腺特异性膜抗原(psma)在前列腺癌(包括转移疾病)中上调。psma由几乎所有前列腺癌表达,并且其表达在分化不良、转移和激素抵抗性癌中进一步增加。因此,对应于经一或多种放射性核素标记的psma结合剂(例如对psma具有高亲和力的化合物)的放射性药品可用于获得患者的核医学图像,根据其可评价患者的各种区域(例如包括但不限于骨骼区域)内的前列腺癌的状况和/或状态。在某些实施例中,当疾病处于局部状态时,使用psma结合剂获得的核医学图像用于鉴别前列腺内癌组织的存在。在某些实施例中,使用包含psma结合剂的放射性药品获得的核医学图像用于鉴别在不仅包括前列腺且还包括其它器官和组织区域(例如肺、淋巴结和骨)的各种区域中癌组织的存在,当疾病是转移性时此是相关的。具体来说,在投与患者时,放射性核素标记的psma结合剂基于其对psma的亲和力在癌组织中选择性积累。以与上述关于99mtcmdp的方式类似的方式,放射性核素标记的psma结合剂在患者内的特定位点的选择性浓缩在核医学图像中产生可检测的热点。随着psma结合剂在体内表达psma的各种癌组织和区域内浓缩,可检测并评估患者的前列腺内的局部癌症和/或患者身体各个区域中的转移癌症。如以下中所述,与患者总体存活率相关的风险指数和指示疾病状态、进展、治疗效能和诸如此类的其它预后指标可基于在向患者投与psma结合剂放射性药品后获得的核医学图像中的强度变化的自动化分析来计算。各种放射性核素标记的psma结合剂可用作核医学成像的放射性药品成像剂以检测和评估前列腺癌。在某些实施例中,所用的特定放射性核素标记的psma结合剂取决于诸如特定成像方式(例如pet;例如,spect)和患者的待成像的特定区域(例如器官)的因素。例如,某些放射性核素标记的psma结合剂适用于pet成像,而其它适用于spect成像。例如,某些放射性核素标记的psma结合剂有利于使患者的前列腺成像,并且主要用于疾病定位时,而其它有利于在整个患者身体中的器官和区域成像,并且可用于评估转移性前列腺癌。各种psma结合剂和其放射性核素标记的型式描述于美国专利第8,778,305号、第8,211,401号和第8,962,799号中,其各自全文以引用方式并入本文中。i.pet成像放射性核素标记的psma结合剂在某些实施例中,放射性核素标记的psma结合剂是适用于pet成像的放射性核素标记的psma结合剂。在某些实施例中,放射性核素标记的psma结合剂包含[18f]dcfpyl(还称为pyltm;还称为dcfpyl-18f):或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含[18f]dcfbc:或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含68ga-psma-hbed-cc(还称为68ga-psma-11):或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含psma-617:或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含68ga-psma-617(其是经68ga标记的psma-617)或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含177lu-psma-617(其是经177lu标记的psma-617)或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含psma-i&t:或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含68ga-psma-i&t(其是经68ga标记的psma-i&t)或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含psma-1007:或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含18f-psma-1007(其是经18f标记的psma-1007)或其医药上可接受的盐。ii.spect成像放射性核素标记的psma结合剂在某些实施例中,放射性核素标记的psma结合剂是适于spect成像的放射性核素标记的psma结合剂。在某些实施例中,放射性核素标记的psma结合剂包含1404(还称为mip-1404):或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含1405(还称为mip-1405):或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含1427(还称为mip-1427):或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含1428(还称为mip-1428):或其医药上可接受的盐。在某些实施例中,通过将放射性核素与金属的放射性同位素[例如锝(tc)的放射性同位素(例如锝-99m(99mtc));例如铼(re)的放射性同位素(例如铼-188(188re);例如铼-186(186re));例如钇(y)的放射性同位素(例如90y);例如镏(lu)的放射性同位素(例如177lu);例如镓(ga)的放射性同位素(例如68ga;例如,67ga);例如铟的放射性同位素(例如111in);例如铜(cu)的放射性同位素(例如67cu)]螯合用放射性核素标记psma结合剂。在某些实施例中,1404经放射性核素标记(例如与金属的放射性同位素螯合)。在某些实施例中,放射性核素标记的psma结合剂包含99mtc-mip-1404,其是经99mtc标记(例如与其螯合)的1404:或其医药上可接受的盐。在某些实施例中,1404可与其它金属放射性同位素[例如铼(re)的放射性同位素(例如铼-188(188re);例如铼-186(186re));例如钇(y)的放射性同位素(例如90y);例如镏(lu)的放射性同位素(例如177lu);例如镓(ga)的放射性同位素(例如68ga;例如67ga);例如铟的放射性同位素(例如111in);例如铜(cu)的放射性同位素(例如67cu)]螯合,以形成具有类似于上文针对99mtc-mip-1404所示的结构的结构的化合物,其中用其它金属放射性同位素取代99mtc。在某些实施例中,1405经放射性核素标记(例如与金属的放射性同位素螯合)。在某些实施例中,放射性核素标记的psma结合剂包含99mtc-mip-1405,其是经99mtc标记(例如与其螯合)的1405:或其医药上可接受的盐。在某些实施例中,1405可与其它金属放射性同位素[例如铼(re)的放射性同位素(例如铼-188(188re);例如铼-186(186re));例如钇(y)的放射性同位素(例如90y);例如镏(lu)的放射性同位素(例如177lu);例如镓(ga)的放射性同位素(例如68ga;例如67ga);例如铟的放射性同位素(例如111in);例如铜(cu)的放射性同位素(例如67cu)]螯合,以形成具有类似于上文针对99mtc-mip-1405所示的结构的结构的化合物,其中用其它金属放射性同位素取代99mtc。在某些实施例中,1427经金属的放射性同位素标记(例如与其螯合),以形成根据下式的化合物:或其医药上可接受的盐,其中m是金属放射性同位素[例如锝(tc)的放射性同位素(例如锝-99m(99mtc));例如铼(re)的放射性同位素(例如铼-188(188re);例如铼-186(186re));例如钇(y)的放射性同位素(例如90y);例如镏(lu)的放射性同位素(例如177lu);例如镓(ga)的放射性同位素(例如68ga;例如,67ga);例如铟的放射性同位素(例如111in);例如铜(cu)的放射性同位素(例如67cu)],用其标记1427。在某些实施例中,1428经金属的放射性同位素标记(例如与其螯合),以形成根据下式的化合物:或其医药上可接受的盐,其中m是金属放射性同位素[例如锝(tc)的放射性同位素(例如锝-99m(99mtc));例如铼(re)的放射性同位素(例如铼-188(188re);例如铼-186(186re));例如钇(y)的放射性同位素(例如90y);例如镏(lu)的放射性同位素(例如177lu);例如镓(ga)的放射性同位素(例如68ga;例如,67ga);例如铟的放射性同位素(例如111in);例如铜(cu)的放射性同位素(例如67cu)],用其标记1428。在某些实施例中,放射性核素标记的psma结合剂包含psmai&s:或其医药上可接受的盐。在某些实施例中,放射性核素标记的psma结合剂包含99mtc-psmai&s(其是经99mtc标记的psmai&s)或其医药上可接受的盐。n.计算机系统和网络架构如图36中所示,展示且描述用于提供本文所述系统、方法和架构的网络环境3600的实现。简要概括来说,现在参考图36,展示且描述实例性云计算环境3600的框图。云计算环境3600可包括一或多个资源提供者3602a、3602b、3602c(统称为3602)。每一资源提供者3602可包括计算资源。在一些实施方案中,计算资源可包括用于处理数据的任何硬件和/或软件。例如,计算资源可包括能够执行算法、计算机程序和/或计算机应用程序的硬件和/或软件。在一些实施方案中,实例性计算资源可包括具有存储和检索能力的应用程序服务器和/或数据库。每一资源提供者3602可连接到云计算环境3600中的任何其它资源提供者3602。在一些实施方案中,资源提供者3602可经由计算机网络3608而连接。每一资源提供者3602可经由计算机网络3608连接到一或多个计算装置3604a、3604b、3604c(统称为3604)。云计算环境3600可包括资源管理者3606。资源管理者3606可经由计算机网络3602连接到资源提供者3604和计算装置3608。在一些实施方案中,资源管理者3606可促进计算资源由一或多个资源提供者3602到一或多个计算装置3604的配设。资源管理者3606可从特定计算装置3604接收对计算资源的请求。资源管理者3606可鉴别能够提供由计算装置3602请求的计算资源的一或多个资源提供者3604。资源管理者3606可选择用以提供计算资源的资源提供者3602。资源管理者3606可促进资源提供者3602与特定计算装置3604之间的连接。在一些实施方案中,资源管理者3606可确立特定资源提供者3602与特定计算装置3604之间的连接。在一些实施方案中,资源管理者3606可以所请求计算资源将特定计算装置3604重新导向到特定资源提供者3602。图37展示可用于实现本发明中所述的技术的计算装置3700和移动计算装置3750的实例。计算装置3700打算表示各种形式的数字计算机,例如膝上型计算机、桌上型计算机、工作站、个人数字助理、服务器、刀片式服务器、大型计算机和其它适当计算机。移动计算装置3750打算表示各种形式的移动装置,例如个人数字助理、蜂窝式电话、智能电话和其它类似计算装置。此处展示的组件、其联系和关系和其功能意味着仅为实例且并不意味着具限制性。计算装置3700包括处理器3702、存储器3704、存储装置3706、连接到存储器3708和多个高速扩展端口3704的高速界面3710以及连接到低速扩展端口3712和存储装置3714的低速界面3706。处理器3702、存储器3704、存储装置3706、高速界面3708、高速扩展端口3710和低速界面3712中的每一者使用各种总线互连且可安装于共同母板上或以其它方式适当地安装。处理器3702可处理供在计算装置3700内执行的指令,包括存储于存储器3704中或存储装置3706上以在外部输入/输出装置(例如耦合到高速界面3708的展示器3716)上显示用于gui的图形信息的指令。在其它实施方案中,多个处理器和/或多个总线可适当地连同多个存储器和若干类型的存储器一起使用。此外,可连接多个计算装置,其中每一装置提供必要操作的若干部分(例如,作为服务器库、刀片式服务器组或多处理器系统)。因此,如本文所用的术语,如果多个功能描述为由“处理器”进行,那么此涵盖其中多个功能由任一数量的计算装置(一或多个)的任何数量的处理器(一或多个)进行的实施例。此外,如果功能描述为由“处理器”进行,那么此涵盖其中功能由任一数量的计算装置(一或多个)(例如在分布的计算系统中)的任何数量的处理器(一或多个)进行的实施例。存储器3704将信息存储于计算装置3700内。在一些实施方案中,存储器3704是一或多个易失性存储器单元。在一些实施方案中,存储器3704是一或多个非易失性存储器单元。存储器3704还可为另一形式的计算机可读媒体,例如磁盘或光盘。存储装置3706能够为计算装置3700提供大容量存储。在一些实施方案中,存储装置3706可为或含有计算机可读媒体,例如软盘装置、硬盘装置、光盘装置或磁带装置、快闪存储器或其它类似固态存储器装置或装置阵列,包括存储区网络或其它配置中的装置。指令可存储于信息载体中。指令在由一或多个处理装置(例如,处理器3702)执行时进行一或多种方法,例如上文所述的那些方法。指令还可由一或多个存储装置(例如计算机或机器可读媒体(例如,存储器3704、存储装置3706或处理器3702上的存储器))存储。高速界面3708管理计算装置3700的带宽密集型操作,而低速界面3712管理较低带宽密集型操作。此功能分配仅是实例的。在一些实施方案中,高速界面3708耦合到存储器3704、展示器3716(例如,经由图形处理器或加速器)且耦合到可接受各种扩展卡(未展示)的高速扩展端口3710。在实施方案中,低速界面3712耦合到存储装置3706和低速扩展端口3714。可包括各种通信端口(例如,usb、以太网(ethernet)、无线以太网)的低速扩展端口3714可(例如)经由网络适配器耦合到一或多个输入/输出装置,例如键盘、指向装置、扫描仪或网络连接装置(例如交换机或路由器)。如图中所示,可以若干种不同形式来实现计算装置3700。例如,可将其实现为标准服务器3720或在此类服务器的组中多次实现。另外,其可在个人计算机(例如膝上型计算机3722)中实现。其还可实现为机架式服务器系统3724的一部分。或者,来自计算装置3700的组件可与移动装置(未展示)(例如移动计算装置3750)中的其它组件组合。所述装置中的每一者可含有计算装置3700和移动计算装置3750中的一或多者,并且整个系统可由彼此通信的多个计算装置构成。除其它组件外,移动计算装置3750还包括处理器3752、存储器3764、输入/输出装置(例如展示器3754)、通信界面3766和收发器3768。移动计算装置3750还可提供有存储装置(例如微型驱动器或其它装置)以提供额外存储。处理器3752、存储器3764、展示器3754、通信界面3766和收发器3768中的每一者使用各种总线而互连,并且若干组件可安装于共同母板上或如果适当以其它方式安装。处理器3752可执行移动计算装置3750内的指令,包括存储于存储器3764中的指令。处理器3752可实现为包括单独和多个模拟和数字处理器的芯片的芯片集。例如,处理器3752可提供移动计算装置3750的其它组件的协调,例如用户界面的控制、由移动计算装置3750运行的应用和由移动计算装置3750进行的无线通信。处理器3752可经由耦合到展示器3754的控制界面3758和展示界面3756与用户通信。例如,展示器3754可为tft(薄膜晶体管液晶展示器)展示器或oled(有机发光二极管)展示器或其它适当展示技术。展示界面3756可包含用于驱动展示器3754以向用户呈现图形和其它信息的适当电路。控制界面3758可从用户接收命令并转换其以供提交到处理器3752。另外,外部界面3762可提供与处理器3752的通信,以实现移动计算装置3750与其它装置的近区通信。例如,外部界面3762可在一些实施方案中提供有线通信或在其它实施方案中提供无线通信,并且还可使用多个界面。存储器3764将信息存储于移动计算装置3750内。存储器3764可实现为一或多个计算机可读媒体、一或多个易失性存储器单元或者一或多个非易失性存储器单元中的一或多者。扩展存储器3774还可经由扩展界面3772提供并连接到移动计算装置3750,扩展界面可包括(例如)simm(单列直插式存储器模块)卡界面。扩展存储器3774可为移动计算装置3750提供额外存储空间或还可存储用于移动计算装置3750的应用程序或其它信息。具体来说,扩展存储器3774可包括用以进行或补充上述过程的指令,并且还可包括安全信息。因此,例如,扩充存储器3774可提供为用于移动计算装置3750的安全模块且可以准许移动计算装置3750的安全使用的指令进行编程。另外,安全应用程序可连同额外信息一起经由simm卡而提供,例如以非黑客方式将鉴别信息放置于simm卡上。例如,存储器可包括快闪存储器和/或nvram存储器(非易失性随机存取存储器),如下文所论述。在一些实施方案中,指令存储于信息载体中。所述指令在由一或多个处理装置(例如,处理器3752)执行时进行一或多种方法,例如上文所述的那些方法。指令还可由一或多个存储装置(例如一或多个计算机或机器可读媒体(例如,存储器3764、扩展存储器3774或处理器3752上的存储器))存储。在一些实施方案中,指令可(例如)在收发器3768或外部界面3762上以所传播信号形式接收。移动计算装置3750可经由通信界面3766无线地通信,所述通信界面如果需要可包括数字信号处理电路。通信界面3766可提供在各种模式或协议下的通信,例如gsm语音呼叫(全球移动通信系统)、sms(短消息服务)、ems(增强型通信服务)或mms通信(多媒体通信服务)、cdma(码分多址)、tdma(时分多址)、pdc(个人数字蜂窝系统)、wcdma(宽带码分多址)、cdma2000或gprs(通用包无线电服务)以及其它模式或协议。例如,此通信可使用射频经由收发器3768而发生。另外,短程通信可(例如)使用wi-fitm或其它此类收发器(未展示)而发生。另外,gps(全球定位系统)接收器模块3770可将额外导航和位置相关无线数据提供到移动计算装置3750,在适当情况下,所述移动计算装置可由移动计算装置3750上运行的应用程序使用。移动计算装置3750还可使用音频编解码器3760以音频方式通信,所述音频编解码器可从用户接收所说信息并将其转换为可用数字信息。音频编解码器3760同样地可(例如)在移动计算装置3750的电话听筒中(例如)经由扬声器向用户产生可听声音。这种声音可包括来自语音电话呼叫的声音,可包括所记录声音(例如,语音消息、音乐文件等)且还可包括由在移动计算装置3750上操作的应用程序产生的声音。如图中所示,可以若干种不同形式来实现移动计算装置3750。例如,其可实现为蜂窝式电话3780。其还可实现为智能电话3782、个人数字助理或其它类似移动装置的部分。本文所述的系统和技术的各种实施方案可以数字电子电路、集成电路、专门设计的asic(专用集成电路)、计算机硬件、固件、软件和/或其组合而实现。这些各种实施方案可包括可在可编程系统上执行和/或解译的一或多个计算机程序中的实施方案,所述可编程系统包括可为专用或通用目的的至少一个可编程处理器(其经耦合以从存储系统接收数据和指令且将数据和指令传输到存储系统)、至少一个输入装置和至少一个输出装置。这些计算机程序(还称为程序、软件、软件应用程序或代码)包括用于可编程处理器的机器指令且可以高级程序和/或面向对象的编程语言和/或以汇编/机器语言实现。如本文中所用术语机器可读媒体和计算机可读媒体是指用于将机器指令和/或数据提供到可编程处理器的任何计算机程序产品、设备和/或装置(例如,磁盘、光盘、存储器、可编程逻辑装置(pld)),包括接收机器指令作为机器可读信号的机器可读媒体。术语机器可读信号是指用于将机器指令和/或数据提供到可编程处理器的任何信号。为提供与用户的相互作用,本文所述系统和技术可在具有用于向用户展示信息的展示装置(例如,crt(阴极射线管)或lcd(液晶展示器)监视器)和用户可通过其将输入提供到计算机的键盘和指向装置(例如,鼠标或轨迹球)的计算机上实现。还可使用其它种类的装置来提供与用户的相互作用;例如,提供给用户的反馈可为任何形式的感观反馈(例如,视觉反馈、听觉反馈或触觉反馈);且来自用户的输入可以任何形式(包括声音、话音或触觉输入)而接收。本文所述的系统和技术可在计算系统中实现,所述计算系统包括后端组件(例如,作为数据服务器);或包括中间件组件(例如,应用程序服务器);或包括前端组件(例如,具有用户可经由其来与本文所述的系统和技术的实施方案相互作用的图形用户界面或网页浏览器的客户端计算机))或此类后端、中间件或前端组件的任一组合。系统的组件可通过任何数字数据通信形式或媒体(例如,通信网络)互连。通信网络的实例包括局域网(lan)、广域网(wan)和因特网。计算系统可包括客户端和服务器。客户端与服务器通常彼此远离且通常经由通信网络相互作用。客户端与服务器的关系是借助于在相应计算机上运行且彼此之间具有客户端-服务器关系的计算机程序而产生。在一些实施方案中,本文所述的各种模块可分离、组合或纳入到单一或组合模块中。图中绘示的模块并不打算将本文所述的系统限于其中展示的软件架构。可组合本文所述的不同实施方案的要素以形成上文未明确描述的其它实施方案。本文所述的过程、计算机程序、数据库等中可不考虑要素而不会不利地影响其操作。另外,图中所绘示的逻辑流程无需所示的特定次序或顺序次序来实现所需结果。各种单独要素可组合成一或多个个别要素以进行本文所述的功能。贯穿本说明,其中设备和系统描述为具有、包括或包含特定组件,或其中过程和方法描述为具有、包括或包含特定步骤,另外预期存在基本上由所述组件组成或由所述组件组成的本发明的设备和系统,并且存在基本上由所述处理步骤组成或由所述处理步骤组成的根据本发明的过程和方法。应理解,只要本发明保持可操作,各步骤的次序或进行特定动作的次序并不重要。此外,可同时执行两个或更多个步骤或动作。尽管已参考特定优选实施例特别地展示和描述了本发明,但所属领域技术人员应理解,在不背离如由所附权利要求书限定的本发明的精神和范围的情况下,可在其中做出形式和细节上的各种改变。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1