一种结直肠癌胶原评价和预后预测装置和存储介质
1.本技术涉及医学成像技术领域,特别涉及一种结直肠癌胶原评价和预后预测装置和存储介质。
背景技术:
2.结直肠癌是世界范围内最常见的恶性肿瘤之一, 且近年来发病率上升趋势明显。在结直肠癌预测判断中tnm分期系统是当前临床最广泛运用的胶原评价和预后预测方法,即通过评估原发灶(tumor)、淋巴结受累(nodes)和远处转移(metastasis)情况对肿瘤进行评估和分期,进而预测预后。
3.但是tnm分期系统仍具有一定的局限性。一方面,相同分期的患者,在接受相似的治疗方案后,其临床结局也差异很大,在ⅱ、ⅲ期结直肠癌中,这一差异更为突出。另一方面,tnm分期装置关注肿瘤自身特征,而缺乏对肿瘤微环境“土壤”的评估。因此,基于肿瘤微环境的预后策略有待进一步补充。
技术实现要素:
4.本技术的目的在于提供一种结直肠癌胶原评价和预后预测装置和存储介质,其能够改善上述问题。
5.本技术的实施例是这样实现的:第一方面,本技术提供一种计算机可读存储介质,其特征在于,所述计算机可读存储介质存储有计算机程序,所述计算机程序包括程序指令,所述程序指令当被处理器执行时使所述处理器执行以下步骤:获取病理组织切片上目标成像区域的多光子成像图像,对所述多光子成像图像进行图像处理,将所述多光子成像图像划分为肿瘤中心区域、侵袭边缘区域和正常组织区域;提取各个区域中的各项胶原特征参数值,根据所述胶原特征参数值分别计算出各个评分参数,所述评分参数包括各个区域的各项胶原特征参数平均值、区域间差异值和变异程度值;其中,所述区域间差异值为任意两个区域之间的所述胶原特征参数平均值之差值,所述变异程度值为其中两个所述区域间差异值的比值;选取目标项胶原特征对应的所述评分参数进行胶原特征评分计算,得到所述病理组织切片的胶原特征评分;联合患者的tnm分期信息和所述胶原特征评分进行预后预测。
6.可以理解,本技术公开了一种计算机可读存储介质。该计算机可读存储介质的内容被执行时可以对包含肿瘤环境信息的病理组织切片进行多光子成像,并进一步通过图像处理进行肿瘤微环境的病理学划分;分别从肿瘤组织、侵袭边缘、正常组织三个区域提取各项胶原特征参数值,比如形态学、能量、纹理特征参数;根据区域特征参数计算区域间差异和变异程度;建立胶原特征评分模型,通过模型纳入的胶原特征参数计算出胶原特征评分;该胶原特征评分能够很好地补充tnm分期系统对肿瘤微环境“土壤”的评估缺失,更加有效
地为结直肠癌预后预测提供参考。
7.在本技术可选的实施例中,所述对所述多光子成像图像进行图像处理,所述将所述多光子成像图像划分为肿瘤中心区域、侵袭边缘区域和正常组织区域,包括:提取出肿瘤和正常组织的交界线,确定包含所述肿瘤的区域为初始肿瘤中心区域,确定包含所述正常组织的区域为初始正常组织区域;将所述交界线向所述初始肿瘤中心区域的方向平移第一距离后,形成第一边界线,将所述交界线向所述初始正常组织区域的方向平移第二距离后,形成第二边界线;确定所述第一边界线和所述第二边界线之间的区域为所述侵袭边缘区域;确定所述初始肿瘤中心区域中除所述侵袭边缘区域以外的区域为所述肿瘤中心区域,确定所述初始正常组织区域中除所述侵袭边缘区域以外的区域为所述正常组织区域。
8.在本技术可选的实施例中,所述提取各个区域中的各项胶原特征参数值,根据所述胶原特征参数值分别计算出各个评分参数,包括:在所述肿瘤中心区域内随机选取三个肿瘤中心子区域roi1、roi2、roi3;计算所述三个所述肿瘤中心子区域的各项所述胶原特征参数值的平均值,作为所述肿瘤中心区域的各项所述胶原特征参数平均值;在所述侵袭边缘区域内随机选取三个侵袭边缘子区域roi4、roi5、roi6;计算所述三个所述侵袭边缘子区域的各项所述胶原特征参数值的平均值,作为所述侵袭边缘区域的各项所述胶原特征参数平均值;在所述正常组织区域内随机选取三个正常组织子区域roi7、roi8、roi9;计算所述三个所述正常组织子区域的各项所述胶原特征参数值的平均值,作为所述正常组织区域的各项所述胶原特征参数平均值。
9.其中,所述提取各个区域中的各项胶原特征参数值,根据所述胶原特征参数值分别计算出各个评分参数,还包括:包括:计算所述肿瘤中心区域和所述侵袭边缘区域的各项所述胶原特征参数平均值之差,作为第一区域间差值;计算所述侵袭边缘区域和所述正常组织区域的各项所述胶原特征参数平均值之差,作为第二区域间差值;计算所述肿瘤中心区域和所述正常组织区域的各项所述胶原特征参数平均值之差,作为第三区域间差值;将所述第一区域间差值与所述第三区域间差值的比值作为区域间变异程度值。
10.可以理解,计算区域间差值和区域间变异程度值有利于多维地对肿瘤微环境胶原特征进行分析。其中,区域间变异程度值小于或等于1时说明肿瘤微环境中肿瘤中心区域至侵袭边缘区域至正常组织区域为同一趋势变化,区域间变异程度较低;区域间变异程度值大于1时说明肿瘤微环境中肿瘤中心区域至侵袭边缘区域至正常组织区域非同一趋势变化,区域间变异程度较高。
11.在本技术可选的实施例中,所述选取目标项胶原特征对应的所述评分参数进行胶原特征评分计算,包括:通过lasso回归算法构建胶原特征评分模型如下式:
;其中,代表所述胶原特征评分,代表第i项所述目标项胶原特征对应的所述评分参数,代表参数对应的计算系数,k代表所述目标项胶原特征的数量。
12.第二方面,本技术提供一种结直肠癌胶原评价和预后预测装置,包括处理器、输入设备、输出设备和存储器,所述处理器、输入设备、输出设备和存储器相互连接,其中,所述存储器可以是如本发明第一方面中所述的计算机可读存储介质,所述处理器被配置用于调用所述程序指令。
13.有益效果:本技术公开了一种计算机可读存储介质。该计算机可读存储介质的内容被执行时可以对包含肿瘤环境信息的病理组织切片进行多光子成像,并进一步通过图像处理进行肿瘤微环境的病理学划分;分别从肿瘤组织、侵袭边缘、正常组织三个区域提取各项胶原特征参数值,比如形态学、能量、纹理特征参数;根据区域特征计算区域间差异和变异程度;建立胶原特征评分模型,通过模型纳入的胶原特征参数计算出胶原特征评分;该胶原特征评分能够很好地补充tnm分期系统对肿瘤微环境“土壤”的评估缺失,更加有效地为结直肠癌预后预测提供参考。
14.计算区域间差值和区域间变异程度值有利于多维地对肿瘤微环境胶原特征进行分析。其中,区域间变异程度值小于或等于1时说明肿瘤微环境中肿瘤中心区域至侵袭边缘区域至正常组织区域为同一趋势变化,区域间变异程度较低;区域间变异程度值大于1时说明肿瘤微环境中肿瘤中心区域至侵袭边缘区域至正常组织区域非同一趋势变化,区域间变异程度较高。
15.为使本技术的上述目的、特征和优点能更明显易懂,下文特举可选实施例,并配合所附附图,作详细说明如下。
附图说明
16.为了更清楚地说明本技术实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本技术的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
17.图1是本技术提供的一种计算机可读存储介质所存储的程序指令的流程示意图;图2是本技术对多光子成像图像的划分示意图;图3是本技术对胶原特征参数平均值的计算原理示意图;图4是本技术联合tnm分期项目和胶原特征评分项目建立的生存列线图;图5是本技术公开的结直肠癌胶原评价和预后预测方法与tnm分期系统胶原评价和预后预测方法的roc曲线示意图;图6是本技术提供的一种结直肠癌胶原评价和预后预测装置的结构示意图。
具体实施方式
18.下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
19.tnm分期系统是国际上最为通用的肿瘤分期系统。tnm分期系统已经成为临床医生和医学科学工作者对于恶性肿瘤进行分期的标准方法,即通过评估原发灶(tumor)、淋巴结受累(nodes)和远处转移(metastasis)情况对肿瘤进行评估和分期,进而预测预后。
20.但是tnm分期系统仍具有一定的局限性。一方面,相同分期的患者,在接受相似的治疗方案后,其临床结局也差异很大,在ⅱ、ⅲ期结直肠癌中,这一差异更为突出。另一方面,肿瘤并不是单一的肿瘤细胞的集合,还包括各种基质细胞、免疫细胞以及细胞外基质、微脉管等组成的肿瘤微环境,恶性肿瘤细胞相当于“种子”,肿瘤微环境相当于“土壤”,tnm分期系统关注肿瘤自身特征,而缺乏对肿瘤微环境这一“土壤”的评估。因此,基于肿瘤微环境的预后策略有待进一步补充。
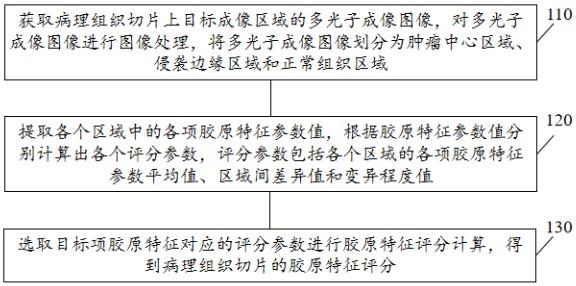
21.第一方面,如图1所示,本技术提供一种计算机可读存储介质,所述计算机可读存储介质存储有计算机程序,所述计算机程序包括程序指令,所述程序指令当被处理器执行时使所述处理器执行以下步骤:110、获取病理组织切片上目标成像区域的多光子成像图像,对多光子成像图像进行图像处理,将多光子成像图像划分为肿瘤中心区域、侵袭边缘区域和正常组织区域。
22.为了能够补充tnm分期系统对肿瘤微环境“土壤”的评估缺失,上述病理组织切片上目标成像区域需要是处于肿瘤交界处的区域。上述病理组织切片的获取方法包括:将结直肠癌手术标本进行常规病理蜡块制备,选取肿瘤交界处的蜡块,连续切片2张,切片厚度为4μm,其中第一张进行he染色,第二张作为上述病理组织切片准备进行多光子成像。上述目标成像区域的确定方法包括:通过数字切片扫描系统precice 600对第一张切片进行20倍扫描,选择浸润深度较深的肿瘤交界区域作为上述交界区域;在第二张切片上与该交界区域的对应区域确定为目标成像区域,该目标成像区域的大小一般选为5mm*5mm。
23.上述多光子成像图像可以由zeiss lsm 880 with airyscan多光子共聚焦激光扫描系统对目标成像区域进行20倍扫描后获取。
24.多光子成像是一种基于非线性光学和飞秒激光镭射之上的多光子显微成像技术,其利用活体组织细胞本身内在的自体荧光及胶原产生的二次谐波进行成像,可无需染色直接获得组织及细胞的胶原组织学特征。基质胶原是肿瘤微环境结构的重要组成部分,参与肿瘤发生、发展的多个过程并影响预后,肿瘤微环境中的高胶原含量与不良预后相关。
25.如图2所示,zen软件(zen 2.3 lite, carl zeiss microscopy gmbh,2011)完成上述肿瘤中心(center of tumor,ct)区域、正常组织(normal tissue,n)区域和侵袭边缘(invasive margin,im)区域的划分。
26.120、提取各个区域中的各项胶原特征参数值,根据胶原特征参数值分别计算出各个评分参数,评分参数包括各个区域的各项胶原特征参数平均值、区域间差异值和变异程度值。
27.其中,区域间差异值为任意两个区域之间的胶原特征参数平均值之差值,变异程
度值为其中两个区域间差异值的比值。
28.对各个区域中的各项胶原特征参数值提取可以由matlab r2015b (mathworks)软件完成。从上述多光子成像图像中一般可以提取出8项形态学特征参数、6项强度特征参数和128项纹理特征参数共142项胶原特征参数。
29.其中,胶原形态学特征参数包括:胶原面积(collagen area)、胶原纤维数量(collagen fiber number)、胶原纤维长度(collagen fiber length)、胶原纤维宽度(collagen fiber width)、胶原纤维直线度(collagen fiber straightness)、胶原纤维交联密度(collagen xlink density)、胶原纤维交联空间(collagen crosslink space)和胶原排列方向(collagen orientation)。
30.其中,胶原强度特征参数由柱状图来分析,胶原强度特征参数包括:柱状图均值(histogram mean)、柱状图方差(histogram variance)、柱状图偏度(histogram skewness)、柱状图峰度(histogram kurtosis)、柱状图能量(histogram energy)和柱状图熵(histogram entropy)。
31.其中,胶原结构特征参数包括80个灰度共生矩阵(gray-level co-occurrence matrix,glcm)的纹理参数和48个gabor小波变换参数(gabor wavelet transform)。通过计算1、2、3、4和5号位置的5个像素以及0
°
、45
°
、90
°
和135
°
的4个不同方向上的对比度、相关性、能量和均匀性来计算上述80个glcm。再通过4个不同尺度和5个不同方向的均值和方差,得到48个gabor小波变换参数。
32.针对各个区域的各项胶原特征参数平均值的计算,如图3所示,可以由zen软件(zen 2.3 lite, carl zeiss microscopy gmbh,2011)完成兴趣区域(region of interest,roi)的选择。在肿瘤中心区域、侵袭边缘区域和正常组织区域内分别随机取3个roi,得到共9个roi,roi大小为844像素
×
844像素(约700μm
×
700μm)。随后分别计算肿瘤中心、侵袭边缘和正常组织三个区域内roi所提取的142项胶原特征参数值的平均值作为该区域的各项胶原特征参数平均值。根据区域特征计算出胶原参数的区域间差异和变异程度。
33.130、选取目标项胶原特征对应的评分参数进行胶原特征评分计算,得到病理组织切片的胶原特征评分。
34.如图5所示为本技术公开的计算机可读存储介质与tnm分期系统胶原评价和预后预测方法的接受者操作特性曲线(receiver operating characteristic curve,roc)示意图。roc曲线,又称为感受性曲线(sensitivity curve),得此名的原因在于曲线上各点反映着相同的感受性,它们都是对同一信号刺激的反应,只不过是在几种不同的判定标准下所得的结果而已。接受者操作特性曲线就是以虚惊概率为横轴,击中概率为纵轴所组成的坐标图,和被试在特定刺激条件下由于采用不同的判断标准得出的不同结果画出的曲线。auc(area under curve)被定义为roc曲线下与坐标轴围成的面积,显然这个面积的数值不会大于1。又由于roc曲线一般都处于y=x这条直线的上方,所以auc的取值范围在0.5和1之间。auc越接近1.0,检测方法真实性越高;等于0.5时,则真实性最低,无应用价值。
35.由图5可以看出,tnm分期系统胶原评价和预后预测方法所得出的患者5年无病生存率(disease free survival,dfs)的auc仅为0.674(图中tnm线所示);通过本技术所公开的计算机可读存储介质所得出的患者5年无病生存率的auc显著提升为0.742(图中tnm+cs
tme
线所示)。由此可以看出,本技术所公开的计算机可读存储介质的预测效能更高。
36.可以理解,本技术公开了一种计算机可读存储介质。该方法对包含肿瘤环境信息的病理组织切片进行多光子成像,并进一步通过图像处理进行肿瘤微环境的病理学划分;分别从肿瘤组织、侵袭边缘、正常组织三个区域提取各项胶原特征参数值,比如形态学、能量、纹理特征参数;根据区域特征计算区域间差异和变异程度;建立胶原特征评分模型,通过模型纳入的胶原特征参数计算出胶原特征评分;该胶原特征评分能够很好地补充tnm分期系统对肿瘤微环境“土壤”的评估缺失,更加有效地为结直肠癌预后预测提供参考。
37.在本技术可选的实施例中,步骤“对多光子成像图像进行图像处理,将多光子成像图像划分为肿瘤中心区域、侵袭边缘区域和正常组织区域”可以由zen软件(zen 2.3 lite, carl zeiss microscopy gmbh,2011)完成,该步骤具体包括:111、提取出肿瘤和正常组织的交界线,确定包含肿瘤的区域为初始肿瘤中心区域,确定包含正常组织的区域为初始正常组织区域。
38.其中,可以通过图像算法提取肿瘤和正常组织的交界线,如图2中的虚线所示,虚线左侧为上述初始肿瘤中心区域,虚线右侧则为上述初始正常组织区域。
39.112、将交界线向初始肿瘤中心区域的方向平移第一距离后,形成第一边界线,将交界线向初始正常组织区域的方向平移第二距离后,形成第二边界线。
40.一般来说,可以将交界线向初始肿瘤中心区域的方向平移500μm形成第一边界线l1(如图2所示),将交界线向初始正常组织区域的方向平移500μm形成第二边界线l2(如图2所示)。
41.113、确定第一边界线和第二边界线之间的区域为侵袭边缘区域。
42.如图2中的侵袭边缘(invasive margin,im)区域所示。
43.114、确定初始肿瘤中心区域中除侵袭边缘区域以外的区域为肿瘤中心区域,确定初始正常组织区域中除侵袭边缘区域以外的区域为正常组织区域。
44.如图2中的肿瘤中心(center of tumor,ct)区域和正常组织(normal tissue,n)区域所示。
45.在本技术可选的实施例中,步骤120具体包括:121、计算肿瘤中心区域和侵袭边缘区域的各项胶原特征参数平均值之差,作为第一区域间差值。
46.122、计算侵袭边缘区域和正常组织区域的各项胶原特征参数平均值之差,作为第二区域间差值。
47.123、计算肿瘤中心区域和正常组织区域的各项胶原特征参数平均值之差,作为第三区域间差值。
48.124、将第一区域间差值与第三区域间差值的比值作为区域间变异程度值。
49.可以理解,计算区域间差值和区域间变异程度值有利于多维地对肿瘤微环境胶原特征进行分析。其中,区域间变异程度值小于或等于1时说明肿瘤微环境中肿瘤中心区域至侵袭边缘区域至正常组织区域为同一趋势变化,区域间变异程度较低;区域间变异程度值大于1时说明肿瘤微环境中肿瘤中心区域至侵袭边缘区域至正常组织区域非同一趋势变化,区域间变异程度较高。
50.在本技术可选的实施例中,步骤130具体包括:通过lasso回归算法构建胶原特征评分模型如下式:
;其中,代表所述胶原特征评分,代表第i项所述目标项胶原特征对应的所述评分参数,代表参数对应的计算系数,k代表所述目标项胶原特征的数量。
51.其中,k=16;代表所述侵袭边缘区域的胶原面积值,为0.181;代表所述侵袭边缘区域的胶原数量值,为0.081;代表所述侵袭边缘区域的胶原长度值,为0.303;代表所述正常组织区域的胶原排布,为-0.515;代表胶原交联密度的所述第一区域间差值,为-0.126;代表所述肿瘤中心区域的灰度共生矩阵中像素距离为3在0
°
方向上的相关性,为0.018;代表所述肿瘤中心区域的尺度为3、方向为60
°
的gabor滤器图像卷积平均值,为0.477;代表所述侵袭边缘区域的尺度为1、方向为60
°
的gabor滤器图像卷积平均值,为-0.119;代表所述侵袭边缘区域的尺度为3、方向为60
°
的gabor滤器图像卷积平均值,为0.232;代表尺度为3、方向为60
°
的gabor滤器图像卷积方差的所述第三区域间差值,为0.016;代表灰度共生矩阵中像素距离为3在45
°
方向上的对比度的所述第一区域间差值,为0.141;代表尺度为2、方向为90
°
的gabor滤器图像卷积方差的所述第一区域间差值,为0.048;代表尺度为4、方向为90
°
的gabor滤器图像卷积方差的所述第一区域间差值,为0.12;代表灰度共生矩阵中像素距离为1在90
°
方向上的相关性的所述区域间变异程度值,为0.24;
代表灰度共生矩阵中像素距离为2在135
°
方向上的相关性的所述区域间变异程度值,为0.145;代表灰度共生矩阵中像素距离为4在0
°
方向上的相关性的所述区域间变异程度值,为0.303。
52.获得胶原评分后,医生可以联合患者的tnm分期信息和胶原特征评分进行预后预测。具体包括:141、联合tnm分期项目和胶原特征评分项目建立生存列线图。
53.步骤141所建立的生存列线图如图4所示。生存列线图包括平行建立分项分数线段、t分期线段、n分期线段、胶原特征评分线段;其中,所述分项分数线段上均匀排布有0分到10分之间的各个分数值;所述t分期线段中的t1/2点、t3点、t4a点和t4b点分别对应所述分项分数线段的0分点、4.8分点、6.6分点、8.3分点;所述n分期线段中的n0点、n1/n1c点、n2a点和n2b点分别对应所述分项分数线段的0分点、2.5分点、3.4分点、5.3分点;所述胶原特征评分线段上均匀排布有-1.8分到0.2分之间的各个分数值,其中0.2分点和2.4分点分别与所述分项分数线段的0分点和10分点对应生存列线图还包括平行建立总分线段、1年无病生存率线段、3年无病生存率线段、5年无病生存率线段;其中,所述总分线段上均匀排布有0分到24分之间的各个分数值;所述1年无病生存率线段中的0.9点、0.8点、0.7点和0.6点分别对应所述总分线段的12.8分点、15.6分点、16.8分点和18分点;所述3年无病生存率线段中的0.9点、0.8点、0.7点和0.6点分别对应所述总分线段的10.4分点、12,4分点、14.4分点和15.2分点;所述5年无病生存率线段中的0.9点、0.8点、0.7点和0.6点分别对应所述总分线段的9.6分点、12分点、13.2分点和14.4分点。
54.142、将联合患者的tnm分期信息和胶原特征评分带入生存列线图进行预后预测,得到患者的无病生存率。
55.举例说明,患者甲计算得到的胶原特征评分为2.305,t分期为t4a,n分期为n1。根据胶原特征评分与该患者的tnm分期,通过图4所示的列线图评估发现,患者术后(尤其是3年后)出现复发、转移或肿瘤相关死亡的可能性较大,建议加强随访密度、增加术后复查内容和次数,选择较为积极的辅助治疗策略。
56.举例说明,患者乙胶原特征评分为0.820,t分期为t3,n分期为n1根据胶原特征评分与该患者的tnm分期,通过图4所示的列线图评估发现,患者术后出现复发、转移或肿瘤相关死亡的可能性较小,建议常规随访与术后复查,选择常规辅助治疗策略。
57.第二方面,本技术提供一种结直肠癌胶原评价和预后预测装置。如图6所示,结直肠癌胶原评价和预后预测装置包括一个或多个处理器601;一个或多个输入设备602,一个或多个输出设备603和存储器604。上述处理器601、输入设备602、输出设备603和存储器604通过总线605连接。存储器604可以是第一方面任一项的所述计算机可读存储介质,所述处理器601被配置用于调用所述程序指令。
58.应当理解,在本发明实施例中,所称处理器601可以是中央处理单元(central processing unit,cpu),该处理器还可以是其他通用处理器、数字信号处理器(digital signal processor,dsp)、专用集成电路(application specific integrated circuit,
asic)、现成可编程门阵列(field-programmable gate array,fpga)或者其他可编程逻辑器件、分立门或者晶体管逻辑器件、分立硬件组件等。通用处理器可以是微处理器或者该处理器也可以是任何常规的处理器等。
59.输入设备602可以用于获取病理组织切片上目标成像区域的多光子成像图像。
60.输出设备603可以用于将通过第一方面任一项方法得到的预后预测输出给目标终端进行显示。
61.该存储器604可以包括只读存储器和随机存取存储器,并向处理器601提供指令和数据。存储器604的一部分还可以包括非易失性随机存取存储器。例如,存储器604还可以存储设备类型的信息。
62.具体实现中,本发明实施例中所描述的处理器601、输入设备602、输出设备603可执行第一方面任一方法所描述的实现方式,也可执行本发明实施例所描述的终端设备的实现方式,在此不再赘述。
63.上述计算机可读存储介质可以是前述任一实施例的终端设备的内部存储单元,例如终端设备的硬盘或内存。上述计算机可读存储介质也可以是上述终端设备的外部存储设备,例如上述终端设备上配备的插接式硬盘,智能存储卡(smart media card,smc),安全数字(secure digital,sd)卡,闪存卡(flash card)等。进一步地,上述计算机可读存储介质还可以既包括上述终端设备的内部存储单元也包括外部存储设备。上述计算机可读存储介质用于存储上述计算机程序以及上述终端设备所需的其他程序和数据。上述计算机可读存储介质还可以用于暂时地存储已经输出或者将要输出的数据。
64.本领域普通技术人员可以意识到,结合本文中所公开的实施例描述的各示例的单元及算法步骤,能够以电子硬件、计算机软件或者二者的结合来实现,为了清楚地说明硬件和软件的可互换性,在上述说明中已经按照功能一般性地描述了各示例的组成及步骤。这些功能究竟以硬件还是软件方式来执行,取决于技术方案的特定应用和设计约束条件。专业技术人员可以对每个特定的应用来使用不同方法来实现所描述的功能,但是这种实现不应认为超出本发明的范围。
65.在本技术所提供的几个实施例中,应该理解到,所揭露的终端设备和方法,可以通过其它的方式实现。例如,以上所描述的装置实施例仅仅是示意性的,例如,上述单元的划分,仅仅为一种逻辑功能划分,实际实现时可以有另外的划分方式,例如多个单元或组件可以结合或者可以集成到另一个装置,或一些特征可以忽略,或不执行。另外,所显示或讨论的相互之间的耦合或直接耦合或通信连接可以是通过一些接口、装置或单元的间接耦合或通信连接,也可以是电的,机械的或其它的形式连接。
66.上述作为分离部件说明的单元可以是或者也可以不是物理上分开的,作为单元显示的部件可以是或者也可以不是物理单元,即可以位于一个地方,或者也可以分布到多个网络单元上。可以根据实际的需要选择其中的部分或者全部单元来实现本发明实施例方案的目的。
67.另外,在本发明各个实施例中的各功能单元可以集成在一个处理单元中,也可以是各个单元单独物理存在,也可以是两个或两个以上单元集成在一个单元中。上述集成的单元既可以采用硬件的形式实现,也可以采用软件功能单元的形式实现。
68.上述集成的单元如果以软件功能单元的形式实现并作为独立的产品销售或使用
时,可以存储在一个计算机可读取存储介质中。基于这样的理解,本发明的技术方案本质上或者说对现有技术做出贡献的部分,或者该技术方案的全部或部分可以以软件产品的形式体现出来,该计算机软件产品存储在一个存储介质中,包括若干指令用以使得一台计算机设备(可以是个人计算机,服务器,或者网络设备等)执行本发明各个实施例中方法的全部或部分步骤。而前述的存储介质包括:u盘、移动硬盘、只读存储器(rom,read-only memory)、随机存取存储器(ram,random access memory)、磁碟或者光盘等各种可以存储程序代码的介质。
69.在本公开的各种实施方式中所使用的表述“第一”、“第二”、“所述第一”或“所述第二”可修饰各种部件而与顺序和/或重要性无关,但是这些表述不限制相应部件。以上表述仅配置为将元件与其它元件区分开的目的。例如,第一用户设备和第二用户设备表示不同的用户设备,虽然两者均是用户设备。例如,在不背离本公开的范围的前提下,第一元件可称作第二元件,类似地,第二元件可称作第一元件。
70.当一个元件(例如,第一元件)称为与另一元件(例如,第二元件)“(可操作地或可通信地)联接”或“(可操作地或可通信地)联接至”另一元件(例如,第二元件)或“连接至”另一元件(例如,第二元件)时,应理解为该一个元件直接连接至该另一元件或者该一个元件经由又一个元件(例如,第三元件)间接连接至该另一个元件。相反,可理解,当元件(例如,第一元件)称为“直接连接”或“直接联接”至另一元件(第二元件)时,则没有元件(例如,第三元件)插入在这两者之间。
71.以上描述仅为本技术的可选实施例以及对所运用技术原理的说明。本领域技术人员应当理解,本技术中所涉及的发明范围,并不限于上述技术特征的特定组合而成的技术方案,同时也应涵盖在不脱离上述发明构思的情况下,由上述技术特征或其等同特征进行任意组合而形成的其它技术方案。例如上述特征与本技术中公开的(但不限于)具有类似功能的技术特征进行互相替换而形成的技术方案。
72.以上所述仅为本技术的可选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1