光控CNS功能障碍的制作方法
相关申请案的交叉参考
本专利申请要求2010年11月5日提交的美国临时申请序列号61/410,748以及2011年3月8日提交的61/464,806的优先权,这两份专利的每一篇的内容均全文以引用方式并入本文中。
发明背景
焦虑是一种不存在立即威胁情况下的持续性担忧加剧状态,在处于疾病状态时会变得严重虚弱。焦虑障碍代表了最常见的精神疾病(达28%的终生患病率),并与重郁症和药物滥用病因学存在关联。虽然长期以来据猜测杏仁核(一个对情感处理具有重要意义的大脑区域)在焦虑中发挥着作用,但是控制和调节焦虑的神经机制尚未得以确定。尽管焦虑障碍的高患病率和严重性,但人们对相应的神经回路基质仍知之甚少,从而阻碍了开发安全有效的治疗措施。可用的治疗措施往往不都是有效,或者就苯二氮类而言,还会上瘾并存在严重的副作用,包括镇静以及可导致认知损害和死亡的呼吸抑制。对哺乳动物大脑中焦虑控制机制的更深入理解对于开发更有效而副作用更少的治疗措施十分必要。尤其引人关注并具有新颖性的是利用抗焦虑作用的天然通路的可能性。
发明概要
本文提供一种包含在基底外侧杏仁核(BLA)的谷氨酸能锥体神经元中表达的光反应性视蛋白的动物,其中该视蛋白在BLA-CeL中的选择性照明诱导动物的焦虑或缓解焦虑。
本文提供一种在BLA的谷氨酸能锥体神经元中表达的光反应性视蛋白的动物,其中该视蛋白为通过光诱导超极化的视蛋白,并且其中该视蛋白在BLA-CeL中的选择性照明诱导动物的焦虑。在一些实施方案中,该视蛋白为NpHR、BR、AR或GtR3。在一些实施方案中,NpHR包含SEQ ID NO:1、2或3的氨基酸序列。在一些实施方案中,动物还包含在BLA的谷氨酸能锥体神经元中表达的第二光反应性视蛋白,其中该第二视蛋白为通过光诱导去极化的视蛋白,并且其中该第二视蛋白在BLA-CeL中的选择性照明减轻动物的焦虑。在一些实施方案中,该第二视蛋白为ChR2、VChR1或DChR。在一些实施方案中,该第二视蛋白为包含SEQ ID NO:8、9、10或11的氨基酸序列的C1V1嵌合蛋白。在一些实施方案中,该第二视蛋白包含SEQ ID NO:6或7的氨基酸序列。
本文提供一种在BLA的谷氨酸能锥体神经元中表达的光反应性视蛋白的动物,其中该视蛋白为通过光诱导去极化的视蛋白,并且其中该视蛋白在BLA-CeL中的选择性照明减轻动物的焦虑。在一些实施方案中,该视蛋白为ChR2、VChR1或DChR。在一些实施方案中,该视蛋白为包含SEQ ID NO:8、9、10或11的氨基酸序列的C1V1嵌合蛋白。在一些实施方案中,该视蛋白包含SEQ ID NO:6或7的氨基酸序列。
本文还提供用于将核酸递送到个体中的BLA谷氨酸能锥体神经元的载体,其中该载体包含编码光反应性视蛋白的核酸并且该核酸可操作地连接到控制视蛋白在谷氨酸能锥体神经元中特异性表达的启动子。在一些实施方案中,该启动子为CaMKIIα启动子。在一些实施方案中,该载体为AAV载体。在一些实施方案中,该视蛋白为通过光诱导去极化的视蛋白,并且其中该视蛋白在BLA-CeL中的选择性照明缓解焦虑。在一些实施方案中,通过光诱导去极化的该视蛋白为ChR2、VChR1或DChR。在一些实施方案中,该视蛋白为包含SEQ ID NO:8、9、10或11的氨基酸序列的C1V1嵌合蛋白。在一些实施方案中,该视蛋白包含SEQ ID NO:6或7的氨基酸序列。在一些实施方案中,该视蛋白为通过光诱导超极化的视蛋白,并且其中该视蛋白在BLA-CeL中的选择性照明诱导焦虑。在一些实施方案中,通过光诱导超极化的该视蛋白为NpHR、BR、AR或GtR3。在一些实施方案中,NpHR包含SEQ ID NO:1、2或3的氨基酸序列。在一些实施方案中,个体为小鼠或大鼠。在一些实施方案中,个体为人。
本文还提供用于将核酸递送到个体中的BLA谷氨酸能锥体神经元的方法,包括向该个体施用有效量的载体,该载体包含编码光反应性视蛋白的核酸并且该核酸可操作地连接到控制视蛋白在谷氨酸能锥体神经元中特异性表达的启动子。在一些实施方案中,该启动子为CaMKIIα启动子。在一些实施方案中,该载体为AAV载体。在一些实施方案中,该视蛋白为通过光诱导去极化的视蛋白,并且其中该视蛋白在BLA-CeL中的选择性照明缓解焦虑。在一些实施方案中,通过光诱导去极化的该视蛋白为ChR2、VChR1或DChR。在一些实施方案中,该视蛋白为包含SEQ ID NO:8、9、10或11的氨基酸序列的C1V1嵌合蛋白。在一些实施方案中,该视蛋白包含SEQ ID NO:6或7的氨基酸序列。在一些实施方案中,该视蛋白为通过光诱导超极化的视蛋白,并且其中该视蛋白在BLA-CeL中的选择性照明诱导焦虑。在一些实施方案中,通过光诱导超极化的该视蛋白为NpHR、BR、AR或GtR3。在一些实施方案中,NpHR包含SEQ ID NO:1、2或3的氨基酸序列。在一些实施方案中,个体为小鼠或大鼠。在一些实施方案中,个体为人。
本文还提供包含BLA、CeL和CeM的冠状脑组织切片,其中光反应性蛋白在BLA的谷氨酸能锥体神经元中表达。在一些实施方案中,该视蛋白为通过光诱导去极化的视蛋白。在一些实施方案中,通过光诱导去极化的该视蛋白为ChR2、VChR1或DChR。在一些实施方案中,该视蛋白为包含SEQ ID NO:8、9、10或11的氨基酸序列的C1V1嵌合蛋白。在一些实施方案中,该视蛋白包含SEQ ID NO:6或7的氨基酸序列。在一些实施方案中,该视蛋白为通过光诱导超极化的视蛋白。在一些实施方案中,通过光诱导超极化的该视蛋白为NpHR、BR、AR或GtR3。在一些实施方案中,NpHR包含SEQ ID NO:1、2或3的氨基酸序列。在一些实施方案中,组织为小鼠或大鼠组织。
本文还提供用于筛选可缓解焦虑的化合物的方法,包括(a)将化合物施用给患有通过选择性照明在BLA谷氨酸能锥体神经元中表达的视蛋白而诱导的焦虑的动物,其中该动物包含在BLA的谷氨酸能锥体神经元中表达的光反应性视蛋白,其中该视蛋白为通过光诱导超极化的视蛋白;以及(b)确定动物的焦虑水平,其中焦虑水平的降低表示化合物可有效治疗焦虑。在一些实施方案中,该视蛋白为NpHR、BR、AR或GtR3。在一些实施方案中,NpHR包含SEQ ID NO:1、2或3的氨基酸序列。
本文还提供用于缓解个体焦虑的方法,包括:(a)向该个体施用有效量的载体,该载体包含编码光反应性视蛋白的核酸并且该核酸可操作地连接到控制视蛋白在BLA的谷氨酸能锥体神经元中特异性表达的启动子,其中该视蛋白在BLA的谷氨酸能锥体神经元中表达,其中该视蛋白为通过光诱导去极化的视蛋白;以及(b)选择性照明BLA-CeL的谷氨酸能锥体神经元中的视蛋白以缓解焦虑。在一些实施方案中,该启动子为CaMKIIα启动子。在一些实施方案中,该载体为AAV载体。在一些实施方案中,该视蛋白为ChR2、VChR1或DChR。在一些实施方案中,该视蛋白为包含SEQ ID NO:8、9、10或11的氨基酸序列的C1V1嵌合蛋白。在一些实施方案中,该视蛋白包含SEQ ID NO:6或7的氨基酸序列。
本文还提供用于诱导个体焦虑的方法,包括:(a)向该个体施用有效量的载体,该载体包含编码视蛋白的核酸并且该核酸可操作地连接到控制视蛋白在BLA的谷氨酸能锥体神经元中特异性表达的启动子,其中该视蛋白在谷氨酸能锥体神经元中表达,其中该视蛋白为通过光诱导超极化的视蛋白;以及(b)选择性照明BLA-CeL的谷氨酸能锥体神经元中的视蛋白以诱导焦虑。在一些实施方案中,该启动子为CaMKIIα启动子。在一些实施方案中,该载体为AAV载体。在一些实施方案中,该视蛋白为NpHR、BR、AR或GtR3。在一些实施方案中,NpHR包含SEQ ID NO:1、2或3的氨基酸序列。
应当理解,本文所述的各种实施方案的性质的一种、一些或全部可加以组合形成本发明的其他实施方案。本发明的这些和其他方面对本领域的技术人员将变得显而易见。
附图简述
考虑到以下说明和附图,可更加全面地理解各种示例性实施方案,其中:
图1显示了根据本公开实施方案的用于提供大脑特异性投射的光遗传学靶向的系统;以及
图2显示了根据本公开实施方案的使用基于焦虑的回路模型的流程图。
图3显示了在CeA诱导的急性可逆抗焦虑作用中BLA终末的投射特异性兴奋。a)所有小鼠在行为操纵前被单只地关在高应力环境中至少1周,然后在所有光开条件下接受20Hz的5-ms光脉冲。ChR2:BLA-CeA组中的小鼠接受CaMKII启动子控制下BLA神经元中ChR2的病毒转导,并植入为BLA胞体屏蔽光线的斜口插管,从而允许选择性照明CeA中的BLA终末,而对照组则仅接受含荧光团的病毒(EYFP:BLA-CeA组)或用于照明BLA胞体的光纤(ChR2:BLA胞体组)。(b-c)ChR2:BLA-CeA组(n=8)中的小鼠在高架十字迷宫中在光开期间接受对CeA中BLA终末的选择性照明,如该ChR2:BLA-CeA代表性路径(b)中所见,其在光开期间相对于光灭期间以及EYFP:BLA-CeA(n=9)和ChR2:BLA胞体(n=7)对照(c)诱导了开臂时间增加5倍,进入开臂的可能性也显著增加(参见插图)。(d-f)ChR2:BLA-CeA组中的小鼠也显示出在光开期间相对于光灭期间以及EYFP:BLA-CeA和ChR2:BLA胞体对照(e)在旷场试验箱中心所花的时间增加,如该代表性图线(d)中所见,但在光开期间未表现出活动度的显著变化(f)。g)冠状切片的共聚焦图像,显示了ChR2:BLA-CeA组中小鼠的CeA和BLA区域,其中125μm×125μm方形表示用于定量的区域。h)放大的区域按组排成行,按大脑区域排成列。(i-k)所有组所有DAPI识别的细胞中EYFP阳性和c-fos阳性神经元的百分比(按区域进行划分)。每个组和区域的计数以图例示出。在各组之中,所研究的区域没有一个表现出EYFP阳性细胞比例的可检测差异。i)EYFP阳性或c-fos阳性的BLA神经元的比例。ChR2:BLA胞体组相对于ChR2:BLA-CeA(p<0.01)或EYFP:BLA-CeA(p<0.05)组具有显著更高的c-fos阳性BLA神经元(F2,9=10.12,p<0.01)比例。j)ChR2:BLA-CeA组相对于EYFP:BLA-CeA组(p<0.05)但非ChR2:BLA胞体组具有显著更高的c-fos阳性细胞比例。k)CeM神经元的汇总数据表明各组之中无可检测的差异。
图4显示了CeA中BLA终末的投射特异性兴奋使CeL神经元活化并引起CeM神经元的前馈抑制。a)代表性光反应性BLA、CeL和CeM细胞的实时双光子图像,所有图像均通过相同的切片成像,叠加在明场图像上。(b-f)相关代表性电流钳图线(Vm=约-70mV)的记录和照明部位的图示。b)得自表达ChR2的BLA锥体神经元的代表性图线,BLA中所有表达ChR2的BLA神经元对每个5ms脉冲(n=4)均出现尖峰(spike)。c)得自BLA投射神经元终末区域(terminal field)中的CeL神经元的代表性图线,显示了对光刺激的亚阈值和超阈值兴奋性反应(n=16)。左边的插图是对于20Hz的40个脉冲序列中每个脉冲出现尖峰的平均概率的细胞群汇总,虚线表示SEM。右边的插图是频率直方图,显示了以20Hz递送的5ms光脉冲的各个细胞尖峰保真度,y轴是每5%bin的细胞数。d)响应电流阶跃(约60pA;以黑色表示)的CeM神经元尖峰的六次扫描以及CeL中BLA终末的20Hz照明时的尖峰抑制。插图为尖峰频率,在CeL神经元的光刺激期间显著降低(n=4)。(e-f)在对CeM广泛照明时,膜片钳试验总结表明EPSC的延迟显著短于IPSC的延迟,而在EPSC与IPSC的振幅方面则无显著差异(n=11;*p=0.04,参见插图)。相同的CeM神经元(n=7)表现出在接受CeM照明时的净兴奋(e)或在对CeL选择性照明时的净抑制(f)。
图5显示了光诱导的抗焦虑作用可归因于单独的BLA-CeL突触活化。(a-b)对18个染料充灌的BLA神经元的双光子多层光切(z-stack)图像进行了重构,它们向CeL和CeM的投射汇总在(a)中,而它们的图像则显示在(b)中,其中红色表示向CeL的投射,蓝色表示向CeM的投射,紫色表示向CeL和CeM两者的投射。c)当在各光斑位置进行全细胞记录时记录部位和光斑位置的示意图,其中光斑以100um的步长以可视化轴突上方以及非轴突上方的方向远离细胞体移动。d)针对与胞体相隔各种距离递送的20Hz序列的尖峰保真度的标准化电流钳汇总,显示了与细胞体相隔约300um处,轴突终末照明导致了低(<5%)尖峰保真度。e)根据与细胞体的距离,照明时在细胞体处所见的去极化电流的标准化电压钳汇总。(f-i)在每个切片标本内的各位置上方通过约150um直径的光斑照明时的代表性电流钳图线(n=7)。细胞体的照明引起了高保真度尖峰(f)。CeL中BLA终末的照明在突触后CeL神经元中引起了强烈的亚阈值和超阈值兴奋性反应(g),但是未在BLA神经元本身中引起可靠的逆向尖峰(h),以及显示了在轴突之外递送的光,以作为光散射对照用于比较(i)。(k-j)将一组单独的ChR2:BLA-CeL小鼠(n=8)各自在高架十字迷宫和旷场试验中测试两次,一个阶段以CeA内输注盐水开始(红色),而另一个阶段则以顺序反平衡的谷氨酸受体拮抗剂NBQX和AP5开始(紫色)。k)CeA中的谷氨酸受体阻滞使以下两个指标的光诱导增加值减小而不影响光灭期间的表现:在高架十字迷宫上开臂中所花的时间以及进入开臂的概率(插图)。j)局部谷氨酸受体拮抗使旷场试验中心时间的光诱导增加值减小,插图显示了合并的汇总。
图6显示了CeA中BLA终末的选择性抑制诱导了急性且可逆的焦虑加剧。a)所有小鼠被按组关在低应力环境中,并在光开期间接受双侧恒定591nm光。eNpHR3.0:BLA-CeA组中的小鼠(n=9)在CaMKII启动子控制下接受了BLA神经元中的eNpHR3.0双侧病毒转导并植入了使光远离BLA胞体的斜口插管以允许对CeA中的BLA终末进行选择性照明,而对照组则接受仅用荧光团的双侧病毒转导(EYFP:BLA-CeA双侧组;n=8)或直接照明BLA胞体的光纤(eNpHR3.0:BLA胞体组;n=6)。b)用eNpHR3.0处理的小鼠的BLA和CeA的共聚焦图像。(c-e)在用于下文的焦虑测定中的相同动物中,相对于EYFP组,eNpHR3.0组的CeM(e)中显著更高比例的神经元表达了c-fos(*p<0.05)。f)eNpHR3.0:BLA-CeA组中小鼠的代表性路径,显示了在CeA的BLA终末选择性照明期间在高架十字迷宫上的开臂探索减少。g)eNpHR3.0小鼠相对于对照在光刺激期间表现出在开臂中所花的时间和进入开臂的概率降低。h)在旷场试验中在汇总的光灭和光开期间eNpHR3.0:BLA-CeA组小鼠的代表性路径。i)对于eNpHR3.0:BLA-CeA组,与对照相比,在光开但非光灭期间,在旷场试验箱中的中心时间显著缩短,插图显示了汇总的数据。(j-l)表达eNpHR3.0的BLA终末的选择性照明在存在卡巴胆碱的情况下足以减少自发性囊泡释放。其中BLA神经元表达eNpHR 3.0的急性切片标本中CeL神经元(j)的代表性图线,显示了当对离开BLA胞体约300μm的BLA终末照明时,在突触后CeL神经元处所见的sEPSC的振幅(k)和频率(l)降低。经各种长度的照明(5-60秒)后在CeL神经元(n=5)处记录的sEPSC振幅(k)和频率(l)的累积分布频率,插图显示了在照明之前、期间和之后相匹配的持续时期中的相应平均值+SEM(**p<0.01;***p<0.001)。(m-p)对表达eNpHR 3.0的BLA终末的选择性照明抑制了通过BLA中的电刺激而诱发的囊泡释放。m)指示刺激电极、记录电极以及约150μm直径光斑的位置的示意图。n)在对表达eNpHR3.0的BLA终末进行选择性照明之前(灭1)、期间(开)和之后(灭2)CeL神经元中EPSC的代表性图线。得自包含表达eNpHR 3.0的BLA神经元(n=7)的切片标本和非转导对照(n=5)的标准化EPSC振幅汇总数据(o)和各细胞数据(p)表明选择性照明CeL中的BLA终末显著(*p=0.006)降低了突触后CeL神经元中电诱发的EPSC的振幅。
图7是显示了用473nm光处理的小鼠在组织学上确认的布置的示意图。图中指明了作为半球反平衡的病毒注射针(圆形)和斜口插管的顶端(x)的单侧布置。颜色指明了处理组,参见图例。这里显示了含有BLA和CeA的冠状断面,数字表示距离前囱的前后坐标(Aravanis et al.,J Neural Eng,4:S143-156,2007)。
图8显示了斜口插管和照明分布的设计。a)在充注荧光素水溶液的比色皿上方发射473nm光的裸光纤的光锥。光锥的角度为约12度。b)相同光纤的光锥并且光线被包鞘在斜口插管中。斜口插管阻挡光线递送到其中一侧,而不会可检测地改变垂直光穿透。c)通过CeA上方的斜口插管由光纤递送光线的示意图。d)指出了当在光纤顶端所见的光功率密度为7mW(约99mW/mm2)时在小鼠脑组织中相隔光纤顶端各种距离处的光功率密度估计值的图表。插图为示出了构造的示意图。光纤处于垂直取向并通过小鼠脑组织块正对功率表的中心。e)显示了通过标准功率表测得的光功率(mW)以及在顶端处、在CeL处(脑组织中约0.5-0.7mm深度)和在CeM处(脑组织中约1.1mm深度)所见的光功率密度估计值(mW/mm2)的表格。
图9显示了斜口插管防止了光递送到BLA和在用于行为测定的光功率下的BLA尖峰。a)示出了通过光纤将光递送到CeA以及BLA中的记录电极(红色)的构造的示意图。b)在使用和不使用斜口插管的情况下将各种光功率递送到CeA时BLA中记录的散点图汇总(n=4个部位)。对于各部位,在使用和不使用斜口插管的情况下进行反复交替记录。x轴显示了光纤顶端处的光功率密度(黑色)和CeL处的估计光功率密度(灰色)。蓝色竖直或阴影区域表示用于行为测定的光功率密度范围(在光纤顶端约7mW;约99mW/mm2)。在此光功率密度范围内未观察到BLA神经元的可靠反应。c)在CeA中的相同记录部位采用7mW(在光纤顶端约99mW/mm2;在CeL约5.9mW/mm2)的20Hz 5ms脉冲光刺激时BLA记录的代表性图线。d)响应单个光脉冲的细胞群尖峰波形揭露出实质性的光限制,即使在12mV的高功率下仍是如此(光纤顶端处约170mW/mm2;CeL处约10.1mW/mm2)。
图10展示了病毒转导不包括闰细胞簇。a)在后续共聚焦图像中显示的闰细胞示意图。(b-d)用于行为操纵的接受BLA中EYFP b)、eNpHR 3.0c)和ChR2d)注射的小鼠的闰细胞的代表性图像。病毒表达未在闰细胞簇中观察到。(e-f)对于用于行为测定的所有6个组,在闰细胞簇中存在非常低的(<2%)YFP表达水平。在各组之中,c-fos表达不存在统计显著性差异。
图11显示了单侧CeA内施用谷氨酸拮抗剂未改变活动度。在旷场试验前施用NBQX和AP5相对于盐水输注未降低活动度(通过平均速度度量)(F1,77=2.34,p=0.1239)。
图12展示了浴液灌流谷氨酸拮抗剂阻断了光诱发的突触传导。通过BLA内输注将AAV5-CamKII-ChR2-EYFP输入野生型小鼠的BLA后4-6周,我们研究了谷氨酸受体拮抗剂NBQX和AP5阻断谷氨酸能传导的能力。a)在对表达ChR2的BLA终末进行20Hz的473nm光照序列时代表性CeL神经元的代表性电流钳(上图)和电压钳(下图)图线。b)浴液灌流NBQX和AP5后相同细胞的反应显示出被取消的尖峰和EPSC。c)浴液灌流NBQX和AP5前后所见的去极化电流的细胞群汇总(n=5),针对用药前的反应标准化。
图13是显示了用594nm光处理的小鼠在组织学上确认的布置的示意图。图中示出了病毒注射针(圆形)和斜口插管顶端(x)的双侧放置。颜色指明了处理组,参见图例。显示了含有BLA和CeA的冠状断面;数字表示距离前囱的AP坐标(Aravanis et el.,J Neural Eng,4:S143-156,2007)。
图14显示了用于eNpHR 3.0终末抑制实验的光刺激参数未阻断细胞体处的尖峰。(a-c)在持续尖峰序列的持续时间的电流阶跃下,在相应代表性图线旁边的光斑位置和记录部位的示意图,其与中间时期中各位置的黄色光照明配对(由黄色水平条表示)。a)在直接照明时表达eNpHR 3.0的BLA神经元的代表性电流钳图线显示出在细胞体照明期间的强效尖峰抑制。b)在距离细胞体约300μm处提供约125μm直径的光斑而不照明轴突时表达eNpHR 3.0的BLA神经元的代表性电流钳图线。c)在距离细胞体约300μm处提供约125μm直径的光斑并照明轴突时表达eNpHR 3.0的BLA神经元的代表性电流钳图线。d)虽然直接照明细胞体诱导了与所有其他条件存在显著性差异的尖峰完全抑制(F3,9=81.50,p<0.0001;n根据条件为3或以上),但是在离开表达eNpHR 3.0的BLA神经元胞体约300μm的远侧照明条件和无光条件之间无显著性差异(F2,7=0.79,p=0.49),从而表明远侧照明未显著抑制细胞体处的尖峰。e)示出了相对于记录部位的光斑位置的示意图,右边则显示了细胞群汇总。细胞群汇总显示了轴突侧支之上和之外根据光斑与细胞体的距离从细胞体记录的标准化超极化电流(n=5)。
图15展示了BLA终末的选择性照明诱导了囊泡释放到CeL神经元上,而未可靠地引起逆行动作电位。示意图和说明对应于下面的图线,而图线颜色则表示细胞类型。光照模式对于两个图线系列均相同。左列是每个细胞40个脉冲光序列的三次重叠扫描的CeL图线(n=8)。这里,两个锁时EPSC表示从突触前ChR2表达性BLA终末的囊泡释放,并且对于所有突触后CeL细胞,对100%的光脉冲均存在兴奋性反应。右列是每个细胞的三次重叠40个脉冲扫描的BLA图线(n=9),其中在轴突终末递送的平均数量的光脉冲导致了超阈值逆行动作电位(5.4%±2%,平均值±SEM)。
图16是曲线图,展示了在eNpHR 3.0和对照组中光刺激未改变活动度。在各组之间以及在各光照期间之间不存在可检测的活动度差异(F1,20=0.023,p=0.3892;F1,100=3.08,p=0.086)。
具体实施方式
本公开涉及对如本文所述的神经系统障碍的控制,诸如与焦虑和焦虑症状相关的障碍。虽然本公开不一定限于这些背景,但是通过对使用这些和其他背景的实例的讨论将认识到本发明的各个方面。
本公开的各个实施方案涉及关于以可测量的指标对神经回路进行暂时控制的光遗传学系统或方法。例如,各种指标或症状可与表现出各种焦虑症状的神经障碍相关。该光遗传学系统靶向患者体内的神经回路以对其选择性控制。该光遗传学系统涉及对患者与神经障碍相关的指标或症状进行监控。这样,光遗传学系统可提供关于神经回路、其功能和/或神经障碍的详细信息。
根据本文所讨论的实施方案,特定的实施方案涉及研究和探索障碍。其他实施方案涉及鉴定和/或研究表型和内表型。另有其他实施方案涉及鉴定治疗靶标。
本公开的多个方面涉及使用人工诱导的焦虑状态研究原本健康的动物中的焦虑。这尤其可用于监控知之甚少并难以在活动物中准确建模的症状和方面。例如,由于没有表现出焦虑状态的可用动物而可能难以测试和/或研究焦虑状态。此外,某些实施方案考虑到可逆的焦虑状态,这尤其可用于建立测试的基线/对照点和/或用于测试治疗对表现出焦虑状态时和未表现出焦虑状态时的相同动物的影响。某些实施方案的可逆焦虑状态还允许重置在对相同动物测试不同治疗的影响之间的基线。
本公开的某些方面涉及关于控制活动物中的焦虑和/或焦虑状态的方法。在某些更具体的实施方案中,症状的监控还包括评估刺激在缓和焦虑症状方面的功效。还存在多种其他方法和应用,其中一些在本文进行了更详细地描述。
可用于本发明的光反应性视蛋白包括通过光诱导神经元中超极化的视蛋白以及通过光诱导神经元中去极化的视蛋白。视蛋白的实例在下表1和2中示出。
表1显示了鉴定出的在可见光谱内抑制细胞活性的视蛋白:
表2显示了鉴定出的在可见光谱内兴奋和调节的视蛋白:
表2(续):
如本文所用,光反应性视蛋白(诸如NpHR、BR、AR、GtR3、Mac、ChR2、VChR1、DChR和ChETA)包括天然存在的蛋白和功能变体、片段、包含片段或全长蛋白的融合蛋白。例如,信号肽可以缺失。变体可具有与天然存在的蛋白质序列以至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%任一百分比相同的氨基酸序列。功能变体可具有与天然存在的蛋白质相同或相似的超极化功能或去极化功能。
在一些实施方案中,NpHR为eNpHR3.0或eNpHR3.1(参见www.stanford.edu/group/dlab/optogenetics/sequence_info.html)。在一些实施方案中,光反应性视蛋白为C1V1嵌合蛋白或C1V1-E162(SEQ ID NO:10)、C1V1-E122(SEQ ID NO:9)或C1V1-E122/E162(SEQ ID NO:11)突变嵌合蛋白(参见Yizhar et al,Nature,2011,477(7363):171-78和www.stanford.edu/group/dlab/optogenetics/sequence_info.html)。在一些实施方案中,光反应性视蛋白为SFO(SEQ ID NO:6)或SSFO(SEQ ID NO:7)(参见Yizhar et al,Nature,2011,477(7363):171-78;Berndt et al.,Nat.Neurosci.,12(2):229-34和www.stanford.edu/group/dlab/optogenetics/sequence_info.html)。
在一些实施方案中,光活化的蛋白为包含与SEQ ID NO:1所示的序列至少95%、至少96%、至少97%、至少98%、至少99%或100%相同的氨基酸序列的NpHR视蛋白。在一些实施方案中,NpHR视蛋白还包含内质网(ER)输出信号和/或膜运输信号。例如,NpHR视蛋白包含与SEQ ID NO:1所示的序列至少95%相同的氨基酸序列以及内质网(ER)输出信号。在一些实施方案中,将与SEQ ID NO:1所示的序列至少95%相同的氨基酸序列通过连接基连接到ER输出信号。在一些实施方案中,ER输出信号包含氨基酸序列FXYENE,其中X可以是任何氨基酸。在另一个实施方案中,ER输出信号包含氨基酸序列VXXSL,其中X可以是任何氨基酸。在一些实施方案中,ER输出信号包含氨基酸序列FCYENEV。在一些实施方案中,NpHR视蛋白包含与SEQ ID NO:1所示的序列至少95%相同的氨基酸序列、ER输出信号和膜运输信号。在其他实施方案中,NpHR视蛋白从N端到C端包含与SEQ ID NO:1所示的序列至少95%相同的氨基酸序列、ER输出信号和膜运输信号。在其他实施方案中,NpHR视蛋白从N端到C端包含与SEQ ID NO:1所示的序列至少95%相同的氨基酸序列、膜运输信号和ER输出信号。在一些实施方案中,膜运输信号衍生自人内向整流钾通道Kir2.1的氨基酸序列。在一些实施方案中,膜运输信号包含氨基酸序列K S R I T S E G E Y I P L D Q I D I N V。在一些实施方案中,将膜运输信号通过连接基连接到与SEQ ID NO:1所示的序列至少95%相同的氨基酸序列。在一些实施方案中,将膜运输信号通过连接基连接到ER输出信号。连接基的长度可以为5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400或500个氨基酸中的任一者。连接基还可包含荧光蛋白,例如但不限于黄色荧光蛋白、红色荧光蛋白、绿色荧光蛋白或青色荧光蛋白。在一些实施方案中,光活化的视蛋白还包含N端信号肽。在一些实施方案中,光活化的视蛋白包含SEQ ID NO:2的氨基酸序列。在一些实施方案中,光活化的蛋白包含SEQ ID NO:3的氨基酸序列。
在一些实施方案中,光活化的视蛋白为衍生自团藻(Volvox carteri)的VChR1和莱茵衣藻(Chlamydomonas reinhardti)的ChR1的嵌合蛋白。在一些实施方案中,嵌合蛋白包含VChR1的氨基酸序列,其具有至少第一和第二被ChR1的相应第一和第二跨膜螺旋替代的跨膜螺旋。在其他实施方案中,嵌合蛋白包含VChR1的氨基酸序列,其具有至少第一和第二被ChR1的相应第一和第二跨膜螺旋替代的跨膜螺旋;以及还包含被ChR1的相应部分替代的位于第二和第三跨膜螺旋之间的胞内环状结构域的至少一部分。在一些实施方案中,位于嵌合光活化蛋白的第二和第三跨膜螺旋之间的整个胞内环状结构域可被ChR1的相应胞内环状结构域替代。在一些实施方案中,光活化的嵌合蛋白包含与SEQ ID NO:8所示的序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,而不含信号肽序列。在一些实施方案中,光活化的嵌合蛋白包含与SEQ ID NO:8所示的序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。C1V1嵌合光活化视蛋白可在嵌合多肽VChR1部分的视黄醛结合袋中的关键位置具有特定的氨基酸取代。在一些实施方案中,C1V1蛋白在SEQ ID NO:8的氨基酸残基E122处具有突变。在一些实施方案中,C1V1蛋白在SEQ ID NO:8的氨基酸残基E162处具有突变。在其他实施方案中,C1V1蛋白在SEQ ID NO:8的氨基酸残基E162和E122处均具有突变。在一些实施方案中,本发明所公开的突变C1V1嵌合蛋白的每一种可具有特定的性质和特征,以用于响应光线而使动物细胞膜去极化。
如本文所用,载体包含编码本文所述的光反应性视蛋白的核酸,并且该核酸可操作地连接到控制视蛋白在谷氨酸能锥体神经元中特异性表达的启动子。可使用可用于将核酸递送到谷氨酸能锥体神经元的任何载体。载体包括病毒载体,诸如AAV载体、逆转录病毒载体、腺病毒载体、HSV载体和慢病毒载体。AAV载体的实例为AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8、AAV9、AAV10、AAV11、AAV12、AAV13、AAV14、AAV15和AAV16。可使用可控制视蛋白在谷氨酸能锥体神经元中表达的CaMKIIα启动子和任何其他启动子。
“个体”是哺乳动物,诸如人。哺乳动物还包括但不限于家畜、用于体育活动的动物、宠物(诸如猫、狗、马)、灵长类动物、小鼠和大鼠。“动物”是非人哺乳动物。
如本文所用,“处理”或“治疗”或“缓解”是获得有益或所需结果(包括并优选地为临床结果)的方法。对于本发明而言,有益或所需临床结果包括但不限于以下一者或多者:表现出疾病(诸如焦虑)一种或多种体征可观察的和/或可测量的减轻、减轻疾病所致的症状、提高患病者的生活质量、降低治疗疾病所需的其他药剂的剂量和/或延迟疾病进展。
如本文所用,药物、化合物或药物组合物的“有效剂量”或“有效量”是足以实现有益或所需结果的量。对于治疗性用途,有益或所需结果包括临床结果,诸如减轻疾病所致的一种或多种症状、提高罹患疾患的患者的生活质量、降低治疗疾病所需的其他药剂的剂量、诸如通过靶向而增强另一种药剂的效果和/或延迟疾病进展。如在临床背景中可以理解的是,药物、化合物或药物组合物的有效剂量可以或可以不与另一种药物、化合物、药物组合物或另一种治疗联用而加以实现。因此,“有效剂量”可在施用一种或多种治疗剂或治疗措施的背景下进行考虑,并且如果联合一种或多种其他药剂或治疗措施时可实现所需的结果,则可以考虑以有效量给予单一药剂。
以上概述并非意图描述本发明的各个所示实施方案或每种实施方式。
详细说明和示例性实验实施方案
本发明据信可用于控制焦虑状态和/或焦虑症状。本发明的具体应用涉及光遗传学系统或方法,其又涉及对与焦虑状态和/或其症状相关的神经回路的暂时、空间和/或细胞类型控制。由于本文所公开的示例性实施方案的许多方面涉及并广泛依赖于本领域之前的发展,因此以下讨论对此类之前的发展进行了概述,以提供对可从中引出实施方式详情和修改(包括实施例中所见的那些)的基础和潜在教导内容的切实理解。以下讨论均在此背景下提供,而参考文献中的教导内容以引用方式并入本文中。虽然本发明不一定限于此类应用,但是通过对使用此背景的各种实例的讨论可认识到本发明的各个方面。
焦虑是指一种不存在立即威胁情况下的持续性担忧加剧状态,在处于疾病状态时会变得严重虚弱。本公开的实施方案涉及使用具有双光子显微镜的细胞类型特异性光遗传学工具、电生理学和焦虑测定法中的一种或多种研究和开发涉及焦虑相关行为潜在的神经回路的治疗措施。
本公开的多个方面涉及在研究与精神疾病相关的神经回路功能中光遗传学靶向大脑而非细胞类型的特异性投射。
根据本公开的特定实施方案,将杏仁核中央核(CeA)中的基底外侧杏仁核(BLA)终末的暂时性精确光遗传学刺激用于产生可逆的抗焦虑作用。光遗传学刺激可通过以下方式实施:用诸如ChR2的光反应性视蛋白对BLA进行病毒转导,然后在下游CeA中进行限制性照明。
根据本公开的其他实施方案,将杏仁核中央核(CeA)中的基底外侧杏仁核(BLA)终末的光遗传学抑制用于增强焦虑相关行为。光遗传学刺激可通过以下方式实施:用诸如eNpHR3.0的光反应性视蛋白对BLA进行病毒转导,然后在下游CeA中进行限制性照明。
本公开的实施方案涉及神经细胞群的特异性靶向,因为在对BLA胞体的直接光遗传学控制下未观察到基于焦虑的作用。例如,靶向作为回路元件的特异性BLA-CeA投射已通过实验证实足以实现哺乳动物大脑中的内源性焦虑控制。
根据本公开的实施方案,靶向作为回路元件的特异性BLA-CeA投射基于下文将更详细讨论的许多因素。杏仁核由具有复杂互联性的在功能和形态学上具有异质性的亚核组成。杏仁核的主要划分为基底外侧杏仁核复合体(BLA),其涵盖外侧(LA)、基底外侧(BL)和基底内侧(BM)杏仁核(约90%的BLA神经元为谷氨酸能神经元)。相比之下,由中央外侧(CeL)和中央内侧(CeM)核组成的杏仁核中央核(CeA)主要(大约95%)由GABA能中型多棘神经元构成。BLA包鞘在GABA能闰细胞(ITC)的致密簇中,这些细胞在功能上与CeA的局域中间神经元和中型多棘神经元均不同。杏仁核的主要输出核为CeM,其在通过化学或电方式兴奋时,据信可通过投射到脑干而介导与恐惧和焦虑相关的自主和行为反应。虽然CeM不直接通过会聚环境和认知信息(LA)的主要杏仁核部位进行控制,但是LA和BLA神经元可使GABA能CeL神经元兴奋,这可向CeM“输出”神经元上提供前馈抑制并减少杏仁核输出。BLA-CeL-CeM是一种研究还不够透彻的通路,已表明其不涉及恐惧消退而是涉及条件性抑制。已表明,可能由于音调和惊吓(tone and shock)的明确不成对而导致的恐惧表达受到抑制与BLA-CeL突触增强相关。
BLA细胞具有遍及大脑的各种各样的投射,包括向终纹床核(BNST)、伏核、海马体和皮质的投射。本公开的多个方面涉及用于选择性控制CeL中的BLA终末而对其他BLA投射几乎没有直接影响/控制的方法。可通过将视蛋白基因表达限制到BLA谷氨酸能投射神经元以及通过将光递送限制到CeA,而促进BLA-CeL突触的优先靶向。
例如,BLA谷氨酸能投射神经元的控制可通过携带光活化的光遗传学控制基因的腺相关病毒(AAV5)载体在CaMKIIα启动子的控制下实现。在BLA内,CaMKIIα只在谷氨酸能锥体神经元而不在局域中间神经元或闰细胞中表达。
图1显示了根据本公开实施方案的用于提供大脑特异性投射的光遗传学靶向的系统。例如,斜口引导插管可用于引导光线,例如,防止光递送到BLA并允许实现CeA的选择性照明。这种光线优先递送到CeA投射可使用立体定位指引方法连同CeL上方的植入而实现。所得的光分布的几何和功能性质可在体外和体内进行定量,例如使用体内电生理记录,以确定用于BLA终末而非BLA细胞体的选择性控制的光功率参数。诸如实施例中所述的那些实验结果支持以下结论:此类选择性兴奋或抑制可导致显著、立即且可逆的基于焦虑的作用。
本公开的实施方案涉及适用于本文确定的各种解剖、功能、结构和回路靶标的以上目标的实现。例如,可研究回路靶标以开发用于焦虑精神疾病的治疗措施。这些治疗措施可包括以下非限制性实例:药理学、电、磁、手术和光遗传学治疗或其他治疗手段。
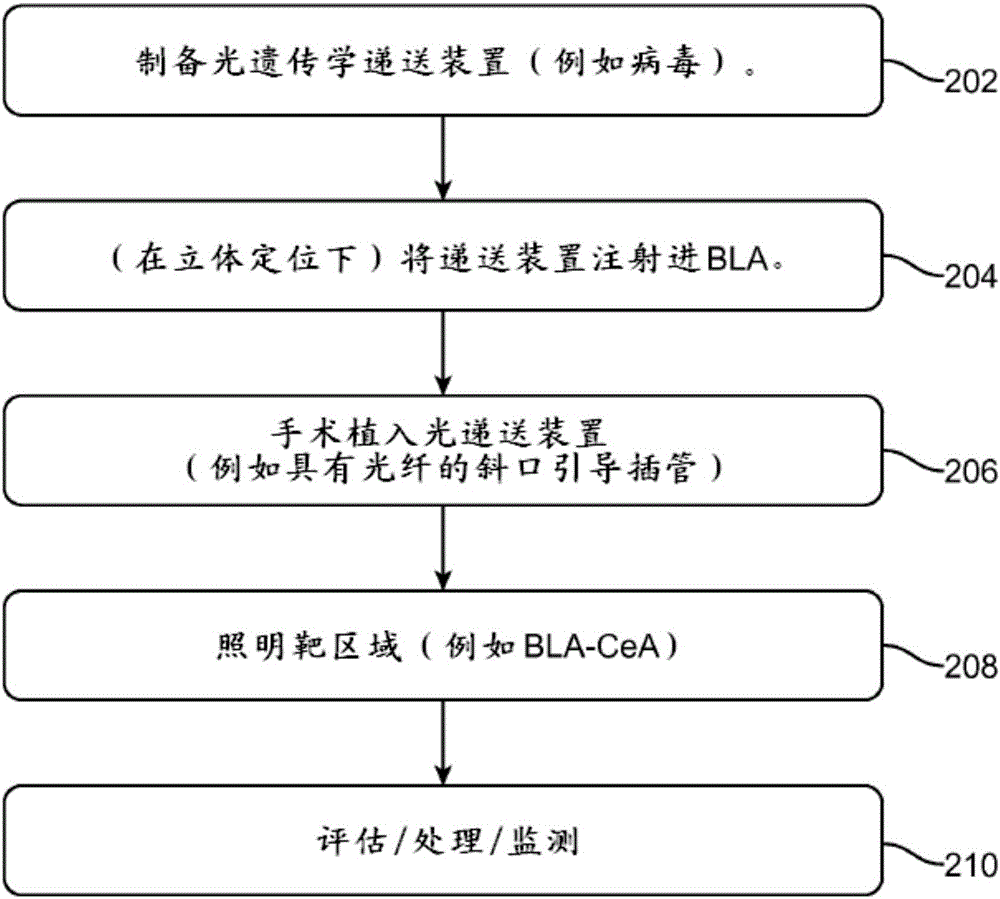
图2显示了根据本公开实施方案的使用基于焦虑的回路模型的流程图。在202形成光遗传学递送装置,诸如病毒递送装置。该递送装置可被构造成将光学反应性视蛋白引向靶细胞,并可包括特定细胞类型的靶向启动子。然后在204可将递送装置在立体定位下(或其他方式下)注射进BLA。然后在206可将光递送装置通过手术植入。该光递送装置可被构造成提供靶向照明(例如,使用定向光学元件)。然后在208对靶区域照明。靶区域可以为例如BLA-CeA。然后在210可监控和/或评估其效果。这还可以与治疗或药物筛选相结合而使用。
本公开的多个实施方案涉及使用确定的模型筛选新的焦虑治疗措施。例如,可以使用本文所述的方法人工诱导或抑制焦虑,然后应用药理、电、磁、手术或光遗传学治疗措施并进行评估。在本公开的其他实施方案中,该模型可用于开发所确定的回路的体外模仿或模拟,然后可用于筛选装置、试剂、工具、技术、方法和途径以及用于研究和探索焦虑和相关障碍。此研究可涉及但不必定限于鉴定表型、内表型和治疗靶标。
本公开的实施方案可涉及作为内源性神经基质对BLA-CeL通路建模,以用于双向调节焦虑的非条件表达。某些实施方案涉及其他下游回路,诸如CeA向BNST的投射,它们在焦虑或焦虑相关行为的表达中的作用。例如,据信,BNST中的促肾上腺皮质激素释放激素(CRH)网络可在调节焦虑相关行为中起着重要作用,因为CeL是BNST的主要CRH来源。其他神经递质和神经调质可调节或门控对分布式神经回路的作用,包括血清素、多巴胺、乙酰胆碱、甘氨酸、GABA和CRH。还有其他实施方案涉及对会聚到此通路以及从此通路分开的神经回路的控制,因为据信BLA-CeL突触的平行或下游回路有助于焦虑表型的调节或表达。此外,在杏仁核的上游,该微回路良好定位,以被来自对处理恐惧和焦虑具有重要意义的区域的自上而下的皮质控制所利用,包括提供对BLA和CeL的强大神经支配的前边缘、下边缘和岛叶皮质。
基于BLA解剖学的实验结果表明,投射到CeL和CeM神经元的BLA神经元群大部分不重叠。在自然状态下,投射CeL的BLA神经元可以微回路体内平衡机制使投射CeM的BLA神经元兴奋,然后当存在偏离回路平衡的突触变化以允许未受抑制的CeM活化时可用于研究潜在的焦虑障碍。
本文所述的实施方案和特定应用(包括实施例)可结合上述方面、实施方案和实施方式中的一个或多个以及结合图中所示和下文所述的那些内容而加以实施。以下实施例可能会参考文献,其全文以引用方式并入本文。有关光反应性分子和/或视蛋白的详细信息,包括方法学、装置和物质,还可以参考以下背景性出版物:Zhang等人的名称为“System for Optical Stimulation of Target Cells”的美国专利公布No.2010/0190229;Zhang等人的名称也为“System for Optical Stimulation of Target Cells”的美国专利公开No.2010/0145418;Boyden等人的名称为“System for Optical Stimulation of Target Cells”的美国专利公布No.2007/0261127;以及名称为“Light Sensitive Ion Passing Molecules”的PCT WO 2011/116238。这些专利申请构成了本专利文献的一部分并全部以引用方式并入本文。根据这些出版物,许多视蛋白可在体内和体外用于哺乳动物细胞,以提供对靶细胞的光学刺激和控制。例如,当将ChR2引入电兴奋细胞诸如神经元时,ChR2紫红质通道蛋白(channelrhodopsin)的光活化可导致细胞兴奋和/或放电。在将NpHR引入电兴奋细胞诸如神经元的情况下,NpHR视蛋白的光活化可导致细胞放电受到抑制。上文引用的专利申请的公开内容的这些和其他方面可用于实施本公开的多个方面。
虽然本公开可存在各种修改和替代形式,但是其细节已通过举例的方式在附图中示出并将更加详细地描述。应当理解,本发明不限于所述特定实施方案和/或应用的公开内容。相反,本发明将涵盖落在本公开精神和范围内的所有修改形式、等效形式和替代形式。
实施例
简介
焦虑是一种不存在立即威胁情况下的持续性担忧加剧状态,在处于疾病状态时会变得严重虚弱1。焦虑障碍代表了最常见的精神疾病(达28%的终生患病率)2,并与重郁症和药物滥用病因学存在关联3-5。虽然长期以来据猜测杏仁核(一个对情感处理具有重要意义的大脑区域9-17)在焦虑中发挥着作用18-23,但是控制和调节焦虑的神经机制尚未得以确定。这里,我们在自由活动的小鼠中将具有双光子显微镜的细胞类型特异性光遗传学工具、电生理学和焦虑测定法相结合,以鉴定焦虑相关行为潜在的神经回路。通过有效利用光遗传学24-26不仅能控制细胞类型还能控制细胞间特定连接的独特能力,我们观察到对杏仁核中央核(CeA)中基底外侧杏仁核(BLA)终末的暂时性精确光遗传学刺激(通过用ChR2进行BLA的病毒转导,然后在下游CeA中进行限制性照明而实现)发挥了显著、即时且可逆的抗焦虑作用。相反,使用eNpHR3.0的相同限定投射的选择性光遗传学抑制25强效、快速且可逆地增强了焦虑相关行为。重要的是,这些作用在对BLA胞体本身的直接光遗传学控制下未观察到。总之,这些结果暗示作为回路元件的特异性BLA-CeA投射对于哺乳动物大脑中的内源性焦虑控制既是必要的也是足够的,并且表明光遗传学靶向特异性投射而非细胞类型在研究与精神疾病相关的神经回路功能中的重要性。
尽管焦虑障碍的高患病率和严重性1,但人们对相应的神经回路基质仍知之甚少,从而阻碍了开发安全有效的治疗措施。可用的治疗措施往往不都是有效,或者就苯二氮类而言,还会上瘾并存在严重的副作用,包括镇静以及可导致认知损害和死亡的呼吸抑制27,28。对哺乳动物大脑中焦虑控制机制的更深入理解29,30对于开发更有效而副作用更少的治疗措施十分必要。尤其引人关注并具有新颖性的是利用抗焦虑作用的天然通路的可能性。
杏仁核在处理中性刺激与积极结果或负面结果之间的关联中具有重要作用,并且还与处理非条件情感状态有关。虽然已在恐惧条件化的背景下对杏仁核微回路进行了功能上的剖析,但是杏仁核还参与许多其他功能和情感状态,包括非条件焦虑。杏仁核由具有复杂互联性的在功能和形态学上具有异质性的亚核组成。杏仁核的主要划分为基底外侧杏仁核复合体(BLA),其涵盖外侧(LA)、基底外侧(BL)和基底内侧(BM)杏仁核(约90%的BLA神经元为谷氨酸能神经元)33,34。相比之下,由中央外侧(CeL)和中央内侧(CeM)核组成的杏仁核中央核(CeA)主要(大约95%)由GABA能中型多棘神经元构成35。BLA包鞘在GABA能闰细胞(ITC)的致密簇中,这些细胞在功能上与CeA的局域中间神经元和中型多棘神经元均不同36,37。杏仁核的主要输出核为CeM,32,35,38-40其在通过化学或电方式兴奋时,通过投射到脑干而介导与恐惧和焦虑相关的自主和行为反应6,12,32,35。虽然CeM不直接通过会聚环境和认知信息(LA)的主要杏仁核部位进行控制12,38,41,但是LA和BLA神经元可使GABA能CeL神经元兴奋42,这可向CeM40,46“输出”神经元上提供前馈抑制并减少杏仁核输出。BLA-CeL-CeM是一种研究还不够透彻的通路,已表明其不涉及恐惧消退而是涉及条件性抑制,因音调和惊吓的明确不成对所致的恐惧表达抑制与BLA-CeL突触的增强相关47。虽然将恐惧表征为一种通过外因触发的位相状态,而焦虑则是一种可能在不存在外部触发因素下发生的持续性状态,因此我们想知道调节恐惧的条件性抑制的回路是否也会涉及调节焦虑的非条件抑制。
材料和方法
受试者:将实验程序开始时为4-6周龄的雄性C57BL/6小鼠维持在12小时的光照/黑暗交替循环中,并随意提供食物和水。图3、4和5中所示的动物(ChR2终末、EYFP终末和ChR2细胞体组中的小鼠)均单只地关在典型的高容量小鼠笼舍中,以增加基线焦虑水平。每只小鼠属于单个处理组。图6中所示的动物(双侧EYFP和eNpHR3.0组)按组关在特殊的高容量笼舍中以降低基线焦虑水平。动物饲养以及动物实验操纵的所有方面均按照National Institute of Health的指导原则进行,并得到了Stanford Institutional Animal Care and Use Committee成员的批准。
光强测量:使用得自急性处死的小鼠的脑组织块进行了光透射测量。然后将组织置于功率表(ThorLabs,Newton,NJ)的光电检测器上方,以测量穿透组织的激光的光功率。将300μm直径的光纤的顶端耦合到473nm蓝色激光器(OEM Laser Systems,East Lansing,MI)。为了表征斜面相对侧的光透射,将功率表的光电检测器平行于斜口插管布置。为了使光锥可视化,我们使用了置于比色皿中的约5mg/ml的荧光素异硫氰酸酯-葡聚糖(FD150s;Sigma,Saint Louis,MO),使具有或不具有斜口插管屏蔽的光纤正对荧光素上方。考虑到由于光锥形输出所致的强度的分率降低以及因组织中的散射所致的光损失,计算了特定深度的功率密度(Aravanis et al.,J Neural Eng,4:S143-156,2007)(Gradinaru et al.,J Neurosci,27:14231-14238,2007)。多模光纤发散角θdiv的半角(决定输出光的角展度)为
其中ntis为灰质的折射率(1.36,Vo-Dinh T 2003,Biomedical Photonics Handbook(Boca Raton,FL:CRC Press))以及NAfib(0.37)为光纤的数值孔径。随着离开光纤的距离(z)因光的锥形扩散所致的强度的分率变化使用三角函数计算
其中
并且r为光纤的半径(100μm)。
将因散射所致的损失后的光分率透射使用经验测量和Kubelka-Munk模型1,2作为双曲线函数建模,而光纤顶端的功率密度以及因锥形扩散和光散射所致的分率变化的联合乘积则得出光纤下方特定深度的功率密度值。
病毒构建和包装:由University of North Carolina的病毒载体中心(viral vector core)将重组AAV载体通过AAV5外壳蛋白进行血清分型,并进行包装。病毒滴度对于AAV-CaMKIIα-hChR2(H134R)-EYFP、AAV-CaMKIIα-EYFP和AAV-CaMKIIα-eNpHR 3.0-EYFP分别为2×10e12个颗粒/mL、3×10e12个颗粒/mL、4×10e12个颗粒/mL。通过使用MluI和EcoRI限制性位点将CaMKIIα-eNpHR3.0-EYFP克隆进AAV主链而构建pAAV-CaMKIIα-eNpHR3.0-EYFP质粒。相似地,通过使用MluI和EcoRI限制性位点将CaMKIIα-EYFP克隆进AAV主链而构建pAAV-CaMKIIα-EYFP质粒。图谱可在www.optogenetics.org在线获得,其以引用方式并入本文。
立体定位注射和光纤放置:所有手术均在无菌条件下通过立体定位指引进行。将小鼠用1.5-3.0%的异氟烷麻醉。所有坐标均相对于前囱,单位为mm3。在所有实验中,无论体内还是体外,均只将病毒递送到BLA,而CeA中的任何病毒表达均从所有实验中排除。将引导插管倾斜以形成45-55度角,以限制向CeA的照明。将斜口引导插管的短侧以前内侧方向设置,而斜口插管的长侧则屏蔽光锥的后外侧,从而面向病毒注射针的相反方向。为了优先靶向BLA-CeL突触,我们将视蛋白基因表达限制到BLA谷氨酸能投射神经元以及将光递送限制到CeA。BLA谷氨酸能投射神经元的控制通过使用携带光活化的光遗传学控制基因的腺相关病毒(AAV5)载体在CaMKIIα启动子的控制下实现。在BLA内,CaMKIIα只在谷氨酸能锥体神经元而不在局域中间神经元中表达4。ChR2终末和EYFP终末组中的小鼠接受光纤的单侧斜口插管植入(半球的反平衡),而eNpHR 3.0或相应的EYFP组中的小鼠则在CeA的上方接受斜口插管的双侧植入(-1.06mm前后位(AP)、±2.25mm中间外侧(ML)和-4.4mm背腹侧(DV);PlasticsOne,Roanoke,VA)3。ChR2细胞体组中的小鼠以(-1.6mm AP;±3.1mm ML;-4.5mm DV)在BLA上方接受Doric跳线长期植入式光纤(NA=0.22;Doric lenses,Quebec,Canada)的单侧植入3。对于所有小鼠,使用面向后侧的斜口33或35号金属针将0.5μl纯化的AAV5经单侧或双侧注射到BLA(±3.1mm AP,1.6mm ML,-4.9mm DV)中3,以将病毒输注限制到BLA。将10μl Hamilton微量注射器(nanofil;WPI,Sarasota,FL)用于通过微量注射器泵(UMP3;WPI,Sarasota,FL)及其控制器(Micro4;WPI,Sarasota,FL)递送浓缩的AAV溶液。然后,将0.5μl病毒溶液在各部位以0.1μl每分钟的速率注射。注射完成后,将针提起0.1mm,再保持10分钟,然后慢慢抽出。将一层粘合水泥(C&B metabond;Parkell,Edgewood,NY)接着为颅骨整形水泥(Dental cement;Stoelting,Wood Dale,IL)用于将光纤引导系统固定到颅骨。20分钟后,将切口使用组织粘合剂(Vetbond;Fisher,Pittsburgh,PA)闭合。将动物放在加热垫上,直至从麻醉中恢复。将引锭帽(dummy cap)(大鼠:C312G,小鼠:C313G)插入以保持引导插管的专利性。在4-6周后进行行为和电生理学实验,以允许病毒表达。
体内记录:如前人所述(Gradinaru et al.,J Neurosci,27:14231-14238,2007),同时进行之前(4-6周前)用AAV-CaMKIIa-ChR2-eYFP病毒构建体在BLA中转导的成年雄性小鼠的中央杏仁核(CeA)光刺激和基底外侧杏仁核(BLA)电记录。动物在开颅手术前用异氟烷深麻醉,并具有阴性捏指(toe pinch)反射。通过立体定位将小鼠对准后,手术摘除约3mm2的杏仁核背侧的颅骨。调整坐标以允许颅骨和大脑发育生长,当小鼠在4至6周龄接受手术时以及当小鼠8-10周龄进行实验时(-1.5mm AP、±2.75mm ML居中)3,将1Mohm的0.005英寸细胞外钨电极(A-M systems)在立体定位下在BLA上方插入经开颅手术的脑区域(单位为mm:-1.65AP,±3.35ML,-4.9DV)3。单独地,将数值孔径为0.2、芯径为200μm的纤维光缆(Thor Labs)在立体定位下插入CeA背侧的大脑(-1.1AP,±2.25ML,-4.2DV)3。采集光诱发反应后,将电压斜升用于在长度为2秒的刺激期间(20Hz、5毫秒脉冲宽度)改变光强。采集光诱发的信号后,记录光纤的精确位置,从大脑中移除光纤,插入定制斜口插管,再次插入相同的位置,并重复相同的方案。在大部分试验中,然后从大脑中取出光纤/插管,移除插管,然后将裸光纤再次插入以确保发出诱发信号的神经元群的保真度。将记录的信号在300Hz与20kHz之间带通滤波,交流放大1000倍或10000倍(A-M Systems 1800),并数字化(Molecular Devices Digidata 1322A)然后使用Clampex软件(Molecular Devices)记录。将Clampex软件用于记录场信号以及控制耦合到光极的473nm(OEM Laser Systems)固态激光二极管光源。将光纤顶端的光功率在<1mW(约14mW/mm2)与28mW(约396mW/mm2)之间调节,并使用标准光功率表(ThorLabs)测量。在将异氟烷麻醉降低到1%的恒定水平后,在BLA背侧约1mm开始电生理学记录。将光极以大约0.1mm的阶梯变化在腹侧降低,直至定位到光诱发的信号。
行为测定:用于行为测定的所用动物均接受BLA神经元病毒转导和植入,使得能够实现单侧(对于ChR2组和对照)或双侧(对于eNpHR3.0组和对照)光递送。对于行为测定,将多模光纤(数值孔径0.37,芯径300μm,BFL37-300;ThorLabs,Newton,NJ)精确切割成用于将光限制到CeA的最佳长度,其短于斜口插管的长边缘,但长于斜口插管的最短边缘。对于光学刺激,将光纤通过FC/PC适配器连接到473nm或594nm激光二极管(OEM Laser Systems,East Lansing,MI)。使用Master-8脉冲刺激器(A.M.P.I.,Jerusalem,Israel)对激光输出进行控制,以针对473nm光实验递送频率为20Hz、脉冲宽度为5毫秒的光序列,而针对594nm光实验递送恒定光。所有包括在内的动物均具有位于BLA中的病毒注射中心,但有时存在向相邻区域的或沿着针道的泄漏。当CeA中存在任何可检测的病毒表达时,将相应的动物排除在外。对光的所有统计显著性效果进行了讨论,而未进行讨论的比较则未表现出可检测的差异。
高架十字迷宫由塑料制成,并包括从中央平台(5×5×5cm)以十字形式呈90度延伸的两个浅灰色开臂(30×5cm)、两个黑色闭臂(30×5×30cm)。迷宫置于地板以上30cm高。将小鼠单独地放在中心。在开始试验阶段前,让小鼠从处理中恢复1-5分钟。将视频跟踪软件(BiObserve,Fort Lee,NJ)用于跟踪小鼠位置、速度以及头、身体和尾巴移动。显示的所有测量值均相对于小鼠身体。光刺激方案按组指定。将ChR2:BLA-CeA小鼠和相应的对照组(EYFP:BLA-CeA和ChR2:BLA胞体)单只地关在高应力环境中至少1周,然后进行焦虑测定:以7-8mW(光纤顶端处为约106mW/mm2,CeL处为约6.3mW/mm2以及CeM处为约2.4mW/mm2)的473nm光脉冲序列(5毫秒脉冲,频率20Hz)对CeA中的BLA终末进行单侧照明。对于ChR2细胞体组,将BLA神经元以较低的光功率直接照明,因为7-8mW的照明诱导了癫痫发作,因此我们以3-5mW(约57mW/mm2)的473nm光脉冲序列(5毫秒脉冲,频率20Hz)对BLA神经元进行单侧照明。对于eNpHR 3.0和相应的EYFP组,所有小鼠被按组关在笼舍中,并接受双侧病毒注射以及以4-6mW(光纤顶端处为约71mW/mm2,CeL处为约4.7mW/mm2以及CeM处为约1.9mW/mm2)的594nm光对CeA中BLA终末进行的双侧照明,其中在5分钟的光开时期中保持恒定照明。将15分钟的试验阶段分成3个为期5分钟的时期,第一个时期无光刺激(光灭),第二个时期以如上指定的条件递送光线(光开),第三个时期无光刺激(光灭)。
将旷场实验箱(50×50cm)和旷场分成中心场(中心,23×23cm)和外场(周边)。将各只小鼠置于旷场周边,通过摄像机记录动物的路径。通过使用相同的视频跟踪软件Viewer2(BiObserve,Fort Lee,NJ)对总行进距离进行分析。在高架十字迷宫试验后,立即进行旷场评估。旷场试验包括18分钟的阶段,其中存在六个为期3分钟的时期。各时期在无光刺激与有光刺激周期之间交替,开始时为光灭时期。对于所有分析和图表,其中只显示“灭”和“开”条件,将3个“灭”时期汇总在一起,将3个“开”时期也汇总在一起。
对于谷氨酸受体拮抗剂操纵,谷氨酸拮抗剂溶液包含溶于盐水(0.9%NaCl)中的22.0mM NBQX和38.0mM D-APV(Tocris,Ellisville,MO)。在焦虑测定前5-15min,将0.3μl谷氨酸拮抗剂溶液通过被插入用于通过光纤递送光线的相同引导插管中的内部输注针输注到CeA,该输注针连接到10μl Hamilton注射器(nanofil;WPI,Sarasota,FL)。通过注射器泵(Harvard Apparatus,MA)调节流速(0.1μl/min)。病毒注射、引导插管和长期植入光纤的放置如图7和10中所示通过组织学加以确认。
双光子光遗传学回路作图和体外电生理记录:将小鼠在4周龄时注射AAV5-CaMKIIα-ChR2-EYFP,并在允许病毒表达的4-6周时间后处死以制作急性切片。制作包含BLA和CeA的冠状切片,以研究BLA与CeA之间的功能联系。在恒定的aCSF灌注下进行双光子成像和电生理记录,其中aCSF包含(单位mM):126NaCl、26NaHCO3、2.5KCl、1.25NaH2PO4、1MgCl2、2CaCl2和10葡萄糖。所有记录均在32℃下进行。将贴片电极(4-6MOhm)充灌(单位mM):10HEPES、4Mg-ATP、0.5MgCl2、0.4Na3-GTP、10NaCl、140葡萄糖酸钾和80Alexa-Fluor 594酰肼(Molecular Probes,Eugene OR)。在BLA、CeL和CeM神经元中进行了全细胞膜片钳记录,让细胞充胀大约30分钟,然后在改进的双光子显微镜(Prairie Microscopes,Madison WI)上成像,其中双光子成像、全细胞记录和光遗传学刺激可同时进行。微电极的串联电阻通常为10–20MOhm。除非另外指明,否则均使用约7mW/mm2的473nm LED(Thorlabs,Newton NJ)引发蓝色光脉冲。将Coherent Ti-Saphire(掺钛蓝宝石)激光器用于对ChR2-YFP(940nm)和Alexa-Fluor 594(800nm)两者成像。还将具有滤光片630/69和542/27的FF560二向色镜(Semrock,Rochester NY)用于分离两种分子的发射。所有图像均使用40X/.8NA LUMPlanFL/IR物镜(Olympus,Center Valley PA)采集。为了分离光纤从BLA向CeL的投射以及研究CeM中的反应,用未照明的BLA如上所述制作切片。通过从正对在CeL上方的物镜的照明,在CeM中进行了全细胞记录。为了进一步确保终末从BLA到CeL的活化是选择性的,将照明围绕CeL的中心限制到大约125μm的直径。这里,使用XCite卤素光源(EXPO,Mississauga,Ontario)引发蓝色光脉冲,该光源具有耦合到快门(Uniblitz,Rochester NY)的470/3滤光片(6.5mW/mm2)。对于功能作图,我们首先从表达ChR2的BLA神经元进行记录,同时采集电生理记录并将细胞用Alexa-Fluor 594酰肼染料充灌以允许双光子成像。沿着充灌BLA神经元的轴突在多个位置采集了双光子多层光切图像。我们然后顺着向CeL核投射的BLA神经元的轴突,从BLA终末区域中的CeL进行记录。接着,我们在顺着CeL神经元轴突向CeM之前,同时地从CeL神经元进行记录、用染料充灌细胞并执行双光子实时成像。我们随后在CeM神经元中重复了这一程序,但将光移回到CeL中的终末区域,以通过体内执行时相同的刺激参数模拟BLA-CeL突触的优先照明。在-70mV和0mV下进行了电压钳记录,以分别分离EPSC和IPSC。通过浴液灌流谷氨酸受体拮抗剂(n=5)NBQX(22μM)和AP5(38μM),EPSC经确认为EPSC;通过浴液灌流荷包牡丹碱(10μM;n=2),IPSC经确认为IPSC,这些物质将分别取消EPSC和IPSC。我们还在约-70mV下细胞静息时进行了电流钳记录。
对于光遗传学驱动的BLA轴突终末中的逆行刺激的表征,将动物在4周龄时注射AAV5-CaMKIIα-ChR2-EYFP,并在允许病毒表达的4-6周后处死用于制作急性切片。切片的制作与上文相同。向aCSF中添加0.1mM木防己苦毒素、10μM CNQX和25μM AP5(Sigma,St.Louis,MO)。在BLA神经元中进行了全细胞膜片钳记录,并在双光子成像前让神经元充灌大约30分钟。微电极的串联电阻通常为10–20MOhm。所有图像均使用40X/.8NA LUMPlanFL/IR物镜(Olympus,Center Valley PA)采集。使用XCite卤素光源(EXPO,Mississauga,Ontario)引发蓝色光脉冲,该光源具有耦合到快门(Uniblitz,Rochester NY)的470/30滤光片(6.5mW/mm2)。沿着充灌BLA神经元的轴突在多个位置采集了双光子多层光切图像。只将朝向CeL核直径超过约300μm的可看到其轴突的神经元包括在实验中,并将向着所有方向都具有突起的神经元也排除在外。通过相对于约125μm直径的蓝色光斑移动切片,进行了轴突之上/之外的刺激。为了对切片的正确表达进行校准,在CeL细胞上进行了全细胞膜片钳试验,并将约125μm直径的蓝色脉冲光斑用于确保从BLA终末向CeL神经元上的突出释放可靠地进行。
为了解剖向CeM的直接和间接投射,将动物在4周龄时注射AAV5-CaMKIIα-ChR2-EYFP,并在允许病毒表达的4-6周后处死用于制作急性切片。切片的制作与上文相同。通过40X/.8NA LUMPlanFL/IR物镜(Olympus,Center Valley PA)递送光线。在CeM核中进行全细胞膜片钳试验前,记下CeL核的位置以便通过限制到此区域的光斑再次回到该位置。在CeM神经元中进行了全细胞膜片钳记录。微电极的串联电阻通常为10–20MOhm。使用XCite卤素光源(EXPO,Mississauga,Ontario)引发蓝色光脉冲,该光源具有耦合到快门(Uniblitz,Rochester NY)的470/30滤光片(6.5mW/mm2)。在CeM记录期间,对CeA中的BLA终末广泛照明(约425-450μm直径),并采用2秒的20Hz、5毫秒光序列。在70mV和0mV下进行了电压钳记录,以分别分离EPSC和IPSC。也进行了电流钳记录。然后,使用约125μm直径的限制光斑将照明移动到CeL。我们在-70mV和0mV再次进行了电压钳记录,并使用2秒的20Hz、5毫秒光序列。对于电流钳中的CeM神经元尖峰抑制实验,我们采用了诱导尖峰所需的最小电流阶跃(约60pA)并同时通过2秒的20Hz、5毫秒光序列对CeL中的ChR2表达性BLA终末进行优先照明(每个细胞6次扫描的平均值)。对于在CeM居中的BLA终末区域的广泛照明与BLA-CeL终末的选择性照明之间的比较实验,在相同的CeM细胞中反复交替地执行了这些条件(n=7)。
为了确认终末抑制未改变体细胞尖峰,将动物在4周龄时注射AAV5-CaMKIIα-eNpHR3.0-EYFP,并在允许病毒表达的4-6周后处死用于制作急性切片。切片的制作与上文相同。在BLA神经元中进行了全细胞膜片钳记录,并让神经元充灌大约30分钟。通过40X/.8NA LUMPlanFL/IR物镜(Olympus,Center Valley PA)递送光线。在BLA神经元上进行了全细胞膜片钳记录。微电极的串联电阻通常为10–20MOhm。使用XCite卤素光源(EXPO,Mississauga,Ontario)引发黄色光脉冲,该光源具有耦合到快门(Uniblitz,Rochester NY)的589/24滤光片(6.5mW/mm2)。成斑之后,将未限制的光斑(直径约425-450微米)置于BLA胞体上方,并施加1秒脉冲。如果记录的电流低于600pA的超极化电流并且轴突向CeL核的行进距离未超过约300μm,则将相应的细胞排除。然后将光斑直径限制到约125μm。通过1秒的光脉冲,进行了轴突之上和之外的电压钳记录。对于电流钳记录,通过膜片微电极向细胞体施加250pA的电流生成动作电位。
为了证实eNpHR3.0表达性BLA终末的选择性照明降低自发囊泡释放的概率,将动物在4周龄时注射AAV5-CaMKIIα-eNpHR3.0-EYFP,并在允许病毒表达的4-6周后处死用于制作急性切片。切片的制作与上文相同。在中央外侧神经元中进行了全细胞膜片钳记录。通过40X/.8NA LUMPlanFL/IR物镜(Olympus,Center Valley PA)递送光线。微电极的串联电阻通常为10–20MOhm。使用XCite卤素光源(EXPO,Mississauga,Ontario)引发黄色光脉冲,该光源具有耦合到快门(Uniblitz,Rochester NY)的589/24滤光片(6.5mW/mm2)。将光斑直径限制到约125μm。将卡巴胆碱以20μM的浓度加到浴液中。在CeL神经元中的sEPSC活动增强后,施加5秒至30秒范围内的光脉冲。
为了证实eNpHR3.0表达性BLA终末的选择性照明可降低电刺激诱发的囊泡释放的概率,将动物在4周龄时注射AAV5-CaMKIIα-eNpHR3.0-EYFP,并在允许病毒表达的4-6周后处死用于制作急性切片。切片的制作与上文相同。将双极同心刺激电极(FHC,Bowdoin ME)置于BLA中。在CeL神经元中进行了全细胞膜片钳记录。通过40X/.8NA LUMPlanFL/IR物镜(Olympus,Center Valley PA)递送光线。微电极的串联电阻通常为10–20MOhm。使用XCite卤素光源(EXPO,Mississauga,Ontario)在中央外侧细胞上方引发琥珀色光脉冲,该光源具有耦合到快门(Uniblitz,Rochester NY)的589/24滤光片(6.5mW/mm2)。将光斑直径限制到约125μm。将电脉冲递送40秒,在10秒时开始递送光线,在中间30秒时关闭光线。
对于解剖跟踪实验,当观察到所跟踪的轴突被切断时将相应的神经元排除,解剖测定中包含的所有BLA神经元(图5a-i)显示出电流阶跃时BLA锥体神经元的典型尖峰模式18。
切片免疫组织化学:在终止体内光刺激后100-110min,将麻醉后的小鼠经心脏灌注冰冷的4%多聚甲醛(PFA)的PBS溶液(pH 7.4)。将脑在4%的PFA中固定过夜,然后在30%的蔗糖的PBS溶液中平衡。在冷冻切片机上切割40μm厚的冠状断面,保存在4℃的冷冻保护剂中直至进行处理用于免疫组织化学分析。将漂片在PBS中洗涤,然后在0.3%Tx100和3%正常驴血清(NDS)中孵育30min。在4℃下在3%NDS/PBS(兔抗c-fos 1:500,Calbiochem,La Jolla,CA;小鼠抗CaMKII 1:500,Abcam,Cambridge,MA)中进行一抗孵育。然后洗涤切片,并在室温下用偶联到Cy3或Cy5(Jackson Laboratories,West Grove,PA)的二抗(1:1000)孵育3小时。在用DAPI(1:50,000)孵育20min后,洗涤切片并通过PVD-DABCO安装到显微镜载片上。
共聚焦显微术及分析:使用20X/0.70NA或40X/1.25NA油浸物镜在Leica TCS SP5扫描激光显微镜上采集了共聚焦荧光图像。使用等同的设置采集了通过多个切片的涵盖10μm深度的多层光切图像。Volocity图像分析软件(Improvision/PerkinElmer,Waltham,MA)计算每个视野的c-fos阳性细胞数,方式是使c-fos免疫反应性的阈值高于背景水平并使用DAPI染色显现核。所有图像和分析均在对实验条件设盲的情况下进行。
统计:对于行为实验和体外电生理学数据,使用非参数自举(bootstrapped)t检验(在适当的情况下配对或非配对)对两两比较进行了检验5,而涉及两组以上的假设则使用线性对比进行检验(分别使用R语言的“boot”和“lme4”包6);将后者与作为遗传或药理学操纵和光处理(开或灭)的固定效应制定为线性混合效应模型(“双向重复测量方差分析”)系数之间的比对。所有假设检验均先验指定。将受试者作为随机效应建模。对于c-fos定量比较,我们使用了单因素方差分析然后是Tukey多重比较检验。
数据图清楚地显示了观测平均值和观测方差之间的关系(也就是说,它们为异方差的;参见例如图3e和图5j)。我们发现标准平方根变换能对此很好地纠正。另外,eNpHR3.0高架十字迷宫(EPM)数据需要通过对时间的线性拟合而消除趋势,以解释随时间变化探索行为的降低。按照双向线性混合效应模型(也称为双向重复测量方差分析)的标准,我们将第ij个细胞中的第k个观测值(yijk)(的平方根修正值)建模为
其中
μ为所有细胞的总平均值(其中观测值集合中的第ij个“细胞”对应于第i种条件和第j种处理)
ci是所有处理(例如遗传操纵)中由于第i种动物条件所致的固定效应
tj是所有条件(例如光开或光灭)中由于第j种处理所致的固定效应
(c:t)ij是由于第ij个细胞中第i种条件和第j种处理的相互作用所致的固定效应
bj是对应于在所有处理中所用的动物的随机效应,以及
eijk是第ijk个观测值中独立同分布(i.i.d.)随机正态干扰,具有平均值0和方差σ2并且对于所有j与bj无关
将固定效应集中到双向方差分析(ANOVA)设计矩阵中、在稀疏矩阵中虚拟编码并让我们可以矩阵形式将模型表示为
其中和分别是随机变量和e的观测值,并且我们的模型假定
其中N(μ,Σ)表示具有平均向量μ和方差-协方差矩阵Σ的多元高斯分布,并且⊥表示两个变量为自变量。为了估计系数向量以及方差参数σ和稀疏(块对角)相对方差-协方差矩阵我们使用由Douglas Bates和Martin Maechler以R语言编写的lme4包,其使用多项式迭代加权最小二乘法首先发现了将随机效应“放在球体内”的坐标的线性变化,然后发现了β、σ和Σ的最大似然估计,从而利用随机效应矩阵的稀疏性加速计算。有关更多信息,参见http://www.r-project.org/的lme4库中的软件包所附的文档。
为了解决最大似然估计,公式2中的设计矩阵X必须具有满列秩。熟知的是,对于具有截距的完全因子设计矩阵(如公式1中)并非如此,并因此必须将线性组合(“对比”)用于限定X的列以便可以估计固定效应系数。由于我们的设计均衡(或接近均衡),我们在与光灭条件相比较的光开相关系数、与对照条件相比较的终末刺激等等之间使用了正交(或接近正交)Helmert对比,如正文中所报告。此类对比使得我们能够在重复测量设计内在彼此之间比较合并的数据(例如,得自多个连续光开条件与光灭条件的数据),从而得到改善的参数估计和检验效能,同时解释动物内的相关性。
结果
BLA细胞具有遍及大脑的各种各样的投射,包括向终纹床核(BNST)、伏核、海马体和皮质的投射38,43。为了测试BLA-CeL突触是否可能为焦虑的相关原因,因此有必要开发一种选择性控制CeL中的BLA终末而不直接影响其他BLA投射的方法。为了优先靶向BLA-CeL突触,我们将视蛋白基因表达限制到BLA谷氨酸能投射神经元以及将光递送限制到CeA。BLA谷氨酸能投射神经元的控制通过携带光活化的光遗传学控制基因的腺相关病毒(AAV5)载体在CaMKIIα启动子的控制下实现;在BLA内,CaMKIIα仅在谷氨酸能锥体神经元中而不在局域中间神经元或闰细胞中表达48。为了将光优先递送到CeA投射,将病毒在立体定位指引下单侧递送进BLA(图7和图8),同时连同在CeL上方植入斜口引导插管以防止将光递送到BLA并允许对CeA进行选择性照明。通过体内电生理记录,将所得的光分布的几何和功能性质在体外和体内进行定量,以确定用于BLA终末而非BLA细胞体的选择性控制的光功率参数(图9)。
为了检验BLA-CeA通路可能执行抗焦虑作用的内源性机制这一假设,我们在两项不同的并得到充分验证的焦虑测定中在投射特异性光遗传学控制下探索了自由活动的小鼠:高架十字迷宫和旷场试验(图3a-f)。当暴露于开放或暴露空间时,小鼠表现出焦虑相关行为,因此在高架十字迷宫的暴露臂或旷场试验箱的中心所花的时间增加表明焦虑减轻49,50。为了测试相关行为的诱导和逆转,我们首先将小鼠暴露于高架十字迷宫三个为期5分钟的时期,其中只在第二个时期中递送光线。
为了确定我们观察到的抗焦虑作用是否是CeA中的BLA终末而不是一般性BLA细胞的活化特异性的,我们将接受投射特异性控制(在ChR2:BLA-CeA组中;图3a)的小鼠与接受对照病毒转导并给予相同照明模式的阴性对照组(EYFP:BLA-CeA)以及在BLA中用AAV-CaMKIIα-ChR2-EYFP病毒转导并直接在BLA上方植入光纤的阳性对照组(ChR2:BLA胞体)进行了比较。对于该组(ChR2:BLA胞体),光刺激未引起在ChR2:BLA-CeA组中观察到的抗焦虑作用(图3b和c);实际上,与对照(EYFP:BLA-CeA和ChR2:BLA胞体组)相比,ChR2:BLA-CeA组在CeA中BLA终末的光诱导活化期间在开臂中所花的时间显著更多(t(42)=8.312;p<0.00001;图3b、c)。ChR2:BLA-CeA小鼠还表现出从迷宫中心的选择点进入开臂而非闭臂的可能性增加(图3c插图),从而表明选择正常致焦虑环境的可能性增加。
我们还探索了小鼠在旷场区域中六个为期3分钟的时期,通过在无光(灭)和光刺激(开)条件之间交替再次测试了可逆性。实验(ChR2:BLA-CeA)小鼠表现出即时、强大和可逆的光诱导抗焦虑反应,如通过在旷场试验箱中心的时间所度量(图3d和e),而EYFP:BLA-CeA和ChR2:BLA胞体组中的小鼠则未表现出这种反应(图3e)。光刺激未明显改变活动度(图3f)。虽然在光灭条件下在各组之中无可检测的差异,但是在光开条件下在ChR2:BLA-CeA组中与EYFP:BLA-CeA或ChR2:BLA胞体组相比,小鼠在旷场中心所化的时间显著增加(t(105)=4.96178;对于各对比p<0.0001)。我们得出结论,选择性刺激BLA向CeA而非BLA胞体的投射产生了急性、快速可逆的抗焦虑作用,从而支持BLA-CeL-CeM通路可能代表了焦虑控制的天然微回路这一假设。
我们接着研究了此光诱导的抗焦虑作用的生理基础。BLA中的谷氨酸能神经元向CeL神经元以及向CeM神经元发送强大的兴奋性投射38;但是,预计不仅是远离光源的CeM突触(图8)而且这些CeM神经元的任何剩余直接兴奋都会导致致焦虑作用而非抗焦虑作用12。然而,CeL神经元可向这些脑干投射性CeM输出神经元发挥强效抑制作用32,35,40,因此,我们假设了对CeA中BLA终末的照明可使BLA-CeL神经元活化,从而引起CeM神经元上的前馈抑制并产生观察到的抗焦虑现象。
为了确认这种光遗传学限定的投射的工作原理,我们通过与行为实验中相匹配的光递送方案进行了体内实验,并将活性依赖性即刻早期基因(c-fos)表达分析作为读出结果以确认神经元活化模式(图3g-k)。在设盲条件下,我们对ChR2:BLA-CeA、EYFP:BLA-CeA和ChR2:BLA胞体组的BLA、CeL和CeM中表达EYFP或表现出c-fos免疫反应性的神经元比例定量(图3i-k)。在BLA中受CaMKIIα启动子控制的病毒表达靶向谷氨酸能神经元47,并且我们未在局域中间神经元和闰细胞中观察到EYFP表达(图10)。在各区域内在各组之中未检测到EYFP阳性细胞比例的显著差异(图3g-k),但是我们发现了与ChR2:BLA-CeA或EYFP:BLA-CeA组相比ChR2:BLA胞体组中c-fos阳性BLA细胞的比例显著更高(图3i;分别为p<0.01和p<0.05)。在ChR2:BLA-CeA与EYFP:BLA-CeA组之间c-fos无可检测的差异,从而表明斜口插管屏蔽有效地防止了向BLA细胞体的直接照明。在ChR2:BLA-CeA组中,相对于EYFP:BLA-CeA组(p<0.05)但非ChR2:BLA胞体组,显著更高比例的CeL神经元表达了c-fos(图3j)。因此,对CeA中表达ChR2的BLA终末的选择性照明导致了CeL神经元的优先活化,而不活化BLA胞体。在CeM中,我们发现了ChR2:BLA胞体组中的c-fos阳性神经元(相对于总神经元)多达ChR2:BLA-CeA中的两倍(图3k),这与解剖学投射一致,因为LA神经元选择性支配CeL神经元,而杏仁核的BL和BM核中的神经元具有向CeL和CeM两者的单突触投射38,43,51。总之,这些数据揭露出:触发急性抗焦虑行为表型的体内照明执行对BLA-CeL突触的选择性照明而不活化BLA细胞体。
为了检验CeL中BLA终末的选择性照明诱导CeM输出神经元的前馈抑制这一假设,我们将全细胞膜片钳记录与实时双光子成像相结合以观察微回路,同时在投射特异性光遗传学控制期间探索这些细胞之间的功能关系(图4a-f)。当将体内所用的光刺激参数通过光纤递送时以及将用于我们的离体实验的参数递送到急性切片上时,我们使靶标位置的光功率密度匹配为约6mW/mm2。图4a显示了BLA-CeL-CeM回路的双光子图像,所有三种细胞均通过同一切片成像(图4a)。对于20Hz、5毫秒的473nm光脉冲的直接照明,表达ChR2-EYFP的BLA神经元显示出稳健、高保真度的尖峰(图4b)。在表达ChR2-EYFP的BLA神经元的终末区域照明期间记录的CeL神经元的代表性图线证实了在CeL中所见的典型兴奋性反应(图4c),其中神经元群汇总揭露了尖峰保真度在40个脉冲光序列中保持稳定,以及揭露了反应性细胞包括弱和强兴奋的CeL细胞(n=16;图4c)。为了测试对BLA-CeL突触的照明是否会因为来自CeL神经元的稳健前馈抑制而在阻断CeM细胞中尖峰的水平上具有功能上的显著性,我们在选择性照明BLA-CeL突触的同时从CeM神经元进行了记录(图4d)。实际上,我们观察到了因CeL中BLA终末的光刺激所致的CeM中的强效尖峰抑制(F2,11=15.35,p=0.0044)(图4d;在照明之前(49±9.0)、期间(1.5±0.87)和之后(33±8.4)每秒的尖峰数;平均值±s.e.m)。接下来,图4e显示了在表达ChR2-EYFP的CeM中BLA神经元终末区域的照明期间记录的CeM反应,以及合并的兴奋性和抑制性输入。电压钳记录中的细胞群汇总示出了EPSC的延迟短于双突触PEPSC的延迟,并且示出了平均IPSC振幅大于平均EPSC振幅(分别在0和-70mV下记录;图4e)。重要的是,在部位之间交替时,完全相同的CeM神经元(n=7)在对CeM的BLA输入进行广泛照明的情况下以可重复的方式产生了净兴奋(图4e),但是在对CeL的BLA输入进行选择性照明的情况下则显示出净抑制(图4f)。这证实了从BLA向CeM的直接和间接输入的平衡可调节CeM输出。总之,这些数据揭露出在结构和功能上鉴定的生理微回路,而CeA中BLA终末的选择性照明借此使BLA-CeL突触活化,从而增加从CeL神经元向脑干投射性CeM神经元的前馈抑制。
为了进一步阐明此抗焦虑作用潜在的杏仁核微回路,我们仔细分析了控制这一现象的解剖和功能特性。虽然已在大鼠中作出了一些努力以对CeA中的BLA侧支的投射作图,但是我们根据经验测试了是重叠的还是不同的BLA神经元群投射到CeL和CeM(图5a、图5b)。一个值得注意的事情是我们在约350um厚的冠状断面中观察这些神经元,并且虽然已经尽了一切努力排除轴突被切断的神经元,但是我们无法排除发生这种情况的可能性,我们也不能否认这引起了靠近CeA的BLA神经元的一些采样偏差。图5a汇总了采样的BLA神经元(n=18)的解剖学投射,并表明44%的神经元仅投射到CeL以及17%的仅投射到CeM。然而,少量的BLA细胞(n=1;6%)投射到CeL和CeM两者,其中一个向CeL和CeM发送单独的侧支,其中一个发送一个侧支,该侧支再向CeL和CeM发送分支。图5b显示了采样的每个细胞的双光子图像,它们均表现出电流阶跃时BLA锥体神经元典型的尖峰模式。
接下来,由于我们的c-fos测定表明CeL中的BLA终末的照明足以使CeL神经元兴奋,但非BLA神经元本身,我们试图通过全细胞记录证实这一假设。通过电刺激,轴突终末的去极化导致了细胞体处的逆行尖峰。然而,有证据表明光遗传学诱导的去极化通过不同的机制发挥功能。为了评价光遗传学诱导的终末刺激在此杏仁核微回路中的特性,我们从表达ChR2的BLA锥体神经元进行了记录,并以视觉确定的轴突侧支上方的方向以及不存在轴突的方向将光斑(直径约120μm)以100μm的步长从细胞体移动(图5c)。给予20Hz光序列时在与胞体各距离处的BLA神经元尖峰保真度汇总在图5d中,而去极化电流则汇总在图5e中。在所有标本中,我们确认了所用的光刺激参数足以引起BLA细胞体处的高保真度尖峰(图5f)和BLA终末处的可靠囊泡释放,如通过从突触后CeL神经元进行的记录所示(图5g;图15)。相比之下,当使光斑距离细胞体300um从相同的BLA神经元进行记录时,我们未观察到可靠的动作电位,无论是否在轴突上方(分别见图5h、图5i)。甚至在浴液灌流GABA和AMPA受体拮抗剂时也观察到了这种逆行尖峰的存在(n=7),从而排除了局部抑制性限制的可能贡献。虽然我们证实了光遗传学诱导的囊泡释放可在BLA锥体神经元中在不存在逆行刺激的情况下发生,但是可能的是,在逆行刺激下可通过比我们在此处所用的(约6mW/mm2)更大的光功率密度实现这种释放。迄今,我们已证实了投射到CeL和CeM的BLA神经元群有很大的区别,并且BLA-CeL突触的照明诱导囊泡释放和CeL兴奋而不使BLA胞体本身强烈活化。
最后,我们在投射特异性光遗传学控制的设置中通过体内药理学分析进一步探索了该机制。为了确定我们观察到的抗焦虑作用是否可能是由于BLA-CeL突触单独的选择性活化所致,而不是穿过CeA的BLA纤维,也不是动作电位向BLA细胞体的反向传播(随后会支配所有BLA投射靶区域),我们测试了局部谷氨酸受体拮抗是否会减弱光诱导的抗焦虑作用。这个问题非常引人关注,因为改变焦虑的CeA中的病变因BLA向穿过CeA的BNST的投射的消融可能性而使人困惑6。我们用AAV-CaMKIIα-ChR2-EYFP对BLA神经元进行了单侧转导,并植入了斜口插管以如之前对CeA中的BLA终末进行选择性照明(n=8;图8),并在高架十字迷宫和旷场试验中对小鼠进行了测试。然而,在这种情况下,我们在相同的动物中通过不同的试验输注谷氨酸拮抗剂NBQX和AP5(使用光纤引导插管)或盐水对照,其中试验的顺序反平衡。确认局部突触机制而非对纤维通道的控制,对于相同的小鼠和光刺激参数,CeA中的局部谷氨酸受体拮抗作用在高架十字迷宫(图5k)和旷场试验(图5j)中均取消了光诱导的焦虑减轻。重要的是,在对照实验中,药物处理未损害活动度(图11),并且浴液灌流NBQX和AP5时在急性切片中的锁时光诱发兴奋性反应被取消(图12)。总之,这些数据表明,我们观察到的光诱导的抗焦虑作用通过BLA-CeL突触的活化所致,而不是归因于BLA向穿过CeA的远侧靶标的投射。
在最后一系列实验中,为了确定内源性焦虑减轻过程是否会被此通路的选择性抑制而阻断,我们测试了这些光遗传学限定的突触的选择性抑制是否会可逆地增加焦虑。我们在BLA中均在CaMKIIα启动子的控制下执行了单独的eNpHR3.0(一种在通过琥珀色光照明时使神经元膜超极化的光活化氯离子泵25)或EYFP的双侧病毒转导,并植入了双侧斜口插管以允许对CeA中的BLA终末进行选择性照明(图6a;图13)。eNpHR3.0表达被限制到BLA中的谷氨酸能CaMKIIα阳性神经元(图6b)。在CeM中,eNpHR3.0:BLA-CeA组相对于EYFP:BLA-CeA双侧和eNpHR 3.0:胞体组仅表现出c-fos表达水平的显著升高(p<0.05;图6c-e),这与以下假设一致:选择性抑制CeA中的BLA终末将抑制从CeL神经元向CeM神经元的前馈抑制,从而增强CeM兴奋性和导致焦虑表型增加的下游过程。重要的是,BLA胞体的抑制未诱导致焦虑反应,这可能是由于直接BLA-CeM兴奋性输入的同时降低。我们还发现,eNpHR3.0:BLA-CeA组相对于EYFP和胞体组(图6f、图6g)在光开期间但非光灭期间表现出高架十字迷宫上开臂时间和开臂进入概率的显著降低,但不改变活动度(图16)。eNpHR3.0:BLA-CeA组还显示出相对于EYFP和胞体组在用594nm光照明时中心时间的显著缩短(统计,p=0.002;图6h、图6i)。最后,我们还证实了表达eNpHR3.0的轴突终末的选择性照明可降低自发(图6j-l)和诱发(图6m-p)囊泡释放的概率,而不阻止细胞体处的尖峰(图14)。这些数据证实了CeA中BLA终末的选择性抑制可诱导焦虑样行为的急性增强。
结论:在这些实验中,我们鉴定了作为内源性神经基质用于双向调节焦虑的非条件表达的BLA-CeL通路。虽然我们将BLA-CeL通路确定为关键基质而非穿过CeL的BLA纤维,但是可能的是,诸如向BNST的CeA投射的其他下游回路也在焦虑或焦虑相关行为的表达中发挥着重要作用4,6,13。实际上,我们的发现可支持这样一种见解,即BNST中的促肾上腺皮质激素释放激素(CRH)网络可在调节焦虑相关行为中发挥关键作用6,52,因为CeL是BNST的主要CRH来源53。
其他神经递质和神经调质可调节或门控对分布式神经回路的作用,包括血清素54,55、多巴胺56、乙酰胆碱57、甘氨酸58、GABA13和CRH59。会聚到此通路以及从此通路分开的神经回路将提供许多调节控制机会,因为BLA-CeL突触的平行或下游回路可能有助于调节焦虑表型的表达6,56。此外,在杏仁核的上游,该微回路良好定位,以被来自对处理恐惧和焦虑具有重要意义的区域的自上而下的皮质控制所利用,包括提供对BLA和CeL的强大神经支配的前边缘、下边缘和岛叶皮质4,13,23,60。
我们对BLA解剖学的研究表明,投射到CeL和CeM神经元的BLA神经元群大部分不重叠。在自然状态下,投射CeL的BLA神经元可以微回路体内平衡机制使投射CeM的BLA神经元兴奋。当存在偏离回路平衡的突触变化以允许未受抑制的CeM活化时,这还可能代表了焦虑障碍潜在的一种可能机制。
总之,此处提供的数据支持将BLA-CeL突触确定为关键性回路元件对于哺乳动物大脑中内源性抗焦虑作用的表达既是必要的也是足够的,从而提供一种深入研究焦虑的新渠道以及一种新的治疗靶标,并且这些数据还证实了分解特异性投射在研究与精神疾病相关的神经回路功能中的重要性。
本发明涉及以下实施方式:
1.一种包含在BLA的谷氨酸能锥体神经元中表达的光反应性视蛋白的动物,其中所述视蛋白为通过光诱导超极化的视蛋白,并且其中所述视蛋白在BLA-CeL中的选择性照明诱导所述动物的焦虑。
2.根据实施方式1所述的动物,其中所述视蛋白选自NpHR、BR、AR和GtR3。
3.根据实施方式1所述的动物,还包含在BLA的谷氨酸能锥体神经元中表达的第二光反应性视蛋白,其中所述第二视蛋白为通过光诱导去极化的视蛋白,并且其中所述第二视蛋白在BLA-CeL中的选择性照明减轻所述动物的焦虑。
4.根据实施方式3所述的动物,其中所述第二视蛋白选自ChR2、VChR1和DChR。
5.一种包含在BLA的谷氨酸能锥体神经元中表达的光反应性视蛋白的动物,其中所述视蛋白为通过光诱导去极化的视蛋白,并且其中所述视蛋白在BLA-CeL中的选择性照明减轻所述动物的焦虑。
6.根据实施方式5所述的动物,其中所述第二视蛋白选自ChR2、VChR1和DChR。
7.一种用于将核酸递送到个体中的BLA谷氨酸能锥体神经元的载体,其中所述载体包含编码光反应性视蛋白的所述核酸并且所述核酸可操作地连接到控制所述视蛋白在谷氨酸能锥体神经元中特异性表达的启动子。
8.根据实施方式7所述的载体,其中编码所述视蛋白的所述核酸可操作地连接到CaMKIIα启动子。
9.根据实施方式7所述的载体,其中所述载体为AAV载体。
10.根据实施方式7所述的载体,其中所述视蛋白为通过光诱导去极化的视蛋白,并且其中所述视蛋白在BLA-CeL中的选择性照明缓解焦虑。
11.根据实施方式10所述的载体,其中所述视蛋白选自ChR2、VChR1和DChR。
12.根据实施方式7所述的载体,其中所述视蛋白为通过光诱导超极化的视蛋白,并且其中所述视蛋白在BLA-CeL中的选择性照明诱导焦虑。
13.根据实施方式12所述的载体,其中所述视蛋白选自NpHR、BR、AR和GtR3。
14.根据实施方式7所述的载体,其中所述个体为小鼠或大鼠。
15.一种用于将核酸递送到个体中的BLA谷氨酸能锥体神经元的方法,包括向所述个体施用有效量的载体,所述载体包含编码光反应性视蛋白的核酸并且所述核酸可操作地连接到控制所述视蛋白在谷氨酸能锥体神经元中特异性表达的启动子。
16.一种包含BLA、CeL和CeM的冠状脑组织切片,其中光反应性蛋白在BLA的谷氨酸能锥体神经元中表达。
17.一种用于筛选可缓解焦虑的化合物的方法,包括
(a)将化合物施用给患有通过选择性照明在BLA谷氨酸能锥体神经元中表达的视蛋白而诱导的焦虑的动物,其中所述动物包含在BLA的谷氨酸能锥体神经元中表达的光反应性视蛋白,其中所述视蛋白为通过光诱导超极化的视蛋白;以及
(b)确定所述动物的焦虑水平,其中所述焦虑水平的降低表示所述化合物可有效治疗焦虑。
18.根据实施方式17所述的方法,其中所述视蛋白选自NpHR、BR、AR和GtR3。
19.一种用于缓解个体焦虑的方法,包括:
(a)向所述个体施用有效量的载体,所述载体包含编码光反应性视蛋白的核酸并且所述核酸可操作地连接到控制所述视蛋白在BLA的谷氨酸能锥体神经元中特异性表达的启动子,其中所述视蛋白在BLA的谷氨酸能锥体神经元中表达,其中所述视蛋白为通过光诱导去极化的视蛋白;以及
(b)选择性照明BLA-CeL的谷氨酸能锥体神经元中的所述视蛋白以缓解焦虑。
20.根据实施方式19所述的方法,其中所述视蛋白选自ChR2、VChR1和DChR。
21.一种用于诱导个体焦虑的方法,包括:
(a)向所述个体施用有效量的载体,所述载体包含编码视蛋白的核酸并且所述核酸可操作地连接到控制所述视蛋白在BLA的谷氨酸能锥体神经元中特异性表达的启动子,其中所述视蛋白在谷氨酸能锥体神经元中表达,其中所述视蛋白为通过光诱导超极化的视蛋白;以及
(b)选择性照明BLA-CeL的谷氨酸能锥体神经元中的所述视蛋白以诱导焦虑。
22.一种涉及改变BLA-CeM的活性以治疗或研究焦虑的装置或方法。
23.根据实施方式22所述的装置或方法,其中改变活性包括选择性刺激BLA-CeL。
24.根据实施方式22所述的装置或方法,其中改变活性包括通过光反应性视蛋白在谷氨酸能锥体神经元中的靶向表达而选择性刺激BLA-CeL。
25.根据实施方式24所述的装置或方法,其中改变活性还包括相对于BLA胞体的照明而选择性照明CeA。
26.根据实施方式24所述的装置或方法,还包括在CeL上方植入斜口引导插管以防止光线递送到BLA并允许选择性照明20CeA。
27.根据实施方式22所述的装置或方法,还包括筛选治疗措施,所述治疗措施包括但不限于药剂、电刺激、磁刺激、手术或光遗传学刺激中的一种或多种。
28.根据前述实施方式任一项所述的装置或方法,还涉及提供靶向BLA-CeM回路的治疗措施,所述治疗措施包括但不限于药剂、电刺激、磁刺激、手术或光遗传学刺激中的一种或多种。
29.一种使用本公开所述的回路模型研究和探索焦虑和/或相关障碍的装置或方法。
30.根据前述实施方式任一项所述的装置或方法,还包括确定表型、内表型和治疗靶标中的一种或多种。
31.一种根据本公开的任何实施方案的装置或方法,所述实施方案包括实施例中所述的实施方案。
虽然已出于清楚理解的目的通过例证和实例的方式比较详细地说明了上述发明,但是这些说明和实例不应视为限制本发明的范围。
本文公开的所有参考文献、出版物和专利申请据此全文以引用方式并入。
参考文献
1.Lieb,R.Anxiety disorders:clinical presentation and epidemiology.Handb Exp Pharmacol,405-432(2005).
2.Kessler,R.C.,et al.Lifetime prevalence and age-of-onset distributions of DSM-IV disorders in the National Comorbidity Survey Replication.Arch Gen Psychiatry 62,593-602(2005).
3.Koob,G.F.Brain stress systems in the amygdala and addiction.Brain Res 1293,61-75(2009).
4.Ressler,K.J.&Mayberg,H.S.Targeting abnormal neural circuits in mood and anxiety disorders:from the laboratory to the clinic.Nat Neurosci 10,1116-1124(2007).
5.Vanderschuren,L.J.&Everitt,B.J.Behavioral and neural mechanisms of compulsive drug seeking.Eur J Pharmacol 526,77-88(2005).
6.Davis,M.,Walker,D.L.,Miles,L.&Grillon,C.Phasic vs sustained fear in rats and humans:role of the extended amygdala in fear vs anxiety.Neuropsychopharmacology 35,105-135.
7.Ehrlich,I.,et al.Amygdala inhibitory circuits and the control of fear memory.Neuron 62,757-771(2009).
8.Han,J.H.,et al.Selective erasure of a fear memory.Science 323,1492-1496(2009).
9.Herry,C.,et al.Switching on and off fear by distinct neuronal circuits.Nature 454,600-606(2008).
10.LeDoux,J.The emotional brain,fear,and the amygdala.Cell Mol Neurobiol 23,727-738(2003).
11.Maren,S.&Quirk,G.J.Neuronal signaling of fear memory.Nat Rev Neurosci 5,844-852(2004).
12.Pare,D.,Quirk,G.J.&Ledoux,J.E.New vistas on amygdala networks in conditioned fear.J Neurophysiol 92,1-9(2004).
13.Shin,L.M.&Liberzon,I.The neurocircuitry of fear,stress,and anxiety disorders.Neuropsychopharmacology 35,169-191.
14.Davis,M.The role of the amygdala in conditioned and unconditioned fear and anxiety.in The Amygdala(ed.A.JP)p.213-288(Oxford University Press,Oxford,UK,2000).
15.Killcross,S.,Robbins,T.W.&Everitt,B.J.Different types of fear-conditioned behaviour mediated by separate nuclei within amygdala.Nature 388,377-380(1997).
16.Tye,K.M.&Janak,P.H.Amygdala neurons differentially encode motivation and reinforcement.J Neurosci 27,3937-3945(2007).
17.Tye,K.M.,Stuber,G.D.,de Ridder,B.,Bonci,A.&Janak,P.H.Rapid strengthening of thalamo-amygdala synapses mediates cue-reward learning.Nature 453,1253-1257(2008).
18.Bahi,A.,Mineur,Y.S.&Picciotto,M.R.Blockade of protein phosphatase 2B activity in the amygdala increases anxiety-and depression-like behaviors in mice.Biol Psychiatry 66,1139-1146(2009).
19.Davis,M.Are different parts of the extended amygdala involved in fear versus anxiety?Biol Psychiatry 44,1239-1247(1998).
20.Etkin,A.,et al.Individual differences in trait anxiety predict the response of the basolateral amygdala to unconsciously processed fearful faces.Neuron 44,1043-1055(2004).
21.Kalin,N.H.,Shelton,S.E.&Davidson,R.J.The role of the central nucleus of the amygdala in mediating fear and anxiety in the primate.J Neurosci 24,5506-5515(2004).
22.Roozendaal,B.,McEwen,B.S.&Chattarji,S.Stress,memory and the amygdala.Nat Rev Neurosci(2009).
23.Stein,M.B.,Simmons,A.N.,Feinstein,J.S.&Paulus,M.P.Increased amygdala and insula activation during emotion processing in anxiety-prone subjects.Am J Psychiatry 164,318-327(2007).
24.Boyden,E.S.,Zhang,F.,Bamberg,E,Nagel,G.&Deisseroth,K.Millisecond-timescale,genetically targeted optical control of neural activity.Nat Neurosci 8,1263-1268(2005).
25.Gradinaru,V.,at aL Molecular and cellular approaches for diversifying and extending optogenetics.Ce//141,154-165.
26.Nagel,G.,at al.Channelrhodopsin-2,a directly light-gated cation-selective membrane channel.Proc Nat/Acad Sci U S A 100,13940-13945(2003).
27.Fraser,A.D.Use and abuse of the benzodiazepines.Ther Drug Monit 20,481-489(1998).
28.Woods,J.H.,Katz,J.L.&Winger,G.Benzodiazepines:use,abuse,and consequences.
Pharmacol Rev 44,151-347(1992).
29.Hovatta,I.&Barlow,C.Molecular genetics of anxiety in mice and men.Anti Med 40,92-109(2008).
30.Hovatta,I.,et al.Glyoxalase 1 and glutathione reductase 1 regulate anxiety in mice.Nature 438,662-666(2005).
31.Blanchard,R.J.,Yudko,E.B.,Rodgers,R.J.&Blanchard,D.C.Defense system psychopharmacology:an ethological approach to the pharmacology of fear and anxiety.Behav Brain Res 58,155-165(1993).
32.LeDoux,J.E.,Iwata,J.,Cicchetti,P.&Reis,D.J.Different projections of the central amygdaloid nucleus mediate autonomic and behavioral correlates of conditioned fear.J Neurosci 8,2517-2529(1988).
33.Carlson,J.lrnmunocytochemical localization of glutamate decarboxylase in the rat basolateral amygdaloid nucleus,with special reference to GABAergic innervation of amygdalostriatal projection neurons.J Comp Neurol 273,513-526(1988).
34.Smith,Y.&Pare,D.Intra-amygdaloid projections of the lateral nucleus in the cat:PHA-L anterograde labeling combined with postembedding GABA and glutamate immunocytochemistry.J Comp Neurol 342,232-248(1994).
35.McDonald,A.J.Cytoarchitecture of the central amygdaloid nucleus of the rat.J Comp Neurol 208,401-418(1982).
36.Bissiere,S.,Humeau,Y.&Luthi,A.Dopamine gates LTP induction in lateral amygdala by suppressing feedforward inhibition.Nat Neurosci 6,587-592(2003).
37.Marowsky,A.,Yanagawa,Y.,Obata,K.&Vogt,K.E.A specialized subclass of interneurons mediates dopaminergic facilitation of amygdala function.Neuron 48,1025-1037(2005).
38.Pitkanen,A.Connectivity of the rat amygdaloid complex.in The Amygdala(ed.A.JP)p.31-99(Oxford University Press,Oxford,UK,2000).
39.Krettek,J.E.&Price,J.L.Amygdaloid projections to subcortical structures within the basal forebrain and brainstem in the rat and cat.J Comp Neurol 178,225-254(1978).
40.Petrovich,G.D.&Swanson,L.W.Projections from the lateral part of the central amygdalar nucleus to the postulated fear conditioning circuit.Brain Res 763,247-254(1997).
41.LeDoux,J.E.,Cicchetti,P.,Xagoraris,A.&Romanski,L.M.The lateral amygdaloid nucleus:sensory interface of the amygdala in fear conditioning.J Neurosci 10,1062-1069(1990).
42.Krettek,J.E.&Price,J.L.A description of the amygdaloid complex in the rat and cat with observations on intra-amygdaloid axonal connections.J Comp Neurol 178,255-280(1978).
43.Petrovich,G.D.,Risold,P.Y.&Swanson,L.W.Organization of projections from the basomedial nucleus of the amygdala:a PHAL study in the rat.J Comp Neural 374,387-420(1996).
44.Pare,D.&Smith,Y.The intercalated cell masses project to the central and medial nuclei of the amygdala in cats.Neuroscience 57,1077-1090(1993).
45.Likhtik,E.,Popa,D.,Apergis-Schoute,J.,Fidacaro,G.A.&Pare,D.Amygdala intercalated neurons are required for expression of fear extinction.Nature 454,642-645(2008).
46.Jolkkonen,E.&Pitkanen,A.Intrinsic connections of the rat amygdaloid complex:projections originating in the central nucleus.J Comp Neurol 395,53-72(1998).
47.Amano,T.,Unal,C.T.&Pare,D.Synaptic correlates of fear extinction in the amygdala.Nat Neurosci 13,489-494.
48.McDonald,A.J.,Muller,J.F.&Mascagni,F.GABAergic innervation of alpha type II calcium/calmodulin-dependent protein kinase immunoreactive pyramidal neurons in the rat basolateral amygdala.J Comp Neurol 446,199-218(2002).
49.Choleris,E.,Thomas,A.W.,Kavaliers,M.&Prato,F.S.A detailed ethological analysis of the mouse open field test:effects of diazepam,chlordiazepoxide and an extremely low frequency pulsed magnetic field.Neurosci Biobehav Rev 25,235-260(2001).
50.Pellow,S.,Chopin,P.,File,S.E.&Briley,M.Validation of open:closed arm entries in an elevated plus-maze as a measure of anxiety in the rat.J Neurosci Methods 14,149-167(1985).
51.Sah,P.&Lopez De Armentia,M.Excitatory synaptic transmission in the lateral and central amygdala.Ann N YAcad Sci 985,67-77(2003).
52.Davis,M.&Shi,C.The extended amygdala:are the central nucleus of the amygdala and the bed nucleus of the stria terminalis differentially involved in fear versus anxiety?Ann N YAcad Sci 877,281-291(1999).
53.Sakanaka,M.,Shibasaki,T.&Lederis,K.Distribution and efferent projections of corticotropin-releasing factor-like immunoreactivity in the rat amygdaloid complex.Brain Res 382,213-238(1986).
54.Holmes,A.,Yang,R.J.,Lesch,K.P.,Crawley,J.N.&Murphy,D.L.Mice lacking the serotonin transporter exhibit 5-HT(1A)receptor-mediated abnormalities in tests for anxiety-like behavior.Neuropsychopharmacology 28,2077-2088(2003).
55.Lesch,K.P.,et al.Association of anxiety-related traits with a polymorphism in the serotonin transporter gene regulatory region.Science 274,1527-1531(1996).
56.Graybiel,A.M.&Rauch,S.L.Toward a neurobiology of obsessive-compulsive disorder.Neuron 28,343-347(2000).
57.Picciotto,M.R.,Brunzell,D.H.&Caldarone,B.J.Effect of nicotine and nicotinic receptors on anxiety and depression.Neuroreport 13,1097-1106(2002).
58.Snyder,S.H.&Enna,S.J.The role of central glycine receptors in the pharmacologic actions of benzodiazepines.Adv Biochem Psychopharmacol,81-91(1975).
59.Lesscher,H.M.,et al.Amygdala protein kinase C epsilon regulates corticotropin-releasing factor and anxiety-like behavior.Genes Brain Behav 7,323-333(2008).
60.Milad,M.R.,Rauch,S.L.,Pitman,R.K.&Quirk,G.J.Fear extinction in rats:implications for human brain imaging and anxiety disorders.Biol Psycho!73,61-71(2006).
- 还没有人留言评论。精彩留言会获得点赞!