一种促进百子莲体胚萌发同步化率的方法与流程
本发明属于百子莲快繁技术领域,具体涉及一种促进百子莲体胚萌发同步化率的方法。
背景技术:
百子莲‘bigblue’(agapanthuspraecoxssp.orientalis‘bigblue’)又名“蓝百合”、“非洲百合”,原产非洲南部,为单子叶多年生草本花卉,具有较强的观赏性。近半个世纪以来,百子莲在国际花卉业发展中脱颖而出,成为风靡全球的鲜切花、盆栽及地被花卉,并体现出极佳的观赏价值。此外,百子莲抗性极强,夏季可抗40℃以上的高温,冬季也可耐-10℃以下的低温,对土壤要求不严,且极少有病虫害发生,该物种在道路绿化、土壤修复领域也具有巨大的发展空间,目前市场上种苗供不应求。
百子莲在原产地南非常用种子或分株繁殖,但引种国内后存在发芽率低,繁殖周期长,繁殖系数低及后代易分化等缺点。体细胞胚胎发生途径具有数量多、繁殖快、结构完整、植株再生率高以及不受季节影响等特点,因此被认为是百子莲无性扩繁和种质保存的较佳途径。
国内百子莲进行体胚诱导的一般流程为:选择小花梗诱导出愈伤组织,通过继代培养诱导出胚性细胞,进而将培养基中的生长素去除继续培养胚性细胞,以利于诱导成熟胚胎并萌发为种苗。
该体系进行快繁的核心在于:利用植物体细胞全能性发育成完整的植株,而体细胞的载体—胚性细胞,可以通过不断继代培养得以扩增。但初期发生的胚性细胞多为单细胞起源,且数量较少,因此,为了维持胚性细胞的数量,通常在胚性细胞阶段进行多次继代培养。而频繁继代会导致材料的同步化程度降低,畸形胚频发,最终严重削弱了体胚发生体系的高效性,导致体胚苗数量的减少。
为减少频繁继代培养造成的体胚数量减少,以及工作量增加的问题,相关研究人员做了胚性细胞的超低温保存研究,旨在减少继代频次,同时能够很好维持胚性愈伤组织的胚性,从而利于后期的体胚苗诱导。但超低温保存技术要求相对较高,同时也会导致材料损失。因此,在百子莲胚性愈伤组织继代增殖的过程中,通过调控体胚发生过程,增加胚性细胞数量,以及调控体胚萌发质量是解决体胚萌发及成苗数量减少的有效途径。
相对于常规的组织培养,体细胞胚胎发生途径相对较困难,许多机理不详。而百子莲以往的研究中,通常利用胚性细胞进行继代保存,并以此为平台进行基因转化、基因功能研究、胚性丧失以及超低温保存等领域的研究,而对体胚发生途径的优化相关的报道和研究较少,尤其是促进体胚萌发同步化相关研究并未见报道。
技术实现要素:
本发明的目的在于克服上述现有技术存在的不足,提供一种促进百子莲体胚萌发同步化率的方法。本发明通过调控体胚萌发过程中的同步化,以获得数量更多、发育阶段一致的体细胞幼苗,更大限度地发挥百子莲体胚体系在种苗快繁领域的优越性。
本发明的目的是通过以下技术方案来实现的:
本发明涉及一种促进百子莲体胚萌发同步化率的方法,所述方法包括如下步骤:
s1、取小花梗外植体诱导出愈伤组织;
s2、通过继代培养诱导出胚性愈伤组织;
s3、胚性愈伤组织置于成熟胚诱导培养基中经2~6℃处理2~4d后,培养诱导出成熟胚胎并萌发为种苗。
优选的,步骤s3中,所述成熟胚诱导培养基含4.43g·l-1ms干粉、2%(w/v)蔗糖、1%(w/v)麦芽糖、0.3~0.7mg·l-1多效唑和0.6~1.0%(w/v)琼脂,ph=5.8。
优选的,步骤s3中,所述培养是在22~28℃光照培养12~18d,光照强度为1500~2500lx。
优选的,步骤s1中,诱导出愈伤组织采用的愈伤组织诱导培养基含:4.43g·l-1ms、1.5~2.0mg·l-1pic、2.5~3.5%(w/v)蔗糖和0.6~1.0%(w/v)琼脂,ph=5.8。
优选的,诱导出愈伤组织是在22~28℃暗培养12~18d。
优选的,步骤s2中,继代培养采用的愈伤组织继代培养基含:4.43g·l-1ms干粉、1.0~1.5mg·l-1pic、2.5~3.5%(w/v)蔗糖和0.6~1.0%(w/v)琼脂,ph=5.8。
优选的,所述继代培养是在22~28℃暗培养50~70d;继代培养的次数为2次。
与现有技术相比,本发明的有益效果如下:
1、百子莲在国内的组培和体细胞胚胎途径快繁中,一般不经低温培养;本发明利用特定的短时间低温处理的方式,使生长发育过程暂时停滞,减缓体胚萌发速度,从而促进了同步化,使得体胚性状更为一致。
2、本发明突破了传统组培仅以蔗糖作为碳源的培养基配方,利用蔗糖以及麦芽糖作为碳源,通过种类和浓度配比的调控,利用麦芽糖释放葡萄糖分子速度较慢的特点,提高了体胚萌发的质量,从而促进同步化,得到数量更多的体细胞胚胎。
3、本发明利用赤霉素对百子莲体胚萌发不利的现象,加入赤霉素合成抑制剂—多效唑,消除了赤霉素的不利影响,提高了体胚萌发数量及促进了体胚的同步化程度。
4、本发明技术处理简单,操作性强,有效改善了胚性细胞的长期继代过程所造成的体胚数量较少,同步化率较低的问题,同时减少了畸形胚的发生。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征目的和优点将会变得更明显。
图1为小花梗外植体小段在愈伤组织诱导培养基中培养15d后的解剖镜观察图;
图2为不含残留小花梗组织的愈伤组织在胚性愈伤组织诱导培养基上培养60d后的解剖镜观察图;
图3为不含残留小花梗组织的愈伤组织诱导后的非胚性与胚性细胞显微形态观察图;
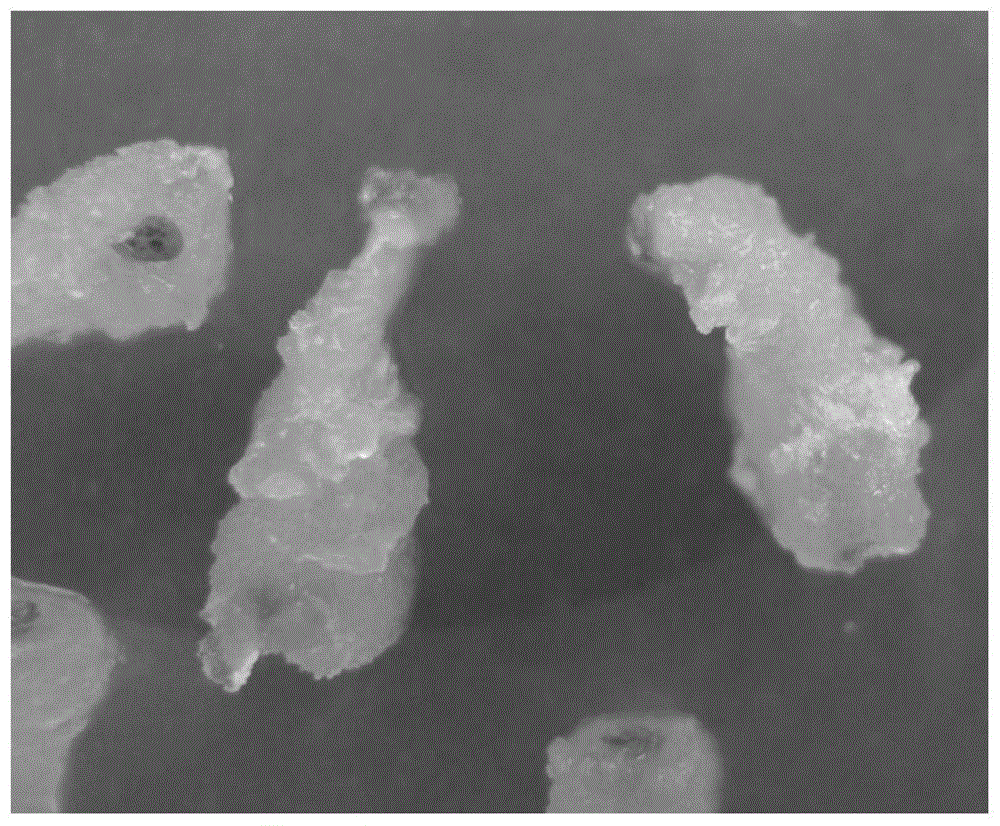
图4为成熟胚的解剖镜观察图。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变化和改进。这些都属于本发明的保护范围。
术语解释:
愈伤组织:愈伤组织(callus)是指植物体局部受到创伤刺激后,在伤口表面新生的组织。它由活的薄壁细胞组成,可起源于植物体多种组织的活细胞。
胚性细胞:胚性细胞即胚性愈伤组织细胞,颜色有乳白色或黄色,表面具球形颗粒,其生长缓慢;从细胞学来看,胚性愈伤组织由等直径细胞组成,细胞较小,原生质浓厚,无液泡,常富含淀粉粒,核大,分裂活性强,具有萌发成为体细胞胚胎的能力。
体胚萌发:胚性细胞在体胚成熟诱导的培养条件下,通过极性发育逐渐转变为类合子胚的结构,类似于植物种子萌发过程产生子叶,最终发育为小植株的过程。
实施例1
本实施例涉及一种促进百子莲体胚萌发同步化率的方法;主要是利用低温处理、糖配比和激素调控,优化了百子莲体胚发生体系,得到数量更多,性状更一致的百子莲体胚。具体步骤如下:
(1)外植体的取材:5~6月份花期,取4~5年生百子莲未开裂的小花苞,在无菌操作台上进行消毒处理(先用75%(v/v)乙醇处理50~70s,用ddh2o冲洗3~5次,然后用5%次氯酸钠消毒处理5~7min,之后ddh2o冲洗3~5次,再用75%乙醇处理50~70s,用ddh2o冲洗3~5次。用无菌滤纸吸干小花苞表面的水分,然后切取小花梗外植体,将小花梗外植体切成0.7~1.0cm的小段;
(2)愈伤组织的诱导:取0.7~1.0cm的小花梗外植体小段,平放状态接种于愈伤组织诱导培养基中,25℃暗培养15d,可见白色半透明的愈伤组织生成(图1为小花梗外植体小段在愈伤组织诱导培养基中培养15d后的解剖镜观察图),愈伤组织诱导率为100%,25~35d天后进行愈伤组织的继代培养;
所述愈伤组织诱导培养基组分为:ms+1.5~2.0mg·l-1pic+2.5~3.5%(w/v)蔗糖+0.6~1.0%(w/v)琼脂,ph5.8。制备方法:每升ddh2o中加入4.43gms干粉培养基,1.5~2.0mgpic(毒莠锭)溶液,25~35g蔗糖,6~10g琼脂,ph5.8。培养基在121℃高压灭菌锅中灭菌处理20~25min后拿到超净工作台内分装,培养皿规格为:90mm×16mm,每皿分装培养基25ml,冷却凝固后,进行外植体的接种,每皿接种10~15个小花梗外植体小段。
(3)愈伤组织的继代培养:取带有残留小花梗组织的愈伤组织细胞团,放置在愈伤组织继代培养基上,22~28℃暗培养,以50~70d为一个继代周期,继代培养2次,愈伤组织逐渐转变为微黄色,部分细胞团现不透明状,表面粗糙;
所述愈伤组织继代培养基组分为:ms+1.0~1.5mg·l-1pic+2.5~3.5%(w/v)蔗糖+0.6~1.0%(w/v)琼脂,ph5.8。培养皿规格为:90mm×16mm。
(4)胚性愈伤组织的诱导:取不含残留小花梗组织的愈伤组织,放置在胚性愈伤组织诱导培养基(培养基组分为:ms+1.0~1.5mg·l-1pic+2.5~3.5%(w/v)蔗糖+0.6~1.0%(w/v)琼脂,ph5.8)上,22~28℃暗培养,50~70d后,多数细胞团现不透明状,微黄色愈伤组织表面出现单细胞起源的胚性愈伤组织(图2为不含残留小花梗组织的愈伤组织在胚性愈伤组织诱导培养基上培养60d后的解剖镜观察图);
胚性细胞的细胞染色验证:取3mm大小的细胞团,放入1.5ml的离心管中,加入500μl的醋酸洋红染色液,在室温下静置30min,用移液器吸取染色液,弃去染色液;然后加入超纯水,不断吹打细胞团,用移液器吸取溶液,再次加入超纯水,本步骤重复3次,取载玻片一枚,用1ml吸头剪去顶端2mm处,吸取直径1mm大小的细胞团,放在载玻片上,放置盖玻片,避免产生气泡,然后轻轻压平,放在leicadm2500显微镜下观察并拍照(见图3,图3为不含残留小花梗组织的愈伤组织诱导后的非胚性与胚性细胞显微形态观察图),可观察到细胞核较大,细胞质浓密的胚性细胞。
(5)胚性细胞的体胚萌发诱导:取1g胚性愈伤组织,放置在成熟胚诱导培养基(ms+2%(w/v)蔗糖+1%(w/v)麦芽糖+0.5mg·l-1多效唑+0.6~1.0%(w/v)琼脂,ph5.8)上,放入4℃冰箱2~4d后取出,22~28℃光照培养,光照强度2500lx,15d后,多数细胞团表面出现胚状颗粒物,呈白色不透明状,30d后,胚状颗粒物生长为成熟胚(图4为成熟胚的解剖镜观察图),为颗粒状结构,基本为白色,呈独立分布状,个别胚的顶部转淡绿色;经统计,光照培养30d后,本发明诱导方法中,1g胚性细胞诱导成熟胚的数量达958.64个,同步化率为87.63%。
对比例1
本对比例与实施例的诱导方法与步骤基本相同,不同之处仅在于:将实施例的步骤(5)中体胚萌发诱导时的低温处理环节去掉,即将体胚苗诱导阶段的胚性细胞转接后,直接放置在22~28℃光照培养,其余与实施例1相同。采用本对比例的方法,在不经4℃低温处理的培养基上,1g胚性细胞诱导成熟胚的数量为641.82个,同步化率为51.30%。
对比例2
本对比例与实施例的诱导方法与步骤基本相同,不同之处仅在于:将实施例的步骤(5)中体胚萌发诱导培养基中的麦芽糖去掉,仅以蔗糖作为碳源,其余与实施例1相同。培养基为ms+3%(w/v)蔗糖+0.5mg·l-1多效唑+0.6~1.0%(w/v)琼脂,ph5.8。采用本对比例的方法,在不含麦芽糖的培养基上,1g胚性细胞诱导成熟胚的数量为436.95个,同步化率为39.28%。
对比例3
本对比例与实施例的诱导方法与步骤基本相同,不同之处仅在于:将实施例的步骤(5)中体胚萌发诱导培养基中的多效唑去掉,即将体胚苗诱导阶段的胚性细胞转接后,放置在不含多效唑的培养基上,即ms+2%(w/v)蔗糖+1%(w/v)麦芽糖+0.6~1.0%(w/v)琼脂,ph5.8,其余与实施例1相同。采用本对比例的方法,在不含多效唑的培养基上,1g胚性细胞诱导成熟胚的数量为542.18个,同步化率为45.86%。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变化或修改,这并不影响本发明的实质内容。在不冲突的情况下,本申请的实施例和实施例中的特征可以任意相互组合。
- 还没有人留言评论。精彩留言会获得点赞!