一种人血管瘤动物模型及其高成功率构建方法与流程
本发明涉及一种动物模型及其构建方法,具体地说,是一种利用人血管瘤内皮细胞构建的人血管瘤母瘤构建的人血管瘤动物模型及其高成功率构建方法。
背景技术:
血管瘤是婴幼儿最常发生的血管生成疾病之一,好发于头面部和四肢等体表部位,占所有新生儿的2.5-12%。一般情况下瘤体在出生后一年开始消退,10年内可自然缓慢的消退恢复正常。但是部分浅表位置的肿瘤可能会影响患者美观和生理功能,还有部分肿瘤会引发溃疡、出血、感染、高流量充血性心衰,甚至会威胁生命。
目前血管瘤的形成机理仍然不明,同时也没有简单易行的人血管瘤动物模型构建方法,这个问题一定程度上限制了对血管瘤发病机理以及治疗方法的深入研究。由于人血管瘤并不能发生在其他物种,进一步增加了建立动物模型的难度。目前报道较多的人血管瘤动物模型构建方法主要包括血管瘤组织移植法和细胞悬液接种法两种。但是血管瘤组织来源受限较多,组织难以获得;细胞悬液接种方法简单,但是成瘤率低,需要多次补种。两种方法都不能简单快捷地构建人血管瘤模型。
中国专利申请号201110118832.x公开了一种人血管瘤动物模型及其构建方法,该发明应用人血管瘤干细胞和人脐静脉内皮细胞共同移植法建立了人血管瘤动物模型。但是该方法操作复杂繁琐且成瘤率不高。因此需要建立一种血管瘤的实验动物模型,能够克服上述已有动物模型的缺点,建立完全类似人血管瘤的特性,用来研究血管瘤的发生机制以及治疗方法。
技术实现要素:
针对现有技术中的缺陷,本发明的目的是提供一种人血管瘤动物模型及其高成功率构建方法。
本发明的目的是通过以下技术方案来实现的:
第一方面,本发明提供了一种人血管瘤动物模型的构建方法,包括以下步骤:
s1、取离体的人血管瘤细胞备用;
s2、将人血管瘤细胞用pbs重悬均匀;
s3、将重悬后的人血管瘤细胞接种到免疫缺陷的动物皮下;
s4、腹腔注射雌二醇,得到母瘤;
s5、摘取母瘤,剥离干净并冲洗;
s6、将冲洗后的母瘤分成30-70mm3的肿瘤组织;
s7、将肿瘤组织接种到免疫缺陷的动物皮下,饲养后即得人血管瘤动物模型;
所述人血管瘤细胞包括人血管瘤内皮细胞、人血管瘤干细胞中的一种或两种的混合。
优选地,步骤s2中,所述的人血管瘤细胞先进行培养、增殖,然后消化,再将人血管瘤细胞数量为1×106~1×108个的消化液搜集、离心,去上清后用pbs重悬均匀。
优选地,所述培养采用dmem完全培养基,所述消化采用0.25%胰酶消化。
优选地,所述的人血管瘤细胞数量为1×106~5×107个,母瘤组织的体积为40~70mm3。
优选地,所述的人血管瘤细胞数量为5×106~1×107个,母瘤组织的体积为50~60mm3。
更优选地,所述的人血管瘤细胞数量为1×107个,母瘤组织的体积为60mm3。
细胞数量会对母瘤的成瘤率造成影响,而母瘤组织体积会影响血管瘤的成瘤率以及生长速度,发明人通过前期实验才获得了上述的细胞数量范围和母瘤组织体积范围。
优选地,所述的免疫缺陷的动物是指t细胞免疫缺陷的裸鼠或t细胞和b细胞严重联合免疫缺陷的scid鼠。
优选地,所述免疫缺陷的动物为6-8周龄动物。
优选地,所述雌二醇的注射量为0.1~1.0mg,更优选0.5mg。雌二醇是与血管瘤生长有关的重要激素,注射雌二醇的目的是为了促进血管瘤生长,防止其生长过程中消退。
优选地,步骤s5中,所述摘取母瘤的具体步骤包括:将含有母瘤的免疫缺陷的动物处死后剥离母瘤。
优选地,步骤s6中,所述接种具体步骤如下:将肿瘤组织通过植入套管针植入的方式接种到6-8周龄的免疫缺陷动物皮下。
本发明还提供了一种根据前述方法构建的人血管瘤动物模型。所述人血管瘤动物模型可应用于研究人血管瘤在发生机制和治疗方法中。
与现有技术相比,本发明具有如下的有益效果:
1、本发明通过步骤s4得到血管瘤(即母瘤)的成功率很低,不到50%,所以不能直接采用s4制得母瘤形成动物模型;而通过母瘤以及后续的步骤形成的动物模型血管瘤成功率可达100%,成瘤率极高,且操作简便。
2、本发明形成的血管瘤动物模型完全具有人类血管瘤的病理特点,病理组织学基础实验证实,血管瘤组织中存在大量新生毛细血管,细胞增殖旺盛,这些病理特点与人类的血管瘤组织非常相似。
3、本发明的动物模型非常适合于人血管瘤的发生机理以及治疗方法的研究,以及评价各种治疗血管瘤药物的疗效和筛选治疗血管瘤的药物。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
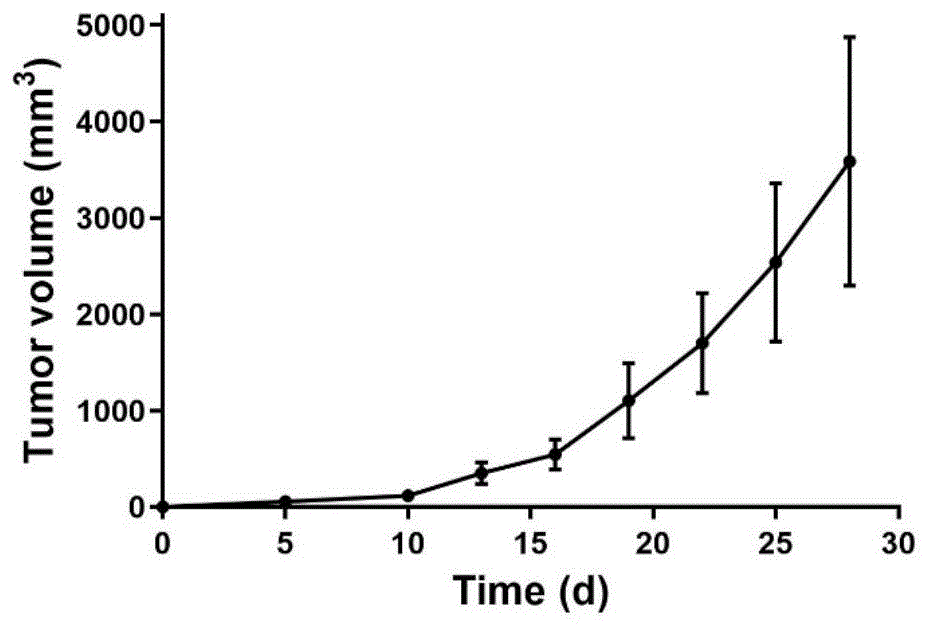
图1是肿瘤生长曲线;
图2是肿瘤图片;a.裸鼠肿瘤图片;b.离体肿瘤图片;
图3是肿瘤切片染色及鉴定;a.肿瘤切片he染色;b.肿瘤切片cd31染色;c.肿瘤切片cd34染色;d.肿瘤切片ki-67染色。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变化和改进。这些都属于本发明的保护范围。
实施例1
本实施例提供了一种人血管瘤动物模型的构建方法,具体步骤如下:
①血管瘤内皮细胞(hemecs)的培养
a、购买或者分离提取得到人血管瘤内皮细胞;
b、将细胞在dmem完全培养基(10%fbs+1%双抗+89%dmem基础培养基)中培养、增殖,血球计数板计数。
②血管瘤内皮细胞(hemecs)构建血管瘤动物模型母瘤
a、将培养的血管瘤内皮细胞用0.25%胰酶消化;
b、计数后,取1×106个细胞消化液于15ml离心管中,以1200rpm离心5分钟,弃上清;
c、加入pbs重悬细胞,离心弃上清,再加入pbs重悬细胞,离心弃上清后加入100μlpbs重悬细胞。
d、取1ml注射器,吸取100μl细胞悬液,注射于6-8周大的balb/c-nu裸鼠皮下;
e、免疫缺陷动物腹腔注射0.5mg雌二醇。
③血管瘤内皮细胞母瘤构建血管瘤动物模型
a、将母瘤鼠(即已形成了母瘤的balb/c-nu裸鼠)处死,剥离母瘤;
b、将母瘤表面多余组织剔除干净,并用pbs将母瘤冲洗干净;
c、将母瘤放入细胞培养皿中,加入少许pbs浸润,用眼科手术剪将肿瘤块剪成60mm3固定大小的肿瘤组织,并用pbs冲洗干净;
d、提前将免疫缺陷动物麻醉,利用植入套管针将准备好的肿瘤组织接种于6-8周大的balb/c-nu裸鼠皮下。
请参照附图1,附图1是免疫缺陷鼠皮下肿瘤的生长曲线图。图中显示血管瘤生长速度很快,四周时间其体积可达5000mm3。
请参照附图2,附图2是是肿瘤图片。a.免疫缺陷鼠肿瘤图片,血管瘤形状均匀,近似于球形,透过皮下可以看到肿瘤表面丰富的血管。b.离体肿瘤图片,图中的6个肿瘤为实施例1方法得到的平行样,肿瘤组织表面致密紧实,血管丰富,形状近似球形生长均匀。
本实施例建立的血管瘤动物模型的组织结构类似于人类的血管瘤,而且成瘤率高,生长速度快,一周后就可以观察到明显的肿瘤凸起。
请参照附图3,附图3是肿瘤切片染色及鉴定。a.肿瘤切片he染色。b.肿瘤切片cd31免疫组化染色,阳性细胞多分布在血管周围,说明肿瘤内血管分布丰富,肿瘤生长活性高。c.肿瘤切片cd34免疫荧光染色,阳性细胞多分布在血管周围,说明肿瘤内血管分布丰富,肿瘤生长活性高。d.肿瘤切片ki-67免疫组化染色,ki-67是一种与细胞增殖特异性相关的核抗原,其在肿瘤内表达丰富说明血管瘤细胞增殖活性高。组织染色结果发现,本发明建立的血管瘤动物模型与人类血管瘤的特征相当。这种动物模型非常适用于人血管瘤的发病机理研究和开发治疗人类血管瘤的药物或方法,及评价各种治疗血管瘤药物和筛选治疗血管瘤的药物。
本发明建立的血管瘤动物模型将组织移植法和细胞悬液接种法两种方法相结合,最终成瘤率100%,避免了人血管瘤组织获取困难以及细胞悬液接种成瘤率低的问题,提供了一种简单高效的血管瘤动物模型构建方法。
由于接种的细胞是人源化的细胞,故形成的血管瘤模型完全具有人类血管瘤的病理特点,组织切片染色也证实:血管瘤组织中存在大量新生毛细血管,细胞增殖活性高,肿瘤生长速度快。这些病理特点与人类的血管瘤组织非常相似。
实施例2
本实施例提供了一种人血管瘤动物模型的构建方法,具体步骤如下:
①血管瘤干细胞的培养
a、购买或者分离提取得到人血管瘤干细胞;
b、将细胞在dmem完全培养基(10%fbs+1%双抗+89%dmem基础培养基)中培养、增殖,血球计数板计数。
②血管瘤干细胞构建血管瘤动物模型母瘤
a、将培养的血管瘤干细胞用0.25%胰酶消化;
b、计数后,取1×106个细胞消化液于15ml离心管中,以1200rpm离心5分钟,弃上清;
c、加入pbs重悬细胞,离心弃上清,再加入pbs重悬细胞,离心弃上清后加入100μlpbs重悬细胞。
d、取1ml注射器,吸取100μl细胞悬液,注射于6-8周大的balb/c-nu裸鼠皮下;
e、免疫缺陷动物腹腔注射0.5mg雌二醇。
③血管瘤干细胞母瘤构建血管瘤动物模型
a、将母瘤鼠(即已形成了母瘤的balb/c-nu裸鼠)处死,剥离母瘤;
b、将母瘤表面多余组织剔除干净,并用pbs将母瘤冲洗干净;
c、将母瘤放入细胞培养皿中,加入少许pbs浸润,用眼科手术剪将肿瘤块剪成60mm3固定大小的肿瘤组织,并用pbs冲洗干净;
d、提前将免疫缺陷动物麻醉,利用植入套管针将准备好的肿瘤组织接种于6-8周大的balb/c-nu裸鼠皮下。
实施例3
本实施例提供了一种人血管瘤动物模型的构建方法,具体步骤与实施例1基本相同,步骤如下:
①培养及扩增人血管瘤内皮细胞。
②将1×106血管瘤内皮细胞用100μlpbs重悬均匀;
③用注射器将上述人血管瘤内皮细胞接种到免疫缺陷的balb/c-nu裸鼠皮下;
④腹腔注射雌二醇0.5mg,得到母瘤;
⑤摘取母瘤,剥离干净并用pbs冲洗;
⑥将母瘤分成30mm3的小块(肿瘤组织);
⑦用植入套管针将肿瘤组织接种到免疫缺陷的balb/c-nu裸鼠皮下。
本发明建立的血管瘤的动物模型形态和组织结构都非常类似于人类的血管瘤,母瘤成功率不高。种植后生长速度适中,两周后可以明显观察到皮下肿瘤凸起。切片染色可以看见大量毛细血管,同时细胞增殖活性高,肿瘤生长速度较快。
实施例4
本实施例提供了一种人血管瘤动物模型的构建方法,具体步骤与实施例1基本相同,步骤如下:
①培养及扩增人血管瘤内皮细胞。
②将5×106血管瘤内皮细胞用100μlpbs重悬均匀;
③用注射器将上述人血管瘤内皮细胞接种到免疫缺陷的balb/c-nu裸鼠皮下;
④腹腔注射雌二醇0.1mg,得到母瘤;
⑤摘取母瘤,剥离干净并用pbs冲洗;
⑥将母瘤分成40mm3的小块(肿瘤组织);
⑦用植入套管针将肿瘤组织接种到免疫缺陷的balb/c-nu裸鼠皮下。
本发明建立的血管瘤的动物模型形态和组织结构都非常类似于人类的血管瘤,母瘤成功率不高。种植后生长速度较快,一周半后可以明显观察到皮下肿瘤凸起。切片染色可以看见大量毛细血管,同时细胞增殖活性高,肿瘤生长速度较快。
实施例5
本实施例提供了一种人血管瘤动物模型的构建方法,具体步骤与实施例1基本相同,步骤如下:
①培养及扩增人血管瘤内皮细胞。
②将1×107血管瘤内皮细胞用100μlpbs重悬均匀;
③用注射器将上述人血管瘤内皮细胞接种到免疫缺陷的balb/c-nu裸鼠皮下;
④腹腔注射雌二醇1.0mg,得到母瘤;
⑤摘取母瘤,剥离干净并用pbs冲洗;
⑥将母瘤分成60mm3的小块(肿瘤组织);
⑦用植入套管针将肿瘤组织接种到免疫缺陷的balb/c-nu裸鼠皮下。
本发明建立的血管瘤的动物模型形态和组织结构都非常类似于人类的血管瘤,母瘤成功率较高。种植后生长速度快,一周后可以明显观察到皮下肿瘤凸起。切片染色可以看见大量毛细血管,同时细胞增殖活性高,肿瘤生长速度快。
实施例6
本实施例提供了一种人血管瘤动物模型的构建方法,具体步骤与实施例1基本相同,步骤如下:
①培养及扩增人血管瘤内皮细胞。
②将5×107血管瘤内皮细胞用100μlpbs重悬均匀;
③用注射器将上述人血管瘤内皮细胞接种到免疫缺陷的balb/c-nu裸鼠皮下;
④腹腔注射雌二醇0.5mg,得到母瘤;
⑤摘取母瘤,剥离干净并用pbs冲洗;
⑥将母瘤分成50mm3的小块(肿瘤组织);
⑦用植入套管针将肿瘤组织接种到免疫缺陷的balb/c-nu裸鼠皮下。
本发明建立的血管瘤的动物模型形态和组织结构都非常类似于人类的血管瘤,母瘤成功率较高。种植后生长速度快,一周后可以明显观察到皮下肿瘤凸起。切片染色可以看见大量毛细血管,同时细胞增殖活性高,肿瘤生长速度快。
实施例7
本实施例提供了一种人血管瘤动物模型的构建方法,具体步骤与实施例1基本相同,步骤如下:
①培养及扩增人血管瘤内皮细胞。
②将1×108血管瘤内皮细胞用100μlpbs重悬均匀;
③用注射器将上述人血管瘤内皮细胞接种到免疫缺陷的balb/c-nu裸鼠皮下;
④腹腔注射雌二醇0.5mg,得到母瘤;
⑤摘取母瘤,剥离干净并用pbs冲洗;
⑥将母瘤分成70mm3的小块(肿瘤组织);
⑦用植入套管针将肿瘤组织接种到免疫缺陷的balb/c-nu裸鼠皮下。
本发明建立的血管瘤的动物模型形态和组织结构都非常类似于人类的血管瘤,母瘤成功率较高。种植后生长速度很快,一周后可以明显观察到皮下肿瘤凸起。切片染色可以看见大量毛细血管,同时细胞增殖活性高,肿瘤生长速度很快,可以观察到肿瘤表面皮肤坏死。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变化或修改,这并不影响本发明的实质内容。在不冲突的情况下,本申请的实施例和实施例中的特征可以任意相互组合。
- 还没有人留言评论。精彩留言会获得点赞!