一种油茶再生体系的再生方法与流程
本发明属于植物组织再生技术领域,具体涉及一种油茶再生体系的再生方法。
背景技术:
油茶(camelliaoleifera)是山茶科(theaceae)山茶属(camellia)的常绿小乔木或灌木,是我国特有的优质木本油料树种,与油棕、椰子和油橄榄并称为世界四大木本油料树种。
茶油中含有90%左右的不饱和脂肪酸、富含维生素e、维生素d、维生素k和维生素a,同时含有微量的角鲨稀、黄酮、茶多酚和山茶甙等。经常食用茶油可预防心血管硬化、降血压、降血脂等,因此茶油被公认为是一种理想的营养保健食用油。
茶油在工业上可作为润滑油和防锈油,可以制取油酸及其酯类、生产肥皂和凡士林等;在医药上,可用于制作针剂和调制各种药膏、药丸等;在化妆业上,通过精炼可制作成天然高级美容护肤系列化妆品;籽榨油后的枯饼,可提取残油、茶皂素,发酵后可作高蛋白饲料,粉碎后可以用来作生物杀虫剂、肥料和机床的抛光粉等;油茶籽壳中含有茶皂素、茶籽多糖、茶籽蛋白等,它们都是化工、轻工、食品、饲料工业产品等的原料,还可制成糠醛、活性炭等,茶籽壳还是一种良好的食用菌培养基;油茶叶部含有花黄素、茶碱等,可做医药工业的原料;因此,油茶全身都是宝,具有重要的经济价值,同时具有重要的生态价值和社会价值。发展油茶产业对减少我国对国外进口食用油的长期依赖,提高我国国民经济和人民生活水平具有重要意义。
目前,油茶种苗繁育主要采用芽苗砧嫁接育苗,但芽苗砧嫁接育苗出圃时间长,而且受育苗季节的限制,同时由于不同油茶品种种子的芽苗砧对接穗的影响,导致同一品种油茶苗不同植株的生长性状存在不一致的现象;而通过油茶组织培养,可以进行快速育苗、提高育苗效率和保持优良品种的性状。
但是,目前油茶组织培养主要是进行带腋芽茎段进行组织培养,这种方法容易进行组培快繁,但茎段培养存在污染率较高的问题,而且无法进行再生培养;也有通过种胚进行组培快速育苗,但这种方法不能保持优良品种的性状;也有利用叶片进行组培再生的研究,但是叶片愈伤组织的诱导率较低,分化率很低,不能满足工厂化育苗的要求。
技术实现要素:
为了解决上述技术问题,本发明提供一种油茶再生体系的再生方法。所述再生方法能显著提高油茶叶片愈伤组织诱导率及分化率,提高油茶组培育苗的效率,同时为构建油茶遗传转化体系奠定基础。
所述油茶再生体系的再生方法,包括:愈伤诱导培养、愈伤分化培养、生根培养和幼苗驯化;所述愈伤诱导培养为暗培养,其采用的愈伤诱导培养基包括激素组分、防褐化剂及30-80g/l的蔗糖。
本发明采用暗培养的愈伤诱导培养方式,同时向愈伤诱导培养基中添加特定激素组分、防褐化剂以及提高蔗糖浓度,通过多重手段系统作用促使油茶叶片愈伤诱导率及分化率显著提升。
进一步地,所述愈伤诱导培养基选自以下配方中的一种:
愈伤诱导培养基配方1:1/2ms基本培养基(粉末)、0.5-3.0mg/l的2,4-d、0.5-2.0mg/l的tdz、30-80g/l的蔗糖、7-9g/l的琼脂、100-500mg/l的水解酪蛋白、100-500mg/l的水解乳蛋白、50-200mg/l的脯氨酸、50-200mg/l的甘氨酸、50-200mg/l的谷氨酰胺、50-100ml/l的椰子水及防褐化剂,ph为5.6-5.8;
其中,所述防褐化剂选自1-2g/l的ppvp、100-500mg/l的维生素c或5-15mg/l的硝酸银中的一种,或1-2g/l的ppvp与100-500mg/l维生素c组合、或1-2g/l的ppvp与5-15mg/l的硝酸银的组合;
愈伤诱导培养基配方2:wpm基本培养基(粉末)、0.5-2.0mg/l的iaa、1.0-3.0mg/l的6-ba、0.1-1.5mg/l的tdz、30-80g/l的蔗糖、7-9g/l的琼脂、100-500mg/l的水解酪蛋白、100-500mg/l的水解乳蛋白、50-200mg/l的脯氨酸、50-200mg/l的甘氨酸、50-200mg/l的谷氨酰胺、40-100ml/l的椰子水以及防褐化剂,并调整ph为5.6-5.8;
其中,所述防褐化剂选自1-2g/l的ppvp、100-500mg/l的维生素c或1-15mg/l的硝酸银中的一种,或1-2g/l的ppvp与100-500mg/l维生素c组合、或1-2g/l的ppvp与5-15mg/l的硝酸银的组合。
进一步地,所述愈伤诱导培养采用划线的方式处理叶片,相比现有技术的切片,更有利于提高其诱导率。具体操作为:将叶片放在无菌滤纸上,用解剖刀垂直叶片中间主脉方向划2-4条线,然后用镊子剥将叶片接种愈伤诱导培养基上,每皿(90mm)接种3-8个叶片。将接种好的培养皿放在培养室中进行暗培养,温度为23-27℃,每20-25天继代一次,培养30-40d后,诱导出愈伤组织。
本发明所述的再生方法中,所述愈伤分化培养采用先暗培养,分化芽后再进行光照培养。具体培养为:选择生长状态良好,淡黄色(白中透黄),疏松,表面凹凸明显或表面有白色小球状胚状体的愈伤组织接种到分化培养基进行暗培养,培养温度为25℃±2℃。每20-25d继代一次,暗条件下培养40-60d后,分化不定芽。
所述愈伤分化培养采用的愈伤分化培养基可选自以下配方中的一种:
愈伤分化培养基配方1:1/2ms培养基(粉末)、0.01-0.5mg/l的naa、0.5-4.0mg/l的6-ba、0.001-0.5mg/l的tdz、30-50g/l的蔗糖、7-10g/l的琼脂、100-500mg/l的水解酪蛋白、100-500mg/l的水解乳蛋白、70-200mg/l的脯氨酸、70-200mg/l的甘氨酸、70-200mg/l的谷氨酰胺,50-100ml/l的椰子水及防褐化剂,并调整ph为5.6-5.8;
其中,所述防褐化剂选自1-2g/l的ppvp、100-500mg/l的维生素c或5-20mg/l的硝酸银中的一种,或1-2g/l的ppvp与100-500mg/l维生素c组合、或1-2g/l的ppvp与5-15mg/l的硝酸银的组合;
愈伤分化培养基配方2:wpm培养基(粉末)、0.01-0.5mg/l的iaa、0.5-3.0mg/l的6-ba、0.001-0.5mg/l的tdz、0-2.0mg/lga3、30-50g/l的蔗糖、7-10g/l的琼脂、100-500mg/l的水解酪蛋白、100-500mg/l的水解乳蛋白、70-200mg/l的脯氨酸、70-200mg/l的甘氨酸、70-200mg/l的谷氨酰胺,50-100ml/l的椰子水及防褐化剂,并调整ph为5.5-5.7;
其中,所述防褐化剂选自1-2g/l的ppvp、100-500mg/l的维生素c或5-20mg/l的硝酸银中的一种,或1-2g/l的ppvp与100-500mg/l维生素c组合、或1-2g/l的ppvp与5-15mg/l的硝酸银的组合。
本发明通过暗培养及特定的愈伤分化培养基的协同作用,可显著提高叶片的分化率。
本发明所述的再生方法中,所述生根培养包括:将生长至2-4cm的不定芽基部用0.2-0.5mg/liba或abt生根粉溶液浸泡5-30s后,然后移栽到装有已消毒的混合培养基质的组培瓶中进行生根培养。光照培养条件为1800-2400lux光照培养16h,培养温度为25℃±2℃。其中,所述混合培养基质是由石英砂、珍珠岩和泥炭土按照质量比1:1:3混合,再加入1/2ms培养基溶液搅拌得到的。所述1/2ms培养基的加入量与基质多少有关,一般加入营养液的量为:用手抓起搅拌后的基质,握拳稍用力就可以挤出水分,此时加入的营养液量较适宜。
本发明所述的再生方法中,所述幼苗驯化移栽包括:将生根的幼苗移栽到装有混合基质的育苗钵中,浇水喷雾,搭建塑料拱棚,保证里面相对湿度达到80%以上,经驯化15-20天后,移到大棚或苗圃中进行常规管理。所述混合基质由红壤土、珍珠岩和泥炭土按照3:1:1的比例混合得到。
此外,为了获得更好的效果,对于直接以幼嫩叶片作为外植体时,须对外植体进行消毒;具体消毒处理过程如下:采油茶幼嫩叶片,先用洗洁精浸泡5-10min,然后用自来水冲洗1-2h,用吸水纸吸干水分。在超净工作台上,将叶片用70%-75%的酒精浸泡10-30s,无菌水清洗3-4次,再用0.08-0.12%的hgcl2表面消毒8-12min,再用无菌水清洗6-8次。
而若使用无菌组培的叶片,则不需要进行消毒处理,可直接进行愈伤诱导培养。
本发明的有益效果如下:
本发明通过对愈伤诱导培养及分化培养的改进,显著提高油茶叶片的诱导率及分化率。
附图说明
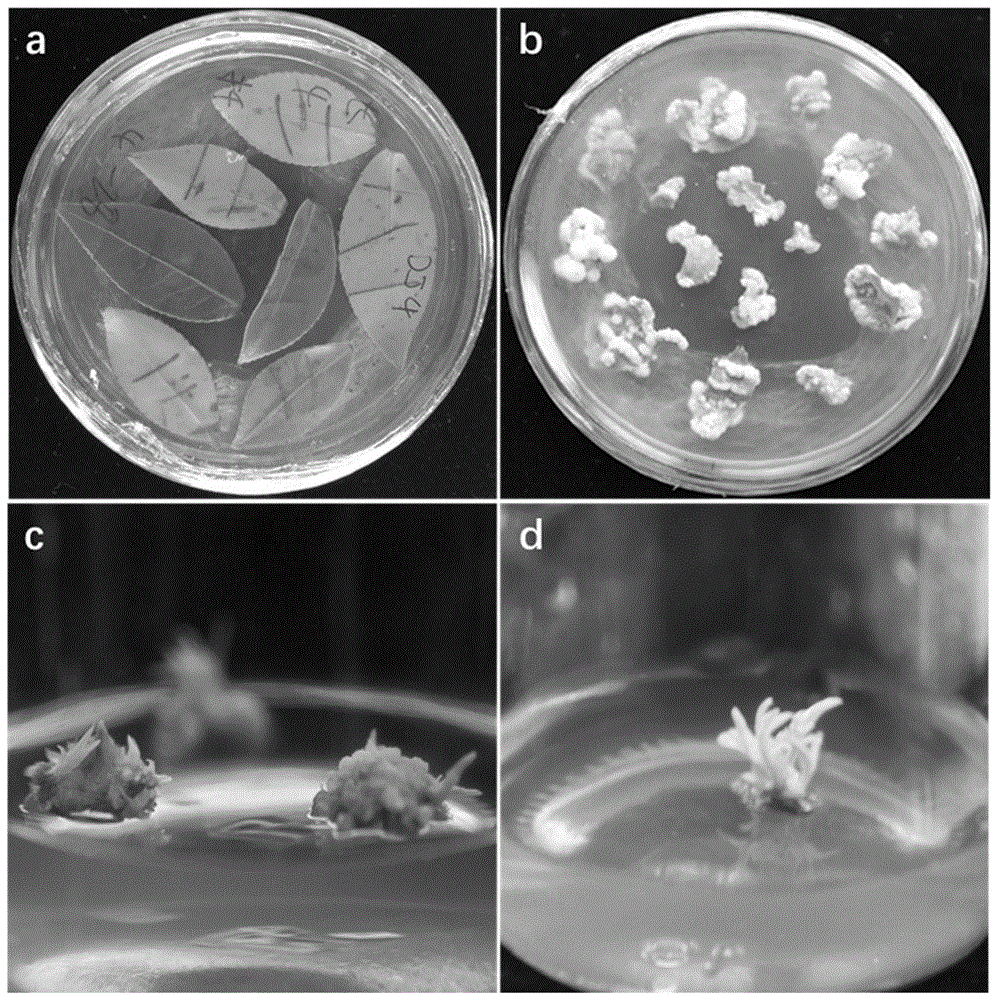
图1为普通油茶叶片的再生过程图;其中,a.叶片划线后进行愈伤诱导培养;b.叶片诱导出愈伤组织;c.愈伤组织暗培养分化出不定芽;d.含不定芽的愈伤组织进行光照培养。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例1
本实施例提供一种油茶叶片的再生方法,如图1所示,包括:
(1)外植体消毒
采‘长林4号’普通油茶的幼嫩叶片,先用洗洁精浸泡5-10min,然后用自来水冲洗1-2h,用吸水纸吸干水分。在超净工作台上,将叶片用70%-75%的酒精浸泡10-30s,无菌水清洗3-4次,再用0.08-0.12%的hgcl2表面消毒8-12min,再用无菌水清洗6-8次。
(2)愈伤诱导培养
具体培养包括:将叶片放在无菌滤纸上,用解剖刀垂直叶片中间主脉方向划2-4条线,然后用镊子剥将叶片接种愈伤诱导培养基上。每皿(90mm)接种3-8个叶片。将接种好的培养皿放在培养室中进行暗培养,温度为23-27℃,每20-25天继代一次,培养30-40d后,诱导出愈伤组织。
愈伤诱导培养基为:1/2ms基本培养基(粉末)、0.5mg/l的2,4-d、0.5mg/l的tdz、40g/l的蔗糖、8g/l的琼脂、200mg/l的水解酪蛋白、200mg/l的水解乳蛋白、100mg/l的脯氨酸、100mg/l的甘氨酸、100mg/l的谷氨酰胺、100ml/l的椰子水,以及2g/l的ppvp和5mg/l的硝酸银,并调整ph为5.6;愈伤诱导率为100%。
如图1a所示。
(3)愈伤分化培养
具体培养为:选择生长状态良好,淡黄色(白中透黄),疏松,表面凹凸明显或表面有白色小球状胚状体的愈伤组织接种到分化培养基进行暗培养,培养温度为25℃±2℃。每20-25d继代一次,暗条件下培养40-60d后,分化不定芽。
所述分化培养基为:1/2ms培养基(粉末)、0.1mg/l的naa、2.0mg/l的6-ba、0.01mg/l的tdz、30g/l的蔗糖、7g/l的琼脂、200mg/l的水解酪蛋白、200mg/l的水解乳蛋白、100mg/l的脯氨酸、100mg/l的甘氨酸、100mg/l的谷氨酰胺,100ml/l的椰子水、1g/l的ppvp和5mg/l的硝酸银,并调整ph为5.8;愈伤分化率为84.3%。
如图1b、图1c所示。
(4)生根培养
将生长至2-4cm的不定芽基部用生根粉溶液浸泡后,然后移栽到装有已消毒的混合培养基质的组培瓶中进行生根培养。光照培养条件为1800-2400lux光照培养16h,培养温度为25℃±2℃。
0.2mg/labt1生根粉溶液浸泡20s。
如图1d所示。
(5)幼苗驯化移栽
将生根的幼苗移栽到装有混合基质的育苗钵中,浇水喷雾,搭建塑料拱棚,保证里面相对湿度达到80%以上,经驯化15-20天后,移到大棚或苗圃中进行常规管理。所述混合基质由红壤土、珍珠岩和泥炭土按照3:1:1的比例混合得到。
实施例2
本实施例提供一种油茶叶片的再生方法,包括:
(1)愈伤诱导培养
叶片材料为‘长林4号’普通油茶的无菌组培苗的叶片,具体培养如实施例1。
愈伤诱导培养基为:1/2ms基本培养基(粉末)、1.0mg/l的2,4-d、0.5mg/l的tdz、50g/l的蔗糖、8g/l的琼脂、250mg/l的水解酪蛋白、250mg/l的水解乳蛋白、100mg/l的脯氨酸、100mg/l的甘氨酸、100mg/l的谷氨酰胺、100ml/l的椰子水,以及1g/l的ppvp和10mg/l的硝酸银,并调整ph为5.6;愈伤诱导率为100%。
(2)愈伤分化培养
具体培养如实施例1。
所述分化培养基为:1/2ms培养基(粉末)、0.05mg/l的naa、1.0mg/l的6-ba、0.05mg/l的tdz、30g/l的蔗糖、7g/l的琼脂、300mg/l的水解酪蛋白、300mg/l的水解乳蛋白、150mg/l的脯氨酸、150mg/l的甘氨酸、150mg/l的谷氨酰胺,100ml/l的椰子水、1g/l的ppvp和5mg/l的硝酸银,并调整ph为5.6;愈伤分化率为88.6%。
(3)生根培养
具体培养如实施例1。区别在于采用0.3mg/labt2生根粉溶液浸泡10s。
(4)幼苗驯化移栽
将生根的幼苗移栽到装有混合基质的育苗钵中,浇水喷雾,搭建塑料拱棚,保证里面相对湿度达到80%以上,经驯化15-20天后,移到大棚或苗圃中进行常规管理。所述混合基质由红壤土、珍珠岩和泥炭土按照3:1:1的比例混合得到。
实施例3
本实施例提供一种油茶叶片的再生方法,包括:
(1)愈伤诱导培养
叶片材料为‘长林4号’普通油茶的无菌组培苗的叶片,具体培养如实施例1。
愈伤诱导培养基为:1/2ms基本培养基(粉末)、1.0mg/l的2,4-d、1.0mg/l的tdz、70g/l的蔗糖、8g/l的琼脂、500mg/l的水解酪蛋白、500mg/l的水解乳蛋白、150mg/l的脯氨酸、150mg/l的甘氨酸、150mg/l的谷氨酰胺、100ml/l的椰子水,以及2g/l的ppvp和10mg/l的硝酸银,并调整ph为5.8;愈伤诱导率为100%。
(2)愈伤分化培养
具体培养如实施例1。
所述分化培养基为:1/2ms培养基(粉末)、0.05mg/l的naa、2.0mg/l的6-ba、0.01mg/l的tdz、300g/l的蔗糖、7g/l的琼脂、500mg/l的水解酪蛋白、500mg/l的水解乳蛋白、200mg/l的脯氨酸、200mg/l的甘氨酸、200mg/l的谷氨酰胺,100ml/l的椰子水、2g/l的ppvp和510mg/l的硝酸银,并调整ph为5.6;愈伤分化率为92.5%。
(3)生根培养
具体培养如实施例1,区别在于采用0.5mg/labt3生根粉溶液浸泡5s。
(4)幼苗驯化移栽
将生根的幼苗移栽到装有混合基质的育苗钵中,浇水喷雾,搭建塑料拱棚,保证里面相对湿度达到80%以上,经驯化15-20天后,移到大棚或苗圃中进行常规管理。所述混合基质由红壤土、珍珠岩和泥炭土按照3:1:1的比例混合得到。
对比例1
与实施例3相同,区别在于:
(2)愈伤诱导培养为光照培养;
其中,愈伤诱导培养基为:1/2ms基本培养基(粉末)、70g/l的蔗糖、8g/l的琼脂、500mg/l的水解酪蛋白、500mg/l的水解乳蛋白、150mg/l的脯氨酸、150mg/l的甘氨酸、150mg/l的谷氨酰胺、100ml/l的椰子水,并调整ph为5.8;
经检测,愈伤诱导率为0%。
(3)愈伤分化培养基:1/2ms培养基(粉末)、300g/l的蔗糖、7g/l的琼脂、500mg/l的水解酪蛋白、500mg/l的水解乳蛋白、200mg/l的脯氨酸、200mg/l的甘氨酸、200mg/l的谷氨酰胺,100ml/l的椰子水,并调整ph为5.6;
经检测,愈伤分化率为0%。
实施例4
本实施例提供一种油茶叶片的再生方法,包括:
(1)外植体消毒:外植体为浙江红花油茶的幼嫩叶片,具体消毒方法同实施例1。
(2)愈伤诱导培养
具体培养如实施例1。
愈伤诱导培养基为:wpm基本培养基(粉末)、1.0mg/l的iaa、2.0mg/l的6-ba、0.3mg/l的tdz、80g/l的蔗糖、8g/l的琼脂、250mg/l的水解酪蛋白、250mg/l的水解乳蛋白、100mg/l的脯氨酸、100mg/l的甘氨酸、100mg/l的谷氨酰胺、100ml/l的椰子水,以及2g/l的ppvp和5mg/l的硝酸银,并调整ph为5.6;愈伤诱导率100%。
(3)愈伤分化培养
具体培养如实施例1。
所述分化培养基为:wpm培养基(粉末)、0.5mg/l的iaa、3.0mg/l的6-ba、0.01mg/l的tdz、1.0mg/lga3、30g/l的蔗糖、7g/l的琼脂、500mg/l的水解酪蛋白、500mg/l的水解乳蛋白、100mg/l的脯氨酸、100mg/l的甘氨酸、100mg/l的谷氨酰胺,100ml/l的椰子水、2g/l的ppvp和10mg/l的硝酸银,并调整ph为5.6。愈伤分化率91.2%。
(4)生根培养
具体培养如实施例1,区别在于采用0.2mg/liba溶液浸泡20s。
(5)幼苗驯化移栽
将生根的幼苗移栽到装有混合基质的育苗钵中,浇水喷雾,搭建塑料拱棚,保证里面相对湿度达到80%以上,经驯化15-20天后,移到大棚或苗圃中进行常规管理。所述混合基质由红壤土、珍珠岩和泥炭土按照3:1:1的比例混合得到。
实施例5
本实施例提供一种油茶叶片的再生方法,包括:
(1)愈伤诱导培养
外植体材料为浙江红花油茶组培幼苗的叶片,具体培养如实施例1。
愈伤诱导培养基为:wpm基本培养基(粉末)、1.0mg/l的iaa、2.0mg/l的6-ba、0.5mg/l的tdz、50g/l的蔗糖、8g/l的琼脂、300mg/l的水解酪蛋白、300mg/l的水解乳蛋白、150mg/l的脯氨酸、150mg/l的甘氨酸、150mg/l的谷氨酰胺、100ml/l的椰子水,以及1g/l的ppvp和10mg/l的硝酸银,并调整ph为5.6;愈伤诱导率100%。
(2)愈伤分化培养
具体培养如实施例1。
所述分化培养基为:wpm培养基(粉末)、1.0mg/l的iaa、2.0mg/l的6-ba、0.1mg/l的tdz、1.0mg/lga3、30g/l的蔗糖、7g/l的琼脂、300mg/l的水解酪蛋白、300mg/l的水解乳蛋白、150mg/l的脯氨酸、150mg/l的甘氨酸、150mg/l的谷氨酰胺,100ml/l的椰子水和10mg/l的硝酸银,并调整ph为5.7。愈伤分化率86.4%。
(3)生根培养
具体培养如实施例1,区别在于采用0.3mg/liba溶液浸泡10s。
(4)幼苗驯化移栽
将生根的幼苗移栽到装有混合基质的育苗钵中,浇水喷雾,搭建塑料拱棚,保证里面相对湿度达到80%以上,经驯化15-20天后,移到大棚或苗圃中进行常规管理。所述混合基质由红壤土、珍珠岩和泥炭土按照3:1:1的比例混合得到。
实施例6
本实施例提供一种油茶叶片的再生方法,包括:
(1)愈伤诱导培养
外植体材料为浙江红花油茶组培幼苗的叶片,具体培养如实施例1。
愈伤诱导培养基为:wpm基本培养基(粉末)、1.0mg/l的iaa、2.0mg/l的6-ba、1.0mg/l的tdz、70g/l的蔗糖、7g/l的琼脂、500mg/l的水解酪蛋白、500mg/l的水解乳蛋白、200mg/l的脯氨酸、200mg/l的甘氨酸、200mg/l的谷氨酰胺、100ml/l的椰子水,以及2g/l的ppvp和5mg/l的硝酸银,并调整ph为5.7;愈伤诱导率100%。
(2)愈伤分化培养
具体培养如实施例1。
所述分化培养基为:wpm培养基(粉末)、0.5mg/l的iaa、2.5mg/l的6-ba、0.05mg/l的tdz、1.0mg/lga3、30g/l的蔗糖、7g/l的琼脂、500mg/l的水解酪蛋白、500mg/l的水解乳蛋白、200mg/l的脯氨酸、200mg/l的甘氨酸、200mg/l的谷氨酰胺,100ml/l的椰子水、1g/l的ppvp和10mg/l的硝酸银,并调整ph为5.6。愈伤分化率93.5%。
(3)生根培养
具体培养如实施例1,区别在于采用0.5mg/liba溶液浸泡5s。
(4)幼苗驯化移栽
将生根的幼苗移栽到装有混合基质的育苗钵中,浇水喷雾,搭建塑料拱棚,保证里面相对湿度达到80%以上,经驯化15-20天后,移到大棚或苗圃中进行常规管理。所述混合基质由红壤土、珍珠岩和泥炭土按照3:1:1的比例混合得到。
对比例2
与实施例6相同,区别在于:
(2)愈伤诱导培养为光照培养;
愈伤诱导培养基为:wpm基本培养基(粉末)、70g/l的蔗糖、7g/l的琼脂、500mg/l的水解酪蛋白、500mg/l的水解乳蛋白、200mg/l的脯氨酸、200mg/l的甘氨酸、200mg/l的谷氨酰胺、100ml/l的椰子水,并调整ph为5.7;
经检测,愈伤诱导率0%。
(3)愈伤分化培养基为:wpm培养基(粉末)、30g/l的蔗糖、7g/l的琼脂、500mg/l的水解酪蛋白、500mg/l的水解乳蛋白、200mg/l的脯氨酸、200mg/l的甘氨酸、200mg/l的谷氨酰胺,100ml/l的椰子水,并调整ph为5.6。
经检测,愈伤分化率0%。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!