一种软枣猕猴桃一步成苗及休眠的繁殖方法与流程
本发明属于植物培养技术领域,具体涉及一种软枣猕猴桃一步成苗及休眠的繁殖方法。
背景技术:
软枣猕猴桃(actinidiaarguta),别名中华软枣猕猴桃、软枣子、藤瓜、狗枣子、金果木、猕猴梨、猕猴桃、软枣、深山木天蓼、藤梨、小洋桃等,是猕猴桃科猕猴桃属藤本落叶植物。果实可食用,营养价值很高,含大量维生素c、淀粉,果胶质等,可加工成果酱、果汁、果脯、罐头、酿酒或用于制作糕点、糖果等多种食品。亦可药用,有强壮、解热、健胃、止血等功能;根及根皮对消化道癌有一定治疗和抑制作用;种子含油量35.62%,是一种较好干性油,而且软枣猕猴桃还具有良好的蜜源和观赏植物,因此,软枣猕猴桃具有极高的经济和药用等价值。目前,软枣猕猴桃还是以野生为主,人工栽培(品种)为辅。
在现有技术中,软枣猕猴桃多采用种子、扦插、嫁接、组培等方式进行常规繁殖,种子繁殖性状产生分离,扦插生根率和嫁接成活率极低。常规组织培养繁殖不仅投入成本高且操作性差,而且大多采用愈伤组织诱导、愈伤组织再分化、继代增殖、生根、炼苗或初代培养、继代增殖、生根、炼苗等多步方式才能达到成苗,尽管生根率可观,但在出瓶炼苗时成活率不足70%,又因在愈伤组织诱导、愈伤组织再分化和继代增殖时,可能产生了与亲本性状出现差异的变异或突变,导致原品种的不一致性问题。因此,提供一种软枣猕猴桃高效、成本低、快速、简捷的种苗繁殖方法具有重要意义。
技术实现要素:
为了解决上述软枣猕猴桃扦插生根率和嫁接成活率低,组织培养成本高且操作性差,出瓶炼苗时成活率低,遗传不稳定等问题,本发明提供一种软枣猕猴桃一步成苗及休眠的繁殖方法。
为实现上述目的,本发明所采用的技术方案是:一种软枣猕猴桃一步成苗及休眠的繁殖方法,包括以下步骤:
s1.材料选择与处理:剪取6月中旬软枣猕猴桃嫩枝条,将嫩枝条去叶后剪成一叶一段的茎段,用75%乙醇涮洗5-15s后移至次氯酸钠溶液浸泡5-15min,无菌水冲洗5-8次,无菌滤纸吸干表面水分作为外植体备用;
s2.培养基制备:以马铃薯上清液10-50g·l-1;铁盐:feso4·7h2o6.80-7.00mg·l-1,na2·edta·2h2o8.50-9.50mg·l-1;微量元素:mnso4·4h2o1.00-1.50mg·l-1,znso4·7h2o0.2-0.3mg·l-1,ki0.08-0.10mg·l-1为基本培养基;附加油菜素内酯溶液0.02-0.12mg·l-1、赤霉素ga3溶液0.05-0.15mg·l-1、吲哚丁酸溶液0.01-0.06mg·l-1,再添加琼脂条7.8g·l-1,白糖10g·l-1,并调节培养基ph值至5.5-6.5;
s3.生长培养:将步骤s1中茎段接种于含有s2培养基的培养瓶中,并置于适宜的环境中培养30天,使得软枣猕猴桃茎段生根并萌发腋芽;
s4.增殖培养:将步骤s3中的茎段继续培养生长至6cm以上的小植株,接着在无菌状态下打开培养瓶,将小植株留1叶剪下苗干,并去叶切割成1叶1段的小茎段后,再次将小茎段转接到s2的培养基中继续培养,获得软枣猕猴桃小植株;
s5.植株落叶休眠:当s4中软枣猕猴桃小植株增殖至一定数量,且小植株长至2.0-3.0cm时,将培养瓶置于光照周期4.0-7.0h·d-1、光照强度250-850lx、温度5-18℃环境下培养22天,使得软枣猕猴桃小植株落叶进入休眠状态;
s6.移栽培养:当s5中小植株落叶休眠后,将小植株从培养瓶中取出,放在高锰酸钾溶液中洗净根上的琼脂,并将小植株栽植到经多菌灵消毒过的草炭土、腐烂松针和河砂的基质畦上或营养钵中培养,获得软枣猕猴桃育苗。
进一步的,步骤s1中次氯酸钠溶液的质量分数为1-5%。
进一步的,基本培养基中马铃薯上清液30g·l-1;铁盐:feso4·7h2o6.95mg·l-1,na2·edta·2h2o9.325mg·l-1;微量元素:mnso4·4h2o1.25mg·l-1,znso4·7h2o0.25mg·l-1,ki0.095mg·l-1。
进一步的,步骤s2中的油菜素内酯溶液0.02-0.07mg·l-1、赤霉素ga3溶液0.05-0.10mg·l-1、吲哚丁酸溶液0.03-0.07mg·l-1。
进一步的,步骤s2中的油菜素内酯溶液0.07-0.12mg·l-1、赤霉素ga3溶液0.10-0.15mg·l-1、吲哚丁酸溶液0.01-0.03mg·l-1。
进一步的,步骤s3培养环境为温度26±2℃、光照强度1000lx、光照周期10h·d-1。
进一步的,步骤s5的培养环境为光照强度500-800lx、温度10-18℃。
进一步的,步骤s5的培养环境为光照强度250-500lx、温度5-10℃。
进一步的,步骤s6中高锰酸钾溶液的浓度为20mg·l-1。
进一步的,步骤s6中炭土、腐烂松针、河砂的质量比2-5:1-3:1。
本发明提供一种软枣猕猴桃一步成苗及休眠的繁殖方法,具有以下优点:
(1)培养基简单、成本低、可操作性强,在整个繁殖过程中仅用1种培养基即可完成茎段生根,并同步腋芽的迅速萌发生长,经过30天的培养,成苗率达99.0%以上,属一步成苗方法;
(2)为提高成苗后定植成活率和缩短定植周期,采用试管苗落叶休眠方法,此方法可免去炼苗过程,仅培养22天软枣猕猴桃试管苗落叶进入休眠状态,休眠率均在99.5%以上;
(3)试管内快速繁殖通过节增殖方式,增殖倍数为25天一个周期,按每瓶接种10个茎段,每个茎段在一个周期内可切割成5-6段计算,每年有14个周期,年生产种苗数为:∑年产成活种苗=10×514×99.0%×99.5%×99.0%株,可见本技术可以满足软枣猕猴桃工厂化育苗的需要。
附图说明
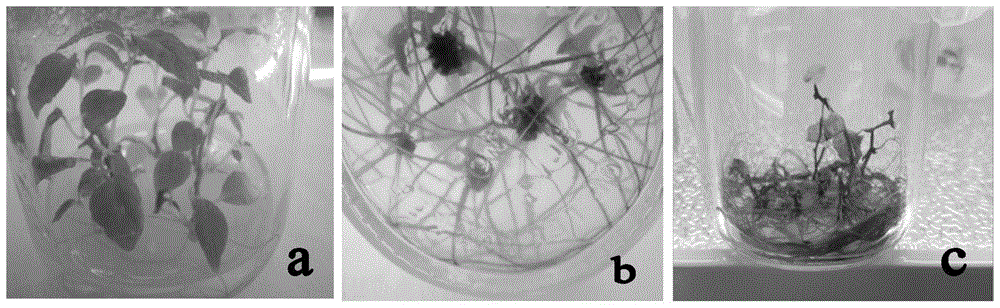
图1中a为软枣猕猴桃腋芽萌发生长并同步生根的一步成苗图;
b为软枣猕猴桃生根图;
c为软枣猕猴桃试管内落叶休眠图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的一部分实施例,而不是全部的实施例。
如图1所示,一种软枣猕猴桃一步成苗及休眠的繁殖方法,包括以下步骤:
1材料与方法
1.1材料选择与处理
6月中旬,剪取优质软枣猕猴桃嫩枝条(选择芽包饱满的枝条),将嫩枝条去叶后剪成一叶一段(长度控制在1.00cm),用75%乙醇(体积分数)涮洗10s后移至3.0%次氯酸钠溶液(质量浓度)浸泡10min,无菌水冲洗6次,无菌滤纸吸干表面水分,去除被乙醇和次氯酸钠损伤的组织作为外植体备用;
1.2软枣猕猴桃茎段生根同步腋芽萌发生长和植株高效再生体系建立
培养基制备:以马铃薯上清液10-50g·l-1;铁盐:feso4·7h2o6.80-7.00mg·l-1,na2·edta·2h2o8.50-9.50mg·l-1;微量元素:mnso4·4h2o1.00-1.50mg·l-1,znso4·7h2o0.2-0.3mg·l-1,ki0.08-0.10mg·l-1为基本培养基;附加油菜素内酯溶液0.02-0.12mg·l-1、赤霉素ga3溶液0.05-0.15mg·l-1、吲哚丁酸溶液0.01-0.06mg·l-1,再添加琼脂条7.8g·l-1,白糖10g·l-1,并调节培养基ph值5.5-6.5;
本实施例的基本培养基中马铃薯上清液30g·l-1;铁盐:feso4·7h2o6.95mg·l-1,na2·edta·2h2o9.325mg·l-1;微量元素:mnso4·4h2o1.25mg·l-1,znso4·7h2o0.25mg·l-1,ki0.095mg·l-1;该基本培养基附加油菜素内酯0.02-0.07mg·l-1、赤霉素(ga3)0.05-0.10mg·l-1和吲哚丁酸(iba)0.03-0.08mg·l-1,琼脂条7.8g·l-1,添加食用白糖10g·l-1,并调节培养基ph值至6.0;
接着将上述1.1的嫩茎段接种于该培养基中,并置于光照周期10h·d-1、光照强度1000lx和温度26±2℃条件下培养。为提高软枣猕猴桃嫩茎段生根同时腋芽萌发生长的速度,通过均匀设计法设计实验,选用u10(103)均匀表,每个处理接种6-8个芽苗,重复3次,筛选影响软枣猕猴桃茎段生根同时腋芽生长的油菜素内酯、赤霉素和吲哚丁酸最佳浓度配比。茎段培养30d统计成苗率,成苗率以茎段生根同时腋芽萌发生长(腋芽生长1.0cm以上)为准。成苗率=(生根并腋芽萌发生长的茎段数/接种的茎段总数)×100%。
植株高效再生体系建立采取节增殖方式,即再生植株茎节为材料,小植株生长至6cm以上时,在无菌状态下打开培养瓶,将小植株留1叶剪下苗干,并去叶切割成1叶1段(长度为1.0cm左右)的小茎段后,再次将小茎段转接到已筛选确定的培养基中,开始生根同步茎段生长培养,计算增殖倍数和周期。
1.3软枣猕猴桃试管内落叶休眠及移栽
为提高成苗后定植成活率和缩短定植周期,采用试管苗落叶休眠方法,此方法可免去炼苗过程。即当软枣猕猴桃种苗扩繁到一定数量后,且试管苗长至2.0-3.0cm时,将培养瓶置于光照周期4-8h·d-1、光照强度500-900lx和温度10-18℃条件下培养,并观察试管苗变化情况,待试管苗落叶后统计时间、光照周期、光照强度和温度,为保证试管苗落叶休眠的速度和确定落叶休眠的最佳条件,应用均匀设计法设计实验,选用u9(93)均匀表,每个处理10瓶,重复3次,筛选影响软枣猕猴桃试管苗落叶休眠的光照周期、光照强度和温度最佳条件参数。休眠率=(试管内落叶的小植株数/实验的小植株总数)×100%。
当试管苗落叶休眠后,将小植株从培养瓶中取出,放在高锰酸钾溶液(浓度为20mg·l-1)中洗净根上的琼脂,将小植株直接栽植到经多菌灵(100倍液)消毒过的草炭土、腐烂松针和河砂(质量比3:2:1)的基质畦上或营养钵中完成移栽,每天早晚喷洒1次清水。
2结果与分析
2.1油菜素内酯、赤霉素和吲哚丁酸对软枣猕猴桃茎段生根同步腋芽萌发生长的影响
表1影响软枣猕猴桃嫩茎段生根同时腋芽萌发生长因素筛选的u10(103)试验设计与结果
实验所得数据(表1)经均匀设计软件分析处理后可得回归方程为y=84.4+62.5x1+103x2-19.3x3,显著性水平α=0.05,复相关系数r=0.9884,剩余标准差s=0.354,检验值ft=84.41﹥临界值f(0.05,3,6)=4.757,回归方程具有显著性,油菜素内酯、赤霉素和吲哚丁酸对成苗的影响均具有显著。通过计算油菜素内酯、赤霉素和吲哚丁酸对成苗的贡献值和贡献率可知,u1=9.22,u1/u=29.0%;u2=25.1,u2/u=79.1%;u3=0.917,u3/u=2.89%,可见吲哚丁酸对成苗贡献最小,对其进行显著性检验可知:检验值f3=7.309﹥临界值f(0.05,1,6)=5.987,说明吲哚丁酸对成苗影响显著。由回归方程可知油菜素内酯和赤霉素与成苗率呈正相关,吲哚丁酸与成苗率呈负相关。由此推测,油菜素内酯和赤霉素质量浓度分别高于0.07mg·l-1、0.10mg·l-1,以及吲哚丁酸质量浓度低于0.03mg·l-1时,可能有更高的成苗率。为验证此推测,又以油菜素内酯质量浓度为0.12、0.11、0.10、0.09、0.08和0.07mg·l-1,赤霉素质量浓度为0.15、0.14、0.13、0.12、0.11和0.10mg·l-1,以及吲哚丁酸质量浓度0.01、0.02和0.03mg·l-1开展6个补充试验,重复3次。经过30d的培养,结果发现,油菜素内酯质量浓度为(0.07-0.09mg·l-1)、赤霉素质量浓度为(0.11-0.13mg·l-1)和吲哚丁酸质量浓度为(0.01-0.02mg·l-1)时成苗率最高,均达99.0%以上。均比表1所列10个处理的成苗率高。当油菜素内酯浓度高于0.09mg·l-1时,茎段基部产生愈伤组织,部分根从愈伤组织部位发出,这样的根在移栽时,根随愈伤组织腐烂而去除,影响成活率;当赤霉素浓度高于0.13mg·l-1时,腋芽细弱,有玻璃化现象。
通过以上系列实验可知,软枣猕猴桃茎段生根同时腋芽萌发生长的培养基为:基本培养基+油菜素内酯(0.07-0.09mg·l-1)+赤霉素(0.11-0.13mg·l-1)+吲哚丁酸(0.01-0.02mg·l-1)。
2.2软枣猕猴桃植株高效再生体系建立
软枣猕猴桃试管内快繁通过节增殖方式,按照1.2中的方法,增殖倍数为25天一个周期,按每瓶接种10个茎段,每个茎段在一个周期内可切割成5-6段计算,每年有14个周期,年生产试管苗数为:∑年产试管苗=10×514×99.0%株,可见本技术可以满足软枣猕猴桃工厂化育苗的需要。
2.3软枣猕猴桃试管内落叶休眠和移栽
表2影响软枣猕猴桃试管苗休眠因素筛选的u9(93)试验设计与结果
数据(表2)经分析处理后可得回归方程为y=107-0.00733x2-0.300x3,显著性水平α=0.05,复相关系数r=0.9340,剩余标准差s=0.5730,检验值ft=20.52﹥临界值f(0.05,2,6)=5.143,回归方程具有显著性,说明光照强度和温度对软枣猕猴桃试管苗休眠影响具有显著性,光照周期对软枣猕猴桃试管苗休眠影响不显著。计算光照强度和温度对软枣猕猴桃试管苗休眠的贡献值和贡献率可知,u2=8.07,u2/u=59.9%;u3=5.40,u3/u=40.1%,说明光照强度大于温度对软枣猕猴桃试管苗休眠的贡献。因光照强度和温度均与休眠率呈负相关。由此猜测,光照强度、温度分别低于500lx、10℃时可能休眠率更高。为验证猜测的可能性,又以光照强度为500、450、400、350、300和250lx,温度为10、9、8、7、6和5℃开展9个补充试验,重复3次。结果发现,光照强度在450-500lx范围内,温度在8-10℃范围内,软枣猕猴桃试管苗休眠最好,经过22d的培养处理,休眠率均在99.5%,均高于表2所列9个处理的休眠率。当光照强度和温度分别低于250lx和8℃时,虽然叶片很快变黄,但叶柄几乎不能与苗干分离,且试管苗出现茎尖萎蔫现象,影响落叶后试管苗的质量。
根据1.3中的方法,当试管苗落叶休眠后,将小植株从培养瓶中取出,放在高锰酸钾溶液(浓度为20mg·l-1)中洗净根上的琼脂,将小植株直接栽植到经多菌灵(100倍液)消毒过的草炭土、腐烂松针和河砂(质量比为3:2:1)的基质畦上或营养钵中完成移栽,每天早晚喷洒1次清水。经统计计算,小植株成活率可达到99.0%以上。
本发明通过采用优质软枣猕猴桃的嫩茎段(一叶一段)为材料,利用植物组织培养技术通过茎段基部生根同步腋芽萌发生长方式,从培养到成苗仅用一种培养基完成试管内一步成苗的简捷快速方法,成苗后再在试管内促使植株落叶进入休眠,休眠植株可免去炼苗步骤直接出瓶定植,成活率可保证99%以上的人工育苗方法,此方法具有整个成苗及定植过程简捷、成本低、遗传稳定性好、可操作性强、易推广、成苗率和移栽成活率高等优点,属一步高效快速成苗技术。可应用于软枣猕猴桃的工厂化育苗。
上述仅为本发明的优选具体实施方式,但本发明的设计构思并不局限于此,凡利用此构思对本发明进行非实质性的改动,均应属于侵犯本发明保护范围的行为。
- 还没有人留言评论。精彩留言会获得点赞!