化合物harzianums及其产生菌的除草活性的制作方法
[0001]
本发明属于除草剂领域,具体涉及化合物harzianums及其产生菌trichoderma brevicompactum在除草药剂、菌剂中的用途。
背景技术:
[0002]
harzianums是一类化学结构相似的四环倍半萜类环氧化物,其中c-9,10间为双键,在c-12,13间为环氧基。这类化合物根据其化学结构的差异可分为四型:a型在c-8位含有h或oh,不含羰基,如t-2毒素、木霉素、harzianum a等;b型在c-8位含有羰基,如雪腐镰刀菌烯醇(nivalenol,niv);c型在c-7,8位含一个环氧基,如扁虫菌素;d型在c-4和c-15中有一个大环结构,其中a,b型较常见。目前已从自然界中分离到200多种该类化合物。这类四环倍半萜类环氧化物由镰刀菌属、漆斑菌属、葡萄穗霉属等真菌产生,是一类对植物和动物都具有一定程度毒性的真菌毒素。其中a类和b类毒性较低。因此,其中具有较高植物毒性和较低动物毒性的四环倍半萜类环氧化物具有成为除草剂的潜力。例如,abbas等人(2013)发现t-2tetraol对哺乳动物细胞毒性较低,而植物毒性较高[1]。
[0003]
脐孢木霉菌(trichoderma brevicompactum)由kraus等在2004年首次发现并命名,也称短密木霉或短致木霉,属于丛梗孢料、木霉属,而有性阶段属于肉座科、肉座菌属,是一种广泛存在于土壤、植物中的木霉菌[2]。脐孢木霉菌的分生孢子簇呈半球状,分生孢子为表面光滑的亚球形或卵圆形结构,其颜色为灰绿色、黄绿色或深绿色,平板上的分生孢子从中心向四周形成典型的同心环状菌落。脐孢木霉菌是一种生防菌株,对多种植物病原真菌具有良好的防治效果,能产生具有生防活性的次级代谢产物来抑制植物病原菌的生长。例如脐孢木霉菌cbs 109720、ibt 40839和ibt 40840等菌株均能代谢合成木霉素(trichodermin),而t.cf.brevicompactum atcc 90237、ibt 40863和nrrl 3199主要代谢合成化合物harzianum a。
[0004]
harzianums类化合物属于a类,与t-2tetraol结构类似,其中,harzianum a最早于1994年分离自木霉属的trichoderma harzianum,具有抗菌活性[3],harzianum b则分离自hypocrea sp.f000527,具有抗癌活性[4]。
[0005]
参考文献
[0006]
[1]h.k.abbas,t.yoshizawa and w.t.shier,2013.cytotoxicity and phytotoxicity of trichothecene mycotoxins produced by fusarium spp,toxicon,74,68-75.doi:10.1016/j.toxicon.2013.07.026;
[0007]
[2]g.f.kraus,i.druzhinina,w.gams,j.bissett,d.zafari,g.szakacs,a.koptchinski,h.prillinger,r.zare and c.p.kubicek,2004.trichoderma brevicompactum sp nov,mycologia,96,1059-1073.doi:10.2307/3762089;
[0008]
[3]d.g.corley,m.miller-wideman and r.c.durley,1994.isolation and structure of harzianum a:a new trichothecene from trichoderma harzianum,j nat prod,57,422-425.doi:10.1021/np50105a019;
[0009]
[4]h.z.jin,j.h.lee,w.d.zhang,h.b.lee,y.s.hong,y.h.kim and j.j.lee,2007.harzianums a and b produced by a fungal strain,hypocrea sp.f000527,and their cytotoxicity against tumor cell lines,j asian nat prod res,9,203-207.doi:10.1080/10286020500531977。
技术实现要素:
[0010]
因此,本发明的目的是提供一类化合物harzianums(化合物1、2及其混合物)及其产生菌trichoderma brevicompactum作为除草药剂中的应用。因而也提供含有上述化合物或其产生菌的除草药剂和菌剂。
[0011]
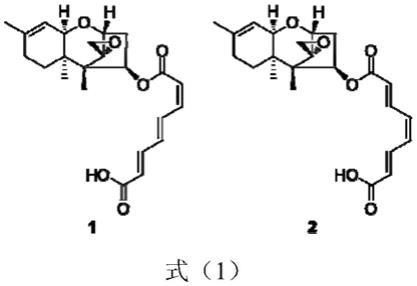
本发明从211株土壤真菌中筛选得到一株具有抑制双子叶植物小白菜发芽和生长的真菌,经its鉴定为脐孢木霉菌(trichoderma brevicompactum)。该菌株已于2020年4月9日由中国微生物菌种保藏管理委员会普通微生物中心(cgmcc)所保藏(保藏地址是:北京市朝阳区北辰西路1号院3号),保藏号为cgmcc no.19618,分类命名为短密木霉trichoderma brevicompactum,经检测存活。通过大发酵,获取足量提取物后进行分离、纯化,得到化合物harzianum a(化合物1)和harzianum b(化合物2)的混合物。其化学结构如式(1)所示:
[0012][0013]
本发明提供的技术方案是:化合物harzianum a,harzianum b或其混合物作为除草药剂中的应用。
[0014]
上述的应用,除草是除指双子叶植物,或单子叶植物杂草,优选地是双子叶植物brassica属、单子叶植物echinochloa属的杂草,更具体地为稗草。
[0015]
本发明还提供一种化合物harzianum a和harzianum b产生菌(trichoderma brevicompactum)的菌株,其菌种保藏号为:cgmcc no.19618。
[0016]
同时,本发明提供一种利用所述的菌株生产化合物harzianum a和harzianum b的方法:通过培养所述菌株,从其菌体中分离所述化合物harzianum a和harzianum b,经层析和高压液相色谱分离提纯,高效液相色谱质谱联用鉴定。
[0017]
本发明还提供一种利用所述的菌株及其发酵产物在除草中的应用,其中除草是指双子叶植物,或单子叶植物杂草,优选地是双子叶植物brassica属、单子叶植物echinochloa属的杂草,更具体地为稗草。
[0018]
所述的应用,其中所述发酵产物是pda固体发酵、等体积甲醇三次初步提取、蒸发干燥的粗提物。
[0019]
本发明还提供一种除草剂,其包含化合物harzianum a,harzianum b或其混合物作为有效成分、或所述的菌株的发酵产物,可溶于甲醇后用水稀释成溶液使用。
[0020]
所述的除草剂,所述除草指双子叶植物,或单子叶植物杂草,优选地是双子叶植物brassica属、单子叶植物echinochloa属的杂草,更具体地为稗草。
[0021]
本发明通过实验表明具有以下有益技术效果:
[0022]
具体来说,本发明评估了trichoderma brevicompactum的发酵粗提物和化合物1、2混合物对双子叶植物brassica属的小白菜发芽和生长的抑制作用。结果显示:trichoderma brevicompactum的发酵粗提物在20-200μg/ml剂量下可以100%抑制小白菜种子萌发;化合物1、2的混合物在2,4,6,8,10μg/ml剂量下均可以100%抑制小白菜种子萌发;在盆栽实验中,化合物1、2的混合物在50μg/cm2剂量下喷洒能够抑制小白菜发芽和生长。化合物1、2混合物对单子叶植物echinochloa crusgalli(l.)beauv..也具有抑制作用。另外,本发明通过体外细胞毒活性实验评估了化合物1和2的混合物对哺乳动物细胞的生长抑制作用。结果显示:化合物1和2的混合物对四种人源肿瘤细胞(a549、hepg2、hela和mcf-7)和一种非洲绿猴肾细胞(vero)均未表现出明显的生长抑制作用(ic
50
>50.0μm),说明化合物1和2的混合物对人体和哺乳动物均具有良好的安全性。因此,化合物1和2及其产生菌trichoderma brevicompactum有望开发成绿色环保、高效低毒的除草药剂,具备广泛的应用前景。
附图说明
[0023]
图1被测菌株的its序列与trichoderma brevicompactum标准菌株的序列比对。
[0024]
图2 trichoderma brevicompactum发酵粗提物对小白菜发芽的抑制活性。
[0025]
图3 trichoderma brevicompactum发酵粗提物在210nm下液相色谱图。图4氯仿组分在210nm下液相色谱图。
[0026]
图5经分离提纯后化合物1-2混合物在210nm下液相色谱图。。
[0027]
图6化合物1-2混合物对小白菜发芽的抑制活性。
[0028]
图7化合物1-2混合物对小白菜生长的抑制活性。
[0029]
图8除草剂24d对小白菜生长的抑制活性。
[0030]
图9盆栽实验中化合物1-2和除草剂24d对小白菜生长的抑制作用(发芽后施药)。
[0031]
图10盆栽实验中化合物1-2和除草剂24d对小白菜生长的抑制活性(发芽前施药)。
[0032]
图11化合物1-2和除草剂24d对小白菜种子发芽率的影响。
[0033]
图12化合物1-2混合物对水稻发芽和生长的抑制活性。
[0034]
图13 24d对稗草生长的抑制活性。
[0035]
图14化合物1-2混合物对稗草根和茎生长的抑制率。
具体实施方式
[0036]
下面通过具体实施方式的详细描述来进一步阐明本发明,但并不是对本发明的限制,仅仅作示例说明。
[0037]
实施例1:trichoderma brevicompactum的its鉴定
[0038]
1.1仪器与材料
[0039]
实验中所用菌株:trichoderma brevicompactum来源于中国农业科学院生物技术所,由本发明人实验室自行保存。该菌株现已于2020年4月9日由中国微生物菌种保藏管理
委员会普通微生物中心(cgmcc)所保藏(保藏地址是:北京市朝阳区北辰西路1号院3号),保藏号为cgmcc no.19618,分类命名为短密木霉trichoderma brevicompactum,经检测存活。实验所用试剂均为国产分析纯产品。培养基:pda和pdb培养基(购自美国bd difco)。dna提取使用ctab法,试剂均为分析纯。
[0040]
实施例中其它未注明具体条件的实验方法,按照常规方法进行,分子克隆按(new york:cold spring harbor laboratory press,1989)实验室手册中所述的条件,或按照制造厂商所建议的条件。
[0041]
1.2实验方法
[0042]
将trichoderma brevicompactum接种与10ml pdb液体培养基中培养七天后,将pdb培养基吸干,收集菌丝体。
[0043]
dna提取:将菌丝体于液氮中研磨,置于ctab裂解液中,65℃水浴30min,dna提取液(酚/氯仿/异戊醇25:24:1)抽提2次,氯仿抽提1次,吸取上清,加入等体积的无水乙醇和十分之一体积的3mol/l醋酸钠(ph 5.2),-20℃沉淀1小时,12000rpm离心10min,弃上清,将沉淀用70%乙醇洗涤两次,干燥,用50μl缓冲液溶解。
[0044]
its序列扩增:
[0045]
扩增引物为its通用引物its1和its4,引物序列如下:
[0046]
its1:5
’-
tccgtaggtgaacctgcgg-3
’
[0047]
its4:5
’-
tcctccgcttattgatatgc-3
’
[0048]
pcr扩增反应采取takara公司的primestar gxl dna polymerase试剂盒进行。
[0049]
1.3实验结果与分析
[0050]
将测序得到的its序列使用ncbi blastn程序进行检索,与trichoderma brevicompactum strain 296的碱基一致性为100%,鉴定未知菌株为trichoderma brevicompactum。
[0051]
待测菌株与trichoderma brevicompactum strain 296its序列比对见图1。
[0052]
实施例2:trichoderma brevicompactum发酵粗提物活性测试
[0053]
2.1实验目的
[0054]
测试trichoderma brevicompactum发酵粗提物对小白菜发芽的抑制活性
[0055]
2.2实验方法
[0056]
1l的pda平板固体发酵14天后,将pda切块,用等体积甲醇提取三次,有机相经减压浓缩(45℃水浴)后得总浸膏,用5ml甲醇复溶将获得的粗提物浸膏用甲醇充分溶解后,再次离心浓缩备用,用甲醇溶解至浓度为100μg/μl。
[0057]
于96孔板中,先加入50μl水,再加入0.2-2.2μl溶解后的粗提物,之后加入5个种子(表面光滑,种子平整,不开裂,品相完整),室温25℃观察其生长状况。
[0058]
2.3实验结果及分析
[0059]
加入真菌粗提物至终浓度0.2mg/ml以上时,小白菜种子不发芽。
[0060]
trichoderma brevicompactum发酵粗提物对小白菜发芽的抑制活性见图2。
[0061]
实施例3化合物1-2的提取分离及结构鉴定
[0062]
3.1仪器与材料
[0063]
实验中所用溶剂氯仿、甲醇、乙酸乙酯为北京化工试剂厂生产,均为分析纯。色谱
纯乙腈为fisher chemical公司生产。柱层析硅胶为青岛海洋化工厂生产(200~300目)。薄层硅胶层析板为烟台黄务硅胶开发试验厂生产。buchi r-300型旋转蒸发仪,buchi i-300型触控中央控制单元,buchi v-300型ptfe膜式真空泵,buchi b-300型电热恒温水浴锅,均由瑞士buchi公司生产。低温冷却液循环泵由上海知信实验仪器技术有限公司生产。半制备高效液相色谱仪为安捷伦1260 infinity ii,c18色谱柱为安捷伦zorbax rx-c18(5μm,9.4
×
250mm)。hresi-ms仪器为agilent ms 6530 q-tof型质谱仪,直接进样测定。高效液相色谱仪为agilent 1290 infinity ii,色谱柱rrhd eclipse plus c18,4.6x100mm。核磁共振谱谱用bruker aviii 400m型超导核磁共振仪测定,以氘代二甲基亚砜残留溶剂峰作标定,氘代二甲基亚砜为美国剑桥公司(cil)生产。
[0064]
3.2实验方法
[0065]
检测方法如下:将发酵产物经高速离心后通过高效液相(hplc)色谱和高分辨质谱检测(hrms/ms)检测。hplc检测条件如下:采用甲醇-水为流动相进行梯度洗脱,梯度洗脱条件:0-20min,甲醇从10%
→
100%;20-23min,甲醇为100%;23-23.01min,甲醇从100%
→
10%,23.01-25min,甲醇为10%,流速0.5ml/min,检测波长为210nm。hrms/ms检测条件如下:负离子模式,碰撞能量25v。
[0066]
分离方法如下:4l pda平板固体培养物用等体积甲醇提取3次,有机相减压浓缩后得总浸膏(1.8g)。总浸膏经80%甲醇完全溶解,用正己烷去除杂质,而后用50%甲醇溶解,加入等体积得氯仿,得氯仿层,有机相减压浓缩后得氯仿层化合物。上半制备高效液相色谱进行梯度洗脱制备,梯度洗脱条件:0-30min,甲醇从10%
→
95%;30-45min,甲醇从95%
→
10%,45.01-48min,甲醇为10%。
[0067]
3.3实验结果与分析
[0068]
氯仿层经半制备高效液相色谱分离,收集馏分保留时间(min)如下:峰1:14.685;峰2:保留时间:16.866;峰3:保留时间:25.132,峰4:保留时间:31.407;峰5:保留时间:34.347;峰6:保留时间:31.916,峰7:保留时间:33.329.其中,峰4所得化合物产量为12.5mg.
[0069]
通过解析高分辨质谱、一维和二维核磁共振谱,鉴定了化合物1
–
2的结构如式(1)所示。
[0070][0071]
其中,化合物1为已报道的harzianum a,化合物2为harzianum b,两者为顺反异构体。化合物1和2的结构鉴定数据如下:
[0072]
化合物1和2:高分辨质谱m/z 401.2003[m+h]
+
,calcd.401.1964,分子式为c
23
h
28
o6;1h(400mhz)和
13
c nmr(100mhz)数据归属如表1所示。
[0073]
表1.化合物1和2的核磁共振数据(测试溶剂为氘代甲醇)
[0074]
[0075][0076]
真菌粗提物在210nm下液相色谱图见图3。
[0077]
氯仿组分在210nm下液相色谱图见图4。
[0078]
经分离提纯后化合物1和2混合物在210nm下液相色谱图见图5。
[0079]
实施例4:化合物1与化合物2混合物抑制小白菜种子萌发
[0080]
4.1实验目的
[0081]
测试分离提取后的化合物1和2混合物对小白菜发芽的抑制活性。
[0082]
4.2实验方法
[0083]
将分离提取后的化合物1和2混合物甲醇充分溶解后,再次离心浓缩备用,用甲醇
溶解至浓度为1μg/μl。
[0084]
于96孔板中,先加入50μl水,再加入0.2-2.2μl溶解后的粗提物,之后加入5个种子(表面光滑,种子平整,不开裂,品相完整),室温25℃观察其生长状况。
[0085]
4.3实验结果及分析
[0086]
加入化合物1和2混合物至终浓度0.002mg/ml以上时,小白菜种子不发芽。
[0087]
化合物1和2混合物对小白菜发芽的抑制活性见图6.
[0088]
实施例5:化合物1和化合物2混合物抑制小白菜生长
[0089]
5.1实验目的
[0090]
测试化合物1和2混合物对小白菜生长的抑制活性,并与阳性对照药物24d比较
[0091]
5.2实验方法
[0092]
将化合物1和2混合物用甲醇溶解,配制成浓度为100μg/μl,10μg/μl,1μg/μl,100ng/μl,10ng/μl,1ng/μl的溶液。
[0093]
将阳性对照药物24d用甲醇溶解,配制成浓度为100μg/μl,10μg/μl,1μg/μl,100ng/μl,10ng/μl,1ng/μl的溶液。
[0094]
配制水琼脂培养基,加入8g/l琼脂粉,121℃,20min灭菌处理。倒平板。
[0095]
小白菜种子表面消毒:将小白菜种子用无菌水冲洗,然后用0.1%有效氯次氯酸钠溶液浸泡3分钟,无菌水冲洗5至6次。冲洗后,将小白菜种子晾干。
[0096]
将表面消毒后的小白菜种子点在倒好的水琼脂平板上,每次仅点一粒种子,每个种子之间距离大约为1.5cm左右,而后于25℃培养,每天24h中,16h光照,8h黑暗,观察植株生长状况。
[0097]
将小白菜种子放置于0.8%水琼脂培养基上,滴加1μl配制好的化合物1和2混合物溶液或阳性药物24d溶液,同时设置甲醇阴性对照。
[0098]
5.3实验结果及分析:
[0099]
表2添加化合物1和2混合物时小白菜地上部分和地下部分的生长情况
[0100] 地上部分/mm地下部分/mmcontrol4.10
±
0.10a83.00
±
1.00a100μg0.00b0.00
±
0.00e10μg0.00b2.00
±
0.00d1μg4.10
±
0.10a5.67
±
0.58c100ng4.17
±
0.15a66.67
±
1.53b10ng4.20
±
0.10a68.00
±
1.00b1ng4.10
±
0.10a81.33
±
1.53a
[0101]
表3添加除草剂24d时小白菜地上部分和地下部分的生长情况
[0102] 地上部分/mm地下部分/mmcontrol4.10
±
0.10a81.00
±
1.00a100μg3.23
±
0.25b0.00
±
0.00f10μg3.30
±
0.20b0.00
±
0.00f1μg4.00
±
0.10a26.00
±
1.00e100ng4.03
±
0.06a66.00
±
1.00d
10ng4.10
±
0.17a68.33
±
:1.53c1ng4.10
±
0.10a70.33
±
0.58b
[0103]
化合物1和2混合物的添加量为1ng-100μg,随着化合物量的增多,小白菜生长的抑制程度越强,1ng-1μg时,小白菜根的长度逐渐缩短(p<0.05),地上部分生长状况未见显著性差异,说明化合物1和2可影响小白菜根的生长,化合物1和2的添加量为100μg时,小白菜种子不发芽。
[0104]
与除草剂24d相比,化合物1和2在100ng以下的剂量下,其抑制地下部分生长的能力与24d相当,1-10μg时略逊于24d,100μg强于24d,抑制种子萌发。
[0105]
化合物1和2混合物对小白菜生长的抑制活性见图7。
[0106]
除草剂24d对小白菜生长的抑制活性见图8。
[0107]
实施例6:化合物1和2混合物抑制小白菜发芽和生长的盆栽实验
[0108]
6.1实验目的
[0109]
测试化合物1和2混合物在土壤环境中抑制小白菜发芽和生长的活性
[0110]
6.2实验方法
[0111]
将化合物1和2和阳性对照药24d配制成10mg/ml的溶液。
[0112]
将混合均匀的营养土装入培养盆中,在培养盆中加入适量清水,使营养土湿润,将营养土表面压实,使各盆营养土的高度一致。然后在每盆中点播15粒小白菜种子,表面轻撒一层干燥的营养土,分别取500μl甲醇、化合物1-2溶液以及24d溶液,均匀喷洒于不同的培养盆表面。培养条件设置为25℃培养,每天24h中,16h光照,8h黑暗,观察植株生长状况。
[0113]
6.3实验结果及分析
[0114]
盆栽实验中化合物1和2混合物和除草剂24d对小白菜生长的抑制活性(发芽后施药)请参见图9。
[0115]
盆栽实验中化合物1和2和除草剂24d对小白菜生长的抑制活性(发芽前施药)请参见图10。
[0116]
化合物1和2和除草剂24d对小白菜种子发芽率的影响请参见图11。
[0117]
与阳性对照甲醇相比,化合物1和2和除草剂24d均可抑制小白菜的生长(图9),但是24d并没有使小白菜种子的发芽率明显降低,化合物1和2则引起了小白菜种子发芽率的降低(图10)。
[0118]
实施例7:化合物1和化合物2混合物抑制单子叶植物稗草的生长
[0119]
7.1实验目的
[0120]
测试化合物1和2混合物对稗草生长的抑制活性。
[0121]
7.2实验方法
[0122]
将化合物1和2用甲醇溶解,配制成浓度为100μg/μl,10μg/μl,1μg/μl,100ng/μl,10ng/μl,1ng/μl的溶液。
[0123]
将阳性对照药物24d用甲醇溶解,配制成浓度为100μg/μl,10μg/μl,1μg/μl,100ng/μl,10ng/μl,1ng/μl的溶液。
[0124]
配制水琼脂培养基,加入8g/l琼脂粉,121℃,20min灭菌处理。倒平板。
[0125]
稗草种子表面消毒:将种子用无菌水冲洗,然后用0.1%有效氯次氯酸钠溶液浸泡3分钟,无菌水冲洗5至6次。冲洗后,将种子晾干。
[0126]
将表面消毒后的稗草种子点在倒好的水琼脂平板上,每次仅点一粒种子,每个种子之间距离大约为1.5cm左右,而后于25℃培养,每天24h中,16h光照,8h黑暗,观察植株生长状况。
[0127]
将稗草种子放置于0.8%水琼脂培养基上,滴加1μl配制好的化合物1和2溶液或阳性药物24d溶液,同时设置甲醇阴性对照。
[0128]
7.3实验结果及分析:
[0129]
化合物1和2混合物的添加量为1ng-100μg,随着化合物量的增多,稗草生长的抑制程度越强,0.1-100μg时,稗草根与茎的长度逐渐缩短(p<0.05),说明化合物1和2可影响稗草的生长,化合物1和2的添加量为100μg时,稗草种子不发芽。
[0130]
与除草剂24d相比,化合物1和2在100μg以下的剂量下,其抑制地下部分生长的能力略逊于24d。
[0131]
化合物1和2混合物对稗草生长的抑制活性见图12。
[0132]
24d对稗草生长的抑制活性见图13。
[0133]
化合物1和2混合物对稗草根和茎生长的抑制率见图14。
[0134]
实施例8:化合物1和化合物2混合物的细胞毒活性
[0135]
8.1仪器与材料
[0136]
酶标仪为genois microplate reader(tecan genios,swizerland);四种人源肿瘤细胞株即人肺癌a549细胞、人肝癌hepg2细胞、人宫颈癌hela细胞、人乳腺癌mcf-7细胞以及非洲绿猴肾表皮vero细胞均购自中国科学院昆明动物研究所;胎牛血清fbs,rpmi1640培养液、dmem培养液购自gibco,usa;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(mtt)购自amresco,usa。
[0137]
8.2实验方法
[0138]
取对数生长期的人肺癌a549细胞、人肝癌hepg2细胞、人宫颈癌hela细胞、人乳腺癌mcf-7细胞、非洲绿猴肾表皮vero细胞加入96孔板中,每孔含有约5000个细胞。再加入不同浓度的化合物1和2,并以阿霉素为阳性对照,以未加样品的细胞孔作为对照组,每组设4个平行孔,置于二氧化碳培养箱中37℃培养72小时,实验终止前4小时加入20μl mtt(5mg/ml)溶液,再培养4小时,弃去培养液后加入150μl dmso,待结晶溶解后在酶联检测仪上检测570nm波长下每孔的od值。按下列公式求出生长抑制率,再由spss(17.0)软件求出半数抑制浓度(ic
50
值)。结果见表2,其中ic
50
用mean
±
s.e.m表示。
[0139][0140]
8.3实验结果与分析
[0141]
由表4中的结果可见,化合物1和2对哺乳动物细胞未表现出明显的细胞毒性。
[0142]
表4.化合物1和2的肿瘤细胞生长抑制活性(ic
50
,μm)
[0143]
[0144]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1