一种葛根组培苗叶片愈伤组织诱导及再生方法与流程
本发明涉及植物组织培养
技术领域:
,具体涉及一种葛根组培苗叶片愈伤组织诱导及再生方法。
背景技术:
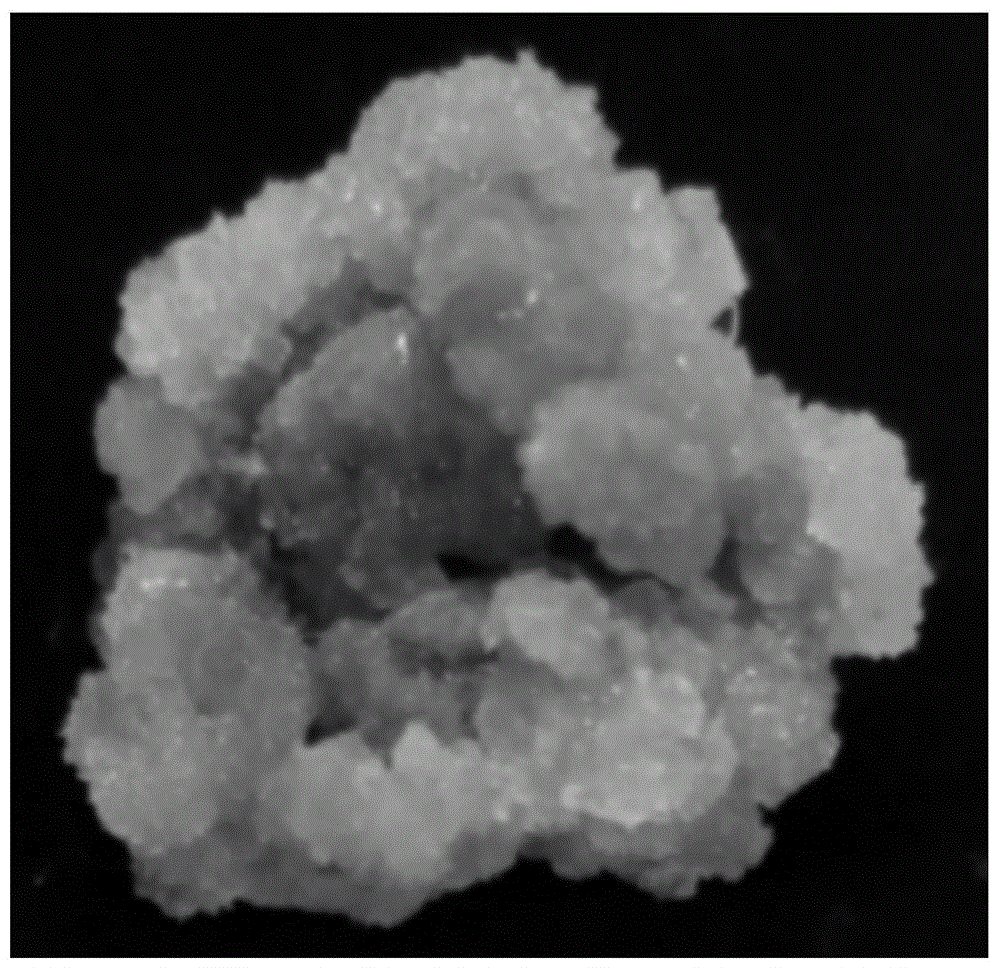
:葛根(puerariathomsoniibenth)为豆科葛属(puerariadc.)植物中资源较为丰富的一类,为中国卫生部首批批准的药食同源两用植物,素有“北参南葛”、“亚洲人参”之美誉。葛根除富含淀粉外,还含有钙、铁、锌等多种微量以及氨基酸、维生素等,具有较高的营养价值。葛根全身是宝,茎皮纤维可拧绳,织葛布,也可做食用菌栽培,块茎富含淀粉,可加工成保健食品,也可酿葛酒,葛花可制葛花茶,解酒功效神奇。对妇女产后的多种疾病有抑制作用,同时具有丰胸、美容效果。可作为天然的保健食品,市场需求量大。葛根传统繁殖方式为扦插繁育,这一繁殖方式不仅成活率和繁殖系数较低,且受自然条件影响较大。另外,生产上葛根若长期通过葛藤进行连续无性繁殖,受连续多年无性繁殖和病虫害危害等因素的影响,必然会出现优良品种种性退化等问题,从而造成产量和品质下降。组织培养离体繁殖技术是在无菌环境下,通过选择高产健康优良无病株系作为起始材料,进行优良品种的快速繁育,可达到提纯复壮、提高产量和品质的效果。利用组培苗叶片进行愈伤组织诱导并再生植株的方式为优良品种的快速繁殖提供了重要手段。更为重要的是,以组培苗叶片为外植体进行愈伤组织诱导并再生植株是葛根遗传转化的重要技术手段,这将为葛根基因功能研究奠定扎实的技术基础。现有的葛根愈伤组织诱导再生体系的建立是从田间材料上挑选叶片,先进行外植体消毒再进行愈伤组织的诱导及再生技术的研究,该方法所用材料有限,存在一定的污染率和死亡率,也极大受到季节限制,这一技术途径根本无法开展遗传转化研究。因此,本专利拟建立一种葛根组培苗愈伤组织诱导及再生技术方法,为建立成熟的葛根遗传转化体系奠定技术基础,也提供一个高效的葛根种苗快繁技术体系。技术实现要素:有鉴于此,本发明的目的在于提供一种葛根组培苗叶片愈伤组织诱导及再生方法,通过本发现所诱导的愈伤组织诱导、愈伤组织分化及继代增殖培养基,大大提高了愈伤组织诱导率及分化率,且获得了较高的增殖系数,大大提高了葛根通过愈伤组织再生效率。为了解决上述技术问题,本发明采用了如下的技术方案:一种葛根组培苗叶片愈伤组织诱导及再生方法,包括以下步骤:(1)材料取样:取生根培养15-20天葛根组培苗于超净工作台上,将该葛根组培苗第2-5节位完全展开的幼嫩叶片切成0.4×0.4cm的大小,待用;(2)愈伤组织诱导:将步骤(1)选定的待用叶片横放入愈伤组织诱导培养基,在黑暗条件下培养2-3周,培养温度为24-26℃;所述愈伤组织诱导培养基以ms为基础培养基,还包括以下质量浓度的组分:6-苄氨基嘌呤1.0-1.5mg/l、2,4-二氯苯氧乙酸1.5-2.0mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述愈伤组织诱导培养基ph为5.7-5.9;(3)愈伤组织分化培养:将步骤(2)诱导得到的愈伤组织切成小块,所取的愈伤组织为结构紧密的的愈伤组织,切成小块后转接至分化培养基中培养,诱导愈伤组织分化;所述分化培养基以ms为基础培养基,还包括以下质量浓度的组分:6-苄氨基嘌呤2.0-3.0mg/l、naa0.02-0.05mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述分化培养基ph为5.7-5.9;(4)丛生芽继代增殖:在无菌条件下,将步骤(3)诱导得到的丛生芽切成小块转接到丛生芽继代增殖培养基中进行增殖培养;所述丛生芽继代增殖培养基以ms为基础培养基,还包括以下质量浓度的组分:6-苄氨基嘌呤0.02mg/l、naa0.05mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述丛生芽继代增殖培养基ph为5.7-5.9;(5)丛生芽再生:将步骤(4)所得再生植株转入生根培养基中进行生根培养。本发明中,进一步地,所述步骤(1)的葛根组培苗通过以下方式获得:剪取带有腋芽的葛根嫩枝,通过组织培养的方法获得葛根组培苗。该葛根组培苗的具体获取方式参见申请人在先申请且已公开的专利:cn111149704a-一种野葛单芽茎段增殖及一步成苗培养方法。本发明中,进一步地,所述步骤(3)愈伤组织分化培养的培养条件为:培养温度为24-26℃、光照条件为1500-2000lx、光照时间为12h/d。本发明中,进一步地,所述步骤(4)还包括:增殖培养25-30d后用相同的培养基,即丛生芽继代增殖培养基进行继代培养,培养条件与愈伤组织分化培养的培养条件相同。本发明中,进一步地,所述步骤(5)中的生根培养基以ms为基础培养基,还包括以下质量浓度的组分:naa0.02mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述生根培养基ph为5.7-5.9。本发明中,进一步地,所述步骤(5)中生根培养的条件为:培养温度为24-26℃、光照条件为1500-2000lx、光照时间为12h/d。综上所述,由于采用了上述技术方案,本发明的有益效果是:本发明提出了以葛根组培苗的叶片进行愈伤组织的诱导的方法,通过采用葛根组培苗叶片诱导再生不定芽,避免了葛根组织培养过程中需要对外植体进行灭菌的问题;本发明通过叶片切割方式、培养条件以及培养基的有机组合,建立了葛根快速、高效繁殖的体系,通过本发明所诱导的愈伤组织诱导、愈伤组织分化及继代增殖培养基,大大提高了愈伤组织诱导率及分化率,且获得了较高的增殖系数,大大提高了葛根通过愈伤组织再生效率。附图说明图1为实施例2中葛根生根苗叶片诱导的愈伤组织示意图片。图2为实施例2中愈伤组织分化出从生芽示意图片。图3为实施例2中丛生芽继代增殖示意图片。图4为实施例2中丛生芽诱导生根示意图片。具体实施方式下面的实施例可以帮助本领域的技术人员更全面地理解本发明,但不可以以任何方式限制本发明。实施例1本实施例提供一种葛根组培苗叶片愈伤组织诱导及再生方法,具体包括以下步骤:(1)材料取样:取生根培养15天葛根组培苗于超净工作台上,将该葛根组培苗第2节位完全展开的幼嫩叶片切成0.4×0.4cm的大小,待用;其中,葛根组培苗通过以下方式获得:剪取带有腋芽的葛根嫩枝,通过组织培养的方法获得葛根组培苗;(2)愈伤组织诱导:将步骤(1)选定的待用叶片横放入愈伤组织诱导培养基,在黑暗条件下培养2周,培养温度为26℃;所述愈伤组织诱导培养基以ms为基础培养基,还包括以下质量浓度的组分:6-苄氨基嘌呤1.5mg/l、2,4-二氯苯氧乙酸2.0mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述愈伤组织诱导培养基ph为5.9;(3)愈伤组织分化培养:将步骤(2)诱导得到的愈伤组织切成小块,所取的愈伤组织为结构紧密的的愈伤组织,切成小块后转接至分化培养基中培养,诱导愈伤组织分化;所述分化培养基以ms为基础培养基,还包括以下质量浓度的组分:6-苄氨基嘌呤3.0mg/l、naa0.05mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述分化培养基ph为5.9;其中,愈伤组织分化培养的培养条件为:培养温度为26℃、光照条件为2000lx、光照时间为12h/d;(4)丛生芽继代增殖:在无菌条件下,将步骤(3)诱导得到的丛生芽切成小块转接到丛生芽继代增殖培养基中进行增殖培养;所述丛生芽继代增殖培养基以ms为基础培养基,还包括以下质量浓度的组分:6-苄氨基嘌呤0.02mg/l、naa0.05mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述丛生芽继代增殖培养基ph为5.9;增殖培养30d后用相同的培养基,即丛生芽继代增殖培养基进行继代培养,培养条件与愈伤组织分化培养的培养条件相同;(5)丛生芽再生:将步骤(4)所得再生植株转入生根培养基中进行生根培养;其中,生根培养基以ms为基础培养基,还包括以下质量浓度的组分:naa0.02mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述生根培养基ph为5.9;生根培养的条件为:培养温度为26℃、光照条件为2000lx、光照时间为12h/d。实施例2本实施例提供一种葛根组培苗叶片愈伤组织诱导及再生方法,具体包括以下步骤:(1)材料取样:取生根培养18天葛根组培苗于超净工作台上,将该葛根组培苗第4节位完全展开的幼嫩叶片切成0.4×0.4cm的大小,待用;其中,葛根组培苗通过以下方式获得:剪取带有腋芽的葛根嫩枝,通过组织培养的方法获得葛根组培苗;(2)愈伤组织诱导:将步骤(1)选定的待用叶片横放入愈伤组织诱导培养基,在黑暗条件下培养2周,培养温度为25℃;所述愈伤组织诱导培养基以ms为基础培养基,还包括以下质量浓度的组分:6-苄氨基嘌呤1.2mg/l、2,4-二氯苯氧乙酸1.7mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述愈伤组织诱导培养基ph为5.8;如图1所示,为葛根生根苗叶片诱导的愈伤组织示意图片;(3)愈伤组织分化培养:将步骤(2)诱导得到的愈伤组织切成小块,所取的愈伤组织为结构紧密的的愈伤组织,切成小块后转接至分化培养基中培养,诱导愈伤组织分化;所述分化培养基以ms为基础培养基,还包括以下质量浓度的组分:6-苄氨基嘌呤2.5mg/l、naa0.03mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述分化培养基ph为5.8;其中,愈伤组织分化培养的培养条件为:培养温度为25℃、光照条件为1700lx、光照时间为12h/d;如图2所示,通过该步骤培养后,愈伤组织分化出从生芽;(4)丛生芽继代增殖:在无菌条件下,将步骤(3)诱导得到的丛生芽切成小块转接到丛生芽继代增殖培养基中进行增殖培养;所述丛生芽继代增殖培养基以ms为基础培养基,还包括以下质量浓度的组分:6-苄氨基嘌呤0.02mg/l、naa0.05mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述丛生芽继代增殖培养基ph为5.8;增殖培养28d后用相同的培养基,即丛生芽继代增殖培养基进行继代培养,培养条件与愈伤组织分化培养的培养条件相同;如图3所示,为丛生芽继代增殖培养后获取的再生植株;(5)丛生芽再生:将步骤(4)所得再生植株转入生根培养基中进行生根培养;其中,生根培养基以ms为基础培养基,还包括以下质量浓度的组分:naa0.02mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述生根培养基ph为5.8;生根培养的条件为:培养温度为25℃、光照条件为1700lx、光照时间为12h/d;如图4所示,为丛生芽诱导生根培养示意图。实施例3本实施例提供一种葛根组培苗叶片愈伤组织诱导及再生方法,具体包括以下步骤:(1)材料取样:取生根培养20天葛根组培苗于超净工作台上,将该葛根组培苗第5节位完全展开的幼嫩叶片切成0.4×0.4cm的大小,待用;其中,葛根组培苗通过以下方式获得:剪取带有腋芽的葛根嫩枝,通过组织培养的方法获得葛根组培苗;(2)愈伤组织诱导:将步骤(1)选定的待用叶片横放入愈伤组织诱导培养基,在黑暗条件下培养2周,培养温度为24℃;所述愈伤组织诱导培养基以ms为基础培养基,还包括以下质量浓度的组分:6-苄氨基嘌呤1.0mg/l、2,4-二氯苯氧乙酸1.5mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述愈伤组织诱导培养基ph为5.7;(3)愈伤组织分化培养:将步骤(2)诱导得到的愈伤组织切成小块,所取的愈伤组织为结构紧密的的愈伤组织,切成小块后转接至分化培养基中培养,诱导愈伤组织分化;所述分化培养基以ms为基础培养基,还包括以下质量浓度的组分:6-苄氨基嘌呤2.0mg/l、naa0.02mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述分化培养基ph为5.7;其中,愈伤组织分化培养的培养条件为:培养温度为24℃、光照条件为1500lx、光照时间为12h/d;(4)丛生芽继代增殖:在无菌条件下,将步骤(3)诱导得到的丛生芽切成小块转接到丛生芽继代增殖培养基中进行增殖培养;所述丛生芽继代增殖培养基以ms为基础培养基,还包括以下质量浓度的组分:6-苄氨基嘌呤0.02mg/l、naa0.05mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述丛生芽继代增殖培养基ph为5.7;增殖培养25d后用相同的培养基,即丛生芽继代增殖培养基进行继代培养,培养条件与愈伤组织分化培养的培养条件相同;(5)丛生芽再生:将步骤(4)所得再生植株转入生根培养基中进行生根培养;其中,生根培养基以ms为基础培养基,还包括以下质量浓度的组分:naa0.02mg/l、蔗糖30.0g/l、琼脂6.0g/l;所述生根培养基ph为5.7;生根培养的条件为:培养温度为24℃、光照条件为1500lx、光照时间为12h/d。效果验证为了说明本申请的实用价值,申请人做以下试验:试验一:不同外植体材料愈伤组织诱导及再生技术效果对比该试验分为以下四个组别:第一组:实施例1所述的葛根组培苗叶片愈伤组织诱导及再生方法;第二组:实施例2所述的葛根组培苗叶片愈伤组织诱导及再生方法;第三组:实施例3所述的葛根组培苗叶片愈伤组织诱导及再生方法;第四组:选用植株母株叶片作为外植体材料,其他方式严格按照实施例2进行。以上四组,每组处理50个外植体,每组实验重复处理4次,取平均值并将数据记录如表1所示。表1葛根愈伤组织诱导效果对比表组别污染率(%)死亡率(%)愈伤组织诱导率(%)第一组01.099.0第二组00.599.5第三组01.099.0第四组12.57.080.5由表1结果可知:直接从母株植株采集叶片进行愈伤组织诱导,不仅污染率高,死亡率较本申请(第一组至第三组)也显著增加,因此愈伤组织的诱导率下降;同时,第一组至第三组采用无菌组培苗叶片作为愈伤组织诱导材料,不仅操作方便,诱导率也比第四组高。试验二:探讨不同植物生长调节剂组合对葛根再生体系的影响该试验分为以下九个组别:第一组:实施例1所述的葛根组培苗叶片愈伤组织诱导及再生方法;第二组:愈伤组织诱导培养基为ms基本培养基+2.0mg/l2,4-d+30.0g/l蔗糖+6.0g/l琼脂,初始培养基ph为5.8,其他步骤严格按照实施例2进行操作;第三组:愈伤组织诱导培养基为:ms基本培养基+1.0mg/lnaa+2.0mg/l2,4-d+30.0g/l蔗糖+6.0g/l琼脂,初始培养基ph为5.8,其他步骤严格按照实施例2进行操作;第四组:愈伤组织诱导培养基为:ms基本培养基+2.0mg/lba+2.0mg/l2,4-d+30.0g/l蔗糖+6.0g/l琼脂,初始培养基ph为5.8,其他步骤严格按照实施例2进行操作;第五组:愈伤组织诱导培养基为:ms基本培养基+1.0mg/lba+1.0mg/lnaa+30.0g/l蔗糖+6.0g/l琼脂,初始培养基ph为5.8,其他步骤严格按照实施例2进行操作;第六组:愈伤组织分化培养基为:ms基本培养基+2.0mg/lba+30.0g/l蔗糖+6.0g/l琼脂,初始培养基ph为5.8,其他步骤严格按照实施例2进行操作;第七组:愈伤组织分化培养基为:ms基本培养基+2.0mg/lba+0.1mg/lnaa+30.0g/l蔗糖+6.0g/l琼脂,初始培养基ph为5.8,其他步骤严格按照实施例2进行操作;第八组:愈伤组织分化培养基为:ms基本培养基+2.0mg/lba+0.05mg/l2,4-d+30.0g/l蔗糖+6.0g/l琼脂,初始培养基ph为5.8,其他步骤严格按照实施例2进行操作;第九组:愈伤组织分化培养基为:ms基本培养基+2.0mg/l2,4-d+0.05mg/lnaa+30.0g/l蔗糖+6.0g/l琼脂,初始培养基ph为5.8,其他步骤严格按照实施例2进行操作。按照以上九组所述的培养方法,每组培养50个外植体,每组实验重复处理4次,研究不同植物生长调节剂组合对葛根再生体系的影响,各指标取平均值,并记录数据如表2所示。表2各组葛根愈伤组织诱导率及分化率对比表组别愈伤组织诱导率(%)愈伤组织分化率(%)第一组99.075.0第二组12.50第三组25.02.0第四组85.070.0第五组65.050.0第六组10032.5第七组99.065.0第八组10055.0第九组10020.5由表2可知,采用本发明的培养方法(第一组)与各对照组(第二组至第九组)相比,愈伤组织诱导率和分化率均较高,说明不同生长调节剂组合虽然诱导出愈伤组织,但将诱导的愈伤转入分化培养基,分化率显著下降,可能是由于诱导的愈伤组织结构发生改变,不适合愈伤组织分化,不合适的植物生长调节剂组合也不利于脱分化产生的愈伤组织进行再分化,因此分化率较低。可见,诱导合适的愈伤组织,获得高效率的愈伤组织诱导率和分化率是本申请解决的难题之一。试验三:探讨培养时间、葛根生根苗叶片和节位对愈伤组织诱导及再生的影响该试验分为以下七个组别:第一组:实施例1所述的葛根组培苗叶片愈伤组织诱导及再生方法;第二组:剪取培养10天的葛根生根苗叶片,其他步骤严格按照实施例2进行操作;第三组:剪取培养25天的葛根生根苗叶片,其他步骤严格按照实施例2进行操作;第四组:剪取培养30天的葛根生根苗叶片,其他步骤严格按照实施例2进行操作;第五组:剪取第1节位完全展开叶的幼嫩叶片,其他步骤严格按照实施例2进行操作;第六组:剪取第6节位完全展开叶的幼嫩叶片,其他步骤严格按照实施例2进行操作;第七组:剪取第7节位完全展开叶的幼嫩叶片,其他步骤严格按照实施例2进行操作。按照以上七组所述的培养方法,每组培养50个外植体,每组实验重复处理4次,研究培养时间、葛根生根苗叶片和节位对愈伤组织诱导及再生的影响,各指标取平均值,并记录数据如表3所示。表3各组葛根愈伤组织诱导率及分化率对比表组别愈伤组织诱导率(%)愈伤组织分化率(%)第一组99.075.0第二组41.06.0第三组65.055.0第四组50.033.5第五组65.010.5第六组75.061.0第七组55.040.0由表3结果可知,非采用本申请的方式进行培养的组别中,培养10天的葛根生根苗的叶片愈伤组织诱导率仅为41.0%,再生率仅为6.0%,培养25天的葛根生根苗的叶片愈伤组织诱导率和分化率也极显著降低,同时研究发现,不同节位的葛根生根苗的叶片愈伤组织诱导率和分化率显著不同,第4节位(实施例2)的叶片愈伤组织诱导率和分化率最高。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1