蛭弧菌诱变株在凡纳滨对虾养殖中的应用
1.本发明属于水产养殖技术领域,具体涉及一种蛭弧菌诱变株的高浓度培养及其在凡纳滨对虾养殖过程中提高虾生长性能的应用。
背景技术:
2.凡纳滨对虾(litopenaeus vannamei),又称南美白对虾,分类学上属于节肢动物门(arthropoda)、甲壳纲(crustacea)、十足目(decapoda)、对虾科(penaeidae)、对虾属(litopenaeus)。它分布广泛,对盐度的耐受范围为0.5%~50%,可以生活在海水、淡水和咸淡水中;最适生长水温为28~32℃,最适生长ph为7.8~8.6,最适溶氧量在5mg/l以上。
3.凡纳滨对虾作为中国三大对虾养殖品种之一,具有较高的经济价值,其养殖规模越来越大,目前养殖产量占我国对虾养殖量的70%以上。随着虾集约化养殖程度越来越高,在养殖过程中,病害日益频发,养殖成功率不高。凡纳滨对虾养殖中的疾病主要包括病毒性疾病(如:白斑综合症)、细菌性疾病(如:红腿病、烂腮病)、寄生虫病(如:固着类纤毛虫病)等,其中细菌性疾病造成凡纳滨对虾发病面积广、死亡率高等问题,这对凡纳滨对虾养殖行业产生了严重的影响。细菌性疾病以弧菌病最为常见,弧菌病是由弧菌属引起的一类疾病,据报道,感染对虾发病的弧菌主要有副溶血弧菌、哈维氏弧菌、溶藻弧菌、鳗弧菌等,主要症状包括红腿、尾部溃烂、肠炎等。
4.目前,在凡纳滨对虾养殖过程中治疗疾病的方法主要是采用抗生素等化学药物控制法,这类药物长期使用会污染环境,且易导致药物残留、引起细菌产生抗药性,从而引发食品安全问题,影响人的身体健康。因此研究一种绿色安全环保且能有效预防该类疾病发生的方法十分必要。
5.微生态制剂是利用特定微生物与病原菌之间的相互作用或竞争关系,从而达到控制病原菌的目的。微生态制剂也就是我们常说的益生菌,是指那些对宿主有益无害的活的微生物,在经过特殊工艺后所制成的制剂,可以用来调整机体及养殖水域微生态平衡。它们不产生药物残留,不引起耐药性,适合大面积使用,且不会引起食品安全问题,因此是一种绿色安全环保的可以替代化学药物的有效方法。其中,蛭弧菌(bdellovibrio-and-like organism,balos)作为一种较为新颖的微生物制剂,凭借其良好的益生作用正越来越受到关注。
6.蛭弧菌是具有捕食特性的寄生型专性需氧革兰氏阴性菌,只有典型细菌体积的1/5左右,能裂解大部分革兰氏阴性菌,如弧菌、大肠杆菌、沙门氏菌等,但蛭弧菌不能侵染裂解真核细胞,对水产动物以及人等哺乳动物无致病性。蛭弧菌的生长可以分为游泳体阶段和蛭质体阶段,处于游泳体阶段的蛭弧菌自由生活运动、高耗能。蛭质体阶段为蛭弧菌裂解宿主的阶段,在这个阶段,蛭弧菌会附着在外膜上进入猎物,形成所谓的bdelloplast。然后,一旦进入bdelloplast,捕食者就会改变其猎物的肽聚糖膜,使其更加灵活,并允许自身生长。在bdelloplast内,蛭弧菌利用它从消化猎物中获得的营养以丝状方式生长,待猎物中营养耗尽后,蛭弧菌进行增殖分裂,释放后代以寻找更多的猎物细胞入侵。
7.据报道,蛭弧菌可以预防治疗水生动物细菌性疾病、提高水生动物免疫活性、促进动物生长等。目前蛭弧菌在水产养殖中的研究应用主要集中在鱼、蟹、鲍鱼、大菱鲆等,而国内针对蛭弧菌来提高凡纳滨对虾虾苗生长性能的应用基本未见报道。此外,综述现有研究发现,现有的蛭弧菌培养的浓度相对较低。
技术实现要素:
8.为了克服现有技术的缺点与不足,本发明的目的在于提供一种蛭弧菌诱变株在凡纳滨对虾养殖中的应用。
9.本实验室从海水样中分离出一株野生型蛭弧菌(bdellovibrio sp.)bdn-1,利用co
60
辐照诱变技术对蛭弧菌(bdellovibrio sp.)bdn-1进行辐照处理,成功得到一株诱变株bdn-1f2,诱变株bdn-1f2对16株受试弧菌的裂解率为93.3%,高于bdn-1的裂解率87.5%(陈丹,吴冰,韩红操,等.一株广盐性蛭弧菌的生物学特性[j].微生物学通报,2019,46(11):3030-3039.)。
[0010]
本发明的目的通过下述技术方案实现:
[0011]
本发明提供一种蛭弧菌诱变株在凡纳滨对虾养殖中的应用。
[0012]
进一步,所述的蛭弧菌诱变株在凡纳滨对虾虾苗培育中的应用。
[0013]
进一步,所述的蛭弧菌诱变株在提高凡纳滨对虾生长性能中的应用。
[0014]
进一步,所述的蛭弧菌诱变株在提高凡纳滨对虾虾苗生长性能中的应用。
[0015]
进一步,所述的蛭弧菌诱变株在调控凡纳滨对虾肠道代谢和/或肠道菌群结构中的应用。
[0016]
优选的,调控肠道菌群结构为提升总有益菌相对丰度,降低(潜在)有害菌的相对丰度。
[0017]
优选的,所述的蛭弧菌诱变株用于上调凡纳滨对虾肠道代谢l-精氨酸、硬脂酸和/或乙酰肉碱。
[0018]
所述的应用是将蛭弧菌诱变株培养液泼洒于凡纳滨对虾虾苗水体中实现。
[0019]
其中,水体中蛭弧菌诱变株浓度为103~105pfu/ml;优选为104pfu/ml。
[0020]
所述的蛭弧菌诱变株为bdellovibrio sp.bdn-1f2,保藏单位:广东省微生物菌种保藏中心(gdmcc),保藏日期:2018年6月11日,保藏地址:广州市先烈中路100号大院59号楼5楼广东省微生物研究所,保藏编号:gdmcc no:60385。该菌株在专利“cn 111363690 a、一株裂解性能强的蛭弧菌诱变株及其应用”中公开。
[0021]
所述的蛭弧菌诱变株培养液的制备方法,包括如下步骤:
[0022]
将蛭弧菌诱变株接种到dnb液体培养基中,并加入宿主悬液、氯化钙溶液,氯化镁溶液,msg溶液,培养用作种子液;然后再接种种子液到dnb液体培养基中,加入宿主悬液、氯化钙溶液、氯化镁溶液、msg溶液,再次培养,然后补加宿主悬液,继续培养,即可得到高浓度蛭弧菌诱变株培养液,其浓度为1~5
×
107pfu/ml;
[0023]
所述的培养的条件为在28℃,200rev/min(rpm)的条件下培养72h;
[0024]
所述的再次培养的条件为在28℃,200rev/min的条件下培养48h;
[0025]
所述的继续培养的条件为在28℃,200rev/min的条件下培养72h;
[0026]
优选的,宿主悬液与dnb液体培养基的体积比值为1:50;氯化钙、氯化镁、msg的摩
尔比为4:2:1;msg的终浓度为5mmol/l;
[0027]
优选的,补加宿主悬液的体积与dnb液体培养基的体积比值为1:50;
[0028]
氯化钙溶液的浓度为1mol/l;
[0029]
氯化镁溶液的浓度为1mol/l;
[0030]
msg溶液的浓度为1mol/l。
[0031]
所述的宿主悬液的制备方法,包括如下步骤:
[0032]
接种宿主至营养肉汤液体培养基中,然后培养,直至对数生长期;然后离心,弃去上清液,收集菌体沉淀,用无菌磷酸盐缓冲盐水(pbs缓冲液:28mmol/l nah2po4,72mmol/l na2hpo4,ph 7.2)重新悬浮菌体至终浓度为1
×
109cfu/ml,获得宿主悬液,使用前在4℃下保存。
[0033]
所述的宿主为柠檬酸杆菌(citrobacter amanolaticus)tc,来源于广东某海域海水,经过人工富集培养、分离纯化得到,然后经过16srrna鉴定为一株柠檬酸杆菌(genbank登录号为mn956654.1),对虾不具有致病或促生长作用。
[0034]
具体的,柠檬酸杆菌(citrobacter amanolaticus)tc在文献“qingqing cao.balos improved gut microbiota health in postlarval shrimp(litopenaeus vannamei)after being subjected to salinity reduction treatment[j].frontiers in microbiology,2020,11(1296).”中公开。
[0035]
所述的培养的条件为在30℃,200rev/min(rpm)的条件下培养13~15h;
[0036]
所述的离心的条件为在4℃,6000rev/min条件下离心10min;
[0037]
本发明利用蛭弧菌诱变株bdn-1f2调控虾肠道代谢物、提升总有益菌相对丰度,降低(潜在)有害菌的相对丰度,进而强化机体各机能,促进凡纳滨对虾虾苗的生长,通过直接将蛭弧菌诱变株bdn-1f2培养液泼洒于凡纳滨对虾虾苗培育水体中实现。
[0038]
本发明相对于现有技术具有如下的优点及效果:
[0039]
(1)本发明提供了一种培养高浓度蛭弧菌诱变株的方法。在dnb培养基中加入msg、氯化镁、氯化钙三种物质,且在培养的第48h,补加一次宿主,再继续培养72h,有助于促进蛭弧菌的生长,可以较好的提高蛭弧菌浓度。
[0040]
(2)本发明为保证蛭弧菌诱变株对凡纳滨对虾虾苗良好的益生作用,在虾苗的培育过程中,将蛭弧菌诱变株培养液直接泼洒于水体中,可以调节肠道代谢以及肠道菌群结构,进而显著提高虾苗的存活率和体重增长率,更好地满足凡纳滨对虾养殖生产实践的需要。
附图说明
[0041]
图1是实施例3中空白对照组与试验组之间的kegg通路富集图;其中,横坐标表示通路名字,纵坐标表示富集率。柱子颜色梯度表示富集的显著性,其中p-value《0.001的标记为***,p-value《0.01的标记为**,p-value《0.05的标记为*。
[0042]
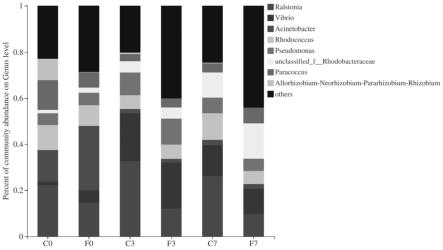
图2是实施例5中属水平上的群落柱形图;其中,横坐标中,c0、c3、c7分别代表空白对照组第0、3、7天的样本;f0、f3、f7分别代表试验组(蛭弧菌组)第0、3、7天的样本。
具体实施方式
[0043]
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
[0044]
本发明提供了制备得到的高浓度蛭弧菌诱变株培养液。此外,本发明还提供了所述蛭弧菌诱变株培养液在凡纳滨对虾虾苗培育中促进其生长的应用。
[0045]
以下将通过实施例对本发明进行详细描述。
[0046]
实施例中涉及到的培养基:
[0047]
营养肉汤(nutrient broth,nb)液体培养基(g/l):称取营养肉汤18g,海水晶15g,溶解于1000ml蒸馏水中,分装后,在121℃、0.1mpa下灭菌处理20min,保存备用。
[0048]
营养肉汤(nutrient broth,nb)固体培养基:营养肉汤液体培养基中加入15
‰
的凝胶强度为1300g/cm2的琼脂粉,在121℃、0.1mpa下灭菌处理20min,冷却至60℃时,倾倒于无菌平板,待凝固后翻转保存备用。
[0049]
稀营养肉汤(diluted nutrient broth,dnb)液体培养基(g/l):称取营养肉汤0.8g,酪蛋白水解物0.5g,酵母提取物0.1g,海水晶15g,溶解于1000ml蒸馏水中,调节ph7.5左右,分装后,在121℃、0.1mpa下灭菌处理20min,保存备用。
[0050]
稀营养肉汤(diluted nutrient broth,dnb)上层培养基:将dnb液体培养基分装后,按比例加入5
‰
的凝胶强度为1200g/cm2的琼脂粉,然后在121℃、0.1mpa下灭菌处理20min,保存备用。使用前,在电炉上加热溶解,放置50℃水浴锅内保存待用。
[0051]
稀营养肉汤(diluted nutrient broth,dnb)下层培养基:往dnb液体培养基中,按比例加入15
‰
的凝胶强度为1300g/cm2的琼脂粉,然后在121℃、0.1mpa下灭菌处理20min,冷却至60℃时,倾倒于无菌平板,待凝固后翻转保存备用。
[0052]
实施例中涉及到的促生长物质配置:
[0053]
1mol/l谷氨酸钠(msg):称取20.584g谷氨酸钠,溶解于100ml蒸馏水中,在121℃、0.1mpa下灭菌处理20min,保存备用。
[0054]
1mol/l氯化镁溶液:称取9.522g氯化镁,溶解于100ml蒸馏水中,在121℃、0.1mpa下灭菌处理20min,保存备用。
[0055]
1mol/l氯化钙溶液:称取14.70g二水合氯化钙,溶解于100ml蒸馏水中,在121℃、0.1mpa下灭菌处理20min,保存备用。
[0056]
实施例中所用的蛭弧菌诱变株为bdellovibrio sp.bdn-1f2。
[0057]
实施例1msg、氯化钙、氯化镁促进蛭弧菌生长的最佳添加量探究
[0058]
(1)探究试验开展:msg、氯化钙、氯化镁的最佳添加量分3次探究试验进行,首先探究msg的最适添加量。在蛭弧菌诱变株培养过程中,分别设置6个组,每组3个重复,每个重复为50ml dnb液体培养基,依次加入0、100、150、200、250、300μl的1mol/l的msg溶液,然后利用dnb双层平板法,检测蛭弧菌诱变株浓度,筛选出msg的最适添加量。在此基础上,再设置6个组,每组3个重复,依次加入0、0.5、0.75、1、1.25、1.5ml的1mol/l的氯化钙溶液,利用dnb双层平板法,检测蛭弧菌诱变株浓度,筛选出氯化钙的最适添加量。然后在msg、氯化钙的最适添加量基础上,再设置6个组,每组3个重复,依次加入0、0.25、0.50、0.75、1ml的1mol/l的氯化镁溶液,利用dnb双层平板法,检测蛭弧菌诱变株浓度,筛选出氯化镁的最适添加量。综上所述,最终筛选出最适蛭弧菌诱变株生长的msg、氯化钙、氯化镁的最适添加量。
[0059]
(2)试验结果
[0060]
msg、氯化钙、氯化镁添加量与蛭弧菌诱变株浓度关系的结果见表1、2、3。从表1可知,msg的最适添加量为250μl,蛭弧菌诱变株的浓度可达7.89
×
105pfu/ml。从表2可知,氯化钙的最适添加量为1ml,蛭弧菌诱变株的浓度可达6.67
×
106pfu/ml。从表3可知,氯化镁的最适添加量为0.50ml,蛭弧菌诱变株的浓度可达3.22
×
107pfu/ml。
[0061]
综述可知,msg、氯化钙、氯化镁的最适添加量分别为250μl、1ml、0.50ml,其蛭弧菌诱变株的浓度为3.22
×
107pfu/ml。
[0062]
表1:msg添加量与蛭弧菌诱变株浓度的关系
[0063]
msg添加量(μl)0100150200250300蛭弧菌浓度(pfu/ml)1.71
×
1052.05
×
1053.31
×
1054.71
×
1057.89
×
1055.45
×
105[0064]
表2:氯化钙添加量与蛭弧菌诱变株浓度的关系
[0065]
氯化钙添加量(ml)00.50.7511.251.5蛭弧菌浓度(pfu/ml)7.89
×
1051.02
×
1064.89
×
1066.67
×
1065.32
×
1065.27
×
106[0066]
表3:氯化镁添加量与蛭弧菌诱变株浓度的关系
[0067]
氯化镁添加量(ml)00.100.250.500.751蛭弧菌浓度(pfu/ml)6.67
×
1067.90
×
1069.21
×
1063.22
×
1072.11
×
1071.02
×
107[0068]
实施例2蛭弧菌诱变株培养液对凡纳滨对虾虾苗(pl4-5)测试试验
[0069]
(1)凡纳滨对虾虾苗(pl4-5)准备:pl4-5(postlarval,pl4-5)是指4-5日龄的凡纳滨对虾糠虾幼体,本次实施例的虾苗全部由广东省的一个虾苗孵化场提供,大小一致,活跃健康,无疾病迹象。
[0070]
(2)蛭弧菌诱变株制备:用无菌接种环从dnb双层琼脂平板中挑取单个噬菌斑,接种到50ml dnb液体培养基中,加入1ml宿主悬液,1000μl 1mol/l的氯化钙溶液,500μl 1mol/l的氯化镁溶液,250μl 1mol/l的msg溶液,在28℃,200rev/min(rpm)的条件下培养72h,用作种子液。然后再分别接种10ml种子液到4个装有500ml dnb液体培养基的锥形瓶中,加入10ml宿主悬液,10ml 1mol/l的氯化钙溶液,5ml 1mol/l的氯化镁溶液,2.5ml 1mol/l的msg溶液。同样地,在28℃,200rev/min的条件下培养48h,然后补加宿主悬液10ml,继续在28℃,200rev/min的条件下培养72h,这样即可得到浓度约为1
×
107pfu/ml的高浓度蛭弧菌诱变株培养液。
[0071]
其中,宿主悬液的制备方法,包括如下步骤:
[0072]
柠檬酸杆菌(citrobacter amanolaticus)tc是从海水中分离出的革兰氏阴性菌(genbank登录号为mn956654.1),用作繁殖蛭弧菌诱变株bdn-1f2的宿主,它被证明无溶血性。接种柠檬酸杆菌菌株tc种子液1ml至nb液体培养基中,然后放入恒温摇床,在30℃,200rev/min(rpm)的条件下培养13~15h,直至对数生长期。然后在4℃,6000rev/min条件下离心10min,弃去上清液,收集菌体沉淀,用无菌磷酸盐缓冲盐水(pbs缓冲液:28mmol/l nah2po4,72mmol/l na2hpo4,ph 7.2)重新悬浮菌体至终浓度为1
×
109cfu/ml,获得宿主悬液,使用前在4℃下保存。
[0073]
(3)试验开展:试验共进行7d,在6个水族箱里面开展,采用人工配置海水模拟海水养殖,每缸加海水约4l,每缸养殖200条,总共1200条凡纳滨对虾虾苗。具体过程如下所示:
[0074]
试验分为2组,1个空白对照组,1个试验组,每组设置3个平行组。用海水晶配置
15
‰
的盐水,以此模拟淡海水养殖,将人工配置盐水煮沸5分钟,然后自然冷却至室温,煮沸的目的是减少水中可能的微生物污染。将6个容量为5l的水族箱用0.1%kmno4消毒,并用无菌盐水彻底冲洗干净,再将煮沸冷却过的盐水倒入6个水族箱,每缸4l。然后对水进行曝气处理,在每个水族箱中放置两个气石,同时使用0.22μm的薄膜过滤器过滤掉空气中的细菌等其它杂质,以减少微生物杂质对试验的干扰,最终保持每个水族箱里的溶解氧为5ppm以上。
[0075]
将1200条虾苗随机分配到6个水族箱,每缸200条虾苗。在试验组,将蛭弧菌诱变株培养液泼洒至水族箱里,最终水体中的浓度约为1
×
104pfu/ml。在空白对照组,不添加蛭弧菌诱变株培养液。虾饵料是由广东省某虾苗孵化场提供的虾苗专用饲料虾片,每天固定时间饲喂三次,饲喂量按照每10只虾0.4mg虾饵料,定期清除残余饵料。
[0076]
养殖采用统一管理方式,连续7天观察虾苗健康状况,第0天、第7天分别取虾样称量体重。试验结束时,记录活虾数目,计算存活率。
[0077]
(4)实验结果
[0078]
表4空白对照组与试验组之间的生长参数指标
[0079]
参数指标空白对照组试验组第0天体重0.063
±
0.003a0.060
±
0.002a第7天体重0.082
±
0.004b0.120
±
0.017a体重增加量(twg)0.019
±
0.006b0.058
±
0.016a体重增长百分百比(ptwg)31.25
±
11.12b91.68
±
24.98a体重增长率(sgr)0.003
±
0.001b0.008
±
0.002a存活率(sr)48.2b69.2a[0080]
注:由于单只虾体重太轻,故转化为30条虾计。
[0081]
twg(mg)=w
i-w0[0082]
ptwg(%)=100
×
(w
i-w0)/w0[0083]
sgr(%day-1
)=100
×
(w
i-w0)/7
[0084]
wi是pl的最终平均体重,w0是pl的初始平均体重。
[0085]
同一行数值上标字母不同表示差异显著,p《0.05。
[0086]
由表4可知,空白对照组在试验后期死亡数目较多,其存活率显著低于试验组(p《0.05)。
[0087]
在体重增长方面,综合twg、ptwg、sgr指标来看,与空白对照组相比,试验组中虾的twg、ptwg、sgr指标皆显著高于空白对照组(p《0.05),表现出明显的生长优势,
[0088]
综上,本发明的蛭弧菌诱变株培养液可以有效提高凡纳滨对虾虾苗(pl4-5)的存活率,促进其体重增长,提高经济效益。
[0089]
实施例3蛭弧菌诱变株培养液对凡纳滨对虾虾苗(pl4-5)肠道菌群影响的代谢组学研究
[0090]
在实施例2的基础上,取其第7天的虾肠道进行lc-ms非靶向代谢组学分析,实验过程如下:
[0091]
1.样本制备
[0092]
取100μl样本研磨液于1.5ml离心管中,加入400μl提取液(乙腈:甲醇=1:1),涡旋
混匀30s后,低温超声提取30min(5℃,40khz),将样品静置于-20℃,30min,4℃,13000g离心15min,移取上清液,氮气吹干,120μl复溶液(乙腈:水=1:1)复溶,低温超声萃取5min(5℃,40khz),4℃,13000g离心5min,移取上清液至带内插管的进样小瓶中上机分析。
[0093]
2.样品质控
[0094]
取等体积的所有样本代谢物混合制备成质控样本(qc),在分析过程中,每8个样本中插入一个qc样本,以考察整个分析过程的重复性。
[0095]
3.数据预处理和搜库
[0096]
上机完成之后,将lc-ms原始数据导入progenesis qi(waters corporation,milford,usa)进行基线过滤、峰识别、积分、保留时间校正、峰对齐,最终得到一个保留时间、质荷比和峰强度的数据矩阵,数据矩阵用80%规则来去除缺失值,再进行填补空缺值。用总和归一化法对样本质谱峰的响应强度进行归一化,同时删除qc样本相对标准偏差》30%的变量,并进行log10对数化处理,得到最终用于后续分析的数据矩阵。
[0097]
4.差异代谢物分析
[0098]
将预处理后的数据上传至相关生物云平台进行数据分析。利用r软件包ropls(version 1.6.2)进行主成分分析(pca)和正交最小偏二乘判别分析分析(opls-da),并使用7次循环交互验证来评估模型的稳定性。将vip(变量投影重要性)》1,p《0.05定为阈值筛选显著差异代谢物。
[0099]
5.生物信息学分析
[0100]
kegg通路注释:通过kegg数据库进行的代谢通路注释,获得差异代谢物参与的通路。
[0101]
6.实验结果
[0102]
(1)差异代谢物富集通路分析
[0103]
在负离子模式下,以vip>1、p<0.05为阈值,筛选差异代谢物。空白对照组与试验组(蛭弧菌组)之间的差异代谢物共筛选出11种,其中8种下调,3种上调。进一步进行kegg通路分析,明确差异代谢物所在的代谢途径,如图1所示,空白对照组与试验组之间差异代谢所富集到的通路一共有8条,其中较显著富集通路有1条(p《0.01);显著富集的有7条(p《0.05)。
[0104]
(2)显著富集通路内差异代谢物变化分析
[0105]
如表5所示,空白对照组与试验组之间显著富集的通路共有8条,但所富集到的差异代谢物仅3种,分别是l-精氨酸、硬脂酸和乙酰肉碱。3种差异代谢物全部上调,其中仅l-精氨酸、乙酰肉碱与虾生长有一定关联。
[0106]
l-精氨酸参与的富集显著的通路有6条,其中较显著(p《0.01)的仅1条,为沙门氏菌感染通路。精氨酸是诱导型一氧化氮合酶和精氨酸酶的常见底物,而在一氧化氮合酶的诱导作用下,动物体会产生no
2-/no,二者可抑制沙门氏菌等病菌的生长。因此在该通路里,l-精氨酸上调,说明在蛭弧菌诱变株bdn-1f2作用下,有效控制了致病菌生长。此外,l-精氨酸还参与了恰加斯病(美国锥虫病)、阿米巴病两个代谢通路。通过观察两个差异代谢物的代谢通路图,我们发现l-精氨酸所起的作用与在沙门氏菌感染通路中的作用相似,即在一氧化氮合酶的作用下生成一氧化氮,降低寄生虫活性,抑制致病菌生长。从上述结果,我们可认为蛭弧菌组中较高的存活率与l-精氨酸的上调有关。
[0107]
乙酰肉碱在动物体内普遍存在,参与许多重要的代谢过程。在本发明中,乙酰肉碱所参与的富集显著的通路是胰岛素抵抗。在胰岛素抵抗通路中,乙酰肉碱在肉碱o-棕榈酰转移酶的作用下,发生β-氧化作用,生成乙酰辅酶a,而乙酰辅酶a在许多与生长相关的代谢过程中都起着关键作用。由此我们认为乙酰肉碱的上调与蛭弧菌组虾良好的生长能力有关。
[0108]
综上可知,从代谢层面来看,蛭弧菌诱变株bdn-1f2可通过调节代谢物上调/下调,进而调节机体生长性状。
[0109]
表5富集通路内差异代谢物变化情况
[0110][0111]
实施例4蛭弧菌诱变株培养液对凡纳滨对虾虾苗(pl7-8)测试试验
[0112]
(1)凡纳滨对虾虾苗(pl7-8)准备:pl7-8(postlarval,pl7-8)是指7-8日龄的凡纳滨对虾糠虾幼体,本次试验的虾苗全部由广东省的一个虾苗孵化场提供,大小一致,活跃健康,无疾病迹象。
[0113]
(2)蛭弧菌诱变株制备:用无菌接种环从dnb双层琼脂平板中挑取单个噬菌斑,接种到50ml dnb液体培养基中,加入1ml宿主悬液,1ml 1mol/l的氯化钙溶液,500μl 1mol/l的氯化镁溶液,250μl 1mol/l的msg溶液,在28℃,200rev/min(rpm)的条件下培养72h,用作种子液。然后再分别接种10ml种子液到4个装有500ml dnb液体培养基的锥形瓶中,加入10ml宿主悬液,10ml 1mol/l的氯化钙溶液,5ml 1mol/l的氯化镁溶液,2.5ml 1mol/l的msg溶液。同样地,在28℃,200rev/min的条件下培养48h,然后补加宿主悬液10ml,继续在28℃,200rev/min的条件下培养72h,这样即可得到浓度约为1
×
107pfu/ml的高浓度蛭弧菌诱变株培养液。
[0114]
其中,宿主悬液的制备参照实施例2。
[0115]
(3)试验开展:试验共进行7d,在6个水族箱里面开展,采用人工配置
[0116]
海水模拟海水养殖,每缸加海水约5l,每缸养殖65条,总共390条凡纳滨对虾虾苗。具体过程如下所示:
[0117]
试验分为2组,1个空白对照组,1个试验组,每组设置3个平行组。用海水晶配置15
‰
的盐水,以此模拟淡海水养殖,将人工配置盐水煮沸5分钟,然后自然冷却至室温,煮沸的目的是减少水中可能的微生物污染。将6个容量为8l的水族箱用0.1%kmno4消毒,并用无菌盐水彻底冲洗干净,再将煮沸冷却过的盐水倒入6个水族箱,每缸5l。然后对水进行曝气处理,在每个水族箱中放置两个气石,同时使用0.22μm的薄膜过滤器过滤掉空气中的细菌等其它杂质,以减少微生物杂质对试验的干扰,最终保持每个水族箱里的溶解氧为5ppm以上。
[0118]
将390尾虾苗随机分配到6个水族箱,每缸65尾虾苗。在试验组,将蛭弧菌诱变株培养液泼洒至水族箱里,最终水体中的浓度约为1
×
104cfu/ml。在空白对照组,不添加蛭弧菌诱变株培养液。虾饵料是由广东省某虾苗孵化场提供的虾苗专用饲料虾片,每天固定时间饲喂三次,饲喂量按照每10只虾0.5mg虾饵料,定期清除残余饵料。
[0119]
养殖采用统一管理方式,连续7天观察虾苗健康状况,第0天、第7天分别取虾样测体重、体长。试验结束时,记录活虾数目,计算存活率。
[0120]
(4)实验结果
[0121]
表6空白对照组与试验组之间的生长参数指标
[0122]
参数指标空白对照组试验组第0天体重0.092
±
0.00a0.084
±
0.02b第7天体重0.100
±
0.01a0.121
±
0.02a体重增加量(twg)0.008
±
0.01b0.037
±
0.03a体重增长百分百比(ptwg)8.10
±
6.74b44.04
±
32.23a体重增长率(sgr)0.11
±
0.10b0.53
±
0.40a第0天体长11.2
±
0.21a11.2
±
0.50a第7天体长10.6
±
0.30b11.8
±
0.64a体长增加量(tlg)-0.6
±
0.09b0.6
±
0.50a体长增长百分百比(ptlg)-5.0
±
1.00b5.0
±
7.00a存活率(sr)89.0
±
8.00b95.0
±
5.00a[0123]
注:tlg(mm)=l
i-l0[0124]
ptlg(%)=100
×
(l
i-l0)/l0[0125]
twg(mg)=w
i-w0[0126]
ptwg(%)=100
×
(w
i-w0)/w0[0127]
sgr(%day-1
)=100
×
(w
i-w0)/7
[0128]
li是pl的最终平均体长,l0是pl的初始平均体长;wi是pl的最终平均体重,w0是pl的初始平均体重。
[0129]
同一行数值上标字母不同表示差异显著,p《0.05。
[0130]
由表6可知,空白对照组的虾存活率显著低于试验组(p《0.05)。
[0131]
在体重增长方面,综合twg、ptwg、sgr指标来看,试验组中虾的twg、ptwg、sgr指标皆显著高于空白对照组(p《0.05);在体长增长方面,结合tlg、ptlg指标来看,试验组中虾的
这二者指标值皆显著高于空白对照组(p《0.05)。可知,试验组虾表现出明显的生长优势,
[0132]
综上,本发明的蛭弧菌诱变株培养液可以有效提高凡纳滨对虾虾苗(pl7-8)的存活率,并提高其生长性能,促进体重、体长增长,为凡纳滨对虾生产养殖业提高经济效益。
[0133]
实施例5蛭弧菌诱变株培养液对凡纳滨对虾虾苗(pl7-8)肠道菌群结构影响的高通量测序分析
[0134]
在实施例4的基础上,取其第0、3、7天的虾肠道进行高通量测序分析,实验过程如下:
[0135]
1.总dna提取和检测
[0136]
采用spin kit for soil试剂盒(usa,mpbio公司),依据其使用说明书提取凡纳滨对虾肠道dna。
[0137]
2.dna检测
[0138]
利用nanodrop2000超微量分光光度计进行dna纯度和浓度检测。
[0139]
3.pcr扩增
[0140]
将所提取的dna用作pcr模板,扩增细菌16s核糖体rna基因的高变v3-v4区。上游引物是338f:5
′‑
actcctacgggaggcagcag-3
′
,下游引物是806r:5
′‑
ggactachvgggtwtctaat-3
′
。pcr反应体系为:5
×
transstart fastpfu缓冲液4μl,2.5mm dntps 2μl,上游引物(5μm)0.8μl,下游引物(5μm)0.8μl,transstart fastpfu dna聚合酶0.4μl,bsa0.2μl,模板dna 10ng,补足ddh2o至20μl。pcr具体扩增程序如下:95℃预变性3min,28个循环(95℃变性30s,55℃退火30s,72℃延伸45s),然后72℃稳定延伸10min,最后在4℃进行保存。
[0141]
4.产物鉴定、纯化及定量
[0142]
pcr产物鉴定:每个样本进行3个pcr重复,将3个重复的pcr产物混合,然后使用2%琼脂糖凝胶电泳检测产物。
[0143]
pcr产物纯化:pcr产物纯化使用axyprep dna gel extraction kit。
[0144]
pcr产物定量与均一化:将pcr产物用quantus
tm fluorometer进行检测定量。按照每个样本的测序量要求,进行相应比例的混合。
[0145]
5.构建pe文库及illumina测序
[0146]
利用nextflex rapid dna-seq kit进行建库,使用illumina公司的miseq pe300平台进行测序,具体过程省略。
[0147]
6.序列处理分析
[0148]
使用trimmomatic软件对原始测序序列进行质控,使用flash软件进行拼接。再使用uparse软件(version 7.1http://drive5.com/uparse/),根据97%的相似度对序列进行otu聚类,在聚类过程中使用uchime软件剔除嵌合体,得到otu代表序列。
[0149]
7.实验结果
[0150]
(1)益生菌属/功能菌属和致病菌属相对丰度统计分析
[0151]
表7样本中致病菌属相对丰度
[0152][0153]
注:c0、c3、c7分别代表空白对照组第0、3、7天的样本;f0、f3、f7分别代表试验组(蛭弧菌组)第0、3、7天的样本;对相对丰度值≥1%的属做了进一步的分类统计(功能不明确的未显示)。
[0154]
表8各样本中益生菌属/功能性菌属相对丰度
[0155]
[0156][0157]
注:c0、c3、c7分别代表空白对照组第0、3、7天的样本;f0、f3、f7分别代表试验组(蛭弧菌组)第0、3、7天的样本;对相对丰度值≥1%的属做了进一步的分类统计(功能不明确的未显示)。
[0158]
由表7可知,7天试验里,c组(空白对照组)致病菌总丰度从42.02%升高至46.19%,而f组(试验组)致病菌总丰度从57.46%下降至33.35%。由表8可知,c组益生菌/功能性菌总丰度从44.57%下降至41.07%,而f组的益生菌/功能性菌从30.05%升高至47.07%。
[0159]
综上可知,无论是对于致病菌,还是益生菌/功能性菌,与空白对照组相比,蛭弧菌诱变株bdn-1f2均展现出良好的控制作用和益生作用。
[0160]
(2)属水平上的群落热图分析
[0161]
如图2所示,更具体地,对相对丰度值≥5%的8个属进行分析,发现蛭弧菌诱变株bdn-1f2对一些致病菌属有明显的控制作用,如下所示:
[0162]
a.雷尔氏菌属(ralstonia):雷尔氏菌被认为是一种机会致病菌,在7天试验里,c组的雷尔氏菌丰度上升了33.79%,而在f组中下降了20.31%,与空白对照组相比,试验组中雷尔氏菌丰度明显降低,表明蛭弧菌诱变株bdn-1f2对雷尔氏菌起到了较好的控制作用。
[0163]
b.弧菌属(vibrio):弧菌属是虾养殖中甚至是水产养殖中最为常见的致病菌,包括鳗弧菌、溶藻弧菌、副溶血弧菌、霍乱弧菌等。在对虾养殖过程中发生的烂尾病、烂鳃病、
红腿病、肠炎、肝胰腺坏死等疾病均与弧菌有关。在7天试验里,弧菌在c组中上升了605%,而在f组中下降了101%,表明蛭弧菌诱变株bdn-1f2抑制弧菌生长。
[0164]
c.红球菌属(rhodococcus):越来越多的研究表明大部分红球菌属是致病菌。在7天试验期间,c组中红球菌属相对丰度上升了19.27%,而在f组中,它下降了25.88%,据此可认为,蛭弧菌诱变株bdn-1f2明显的抑制了它的生长。
[0165]
d.副球菌属(paracoccus):副球菌属具有反硝化作用,可利用硝酸盐或亚硝酸盐作为唯一氮源进行需氧或厌氧生长,是一种益生菌属。在7天试验期间,它的相对丰度在c组中下降了68.14%,在f组中上升了14.44%,由此表明蛭弧菌诱变株bdn-1f2可促进副球菌属的生长。
[0166]
(3)肠道菌群与虾生长性能相关性
[0167]
通过实验结果(1)、(2)可知蛭弧菌诱变株bdn-1f2对某些致病菌属和有益菌属起到较好的调控作用。进一步地,为了解这种调控作用与虾生长之间的关联作用,我们通过pearson相关性分析方法研究了某些肠道菌属与虾生长性能之间的相关性,结果如表9所示:
[0168]
a.paracoccus与sr(存活率)呈显著正相关(p《0.05)。paracoccus是一种潜在的益生菌,研究表明,paracoccus能抑制海参皮肤溃疡综合征的病原体vibrio splendidus的生长,提高海参的免疫力。这说明paracoccus或许可以提高虾的免疫能力,进而提高存活率。研究结果显示,在7天试验期间,对照组中paracoccus的相对丰度从12.21%下降到3.89%,而在试验组,其丰度从6.65%上升到7.61%,与之相对应的是试验组的存活率要显著高于空白对照组。
[0169]
b.vibrio与sr(存活率)呈显著负相关(p《0.05)。vibrio是水产养殖中公认的致病菌,会引起弧菌病;研究结果显示,在7天试验期间,空白对照组中vibrio的相对丰度从1.87%升至13.18%,而在试验组,其丰度从5.44%先上升至20.01%再下降至10.96%,与之相对应的是试验组的存活率要显著高于空白对照组。
[0170]
c.staphylococcus与bw(体重)呈显著负相关(p《0.05)。研究指出,staphylococcus对人和虾均具致病性,但其与体重之间的关系尚未有研究涉及。研究结果显示,在7天试验期间,试验组中staphylococcus的相对丰度从4.43%下降至0.19%,空白对照组中从2.31%下降至0.20%,其下降程度低于试验组,与之相对应的是试验组的虾体重要显著大于空白对照组。
[0171]
d.yangia与bw(体重)、tlg(体长增长量)、ptwg(体重增长百分比)、twg(体重增长量)呈显著正相关。已有研究表明yangia是非致病性的,可在细胞内产生聚羟基链烷酸酯,作为碳和能量存储材料,既然与能量存储有关,这应该是其与生长参数呈正相关性的原因。
[0172]
综上可知,蛭弧菌诱变株bdn-1f2通过调控致病菌和益生菌的生长,而这些菌属与虾生长之间又存在一定的正/负效应作用,从而最终表现为蛭弧菌诱变株bdn-1f2促进了虾生长。
[0173]
表9菌群相对丰度与生长参数的皮尔逊相关性分析
[0174][0175]
注:***表示在0.001水平有显著相关性;**表示在0.01水平上具有显著相关性;*表示在0.05水平上的显著相关性。bl:体长;bw:体重;ptlg:体长增长百分比;tlg:体长增长量;ptwg:体重增长百分比;twg:体重增长量;sgr:体重增长率;sr:存活率。
[0176]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1