一种梅花以体细胞胚途径再生植株的方法及其专用培养基
本发明涉及植物组织培养技术领域,具体涉及一种梅花以体细胞胚途径再生植株的方法及其专用培养基。
背景技术:
梅花(prunusmume)是中国的传统名花,在中国园林及花文化中有重要的地位和影响。除中国外,目前仅有日本、朝鲜等少数几个国家有梅花栽培。在中国,梅花分别有3000多年的应用史和2000多年的栽培史,中国对于梅花的研究一直比较活跃。梅花主要分布在中国长江流域及以南地区,大致以北至黄河、南至珠江为界线。在中国北方地区梅花品种主要以杏梅系和樱李梅系为主,少见真梅系品种,梅花在北方种植主要受到冬季低温的限制。为了使中国传统名花国际化,使得梅花种植范围分布更广泛,具有优异性状的梅花育种显得尤为重要。
植物的体细胞胚发生是植物的体细胞在离体条件下,通过与合子胚类似的发育途径得到新个体的过程。体细胞胚发生途径再生体系的建立有助于梅花的试管苗快繁,人工种子的生产和冷藏保存,同时胚性细胞是进行梅花遗传转化的最佳受体,可以以体细胞胚为受体进行梅花遗传转化。而高效稳定的再生体系的建立是成功进行梅花遗传转化的基础。
专利申请cn107278891a公开了一种杏梅组织培养快速繁殖方法,以当年生的杏梅种子为外植体,经消毒、冷藏、启动培养后,获得不定芽,不定芽可以抽生成苗。
专利申请cn102550404a的公开了一种梅花叶片愈伤组织高效诱导方法,以梅花品种‘淡寒红’种子实生苗的叶片为外植体,能够高效诱导愈伤组织,但未获得再生植株。
吕英民(吕英民,曹亮,张启翔.梅花品种‘美人’叶片离体再生体系的建立[j].分子植物育种,2006,4(6):887-894.)等以樱李梅品种‘美人梅’的叶片为外植体,通过诱导愈伤,愈伤分化最终获得生根苗。
杨洁(杨洁,闻娟,晏晓兰,包满珠,张俊卫.‘雪梅’未成熟合子胚体胚发生与植株再生[j].北京林业大学学报,2013,35(1):21-24.)等以梅花‘雪梅’未成熟合子胚为外植体,在诱导培养基上获得体细胞胚,体细胞胚可以增殖并分化出不定芽。
上述通过以叶片为外植体的器官发生途径和以未成熟合子胚为外植体的体细胞胚发生途径虽然获得了再生植株,但存在着再生效率低等问题,不能满足梅花遗传转化和植株再生的需求。
技术实现要素:
本发明的目的是提供一种梅花以体细胞胚途径再生植株的方法。本发明的另一目的是提供梅花体细胞胚萌发培养基以及用于梅花以体细胞胚途径再生植株的试剂。
为实现上述目的,本发明将梅花未成熟种子、组培苗叶片等外植体,通过体细胞胚发生途径进行梅花植株的再生,本发明首先针对该再生过程的各步骤涉及的培养基进行了优化,并具体提供以下技术方案:
本发明提供一种梅花体细胞胚萌发培养基,该培养基包括第一基本培养基、第一附加组分和培养基凝固剂。
其中,第一附加组分包括:6-苄基腺嘌呤(6-ba)1.5-2.5mg/l,萘乙酸(naa)0.3-0.7mg/l,苯基噻二唑基脲(tdz)0.5-1.5mg/l,赤霉素(ga3)0.5-1.0mg/l,糖类20-40g/l,其中,苯基噻二唑基脲和赤霉素的总浓度为1.0-2.0mg/l。
上述第一附加组分添加至第一基本培养基中,上述浓度为各组分在萌发培养基中的终浓度。
本发明发现,将6-苄基腺嘌呤、萘乙酸、苯基噻二唑基脲、赤霉素以上述浓度配比添加至基本培养基中,并控制苯基噻二唑基脲和赤霉素的总浓度,得到的萌发培养基能够显著提高梅花体细胞胚的萌发率,提高体细胞胚再生为植株的效率。
进一步地,本发明还发现,将上述萌发培养基中,萘乙酸和赤霉素的浓度之比控制为1:(1-2),更有利于提高梅花体细胞胚的萌发率。
萌发培养基中使用的基本培养基优选为1/2q&l基本培养基。
萌发培养基中使用的糖类优选为蔗糖。
1/2q&l基本培养基和蔗糖能够更好地与6-苄基腺嘌呤、萘乙酸、苯基噻二唑基脲、赤霉素配合作用,有利于提高梅花体细胞胚的萌发率。
萌发培养基中使用的培养基凝固剂优选植物凝胶、琼脂中的一种。
作为本发明的优选方案,本发明提供一种梅花体细胞胚萌发培养基,该培养基为在1/2q&l基本培养基中添加如下组分,各组分在萌发培养基中的终浓度如下:6-苄基腺嘌呤1.8-2.2mg/l,萘乙酸0.4-0.6mg/l,苯基噻二唑基脲0.8-1.2mg/l,赤霉素0.5-1.0mg/l,糖类25-35g/l,琼脂粉5.5-8.0g/l,ph6.0-6.2。
以上所述的体细胞胚萌发培养基可与用于梅花体细胞胚分化再生为梅花植株的培养。
第二方面,本发明提供用于梅花以体细胞胚途径再生植株的试剂,该试剂包括以上所述的梅花体细胞胚萌发培养基,还包括体细胞胚诱导培养基。
其中,所述体细胞胚诱导培养基包括第二基本培养基、第二附加组分和培养基凝固剂,所述第二附加组分包括:6-苄基腺嘌呤0.1-0.5mg/l,2,4-二氯苯氧乙酸(2,4-d)1.0-4.0mg/l,蔗糖或葡萄糖30-60g/l。上述附加组分的添加能够显著提高由梅花外植体诱导体细胞胚发生的诱导率。
体细胞胚诱导培养基中使用的基本培养基优选为1/2ms基本培养基、1/2q&l基本培养基中的一种。
体细胞胚诱导培养基中使用的培养基凝固剂优选植物凝胶、琼脂中的一种。
优选地,以上所述的梅花体细胞胚诱导培养基为在1/2ms或1/2q&l基本培养基中添加如下组分,各组分在诱导培养基中的终浓度如下:6-苄基腺嘌呤0.1-0.5mg/l,2,4-二氯苯氧乙酸1.0-4.0mg/l,蔗糖或葡萄糖30-60g/l,植物凝胶2-3g/l,ph6.0-6.2。该诱导培养基能够显著提高由梅花外植体诱导体细胞胚发生的诱导率。
以上所述的体细胞胚诱导培养基可用于梅花外植体诱导产生体细胞胚的培养。
本发明中,所述梅花外植体可为未成熟种子、组培苗叶片等。
进一步地,所述试剂还可包括体细胞胚增殖培养基,所述体细胞胚增殖培养基包括第三基本培养基、第三附加组分和培养基凝固剂。
其中,所述第三附加组分包括:2,4-二氯苯氧乙酸1.0-2.0mg/l,6-苄基腺嘌呤0.3-0.7mg/l,蔗糖20-40g/l,硝酸银0-10mg/l,酸水解酪蛋白0-100mg/l。上述附加组分的添加能够显著提高梅花体细胞胚的增殖速度,提高其增殖效率,而且,在该增殖培养基中培养,梅花体细胞胚可长期继代保存并能够很好地保持其分化为植株的能力。
本发明的增殖培养基也可作为体细胞胚的一般继代培养基或长期继代培养基。
体细胞胚增殖培养基中使用的基本培养基优选为1/2ms基本培养基、1/2wpm基本培养基、1/2q&l基本培养基中的一种。
体细胞胚增殖培养基中使用的培养基凝固剂优选植物凝胶、琼脂中的一种。
优选地,以上所述的体细胞胚增殖培养基为在1/2q&l基本培养基中添加如下组分,各组分在增殖培养基中的终浓度如下:2,4-二氯苯氧乙酸1.4-1.6mg/l,6-苄基腺嘌呤0.4-0.6mg/l,蔗糖25-35g/l,硝酸银0-10mg/l,酸水解酪蛋白0-100mg/l,琼脂粉5.5-8.0g/l,ph6.0-6.2。该增殖培养基能够显著提高梅花体细胞胚的增殖效率。
本发明发现,对于部分梅花品种(例如:梅花品种“丽江照水”)而言,添加硝酸银和酸水解酪蛋白中的一种或两种能够显著提高其体细胞胚的增殖效率,其中同时添加硝酸银和酸水解酪蛋白得到的增殖培养基的体细胞胚增殖效率的提升幅度更大。
当添加硝酸银、酸水解酪蛋白时,其在培养基中的终浓度优选为:硝酸银8-12g/l,酸水解酪蛋白95-105g/l。
以上所述的体细胞胚增殖培养基可为选自如下(1)和(2)中的任一种:
(1)在1/2q&l基本培养基中添加如下组分,各组分在增殖培养基中的终浓度如下:2,4-二氯苯氧乙酸1.4-1.6mg/l,6-苄基腺嘌呤0.4-0.6mg/l,蔗糖25-35g/l,琼脂粉5.5-8.0g/l,ph6.0-6.2。
(2)在1/2q&l基本培养基中添加如下组分,各组分在增殖培养基中的终浓度如下:2,4-二氯苯氧乙酸1.4-1.6mg/l,6-苄基腺嘌呤0.4-0.6mg/l,蔗糖25-35g/l,硝酸银8-12mg/l,酸水解酪蛋白95-105mg/l,琼脂粉5.5-8.0g/l,ph6.0-6.2。
以上所述的用于梅花以体细胞胚途径再生植株的试剂中,体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基分别独立包装,用于梅花以体细胞胚途径再生植株的不同阶段的细胞或组织培养。
以上所述的用于梅花以体细胞胚途径再生植株的试剂中,体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基能够配合作用,很好地衔接梅花外植体诱导为体细胞胚、体细胞胚增殖、萌发再生为植株的各个生长发育阶段,显著提高由梅花外植体经体细胞胚途径再生为植株的再生效率。
本发明还提供所述梅花体细胞胚萌发培养基或用于梅花以体细胞胚途径再生植株的试剂在梅花体细胞胚制备、梅花遗传转化、梅花植株快速繁殖或梅花人工种子制备中的应用。
本发明提供一种梅花以体细胞胚途径再生植株的方法,该方法包括:将梅花外植体在所述体细胞胚诱导培养基上培养,得到体细胞胚,将所述体细胞胚在所述体细胞胚增殖培养基上增殖,得到次生体细胞胚,将所述次生体细胞胚在所述体细胞胚萌发培养基中培养,形成植株。
优选地,在诱导培养基上培养的条件为:温度22-26℃,黑暗培养。在增殖培养基和萌发培养基中培养的条件为:温度22-26℃,光照强度为1000-15000lx,光照周期为12-16h。
可选地,本发明所述的方法还包括:将增殖培养获得的体细胞胚在体细胞胚继代培养基上培养,使其长期继代并保持分化能力。
本发明的有益效果在于:
1、本发明所采用的外植体来源不受季节限制,具有来源广泛,取材方便等优点,可以周年进行梅花的组织培养和体细胞胚诱导。
2、本发明制备的体细胞胚能够长期继代并保持其分化能力,是农杆菌介导等梅花遗传转化的良好受体,可用于作为梅花遗传转化的材料,为培育转基因梅花新品种奠定了技术基础。
3、在本发明提供的体细胞胚诱导培养基中进行诱导,外植体诱导产生体细胞胚的效率显著提高。将体细胞胚在本发明提供的增殖培养基离体培养,梅花体细胞胚可通过次生体细胞胚形式不断增殖,具有良好的增殖效果。且在该增殖培养基中进行离体培养,梅花体细胞胚可以长期继代保存并能保持其进一步分化为小植株的能力。将增殖的体细胞胚在本发明提供的萌发培养基中培养,体细胞胚可高效分化、再生为梅花植株。
4、本发明提供的通过体细胞胚发生途径建立梅花再生体系的方法有效提高了梅花外植体以体细胞胚途径再生为植株的效率,为梅花体细胞胚的制备以及梅花植株的快速、高效再生提供了有效的方法。
附图说明
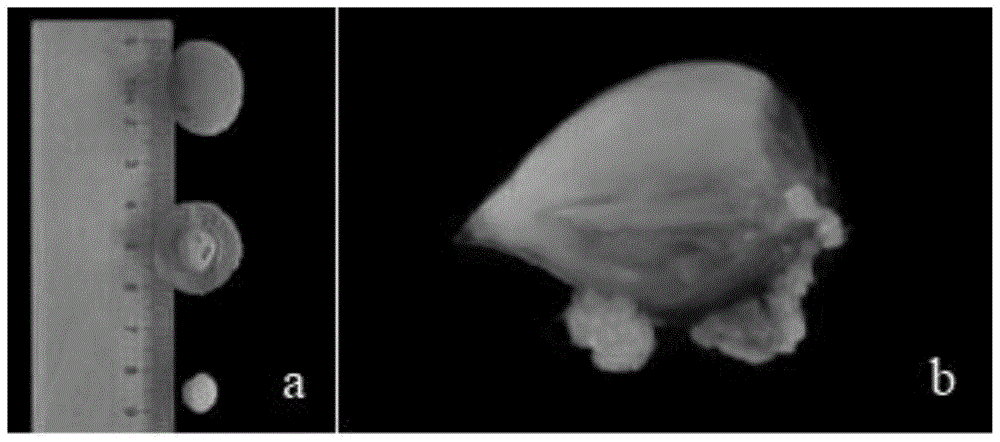
图1为本发明实验例1中梅花‘淡丰后’早期未成熟种胚和诱导获得的体细胞胚,其中,a为早期未成熟种胚,b为未成熟种胚上生成的体细胞胚。
图2为本发明实验例1中梅花‘淡丰后’体细胞胚的增殖。
图3为本发明实验例1中梅花‘淡丰后’体细胞胚萌发后形成的芽体。
图4为本发明实验例1中梅花‘淡丰后’生根的组培苗。
图5为本发明实验例1中梅花‘丽江照水’诱导获得的体细胞胚。
图6为本发明实验例1中梅花‘丽江照水’体细胞胚的增殖。
图7为本发明实验例1中梅花‘丽江照水’体细胞胚萌发后形成的植株。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
以上实施例中,ms基本培养基的配制参见:murashiget.andf.skoog,1962;1/2ms基本培养基是ms基本培养基中的大量元素减半、微量元素减半、fe盐减半、有机元素不变。q&l基本培养基的配制参见:quoirinm.&lepovrep,1977;1/2q&l基本培养基是q&l基本培养基中的大量元素减半、微量元素减半、fe盐减半、有机元素不变。
以下实施例中使用的2,4-二氯苯氧乙酸(2,4-d)、6-苄基腺嘌呤(6-ba)、苯基噻二唑基脲(tdz)、萘乙酸(naa)、赤霉素(ga3)、植物凝胶(gel)、琼脂粉(agar)均可通过商业途径购买得到。
实施例1
本实施例提供一种梅花体细胞胚萌发培养基,其组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,tdz1.0mg/l,ga30.5mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
实施例2
本实施例提供一种梅花体细胞胚萌发培养基,其组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,tdz1.0mg/l,ga31.0mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
实施例3
本实施例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基(也可作为体细胞胚继代培养基)和体细胞胚萌发培养基。
其中,体细胞胚诱导培养基的组成如下:1/2ms基本培养基,6-ba0.5mg/l,2,4-d2.0mg/l,蔗糖30g/l,gel2.5g/l,ph6.0;
体细胞胚增殖培养基的组成如下:1/2q&l基本培养基,2,4-d1.5mg/l,6-ba0.5mg/l,蔗糖30g/l,agar7.5g/l,ph6.0;
体细胞胚萌发培养基的组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,tdz1.0mg/l,ga30.5mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
实施例4
本实施例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例3的区别仅在于,体细胞胚诱导培养基中2,4-d的浓度为1.0mg/l。
实施例5
本实施例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例3的区别仅在于,体细胞胚增殖培养基中的1/2q&l基本培养基替换为1/2ms基本培养基。
实施例6
本实施例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例3的区别仅在于,体细胞胚萌发培养基的组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,ga31.0mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
实施例7
本实施例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例3的区别仅在于,体细胞胚萌发培养基的组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,tdz1.0mg/l,ga31.0mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
实施例8
本实施例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基(也可作为体细胞胚继代培养基)和体细胞胚萌发培养基。
其中,体细胞胚诱导培养基的组成如下:1/2q&l基本培养基,6-ba0.1mg/l,2,4-d4.0mg/l,葡糖糖60g/l,gel2.5g/l,ph6.0;
体细胞胚增殖培养基的组成如下:1/2q&l基本培养基,2,4-d1.5mg/l,6-ba0.5mg/l,硝酸银为10mg/l,酸水解酪蛋白为100mg/l,蔗糖30g/l,agar7.5g/l,ph6.0;
体细胞胚萌发培养基的组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,tdz1.0mg/l,ga31.0mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
实施例9
本实施例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例8的区别仅在于,体细胞胚诱导培养基中1/2q&l基本培养基替换为1/2ms基本培养基。
实施例10
本实施例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例8的区别仅在于,体细胞胚增殖培养基中不含有硝酸银和酸水解酪蛋白。
实施例11
本实施例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例8的区别仅在于,体细胞胚增殖培养基中不含有酸水解酪蛋白。
实施例12
本实施例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例8的区别仅在于,体细胞胚增殖培养基中不含有硝酸银。
实施例13
本实施例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例8的区别仅在于,体细胞胚萌发培养基的组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,ga31.0mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
实施例14
本实施例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例8的区别仅在于,体细胞胚萌发培养基的组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,tdz1.0mg/l,ga30.5mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
实施例15
本实施例提供一种梅花以体细胞胚途径再生植株的方法,其步骤如下:
(1)以梅花未成熟种子或组培苗叶片为外植体,将外植体在体细胞胚诱导培养基中培养诱导出体细胞胚;培养温度为24±2℃,黑暗培养;
(2)将步骤(1)得到的体细胞胚接种到体细胞胚增殖培养基中进行增殖培养,并促进其进一步分化,得到次生体细胞胚,培养室内培养温度24±2℃,光照强度1000-1500lx,光照周期为14h(一天24h中,14h光照培养,10h黑暗培养);
(3)将步骤(2)得到的次生体细胞胚接种到体细胞胚萌发培养基中形成植株,培养室内培养温度24±2℃,光照强度1000-1500lx,光照周期为14h。
以上方法中,体细胞胚诱导培养基、体细胞胚增殖培养基、体细胞胚萌发培养基来自于用于梅花以体细胞胚途径再生植株的试剂,用于梅花以体细胞胚途径再生植株的试剂的配方为选自实施例3-14中的任一种。
对比例1
本对比例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例3的区别仅在于,体细胞胚诱导培养基中不含有2,4-d。
对比例2
本对比例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例3的区别仅在于,体细胞胚增殖培养基中的基本培养基替换为1/2wpm。
对比例3
本对比例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例3的区别仅在于,体细胞胚萌发培养基的组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
对比例4
本对比例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例3的区别仅在于,体细胞胚萌发培养基的组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,ga30.5mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
对比例5
本对比例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例3的区别仅在于,体细胞胚萌发培养基的组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,tdz1.0mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
对比例6
本对比例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例8的区别仅在于,体细胞胚诱导培养基中2,4-d的浓度为5.0mg/l。
对比例7
本对比例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例8的区别仅在于,体细胞胚诱导培养基中2,4-d的浓度为5.0mg/l,1/2q&l基本培养基替换为1/2ms基本培养基。
对比例8
本对比例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例8的区别仅在于,体细胞胚萌发培养基的组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
对比例9
本对比例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例8的区别仅在于,体细胞胚萌发培养基的组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,ga30.5mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
对比例10
本对比例提供一种用于梅花以体细胞胚途径再生植株的试剂,其包括体细胞胚诱导培养基、体细胞胚增殖培养基和体细胞胚萌发培养基,其与实施例8的区别仅在于,体细胞胚萌发培养基的组成如下:1/2q&l基本培养基添加6-ba2.0mg/l,naa0.5mg/l,tdz1.0mg/l,蔗糖30g/l,agar7.5g/l,ph6.0。
实验例1
本实验例以梅花‘淡丰后’未成熟种子和梅花‘丽江照水’组培苗叶片作为梅花外植体,采用实施例3-14和对比例1-10的用于梅花以体细胞胚途径再生植株的试剂以及实施例15的梅花以体细胞胚途径再生植株的方法,将外植体以体细胞胚途径进行植株再生,具体如下:
1、试验材料来源及其处理
试验材料梅花‘淡丰后’未成熟种子选自生长在国家鹫峰森林公园北京林业大学实践基地内的生长健壮、无病虫害的优良梅花品种‘淡丰后’的未成熟果实(盛花后6周)。果实处理方法:将采集的梅花‘淡丰后’的未成熟果实切开,取出其带内种皮的种子,挑选在清水中能下沉的饱满种子,流水下冲洗30min。在超净工作台上用70%的酒精消毒40s,然后再用2%naclo消毒20min,无菌水冲洗3-4次,滤纸吸干表面液体备用。
试验材料梅花‘丽江照水’组培苗叶片选自实验室保存的健壮、生长一致的‘丽江照水’无菌苗。将中上部的叶片切下,主叶脉划伤,以叶背面朝下接种于诱导培养基上。
其中利用实施例3和实施例8的试剂进行植株再生的结果如下:
在超净工作台上将梅花‘淡丰后’的未成熟合子胚接种于实施例3的诱导培养基上,每一培养皿中接种9个外植体,黑暗培养。8周后未成熟合子胚上有体细胞胚产生(图1),有的外植体则变褐死亡,未能诱导出体细胞胚。
将梅花‘淡丰后’体细胞胚接种到实施例3的体细胞胚增殖培养基上,在光照条件下培养。这些体细胞胚可在体细胞胚增殖培养基上快速增殖(图2),将梅花‘淡丰后’体细胞胚接种到实施例3的体细胞胚继代培养基上,可长期保存。将梅花‘淡丰后’次生体细胞胚接种到实施例3的体细胞胚萌发培养基上,体细胞胚成熟并萌发(图3)。将萌发的芽体接种到新鲜的生根培养基中,8周后,梅花‘淡丰后’再生成完整植株(图4)。
在超净工作台上将梅花‘丽江照水’无菌苗中上部叶片种于实施例8的诱导培养基上,每一培养皿中接种9个外植体,黑暗培养。8周后在叶片边缘有体细胞胚产生(图5),有的外植体则变褐死亡,未能诱导出体细胞胚。
将诱导得到的体细胞胚接种到实施例8的体细胞胚增殖培养基上,在光照条件下培养。这些体细胞胚可在体细胞胚增殖培养基上快速增殖(图6),将诱导得到的体细胞胚接种到实施例8的体细胞胚继代培养基上,可长期保存。将次生体细胞胚接种到实施例8的体细胞胚萌发培养基上,体细胞胚可以萌发成苗(图7)。
采用实施例3-7以及对比例1-5的试剂进行梅花‘淡丰后’未成熟种子的植株再生的各阶段的效果如表1、表2和表3所示。
表1梅花‘淡丰后’体细胞胚诱导率
注:表1中数据显示为平均值±标准误,不同字母表示在p<0.05水平上差异显著。
结果表明,以梅花‘淡丰后’的未成熟合子胚为外植体诱导体细胞胚的发生,当采用实施例3的体细胞胚诱导培养基时,‘淡丰后’体细胞胚诱导率最高,为62.19%。
表2不同培养基对梅花‘淡丰后’体细胞胚生长发育状态的影响
注:表2中水渍化1、2、3分别表示无水渍化、水渍化较轻、水渍化严重。颗粒性1、2分别表示颗粒性明显、颗粒性不明显。数据显示为平均值±标准误,不同字母表示在p<0.05水平上差异显著。
结果表明,实施例和对比例的不同体细胞胚增殖培养基得到的梅花‘淡丰后’的体细胞胚增殖效果存在显著性差异。在实施例3的体细胞胚增殖培养基上,‘淡丰后’的体细胞胚生长状态为无水渍化的金黄色,且颗粒性明显,增殖系数为2.39。
表3不同萌发培养基对梅花‘淡丰后’体细胞胚萌发的影响
注:表3中数据显示为平均值±标准误,不同字母表示在p<0.05水平上差异显著。体细胞胚萌发率(%)=萌发的体细胞胚数/接种的体细胞胚总数×100%。
结果表明,实施例和对比例的不同体细胞胚萌发培养基得到的梅花‘淡丰后’的体细胞胚萌发效果存在显著性差异。在实施例3的萌发培养基上,‘淡丰后’体细胞胚萌发率最高,达到33.41%。
采用实施例8-14以及对比例6-10的试剂进行梅花‘淡丰后’未成熟种子的植株再生的各阶段的效率如表4、表5和表6所示。
表4体细胞胚诱导率
注:表4中数据显示为平均值±标准误,不同字母表示在p<0.05水平上差异显著。
结果表明,以梅花‘丽江照水’的无菌苗叶片为外植体诱导体细胞胚的发生,当采用实施例8的试剂时,其体细胞胚诱导率最高,为10.26%。
表5不同培养基对梅花体细胞胚生长发育状态的影响
注:水渍化1、2、3分别表示无水渍化、水渍化较轻、水渍化严重。颗粒性1、2分别表示颗粒性明显、颗粒性不明显。褐化1、2、3分别表示基本无褐化、褐化较轻、褐化严重。数据显示为平均值±标准误,不同字母表示在p<0.05水平上差异显著。
结果表明,实施例和对比例的不同体细胞胚增殖培养基得到的梅花‘丽江照水’的体细胞胚增殖效果存在显著性差异。在实施例8的体细胞胚增殖培养基上,更利于‘丽江照水’的次生体细胞胚的发生和生长发育。
表6不同萌发培养基对梅花‘丽江照水’体细胞胚萌发的影响
注:表6中数据显示为平均值±标准误,不同字母表示在p<0.05水平上差异显著。体细胞胚萌发率(%)=萌发的体细胞胚数/接种的体细胞胚总数×100%。
结果表明,实施例和对比例的不同体细胞胚萌发培养基得到的梅花‘丽江照水’的体细胞胚萌发效果存在显著性差异。在实施例8的萌发培养基上,‘淡丰后’体细胞胚萌发率最高,达到22.30%。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!